TGF-β调节仔猪睾丸支持细胞增殖的机制
黄 莎,孙 思,邓 洁,胡 煜,练 雨,王鲜忠
(西南大学动物科技学院 重庆市牧草与草食家畜重点实验室,重庆 400716)
TGF-β是一种多肽类细胞因子,具有调节细胞增殖、凋亡、分化和免疫抑制等作用[1];研究TGF-β调控支持细胞增殖的机制能为治疗和预防雄性生殖障碍疾病奠定基础。TGF-β参与了多种细胞的增殖调节,Smad信号通路在其中发挥了重要作用[2]。原癌基因c-Myc是TGF-β/Smad信号通路下游重要的靶基因,是促进细胞从G1期~S期转换的转录激活因子,在调节细胞增殖、分化、凋亡中发挥着重要的作用[3]。研究发现,Smad蛋白可以通过与c-Myc的直接相互作用和Skp2的募集来增强c-Myc的泛素化,下调c-Myc蛋白的表达水平,达到抑制肿瘤细胞增殖的作用。在癌症发生早期,TGF-β也可通过下调c-Myc表达达到抑癌作用[4]。C.Itman等[5]发现,TGF-β对支持细胞的增殖过程具有一定的调节作用;但TGF-β是否通过TGF-β/Smad通路,进一步调节c-Myc和Skp2的表达水平来调节睾丸支持细胞的增殖,目前还不清楚。miR-24是一种功能多样的miRNA,与肿瘤形成、细胞增殖、凋亡及分化有密切的关系[6]。TGF-β能诱导SMMC-7721细胞中miR-23a~27a~24-2基因簇的表达,而且该基因簇的miRNA具有抗凋亡促增殖的作用[7-8]。但miR-24是否也参与了TGF-β诱导的支持细胞增殖还不清楚。本研究利用体外培养的仔猪睾丸支持细胞,研究TGF-β是否通过影响miR-24的表达,进而影响Smads的活性并调节c-Myc和Skp2的表达,从而调控细胞增殖,为进一步揭示TGF-β调控支持细胞增殖的分子机制奠定基础。
1 材料与方法
1.1 主要试剂和材料
DMEM/F-12Hams、胎牛血清和新生小牛血清购自美国Gibco公司;胰蛋白酶、Ⅵ型胶原酶购自美国Sigma公司;TGF-β1购自美国PeproTech公司;p-Smad3(Ser423)、Smad3和beta-Actin抗体购自北京博奥森生物技术有限公司。总RNA提取试剂盒、反转录及荧光定量试剂盒购自生工生物工程(上海)股份有限公司。仔猪睾丸采自重庆本地3周龄长白猪。
1.2 细胞培养
睾丸支持细胞分离培养按照实验室前期所建立的方法进行[9]。利用GATA-4作为标记分子通过免疫荧光进行支持细胞纯度鉴定,如果纯度高于90%,则可以用于后续试验。
1.3 TGF-β对支持细胞增殖的影响
细胞培养至48 h左右,用不同浓度的TGF-β (0~300 pg·mL-1)处理细胞不同时间(0~48 h),用CCK-8试剂盒检测支持细胞活性;通过流式细胞术检测TGF-β对支持细胞周期的影响。
1.4 TGF-β对Smad3磷酸化及ssc-miRNA-24表达的影响
用TGF-β(180 pg·mL-1)处理支持细胞不同时间(0~48 h)。通过Western blotting检测细胞中Smad3磷酸化水平;通过RT-qPCR检测ssc-miRNA-24的表达水平。
1.5 TGF-β/Smad通路抑制剂LY2109761对TGF-β作用的影响
加入1、10、100 μmol·L-1TGF-β/Smad通路抑制剂LY2109761处理细胞6 h,然后用TGF-β处理细胞24 h,用CCK-8试剂盒检测支持细胞活性,筛选出最佳作用浓度。
用上述试验得到的最适浓度抑制剂LY2109761(10 μmol·L-1)预处理细胞6 h,然后加入TGF-β处理支持细胞24 h。通过流式细胞术检测细胞周期;用RT-qPCR检测c-Myc、Skp2 mRNA表达水平。
1.6 ssc-miRNA-24模拟物、抑制剂对TGF-β调节支持细胞增殖的影响
ssc-miRNA-24模拟物(Mimics)、抑制剂(Inhibitor)和NC阴性对照(Negative control)序列由广州锐博生物科技有限公司设计并合成。RNA oligo合成信息见表1。
表1RNAoligo合成
Table1ThesequencesofRNAoligo
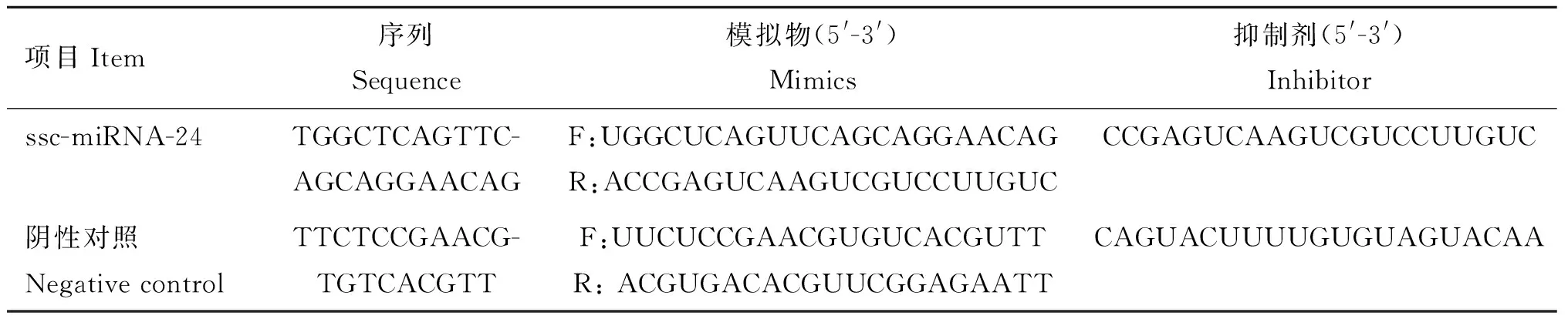
项目Item序列Sequence模拟物(5'-3')Mimics抑制剂(5'-3')Inhibitorssc-miRNA-24TGGCTCAGTTC-AGCAGGAACAGF:UGGCUCAGUUCAGCAGGAACAGR:ACCGAGUCAAGUCGUCCUUGUCCCGAGUCAAGUCGUCCUUGUC阴性对照NegativecontrolTTCTCCGAACG-TGTCACGTTF:UUCUCCGAACGUGUCACGUTTR:ACGUGACACGUUCGGAGAATTCAGUACUUUUGUGUAGUACAA
细胞贴壁约60%~70%后,将目的基因转染到支持细胞内,在32 ℃、5% CO2的培养箱中孵育6 h,转染过程具体操作步骤按照实验室前期所建立的方法进行[10]。然后用TGF-β(180 pg·mL-1)处理支持细胞24 h,用CCK-8试剂盒检测支持细胞活性,通过Western blotting检测Smad3磷酸化水平,用RT-qPCR检测c-Myc、Skp2 mRNA的表达水平。
1.7 支持细胞活性与周期检测
用CCK-8试剂盒检测支持细胞活性。将CCK-8加入到样品中反应1~4 h,酶标仪测定吸光度(OD450 nm)。依据说明书上的细胞存活计算公式计算细胞活性。公式:细胞活性(Cell viability,%)=(OD加药处理组-OD空白组)/(OD对照组-OD空白组)×100%。
通过流式细胞术检测细胞周期。选择氩离子气体激光器为激光光源,激发波长为488 nm,发射波长为525 nm,用Mod Fit LT软件进行统计分析,根据结果分别计算PI=(S+G2/M)/(G0/G1+S+G2/M)×100%,SPF=S/(G0/G1+S+G2/M)×100%。其中S、G2、G1、G0、M分别表示细胞周期。
1.8 Western blotting检测
细胞相应处理后,提取蛋白样品,用BCA蛋白浓度测试试剂盒检测蛋白浓度。SDS-PAGE凝胶电泳和Western boltting按文献[9]所述的方法进行。Rabbit Anti-phospho-Smad3(Ser423)和Rabbit Anti-Smad3按1∶300进行稀释,Rabbit Anti-beta-Actin按1∶250进行稀释,所用辣根过氧化物酶标记山羊抗兔IgG(H+L)按1∶1 000稀释。
1.9 实时定量PCR(RT-qPCR)
用总RNA提取试剂盒提取细胞中总RNA,检测总RNA的纯度和浓度[11],调节反转录所用模板浓度,并用反转录合成试剂盒进行反转录合成cDNA,具体操作步骤按照试剂盒说明书进行。根据GenBank中β-actin、c-Myc、Skp2的mRNA序列设计引物,由上海生工生物工程有限公司合成,引物信息见表2。荧光定量PCR的反应体系总体积为10 μL,包括cDNA 0.5 μL,上下游引物(浓度为20 pmol·μL-1)各0.5 μL,50×ROX Reference Dye 0.5 μL,2×SuperReal PreMix Plus(with SYBR GreenⅠ)5 μL,ddH2O为3 μL。反转录反应条件:25 ℃ 5 min;42 ℃ 30 min;85 ℃ 5 min;实时定量PCR反应条件:95 ℃ 15 s;95 ℃ 10 s,68 ℃ 30 s,共39个循环。每个样品设3个重复。
表2引物序列
Table2Thesequencesofprimers
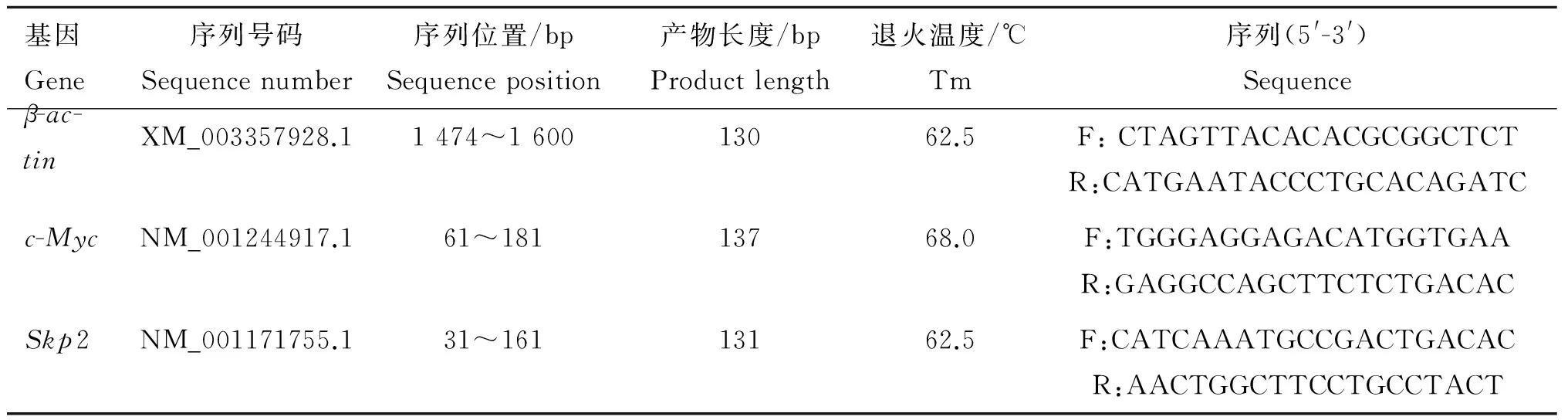
基因Gene序列号码Sequencenumber序列位置/bpSequenceposition产物长度/bpProductlength退火温度/℃Tm序列(5'-3')Sequenceβ-ac-tinXM_003357928.11474~160013062.5F:CTAGTTACACACGCGGCTCTR:CATGAATACCCTGCACAGATCc-MycNM_001244917.161~18113768.0F:TGGGAGGAGACATGGTGAAR:GAGGCCAGCTTCTCTGACACSkp2NM_001171755.131~16113162.5F:CATCAAATGCCGACTGACACR:AACTGGCTTCCTGCCTACT
1.10 数据分析
2 结 果
2.1 TGF-β对支持细胞增殖的影响
图1A结果表明,60~300 pg·mL-1的TGF-β处理细胞24 h均显著增加了细胞的活性(P<0.05);当TGF-β浓度为180 pg·mL-1时,这一作用最强,与对照组相比,细胞活性提高了20.93%(P<0.05)。图1B可见,180 pg·mL-1TGF-β处理细胞不同时间对细胞活性影响存在差异,当处理时间为24 h时,作用最强,与对照组相比增加了37.76%(P<0.05)。与对照组相比,180 pg·mL-1TGF-β能以时间(0~24 h)依赖方式促进细胞增殖(P<0.05),24 h时细胞作用最显著;处理24 h时细胞增殖指数、S期细胞比例与对照组相比分别增加了30.04%、37.81%(P<0.05)(表3)。
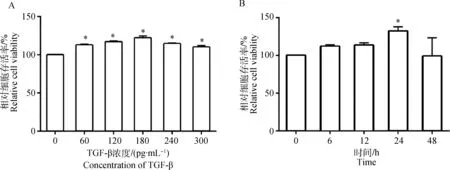
A.不同浓度的TGF-β作用24 h对支持细胞活性的影响;B.180 pg·mL-1 TGF-β处理不同时间对支持细胞活性的影响。*. P<0.05。下同A. Effect of different dose of TGF-β on viability of Sertoli cells for 24 hours; B. Effect of 180 pg·mL-1 TGF-β on viability of Sertoli cells at different time points. *. P<0.05.The same as below图1 TGF-β对支持细胞活性的影响Fig.1 Effect of TGF-β on viability of Sertoli cells
表3TGF-β处理不同时间对睾丸支持细胞PI和SPF的影响
Table3EffectofTGF-βonPIandSPFofSertolicellsatdifferenttimepoints
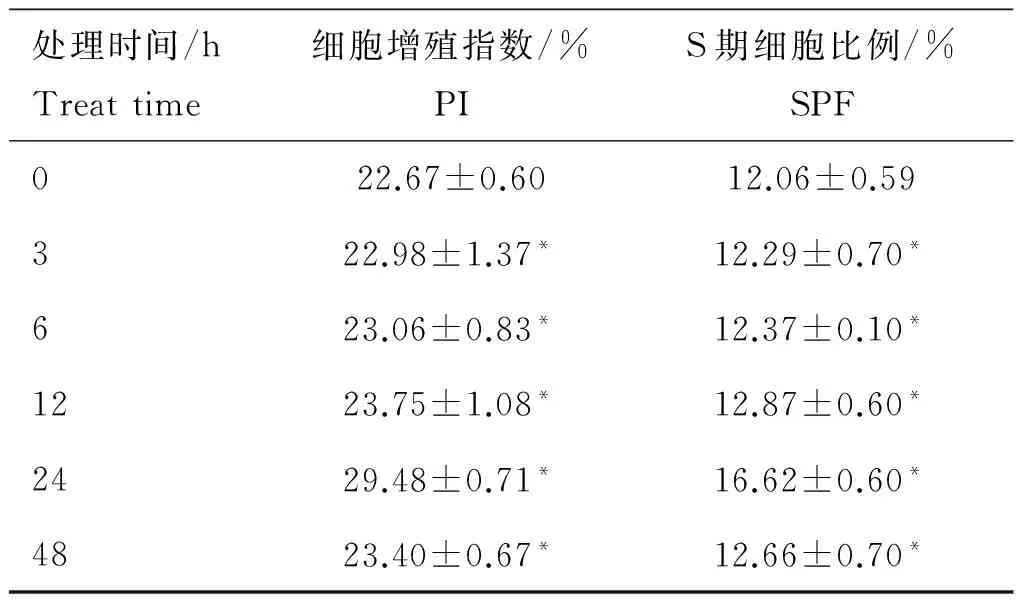
处理时间/hTreattime细胞增殖指数/%PIS期细胞比例/%SPF022.67±0.6012.06±0.59322.98±1.37*12.29±0.70*623.06±0.83*12.37±0.10*1223.75±1.08*12.87±0.60*2429.48±0.71*16.62±0.60*4823.40±0.67*12.66±0.70*
2.2 TGF-β对Smad3磷酸化水平及ssc-miRNA-24表达的影响
图2A结果表明,TGF-β(180 pg·mL-1)处理0~24 h,Smad3磷酸化水平逐渐降低;处理24 h时Smad3磷酸化水平达到最低,与对照组相比,降低了58.19%(P<0.05);处理48 h的磷酸化水平有所增加。图2B表明,ssc-miRNA-24的表达在0~24 h内随TGF-β处理时间延长而增加,24 h时达到最高,与对照组相比,ssc-miRNA-24的表达增加了53.67%(P<0.05),48 h时与对照组相比无显著差异(P>0.05)。
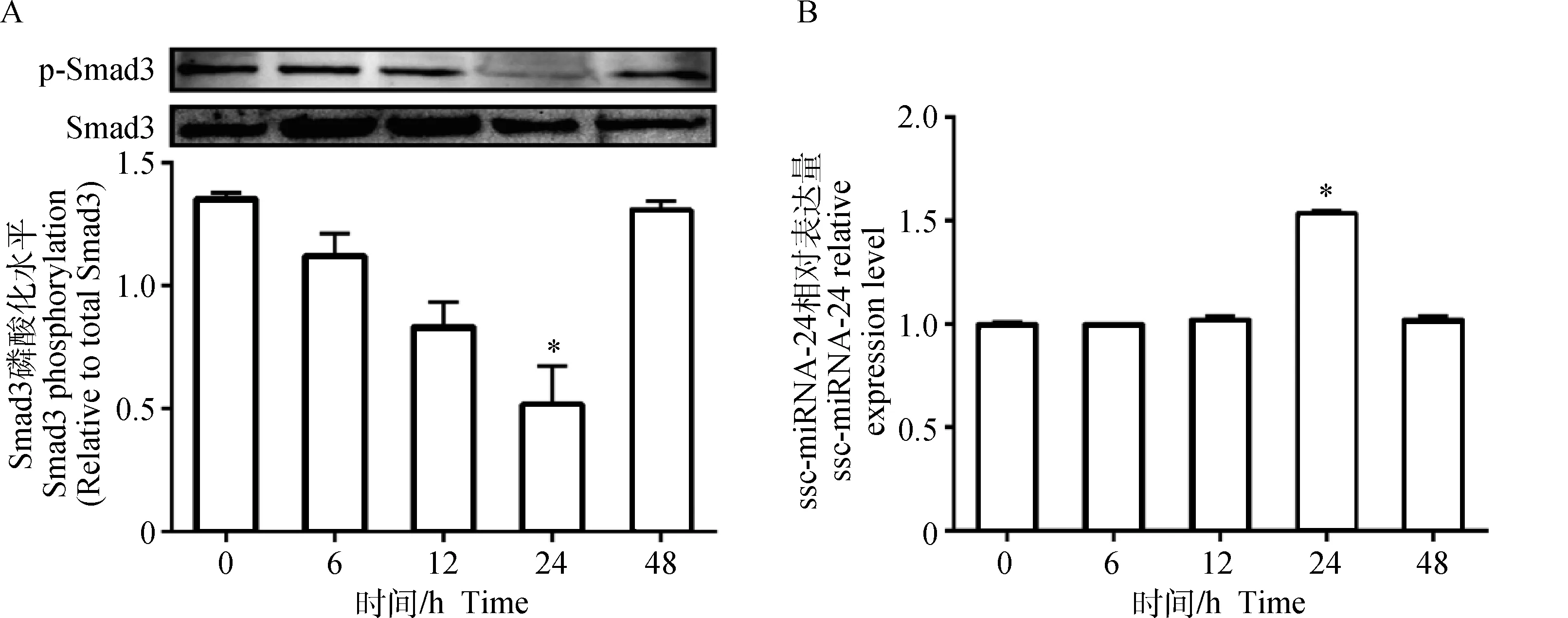
图2 TGF-β对Smad3磷酸化水平(A)及ssc-miRNA-24表达的影响(B)Fig.2 Effect of TGF-β on Smad3 phosphorylation level(A) and ssc-miRNA-24 expression (B)
2.3 TGF-β/Smad通路抑制剂LY2109761对TGF-β作用的影响
图3A结果表明,不同浓度的LY2109761(1、10、100 μmol·L-1)均显著增强了支持细胞的活性,10 μmol·L-1时作用最强(P<0.05)。10 μmol·L-1LY2109761与TGF-β共同作用显著增强了支持细胞的活性(P<0.05), 其促增殖作用较10 μmol·L-1LY2109761单独作用时显著(P<0.05),但与TGF-β单独作用时的促增殖作用无显著差异(P>0.05)。图3B可以看出,与对照组相比,各处理组均增加了c-Myc和Skp2 mRNA的表达,其中,TGF-β与LY2109761的共同作用最显著,c-Myc和Skp2 mRNA分别增加了123.26%、92.86%,达到显著水平(P<0.05)。TGF-β、LY2109761单独作用时细胞的PI与SPF与对照组相比均增加显著(P<0.05);TGF-β+LY2109761组细胞增殖显著高于其他处理组,与对照组相比,PI增加了40.41%,SPF增加了44.73%(P<0.05)(表4)。
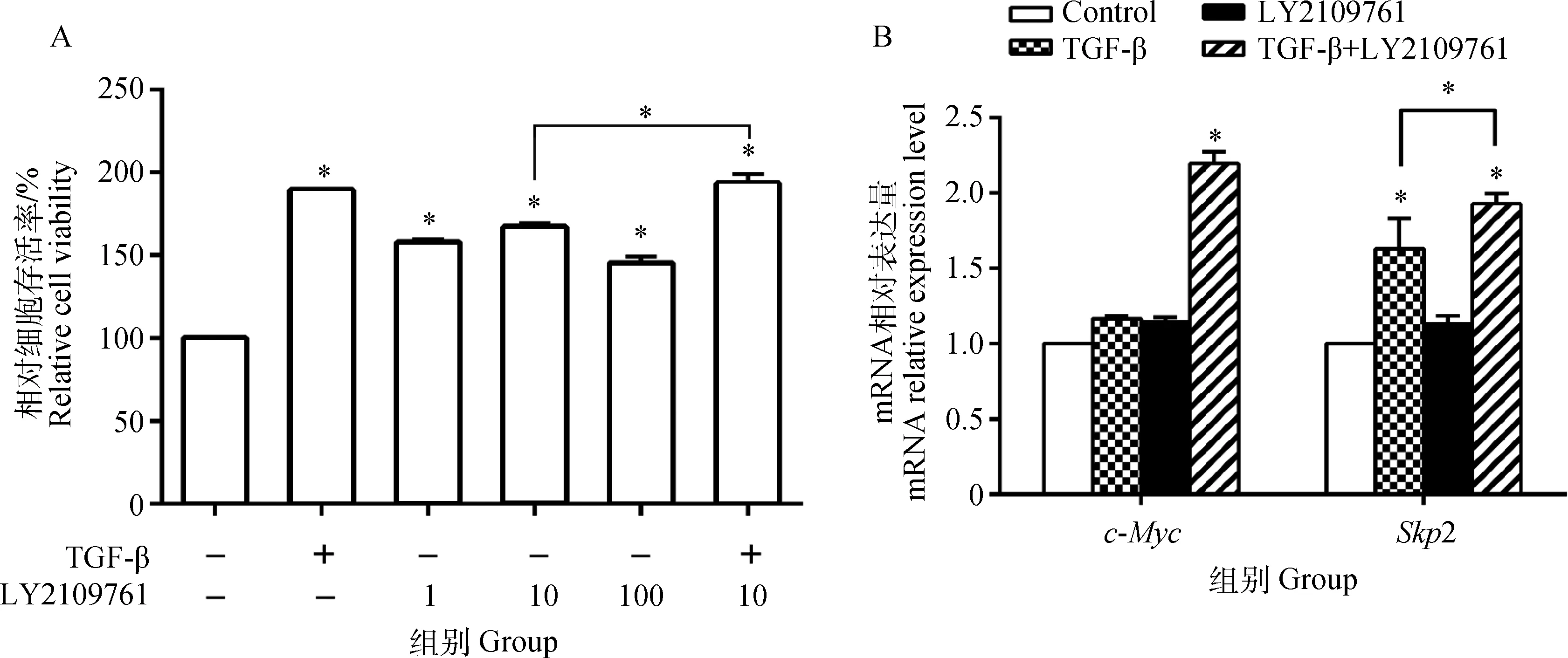
A. LY2109761对TGF-β诱导的支持细胞活性的影响;B. LY2109761对TGF-β诱导的c-Myc和Skp2 mRNA表达的影响A. Effect of LY2109761 on TGF-β-induced the viability of Sertoli cells; B.Effect of LY2109761 on TGF-β-induced the expressions of c-Myc and Skp2 mRNA图3 LY2109761对TGF-β作用的影响Fig.3 Influence of LY2109761 on effect of TGF-β
2.4 ssc-miRNA-24模拟物和抑制剂对TGF-β调节支持细胞增殖的影响
从图4A可以看出,与对照组相比,TGF-β+miR-24 mimics组、TGF-β组以及miR-24 mimics组细胞活性均显著增加(P<0.05),其中,TGF-β+miR-24 mimics组作用最明显;miR-24 inhibitor组与对照组相比,其细胞活性则显著降低(P<0.05)。从图4B可见,TGF-β与miR-24 mimics共同作用于支持细胞时,Smad3的磷酸化水平最低,与空白对照组相比降低了36.19%(P<0.05)。从图4C可知,水平;TGF-β和miR-24 mimics的共同作用与对照组相比,其c-MycmRNA、Skp2 mRNA的表达水平分别提高了159.72%、26.00%(P<0.05)。
表4TGF-β/Smad抑制剂LY2109761对TGF-β调节睾丸支持细胞周期的影响
Table4EffectofinhibitorLY2109761ofTGF-β/SmadonTGF-βregulatingSertolicellscycle
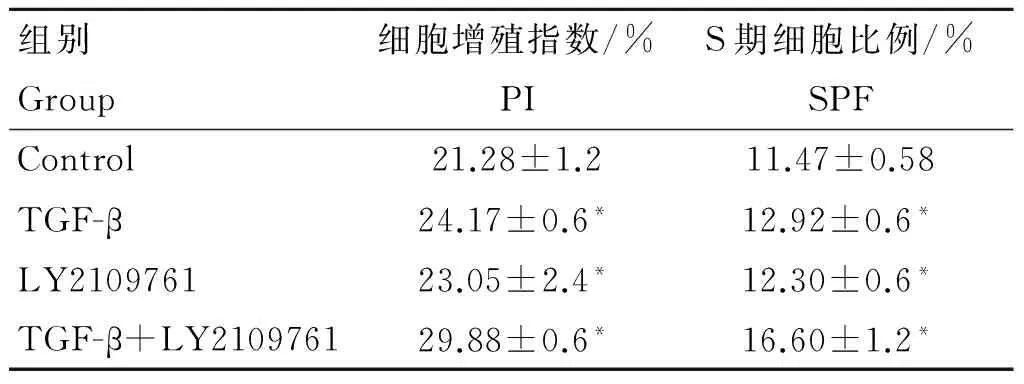
组别Group细胞增殖指数/%PIS期细胞比例/%SPFControl21.28±1.211.47±0.58TGF-β24.17±0.6*12.92±0.6*LY210976123.05±2.4*12.30±0.6*TGF-β+LY210976129.88±0.6*16.60±1.2*
与空白对照组相比,TGF-β及miR-24 mimics单独或共同作用时均提高了c-Myc、Skp2 mRNA的表达
3 讨 论
本研究结果表明,60~300 pg·mL-1TGF-β均增加了支持细胞活性;TGF-β浓度为180 pg·mL-1时效果最显著。在小鼠成纤维细胞中,TGF-β1(250 pg·mL-1)可以促进细胞生长,大剂量(25 ng·mL-1)则抑制细胞生长[12],这表明,TGF-β对细胞的作用表现为促进还是抑制,主要取决于细胞的类型、来源、分化状态和生长条件[13]。
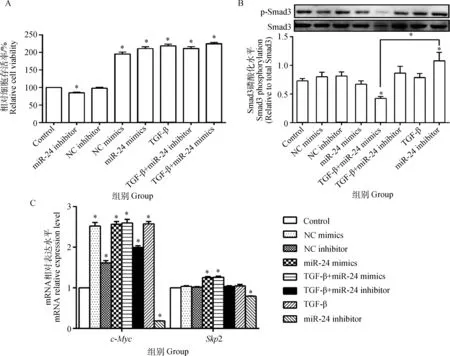
图4 ssc-miRNA-24 mimics和 ssc-miRNA-24 inhibitor对细胞活性(A)、 Smad3磷酸化水平(B)和c-Myc、Skp2 mRNA表达(C)的影响Fig.4 Effects of ssc-miRNA-24 mimics and ssc-miRNA-24 inhibitor on cell viability(A),Smad3 phosphorylation level(B) and c-Myc,Skp2 mRNA expression(C)
在0~24 h内,随着TGF-β处理时间的增加,细胞增殖能力显著增强,细胞内Smad3磷酸化水平不断降低。在Smad依赖的信号通路中,TGF-β与TβRⅡ先结合进而磷酸化TβRⅠ形成活化的配体受体复合物,接着TβRⅠ磷酸化细胞内Smad2/3蛋白[14-15]。这表明,TGF-β可以降低Smad依赖途径中TβRⅠ、TβRⅡ与Smad的结合活性,促进支持细胞增殖,这与敲除小鼠Smad3后创伤愈合速度显著加快,抑制Smad3可以促进细胞增殖相一致[16-17]。
TGF-β能诱导支持细胞中c-Myc与Skp2的表达;TGF-β/Smad通路抑制剂LY2109761作用于支持细胞后,c-Myc、Skp2 mRNA的表达显著升高,细胞增殖能力显著增加。这与c-Myc是TGF-β/Smad通路中重要下游因子,可促进细胞分裂增殖,被抑制后,细胞增殖能力下降[18]相一致,也与过表达Skp2能够促进细胞增殖相吻合[19]。这些结果说明,TGF-β能够通过抑制Smad蛋白的信号传导,从而上调c-Myc、Skp2基因,促进支持细胞增殖。
TGF-β能以时间依赖方式促进支持细胞中ssc-miRNA-24的表达;这与TGF-β刺激C2C12肌原细胞后,细胞中高表达的miR-24受到抑制导致细胞增殖下降[6]不符,但与TGF-β以剂量时间依赖的方式上调心成纤维细胞中miR-24水平,并刺激心成纤维细胞增殖[20]相一致。为了研究ssc-miRNA-24影响支持细胞增殖的机制,本研究利用ssc-miRNA-24模拟物和抑制剂验证其作用。结果发现,ssc-miRNA-24 mimics抑制了Smad3的蛋白表达和磷酸化水平,而添加ssc-miRNA-24 inhibitor则促进了Smad3蛋白表达和磷酸化水平,这与miR-24可以抑制Smad的作用相吻合[21],也与Smad4敲除小鼠中miR-24表达高于野生型小鼠相一致[22]。本研究还发现,miR-24 mimics使c-Myc和Skp2 mRNA表达水平显著升高,细胞活性显著增强;而添加miR-24 inhibitor 则显著抑制了c-Myc和Skp2 mRNA的表达,细胞活性显著降低。综上表明,TGF-β可以促进ssc-miRNA-24的表达,miR-24则能与Smad3蛋白结合并降低Smad3的活性,进而增强c-Myc、Skp2的表达,从而促进支持细胞的增殖。
4 结 论
TGF-β(0~300 pg·mL-1)以时间剂量依赖方式调节支持细胞的增殖, 180 pg·mL-1TGF-β 24 h对细 胞增殖影响显著。TGF-β能通过影响ssc-miRNA-24的表达调节Smad3的磷酸化水平,进而调节c-Myc与Skp2 mRNA的表达,从而调控支持细胞增殖。
参考文献(References):
[1] SUN T, XIN Z C, JIN Z, et al. Effect of TGF-β/Smad signaling on Sertoli cell and possible mechanism related to complete Sertoli cell-only syndrome[J].MolCellBiochem, 2008, 319(1-2): 1-7.
[2] DERYNCK R, ZHANG Y E. Smad-dependent and Smad-independent pathways in TGF-β family signalling[J].Nature, 2003, 425(6958): 577-584.
[3] HARPER J V, BROOKS G. The mammalian cell cycle: An overview[J].MethodsMolBiol, 2005, 296: 113-153.
[4] KIM T A, KANG J M, NIDERHUBER J, et al. Abstract LB-304: Smad7-Skp2 complex orchestrates c-Myc stability[J].CancerRes, 2014, 74(S19): 304.
[5] ITMAN C, LOVELAND K L. Smads and cell fate: distinct roles in specification, development, and tumorigenesis in the testis[J].IubmbLife, 2013, 65(2): 85-97.
[6] SUN Q, ZHANG Y, YANG G, et al. Transforming growth factor-β-regulated miR-24 promotes skeletal muscle differentiation[J].NucleicAcidsRes, 2008, 36(8): 2690-2699.
[7] HUANG S L,HE X H,LIANG L H,et al.Upregulation of miR-23 a approximately 27a approximately 24 decreases transforming growth factor-beta-induced tumor-suppressive activities in human hepatocellular carcinoma cells[J].IntJCancer, 2008, 123(4): 972-978.
[8] MUSTO A,NAVARRA A,VOCCA A, et al. miR-23a, miR-24 and miR-27a protect differentiating ESCs from BMP4-induced apoptosis[J].CellDeathDiffer, 2014, 22(6): 1047-1057.
[9] WANG X Z, ZHAO B C, ZHOU Y L, et al. 17β-estradiol regulates cultured immature boar sertoli cell proliferation via the cAMP-ERK1/2 pathway and the estrogen receptor β[J].AgrSciChina, 2010, 9(8): 1201-1210.
[10] JIAO Z J, YI W, RONG Y W, et al. microRNA-1285 regulates 17β-estradiol-inhibited immature boar sertoli cell proliferation via adenosine monophosphate-activated protein kinase activation[J].Endocrinology, 2015, 156(11): 4059-4070.
[11] LUCAS T F, SIU E R, ESTEVES C A, et al. 17 β-estradiol induces the translocation of the estrogen receptors ESR1 and ESR2 to the cell membrane, MAPK3/1 phosphorylation and proliferation of cultured immature rat Sertoli cells[J].BiolReprod, 2008, 78(1): 101-114.
[12] 彭 艳,李 平,陈 磊,等. c-Ski在TGF-β1双向调节小鼠皮肤原代成纤维细胞增殖中的作用[C]//重庆市生物化学与分子生物学学术会议[A]. 重庆: 2009.
PENG Y, LI P, CHEN L, et al. The effect of c-Ski in TGF-β1 regulating the proliferation of mouse skin primary fibroblast by two-way[C]//The Summary Abstracts of Chongqing Biochemistry and Molecular Biology Conference [A]. Chongqing: 2009. (in Chinese)
[13] RAHIMI R A, LEOF E B. TGF-β signaling: A tale of two responses[J].JCellBiochem, 2007, 102(3): 593-608.
[14] MASSAGUé J, CHEN Y G. Controlling TGF-β signaling[J].GeneDev, 2000, 14(6): 627-644.
[15] 杨 彬,徐丹丹,孙志鹏,等.金黄色葡萄球菌对奶牛乳腺成纤维细胞TGF-β1/Smad信号通路及其转分化的影响[J].畜牧兽医学报,2016, 47(7): 1495-1501.
YANG B,XU D D,SUN Z P,et al.The effect of staphylococcus aureus on TGF-β1/smad signaling pathway and transdifferentiation in bovine mammary fibroblasts[J].ActaVeterinariaetZootechnicaSinica, 2016, 47(7): 1495-1501. (in Chinese)
[16] ASHCROFT G S,ROBERTS A B.Loss of Smad3 modulates wound healing[J].CytokineGrowthFactorRev, 2000, 11(1-2): 125-131.
[17] LUO K Q, CHANG D C. The gene-silencing efficiency of siRNA is strongly dependent on the local structure of mRNA at the targeted region[J].BiochemBiophysResCommun, 2004, 318(1): 303-310.
[18] SMITH A P, VERRECCHIA A, FAGG, et al. A positive role for Myc in TGFβ-inducedSnailtranscription and epithelial-to-mesenchymal transition[J].Oncogene, 2009, 28(3): 422-430.
[19] ZHANG W W, CAO L L, SUN Z J, et al. Skp2 is over-expressed in breast cancer and promotes breast cancer cell proliferation[J].CellCycle, 2016, 15(10): 1344-1351.
[20] 王 珏, 郑 哲, 徐瑞霞, 等. miR-24作用于TGF-β通路调控心肌梗死后胶原代谢过程[C]//中国心脏大会(CHC)2011暨北京国际心血管病论坛[A]. 北京: 中华医学会, 国家心血管病中心, 2011.
WANG J, ZHENG Z, XU R X, et al. Role of miR-24 in the TGF-β pathway regulating the metabolism of collagen after myocardial infarction[C]//China Heart Congress[A]. Beijing: Chinese Medical Association, National Center of Cardiovascular Diseases, China, 2011. (in Chinese)
[21] CHAN M C, HILYARD A C, WU C, et al. Molecular basis for antagonism between PDGF and the TGFβ family of signalling pathways by control of miR-24 expression[J].EMBOJ, 2010, 29(3): 559-573.
[22] ROGLER C E, MATARLO J S, KOSMYNA B, et al. Knockdown of miR-23, miR-27, and miR-24 alters fetal liver development and blocks fibrosis in mice[J].GeneExp, 2017, 17(2): 99-114.

