软模板法制备三维花状MgAl-LDH及其吸附性能
黄 云 马若男 曾宪哲 相明雪 崔锡俊 章 萍*,,2
(1南昌大学资源环境与化工学院鄱阳湖环境与资源利用教育部重点实验室,南昌 330031)
(2南昌大学环境检测中心,南昌 330031)
0 引 言
以水滑石为代表的双金属氢氧化物(Layered double hydroxides,LDHs),是一类阴离子型二维层状粘土矿物,其结构单元是由相互平行且带正电荷的主层板及用以平衡层板正电荷的阴离子、水分子组成,化学式通式为[M2+1-xM3+x(OH)2]x+(An-)x/n·mH2O,其中:M2+和M3+分别代表层板上二价和三价金属阳离子,An-为层间阴离子[1-4]。二维LDHs多为六方片状[5-6],形貌单一,比表面积小。近年来,为满足LDHs在储能、吸附、催化等方面的实际需求[7-10],将二维LDHs转变成多孔、比表面积更大的三维LDHs的研究已受到越来越多的关注。目前,三维LDHs的合成主要集中于结构重建、原位生长、剥离自组装等方法[11-13]。技术上虽已取得长足进步,但仍迫切需要寻找一种操作简单、形貌可控的制备方法。
软模板法是利用有机分子或高分子聚合物作为模板剂(如表面活性剂、生物分子等),通过有机-无机材料之间的相互作用,在无需复杂设备条件下,自组装形成介孔、中空材料的制备方法[14-16]。软模板法能有效控制材料的形貌,结构和尺寸,且合成过程简单、模板剂多样,目前已有研究者将其引入三维LDHs制备中。如Sun等[17]利用柠檬酸钠作为模板制备出Ni-Al LDH微球,用作N2吸附;von Hoessle等[18]将磺化三聚氰胺甲醛缩聚物作为模板,制备出花状CaAl-LDH微球,用于铝酸三钙水化影响研究。这些研究大多探讨合成控制因素对三维LDH结构的影响,鲜少涉及到软模板剂参与三维LDHs形成机理的探讨。此外,作者前期研究发现,将表面活性剂十二烷基硫酸钠(SDS)作为改性剂可将二维LDHs表面亲水性转变为憎水性,提高其对水体中非离子型污染物的去除效果[19]。因而采用表面活性剂作为模板形成的三维LDHs作为环境中非离子有机污染物的吸附材料的研究尚未见报道。
因此,本研究采用软模板法,选取SDS为模板剂,以硝酸镁、硝酸铝和尿素为原料,在水热合成条件下,通过SDS与反应物离子的相互作用,合成出三维花状MgAl-LDH(3D-MgAl LDH)。通过系统探究Mg/Al物质的量之比,SDS浓度及水热反应时间等对3D-MgAl LDH结构、形貌的影响,探讨3D-MgAl LDH形成机理。此外,以萘作为非离子型污染物代表,通过等温吸附实验,考察3D-MgAl LDH对其吸附性能,为经软模板法合成的三维LDHs作为去除水体中有机污染物的环境材料提供理论支持。
1 实验方法
1.1 3D-MgAl LDH的制备
采用水热法制备3D-MgAl LDH。称取1.6 mmol Mg(NO3)2·6H2O 和 0.8 mmol Al(NO3)3·9H2O 于50 mL去离子水中配成混合盐溶液 (溶液A);称取0.48 g尿素溶解在溶液A中。将30 mL浓度为0.1 mol·L-1的SDS溶液与溶液A快速混合,激烈搅拌后超声30 min。所得白色悬浊液转移至内衬聚四氟乙烯的不锈钢反应釜中,150℃下水热反应6 h。反应后,产物离心,洗涤,干燥。
按照上述方法,改变反应条件,制备一系列3DMgAl LDH,探究反应条件对3D-MgAl LDH形成的影响。反应条件如下:(1)调节nMg/nAl=2,1,1/2和1/3;(2)设定 SDS 浓度依次为 0.01,0.1 和 0.2 mol·L-1;(3)水热反应时间依次设定为1,3,6和12 h。
此外,采用共沉淀方法[20],在nMg/nAl=2和SDS浓度为 0.1 mol·L-1条件下制备二维 MgAl LDH(2DMgAl LDH),用作对比萘去除率实验。
1.2 产物表征
采用德国BRUKER公司D8 ADVANCE型X射线衍射仪 (XRD)分析样品的物相结构,Cu靶Kα辐射源,λ=0.154 18 nm,管电压40 kV,管电流50 mA,扫描速度 2°·min-1;美国 Thermo 公司 NICOLET 5700型红外光谱分析仪(FT-IR)分析样品官能团;日本JEOL JSM 6701F场发射扫描电镜带能谱仪(SEM)对样品形貌进行分析,工作电压5 kV;JEM-2100型透射电子显微镜(TEM)表征样品形貌,工作电压200 kV。美国PE公司Optima 8000型电感耦合等离子体反射光谱仪(ICP-OES)分析样品溶液组分。
1.3 3D-MgAl LDH的吸附性能测试
1.3.1 吸附动力学研究
称取0.015 g 3D-MgAl LDH样品投加至15 mL萘初始浓度为30 mg·L-1的溶液中,于室温下水浴振荡,定时取样,混合物经离心分离后,上清液在λ=219 nm波长下测量吸光度值,以确定萘的残余量。
3D-MgAl LDH吸附萘的吸附量(qe)的计算方法按式(1)[21]进行。

式中C0和Ct分别为萘的初始浓度和时间t时的浓度(mg·L-1);V 为萘溶液的反应 体积(L);m 为 3DMgAl LDH 吸附剂的用量(g);qe为吸附量(mg·g-1)。
1.3.2 吸附等温曲线研究
称取0.015 g 3D-MgAl LDH投加至15 mL不同浓度萘溶液(10~50 mg·L-1)中,于室温下水浴振荡8 h后离心分离,上清液吸光度测试及萘吸附量计算同上,并绘制吸附量对平衡浓度的等温吸附曲线。
2 结果与讨论
2.1 Mg/Al物质的量之比对3D-MgAl LDH形成的影响
图1为不同Mg/Al物质的量之比条件下合成产物的XRD图。从图中可以看出,nMg/nAl=2和1时,均在 3.24°、6.68°、10.01°及 60.65°处出现了对应LDHs 的(003),(006),(009)和(110)晶面特 征 衍射峰[22]。 在 2θ=20.45°处出现了代表 SDS (PDF No.39-1996)的特征峰(用#表示)。上述结果表明,nMg/nAl=2或1时,可形成晶态良好的3D-MgAl LDH。然而,随着Al含量增大(nMg/nAl=1/2或1/3),产物中出现了大量铝的氢氧化物(PDF No.49-0133,用△表示)和铝的硫氧化物(PDF No.22-0006,用◆表示)的特征峰,并且代表LDH晶面特征峰和SDS的特征峰消失,说明当反应体系中Al含量过多时,LDH主层板上金属比例失衡,导致LDH无法形成。

图1 不同Mg/Al物质的量之比(nMg/nAl)的3D-MgAl LDH的XRD图Fig.1 XRD patterns of 3D-MgAl LDH with different ratios of nMg/nAlfrom 2°~5°(a)and 5°~65°(b)

图2 不同Mg/Al物质的量之比(nMg/nAl)的3D-MgAl LDH的FT-IR图谱Fig.2 FT-IR spectra of 3D-MgAl LDH with different ratios of nMg/nAl
图2 为不同Mg/Al物质的量之比条件下合成产物的FT-IR图谱。由图可知,当nMg/nAl=2和1时,分别在3 530和3 510 cm-1处出现了强而宽的吸收峰,这是由层板羟基和层间水分子伸缩振动引起的。2 962~2 856 cm-1范围内的振动峰为-CH2对称和反对称伸缩振动峰;1 210 cm-1为S=O较强的特征吸收峰,表明样品中含有SDS。445 cm-1处出现代表LDH主层板结构的金属氧键M-O的伸缩振动峰(M为Mg或Al),与文献中报道一致[23]。然而,随着Al含量增加(nMg/nAl=1/2 或 1/3),在 3 530~3 510 cm-1处未出现OH伸缩振动峰,表明产物中不含羟基基团和层间水,即片层结构消失;同时,代表SDS的特征振动峰变弱(nMg/nAl=1/2)或发生明显偏移(nMg/nAl=1/3),上述结果进一步证实了XRD分析的结果。

图3 不同Mg/Al物质的量之比(nMg/nAl)的3D-MgAl LDH的SEM图Fig.3 SEM images of 3D-MgAl LDH with different ratios of nMg/nAl
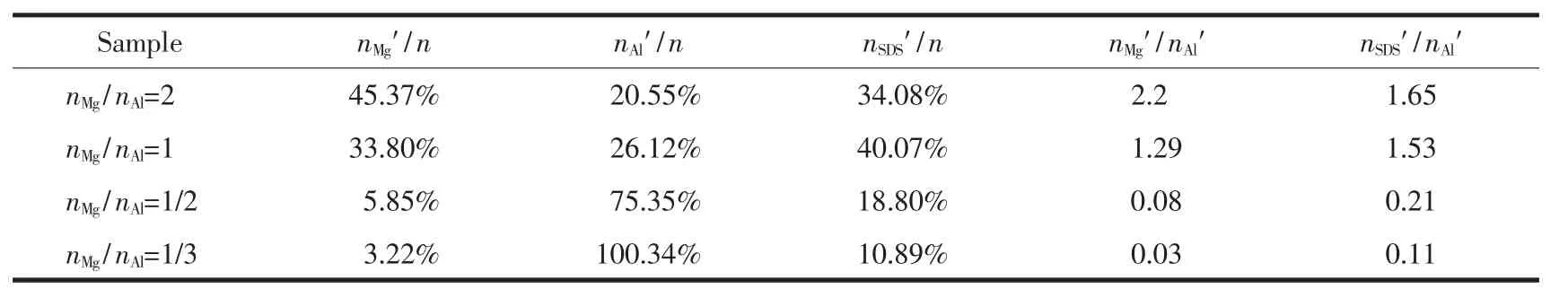
表1 样品中Mg、Al和SDS的含量Table 1 Mg,Al and SDS content of samples
图3为不同Mg/Al物质的量之比条件下合成产物的SEM图。由图3a可以看出,产物是由无数LDH纳米片交叉聚集形成的花状微球,且花球形貌良好。此外,纳米片尺寸均一,厚度约为56 nm,层片间有明显空隙。当nMg/nAl=1时,花球尺寸变大,层片间出现堆叠,厚度增加至100 nm,层片结构不及前者明显。而当nMg/nAl=1/2时,产物表面出现大量微小碎片,形貌发生明显变化。进一步增加Al含量后(nMg/nAl=1/3),产物表面微小碎片彻底消失,形成表面光滑的圆球。这是由于Mg/Al物质的量比失衡后,无法生成LDH纳米片。
为了进一步探究Mg/Al物质的量之比对合成产物的影响,将图1所示的样品溶解于25%(w/w)稀硝酸进行了ICP分析,计算结果如表1所示。由表可知,nMg/nAl=2和1的样品实际Mg/Al物质的量比值(nMg′/nAl′)分别为 2.2 和 1.29,与实验初始设定 nMg/nAl相差不大,此时,SDS 的实际百分含量(nSDS′/n)分别为34.08%和40.07%。当nMg/nAl=1/2和1/3时,nMg′/nAl′的值分别仅为0.08和0.03,SDS/Al物质的量比值(nSAS′/nAl′)降为 0.21 和 0.11,数值远小于前 2 组样品的比值。结合XRD分析结果,表明当Al含量过高时,无法形成LDH纳米片,并会影响SDS与LDH之间的相互作用,这一点将在后文SDS浓度对3DMgAl LDH形成的影响进行详细论述。基于上述研究结果,选取nMg/nAl=2时制备的样品用于对SDS浓度及水热反应时间影响的实验研究。
2.2 SDS浓度对3D-MgAl LDH形成的影响
图4为不同SDS浓度条件下合成样品的XRD图。从图中可看出,所有样品均出现了相对强度较大的(003)、(006)、(009)和(110)晶面特征衍射峰,且当SDS 浓度为 0.2 mol·L-1时,其层间距 d(003)为 2.72 nm,3D-MgAl LDH的主层板厚度为0.48 nm,以及SDS溶于水后产生的DS-烷基链长度为1.85 nm[24]。通过计算晶面间距与主层板厚度之差可得层内通道高度2.24 nm,其值介于单个和双个有机阴离子链长之间,因而推断出SDS阴离子在层板间为双分子垂直于层板形成交错有序的排布模式[25],形成有机阴离子插层的LDH。

图4 不同SDS浓度合成的3D-MgAl LDH的XRD图Fig.4 XRD patterns of 3D-MgAl LDH at different concentrations of SDS from 2°~5°(a)and 5°~65°(b)
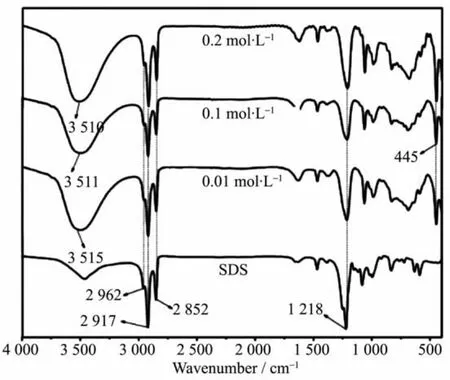
图5 不同SDS浓度合成的固样的FT-IR图谱Fig.5 FT-IR spectra of 3D-MgAl LDH at different concentrations of SDS

图6 不同SDS浓度下合成的3D-MgAl LDH的SEM图Fig.6 SEM images of 3D-MgAl LDH at different concentrations of SDS
图5 为不同SDS浓度条件下合成样品的FT-IR图谱。由图可知,3组样品的FT-IR图谱基本一致,特征峰与图2分析结果相一致,表明3组样品均为有机LDH。值得注意的是,本课题组前期研究发现,SDS仅作为有机阴离子取代LDH层间无机阴离子时,FT-IR图谱在3 636和3 480 cm-1处会出现2个单峰[26],分别代表羟基基团和水分子,此发现区别于3D-MgAl LDH在3 530,3 500 cm-1处出现的强而宽的振动峰,该结果表明三维LDH层板上的羟基基团和水分子存在的化学环境与二维LDH不同,说明部分SDS通过静电作用吸附在LDH主层板外表面或者LDH层板边缘,改变了LDH主层板上的化学环境[25]。
为了进一步探究SDS浓度对3D-MgAl LDH形成的影响,不同SDS浓度条件下合成样品的SEM图如图6所示。当SDS浓度为0.01 mol·L-1时,产物主要表现为不规则弯曲纳米片(LDH),且纳米片之间有一定的堆叠。当SDS浓度为0.1 mol·L-1时,纳米片之间存在明显空隙,可进行弯曲、交叉生长,最终自组装形成形貌良好的三维花球。当SDS浓度提高至0.2 mol·L-1时,产物表面层片结构不及前者明显,LDH层片间的空隙变小,甚至消失。由此说明产物形貌的改变与SDS的浓度有关。结合XRD、FT-IR结果可以看出,当SDS浓度较低时(0.01 mol·L-1),DS-作为阴离子优先插层形成有机MgAl LDH纳米片,剩余少量SDS存留在溶液中或纳米片表面。因残留SDS浓度较低,与LDH纳米片之间的作用力相对较弱,仅能够将LDH纳米片表面变弯曲。当SDS浓度过高时(0.2 mol·L-1),除作为阴离子插层外,过量的SDS游离在LDH纳米片边缘或者吸附在主层板外表面,高浓度SDS与LDH纳米片之间相互作用变强,促进三维花球的形成。但由于SDS本身具有凝聚性[22],SDS浓度越高,凝聚现象越严重,从而导致纳米片之间堆叠现象加重,因此图6c显示样品中由单个纳米片形貌组装成的花状结构被圆块状结构取代。
2.3 水热反应时间对3D-MgAl LDH形成的影响
为了探究反应时间对3D-MgAl LDH形成的影响,图 7(a,b)分别是产物在 2°~5°和 5°~65°的 XRD图。从图中可以看出,水热反应时间除1 h外,合成的产物均在 2θ=3.31°、6.68°、10.01°和 60.65°处出现了对应于 3D-MgAl LDH 的(003)、(006)、(009)和(110)晶面的衍射峰,d值约为2.7 nm。且随着反应时间的延长(图7a),代表(003)晶面的特征峰的强度逐渐增强,半峰宽随之变窄,说明合成的产物随着时间的延长结晶度变好,晶粒尺寸逐渐变大。

图7 不同反应时间合成的3D-MgAl LDH的XRD图Fig.7 XRD patterns of 3D-MgAl LDH prepared at different reaction times from 2°~5°(a)and 5°~65°(b)
图8 为不同反应时间条件下合成样品的SEM图。由图8a可知,当反应时间为1 h时,样品表面较为光滑,呈不规则的块状结构;当反应时间为3 h时,样品表面开始出现层片,初见花球雏形(图8b);当水热反应时间延长至6 h时(图8c),其花球状较前者更为规整,纳米片清晰可见,交叉生长,最终形成完整的三维花球。花球直径约在1.5~2 μm,纳米片厚度约为69 nm。反应时间继续延长至12 h时(图8d),纳米片进一步交叉生长,厚度增至169 nm,单个花球消失。这是由于反应时间过长,纳米片继续生长,导致其厚度增加,纳米片之间的空隙减小,相互连接,致使单个花球消失。因此,三维花状LDH的形成受反应时间的影响,最佳水热反应时间为6 h。

图8 不同反应时间合成的3D-MgAl LDH的SEM图Fig.8 SEM images of 3D-MgAl LDH at different reaction times
基于上述分析,本研究提出了三维花状MgAl LDH的可能生长机理(图9a)。在水热反应过程中,SDS的作用主要有2个方面:一方面DS-作为有机阴离子插层,合成有机LDH纳米片,同时,在此过程中受到Mg/Al物质的量比的影响,即合适的Mg/Al物质的量比组成的LDH主层板提供正电荷与DS-通过静电作用结合形成有机LDH。另一方面,SDS作为一种常见的阴离子表面活性剂,以合适的浓度溶于水后自身会形成类球状胶束,即疏水基聚集在一起形成内核[27],亲水基与溶液中水接触形成外核,故而SDS的亲水基可与LDH主层板上的羟基基团或者LDH纳米片边缘水相接触,诱导纳米片之间交叉生长,最终形成三维花状LDH。最佳合成样品的 TEM 图(nMg/nAl=2,SDS 浓度为 0.1 mol·L-1,水热反应时间6 h)表明3D-MgAl LDH层片结构明显,三维花球完整,结晶度高,尺寸均一(图9b)。

图9 3D-MgAl LDH形成机理示意图(a)及最佳合成条件下样品TEM图(b)Fig.9 Schematic illustration of the formation mechanism(a);TEM image of 3D-MgAl LDH(b)
2.4 3D-MgAl LDH对萘去除性能研究
图10 a为2D和3D-MgAl LDH对萘的去除率效果图。由图可知,3D-MgAl LDH对初始浓度为31 mg·L-1的萘溶液去除率为100%,而2D-MgAl LDH对其去除率仅为50%左右,说明三维结构提高了LDHs对萘的去除效果。故本工作深入研究了3DMgAl LDH对萘的吸附行为。图10b为25℃时,溶液实际初始浓度为31 mg·L-1条件下3D-MgAl LDH对萘的吸附动力学曲线。由图10b可知吸附量随着时间的延长而迅速增加,反应在30 min左右达到平衡。3D-MgAl LDH对萘的平衡吸附量约为30.98 mg·g-1。用常见的一级动力学方程(式(2))、二级动力学方程(式(3))[28]:

式中:qt为 t时的吸附量(mg·g-1),t为反应进行时间(min),qe为平衡吸附量 (mg·g-1)、b 为各动力学方程常数,对图10b数据进行曲线拟合。所得结果见表2。由表2可知,3D-MgAl LDH对萘的吸附符合一级反应动力学方程,R2=0.919 9(R2为相关系数),一级反应动力学模型拟合得到的最大吸附量为30.22 mg·g-1,与实验结果(30.98 mg·g-1)相近。

表2 3D-MgAl LDH对萘的吸附动力学拟合参数Table 2 Fitting parameters of kinetics curve for naphthalene adsorption by 3D-MgAl LDH

图10 2D,3D-MgAl LDH对萘去除率柱状图 (a)、3D-MgAl LDH对萘的吸附动力学曲线(b)及吸附等温线 (c)Fig.10 Remove efficiency of 2D and 3D-MgAl LDH(a),kinetics(b)and isotherms(c)of naphthalene adsorption on 3D-MgAl LDH
图10c为3D-MgAl LDH对萘的等温吸附曲线。从图中可明显看出,3D-MgAl LDH对萘的等温吸附曲线呈线性,吸附量随着萘初始浓度的增加而增大,对萘的吸附率达到了90%。大量研究表明,当吸附介质的有机碳含量大于0.5%(w/w)时,吸附介质上的有机碳是有机物的唯一重要的吸附相[29],因此可将多相模型简化为单相模型进行处理[30]。3DMgAl LDH样品中有机碳的含量经计算,约为59%,故3D-MgAl LDH中的有机碳含量大于0.5%,因此可采用单相模型处理。假设3D-MgAl LDH对萘的吸附是由分配作用所致,等温吸附曲线可用线性吸附模型表示:

式中Qp为有机物在3D-MgAl LDH上的浓度(mg·g-1),Ce为有机物在水中的平衡浓度(mg·L-1),Kp为3DMgAl LDH对萘的分配系数,Koc为有机碳标化过的分配系数,foc为3D-MgAl LDH的有机碳百分含量(w/w)。
对图10c等温吸附数据进行线性拟合,拟合方程为y=0.906 4x,R2=0.977 3,接近于 1,说明 3DMgAl LDH对萘的吸附符合该线性吸附模型,即3D-MgAl LDH对萘的吸附符合分配作用,3D-MgAl LDH对萘有溶解作用,且其吸附效果与萘在水中的溶解度和辛醇-水分配系数有关。常温下,萘在水中的最大溶解度为30 mg·L-1[31],本研究中3D-MgAl LDH对萘最大去除量约为31 mg·g-1,去除率高达到100%,表明3D-MgAl LDH可作为高效去除水环境中的非离子型污染物的环境材料。
3 结 论
(1)本研究以SDS作为软模板剂,经水热处理成功合成了结晶度高,形貌均一的3D-MgAl LDH。3DMgAl LDH 呈花球状,直径在 1.5~2 μm,纳米片厚度约69 nm。
(2)Mg/Al物质的量比,SDS浓度和水热反应时间均会影响3D-MgAl LDH的形成。其中nMg/nAl=2,SDS浓度为 0.1 mol·L-1,水热反应时间为 6 h时,有利于合成出花状形貌完整、片层厚度均一的3DMgAl LDH。
(3)3D-MgAl LDH对萘最大吸附量约为31 mg·g-1,去除率高达100%;3D-MgAl LDH对萘吸附的动力学方程属一级反应动力学方程,吸附等温拟合符合线性方程,表明其作用机理为分配作用。3DMgAl LDH对非离子型污染物表现出良好的吸附性能,其在废水处理方面具有潜在的应用价值。
参考文献:
[1]Zou Y D,Wang P Y,Yao W,et al.Chem.Eng.J.,2017,330:573-584
[2]Valente J S,Pfeiffer H,Lima E,et al.J.Catal.,2011,279(1):196-204
[3]Li D L,Lu M M,Cai Y B,et al.Appl.Clay Sci.,2016,132-133:243-250
[4]Zhang K,Wang W H,Kuai L,et al.Electrochim.Acta,2017,225:303-309
[5]Sun Z Y,Jin L,Shi W Y,et al.Chem.Eng.J.,2010,161(1/2):293-300
[6]ZHANG Ping(章萍),HUANG Yao(黄尧),WANG Tian-Qi(王天琪),et al.Journal of Nanchang University:Engineering&Technology(南昌大学学报:工科版),2013,35(3):222-226
[7]Xu Z P,Jin Y G,Liu S M,et al.J.Colloid Interface Sci.,2008,326(2):522-529
[8]Wang C,Ma B,Xu S M,et al.Nano Energy,2017,32:463-469
[9]Zhang L J,Chen R,Hui K N,et al.Chem.Eng.J.,2017,325:554-563
[10]Li Y,Liu S T,Chen W,et al.J.Alloys Compd.,2017,712:139-146
[11]Wang Y,Dou H,Wang J,et al.J.Power Sources,2016,327:221-228
[12]Kim J E,OH J H,Kotal M,et al.Nano Today,2017,14:100-123
[13]Zubair M,Daud M,Mckay G,et al.Appl.Clay Sci.,2017,143:279-292
[14]Lu L,Li J,Ng D H L,et al.J.Ind.Eng.Chem.,2017,46:315-323
[15]Li H G,Inukal K,Takahashi Y,et al.J.Asian Ceram.Soc.,2017,5(2):216-225
[16]He X J,Yu H H,Fan L W,et al.Mater.Lett.,2017,195:31-33
[17]Sun T,Wang J J,Khoso N A,et al.Mater.Lett.,2017,191:61-64
[17]Sun Y Y,Zhou J B,Cai W Q,et al.Appl.Surf.Sci.,2015,349:897-903
[18]von Hoessle F,Plank J,Leroux F.J.Phys.Chem.Solids,2015,80:112-117
[19]ZHANG Ping(章萍),QIAN Guang-Ren(钱光人),WANG Tian-Qi(王天琪),et al.Chinese Journal of Environmental Engineering(环境工程学报),2013,7(10):3708-3712
[21]Li H,Li J,Xu C,et al.J.Alloys Compd.,2017,698:852-862
[22]El Hassani K,Beakou B H,Kalnina D,et al.Appl.Clay Sci.,2017,40:24-131
[23]Sun H X,Chu Z Y,Hong D H,et al.J.Alloys Compd.,2016,658:561-568
[24]Zhang P,Wang T Q,Qian G R,et al.Spectrochim.Acta,Part A,2015,149:166-172
[25]Zhao H T,Nagy K L.J.Colloid Interface Sci.,2004,274(2):613-624
[26]Tao Q,Yuan J,Frost R L,et al.Appl.Clay Sci.,2009,45(4):262-269
[27]Zhang P,Qian G R,Xu Z P,et al.J.Colloid Interface Sci.,2012,367(1):264-271
[28]Sun X M,Li Y D.Angew.Chem.Int.Ed.,2004,43(5):597-601
[29]Wang T Q,Zhang P,Wu D S,et al.J.Colloid Interface Sci.,2015,443:65-71
[30]Chen C P,Zhou W J,Yang Q,et al.Chem.Eng.J.,2014,240:487-493
[31]Zhu L Z,Ruan X X,Chen B L,et al.Chemosphere,2008,70(11):1987-1994

