Dy3+,Eu3+共掺的 LiGd(MoO4)2单一相荧光粉的合成、发光及能量传递
于 汀 高明燕 宋 岩 李 丹 刘桂霞 董相廷 王进贤
(长春理工大学化学与环境工程学院,应用化学与纳米技术吉林省高校重点实验室,长春 130022)
0 引 言
随着环境问题和能源消耗问题日益严重,白光LED作为新一代的固态照明光源,以其低污染、低能耗、高稳定性和特有的发光效率得到了广泛的重视[1]。
目前,商业的实现白光LED的方法是用蓝光InGaN芯片激发黄色荧光粉(YAG∶Ce3+)。这种方法的优点是应用广、发光效率高(>100 lm·W-1),缺点是色温高(CCT>6 000 K)、显色指数低(Ra<80),这是由于光谱中缺少红色成分,从而限制了其应用范围[2-7]。这种局限性可利用紫外光(UV)LED芯片激发红、蓝、绿三色荧光粉来解决。然而,这种方法中,由于红光和绿光对蓝光强烈的重吸收导致了相对低的发光效率,并且实验过程复杂且成功率低。因为制备红、绿、蓝三色荧光粉需要单独实验,要求所制备荧光粉的粒度必须相互适应,否则混合时容易团聚或沉淀。最近,研究者利用紫外光或近紫外光激发单相荧光粉[8-11],以实现白光尤其是暖白光发射。与多相荧光粉相比较,单相荧光粉具有发光效率高、显色指数高、色温低、成本低和制作过程简单的优势。
在单相荧光粉中,实现暖白光最常用的方法是在同一基质中掺杂2种或2种以上稀土离子,在紫外或近紫外光激发下,不同稀土离子的发光和能量传递对于实现暖白光发射起着重要作用[12-17]。具有四方晶系和单斜晶系结构的稀土双钼酸盐ALn(MoO4)2(A=碱金属离子,Ln=稀土离子),在传感器、平板显示器、核辐射探测器以及半导体激光器等领域有广泛的应用[18-20]。其中白钨矿结构的钼酸盐,Mo6+和O2-是四配位,稀土离子(碱金属离子)和O2-是八配位[21-24],具有很高的物理和化学稳定性,在紫外光区有强烈的吸收能力[25-26],可作为理想的发光基质。近年来,双钼酸盐荧光粉的研究引起了广泛关注。例如:Cheng等[27]通过高温固相法合成了Li1-xAgxLu1-y(MoO4)2∶yEu3+白钨矿型固溶体荧光粉,详细研究了其晶体结构和发光性。Ren等[28]通过高温固相法合成了 KGd(MoO4)2∶Sm3+红色荧光粉。 Li等[29]通过高温固相法成功合成 MRE(MoO4)2∶Eu3+(M=Li,Na,K;RE=Gd,Y,Lu)红色荧光粉。传统的高温固相法通常需要较高的温度和较长的反应时间,安全性低。溶胶-凝胶法具有合成温度低、安全性高、反应条件温和、所制备的发光材料的粒径较小的优点。如:Liu等[30]通过溶胶-凝胶法合成了 LiLn(MO4)2∶Eu3+(Ln=La,Eu,Gd,Y;M=W,Mo)红色荧光粉。 Hu 等[31]通过溶胶-凝胶法合成结晶良好的 LiLa(MoO4)2∶Yb3+,Tm3+上转换荧光粉,该荧光粉在980 nm激发下,发射蓝光。Li等[32]通过溶胶-凝胶法合成 ALn(MoO4)2∶Yb3+,Er3+(A=Li,Na,K;Ln=La,Gd,Y)上转换荧光粉。上述文章均从单掺杂下转换发光和上转换发射单色荧光来讨论,却较少有文章对双掺杂下转换发射白光进行报道。Dy3+可以发射蓝光和黄光,Eu3+发射红光,Dy3+和Eu3+共掺杂可以实现白光发射。在稀土离子共掺杂的LiGd(MoO4)2体系中可以通过稀土离子之间有效的能量传递实现多色发光和白光发射。
本文以LiGd(MoO4)2为基质,Dy3+和Eu3+为激活剂,采用溶胶-凝胶法合成了一系列LiGd(MoO4)2∶Dy3+,Eu3+荧光粉,详细讨论了Dy3+和Eu3+间的能量传递过程及发光机理。所制备的荧光粉可被紫外光或近紫外光有效激发实现暖白光发射。
1 实验部分
1.1 试剂与仪器
氧化钆(Gd2O3)、氧化铕(Eu2O3)、氧化镝(Dy2O3)(纯度99.99%,上海跃龙有色金属有限公司),硝酸锂(LiNO3,纯度99.0%,天津市光复精细化工研究所),浓硝酸(HNO3,纯度 65%~68%,北京化工厂),钼酸铵((NH4)6Mo7O24·4H2O,纯度 99%,天津市化学试剂四厂),柠檬酸(C6H8O7·H2O,纯度 99.5%,天津市光复精细化工研究所),乙二醇(HOCH2CH2OH,纯度96.0%,天津市富宇精细化工有限公司),去离子水(H2O,自制)。
1.2 实验过程
本实验中所用的试剂均购自试剂公司,没有进一步提纯处理。称取一定量的 Gd2O3、Dy2O3、Eu2O3粉末置于烧杯中,滴加过量的硝酸,于磁力搅拌器上加热搅拌,蒸发过量的硝酸,待溶液成为胶状后,室温下冷却,然后加入去离子水溶解,配制成0.1 mol·L-1的 Gd(NO3)3溶液,0.05 mol·L-1的 Dy(NO3)3溶液和0.05 mol·L-1的Eu(NO3)3溶液。称取定量的LiNO3固体置于烧杯中,加入去离子水使其充分溶解,配制成 0.2 mol·L-1的 LiNO3溶液。
此实验分别制备 LiGd(MoO4)2∶0.06Dy3+,xEu3+(x=0,0.005,0.01,0.03,0.05,0.07,0.10)和 LiGd(MoO4)2∶yDy3+,0.01Eu3+(y=0,0.02,0.04,0.06,0.08,0.10) 荧光粉。 以制备 LiGd(MoO4)2∶0.06Dy3+,0.01Eu3+荧光粉为首先将1.576 g柠檬酸溶于20 mL去离子水中,待其充分溶解后加入0.531 4 g钼酸铵,充分溶解,所得混合溶液记为溶液A。准确量取1.5 mmol LiNO3和 1.395 mmol Gd(NO3)3、0.09 mmol Dy(NO3)3、0.015 mmol Eu(NO3)3溶液,加入 7.5 mmol柠檬酸(稀土离子与柠檬酸的物质的量比是1∶5),使其充分溶解,所得溶液记为溶液B。将A和B两溶液混合搅拌30 min,加入0.9 mL乙二醇(乙二醇与柠檬酸的物质的量比是1∶1),90℃加热搅拌2 h得到黄色透明溶胶,置于真空干燥箱180℃下2 h得到黑色孔状凝胶,取出后自然冷却,将凝胶转移到30 mL坩埚中,分别于500和800℃煅烧5 h得到白色粉末样品。
1.3 表征方法
采用丹东奥龙射线仪器有限公司生产的Y-2000型X射线衍射仪进行物相分析和晶体结构分析。用Cu靶Kα辐射,λ=0.154 06 nm,用Ni做滤波片,工作电流和电压分别是20 mA,30 kV,测试范围 2θ=10°~90°,步宽为 0.125°, 扫描速度是 10°·min-1。采用荷兰FEI公司的PHIIJIPS XL-30型场发射环境扫描电子显微镜(FESEM),观察样品的形貌和尺寸,工作电压10.0 kV。采用日本HITACHI公司生产的F-7000型荧光光谱仪分析样品的荧光光谱和荧光寿命。用Xe灯为激发源,波长范围200~700 nm,步长为 1 nm,扫描速率 1 200 nm·min-1,荧光寿命范围 0~10 ms,步长 0.01 ms。
2 结果与讨论
2.1 X射线衍射分析
图1为制备的不同掺杂离子和不同掺杂浓度的LiGd(MoO4)2荧光粉的XRD图。由图可见,所有样品的衍射峰与LiGd(MoO4)2的标准卡片(PDF No.18-0728)相匹配,为四方晶系,空间点群I41/a,晶胞参数 a=b=0.519 2 nm、c=1.131 0 nm、Z=2,无杂峰,说明掺入不同浓度的Dy3+,Eu3+未能影响基质结构,所合成的样品均为纯相的LiGd(MoO4)2。

图 1 样品 LiGd(MoO4)2∶Dy3+,Eu3+的 XRD 图Fig.1 XRD patterns of LiGd(MoO4)2∶Dy3+,Eu3+samples
2.2 场发射扫描电镜(FESEM)分析
图 2 为所合成的 LiGd(MoO4)2∶Dy3+,Eu3+荧光粉的FESEM照片,从照片中可以看出样品为不规则的球形颗粒,粒径直方图显示样品的平均粒径为1.8 μm。
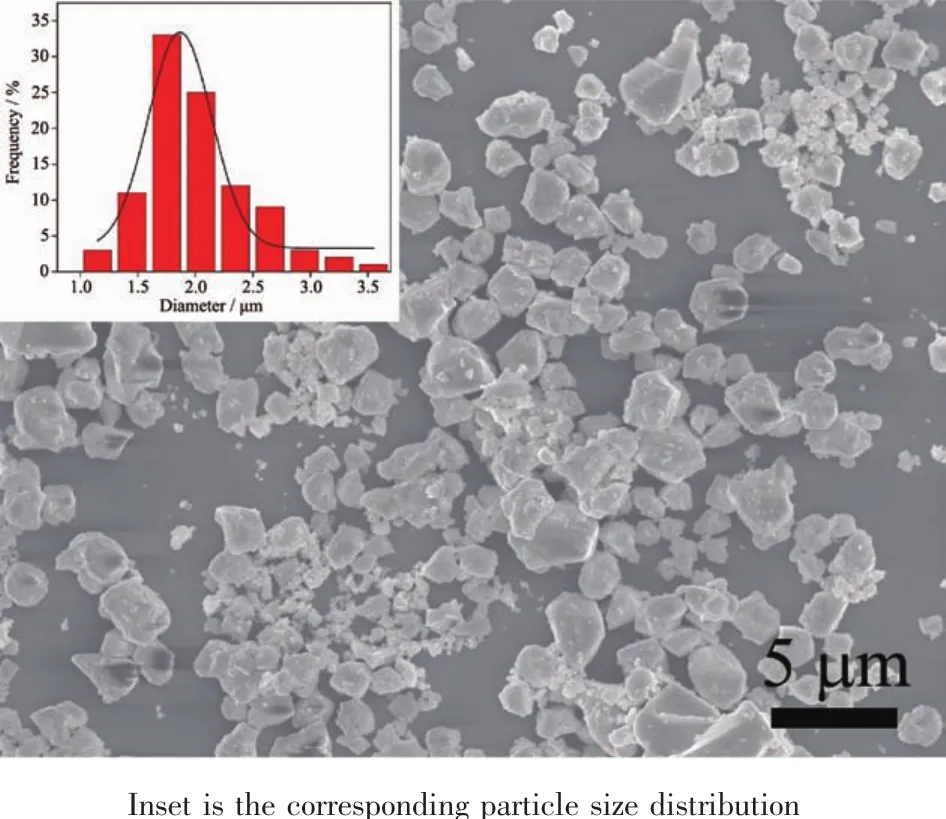
图 2 LiGd(MoO4)2∶Dy3+,Eu3+的 FESEM 照片Fig.2 FESEM image of the LiGd(MoO4)2∶Dy3+,Eu3+samples
2.3 荧光光谱分析
图 3 是 LiGd(MoO4)2∶0.06Dy3+(a)、LiGd(MoO4)2∶0.01Eu3+(b)和 LiGd(MoO4)2∶0.06Dy3+,0.01Eu3+(c)的激发和发射光谱。如图3(a)所示,在575 nm波长监测下,激发光谱由较弱的位于250~345 nm范围内O2--Mo6+的电荷迁移带(CTB)和位于345 nm以后的较强的Dy3+的f-f跃迁吸收峰组成,分别对应于Dy3+的6H15/2基态到6P7/2(354 nm)、6P5/2(368 nm)、4I13/2(389 nm)、4G11/2(428 nm)和4I15/2(455 nm)激发态的跃迁,最强激发峰位于354 nm。在354 nm紫外光的激发下,LiGd(MoO4)2∶0.06Dy3+荧光粉的发射峰由位于488 nm处的Dy3+(4F9/2→6H15/2)磁偶极跃迁和575 nm处的(4F9/2→6H13/2)电偶极跃迁组成,为Dy3+的特征蓝光和黄光发射。

图3 样品的激发和发射光谱Fig.3 Excitation and emission spectra of samples
由图3(b)可见,在616 nm波长监测下,激发光谱由位于250~350 nm范围内较强的O2--Mo6+的电荷迁移带(CTB)和位于350 nm以后的Eu3+的f-f跃迁吸收峰组成,分别对应于Eu3+的7F0基态到5D4(363 nm)、5G4(383 nm)、5L6(395 nm)、5D3(417 nm)和5D2(466 nm)激发态的跃迁,较强的电荷迁移带说明钼酸根将吸收的能量有效的传递给Eu3+。在395 nm近紫外光的激发下,LiGd(MoO4)2∶0.01Eu3+荧光粉的发射峰位于616 nm处,归属于Eu3+的5D0→7F2电偶极跃迁,为特征红光发射。
如图 3(c)可见,当 575 nm(Dy3+,4F9/2→6H13/2)为监测波长时,LiGd(MoO4)2∶0.06Dy3+,0.01Eu3+荧光粉的激发光谱与图 3(a)相似。而 616 nm(Eu3+,5D0→7F2)做监测波长时,LiGd(MoO4)2∶0.06Dy3+,0.01Eu3+荧光粉的激发光谱中,除了位于250~345 nm范围内O2--Mo6+的电荷迁移带和位于395和466 nm处的Eu3+的特征激发峰外,还可以看到位于354 nm(6H15/2→6P7/2)和 368 nm(6H15/2→6P5/2)两个 Dy3+的特征吸收峰,这表明Dy3+与Eu3+之间发生了能量传递,并且能量传递方向是Dy3+→Eu3+。在354 nm紫外光的激发下,LiGd(MoO4)2∶0.06Dy3+,0.01Eu3+发射光谱中同时出现了位于488和575 nm处的Dy3+的蓝光和黄光发射,以及位于616 nm处的Eu3+(5D0→7F2)的红光发射。因此,在同一基质中,通过调节掺杂离子的浓度,有望得到白光。
图4为在354 nm激发下,LiGd(MoO4)2∶0.06Dy3+,xEu3+(a)和 LiGd(MoO4)2∶yDy3+,0.01Eu3+(b)的发射光谱。如图4(a)所示,固定Dy3+的掺杂浓度,随着Eu3+掺杂浓度的增加,Dy3+的发光强度降低,而Eu3+的发光强度升高,当x=0.07时,达到Eu3+的猝灭浓度,Eu3+的发光强度开始降低,说明Dy3+→Eu3+之间有能量传递。图4(b)为固定Eu3+掺杂浓度,改变Dy3+的掺杂浓度的不同样品的发射光谱,由图可见,随着Dy3+掺杂浓度的增加,Eu3+的发射强度变化和Dy3+的发射强度变化规律一致:均出现从增强到最大最后降低的趋势。进一步证明了Dy3+→Eu3+发生了能量传递。
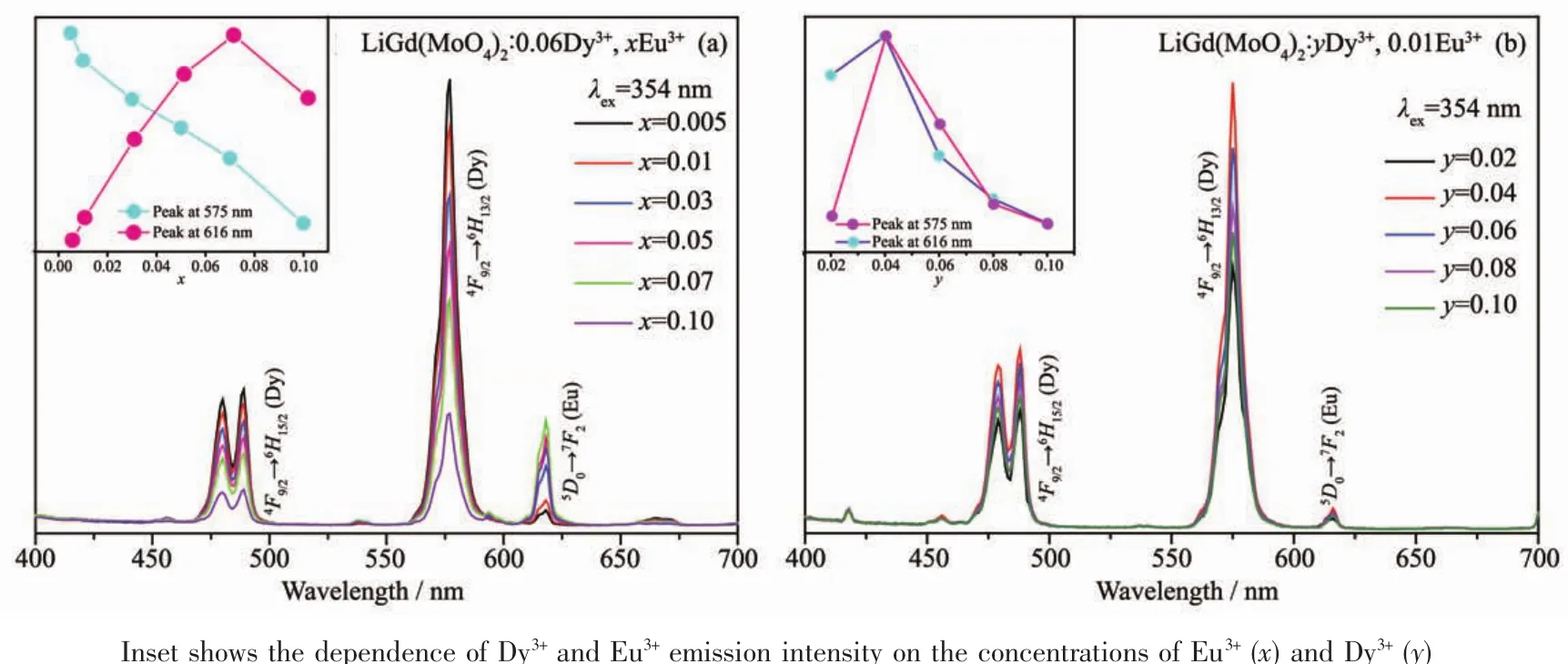
图 4 LiGd(MoO4)2∶0.06Dy3+,xEu3+(a) 和 LiGd(MoO4)2∶yDy3+,0.01Eu3+(b)的发射光谱Fig.4 Emission spectra for LiGd(MoO4)2∶0.06Dy3+,xEu3+(a)and LiGd(MoO4)2∶yDy3+,0.01Eu3+(b)phosphors
为了进一步验证Dy3+→Eu3+的能量传递,对LiGd(MoO4)2∶0.06Dy3+,xEu3+(x=0,0.005,0.01,0.03,0.05,0.07)中 Dy3+(4F9/2→6H13/2)的荧光寿命进行测试(λex=354 nm,λem=575 nm),衰减曲线如图5所示。根据公式(1)进行拟合处理,其中I代表任意时间的强度,I0代表t=0时的强度,A代表拟合参数,τ代表衰减寿命。不同Eu3+掺杂浓度样品的Dy3+的荧光寿命值依次为 0.229 86,0.228 09,0.202 84,0.183 61,0.182 83和0.179 67 ms。由此可见,Dy3+的荧光寿命随着Eu3+掺杂浓度的增加而逐渐降低,进一步说明Dy3+将能量传递给Eu3+。

能量传递的临界距离是研究发光性能的一个重要参数,采用公式(2)计算Dy3+与Eu3+之间能量传递的临界距离[33]:

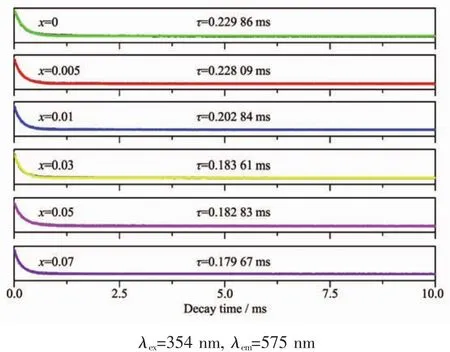
图 5 LiGd(MoO4)2∶0.06Dy3+,xEu3+荧光粉中 Dy3+的荧光衰减曲线Fig.5 Decay curves for the luminescence of Dy3+in LiGd(MoO4)2∶0.06Dy3+,xEu3+phosphors displayed on a normalized intensity
其中V表示晶胞体积,xc表示临界浓度,Z表示晶胞结构中可被阳离子占据的总晶格数,对于LiGd(MoO4)2晶体,V=0.304 9 nm3,Z=2。xc为 LiGd(MoO4)2∶Dy3+,Eu3+中 Dy3+的发光强度是 LiGd(MoO4)2∶Dy3+中Dy3+发光强度的一半时所对应的Dy3+和Eu3+的相对浓度之和,根据图3和图4a,xc值为0.11,通过计算能量传递的临界距离Rc=1.383 nm,临界距离值远大于0.5 nm,所以Dy3+→Eu3+的能量传递机理为多极-多极相互作用。
根据Dexter能量传递理论,采用公式(3)[34]进行拟合,分析能量传递机理,其中IS0代表Dy3+的发光强度,IS代表 Eu3+掺杂时Dy3+的发光强度,C代表Dy3+和 Eu3+的共掺相对浓度。公式(3)中,当 n=6、8、10时,分别代表偶极-偶极、偶极-四级、四级-四级相互作用。如图6所示,当n=8时,直线拟合最好,说明Dy3+→Eu3+的能量传递是通过偶极-四极相互作用来实现的。

采用公式(4)计算能量传递效率[35]:

其中ηT代表能量传递效率,IS0代表Dy3+的发光强度,IS代表存在Eu3+掺杂时Dy3+的发光强度。如图7所示,能量传递效率ηT随着Eu3+掺杂浓度的增加而逐渐升高,当x=0.07时,ηT接近70%,说明从Dy3+到Eu3+能够实现有效地能量传递。

图 6 LiGd(MoO4)2∶0.06Dy3+,xEu3+(x=0.005,0.01,0.03,0.05,0.07)荧光粉中Dy3+的 Iso/Is与(CDy+CEu)6/3,(CDy+CEu)8/3和(CDy+CEu)10/3关系曲线Fig.6 Dependence Iso/Isof Dy3+on(CDy+CEu)6/3,(CDy+CEu)8/3 and(CDy+CEu)10/3in LiGd(MoO4)2∶0.06Dy3+,xEu3+(x=0.005,0.01,0.03,0.05,0.07)phosphors
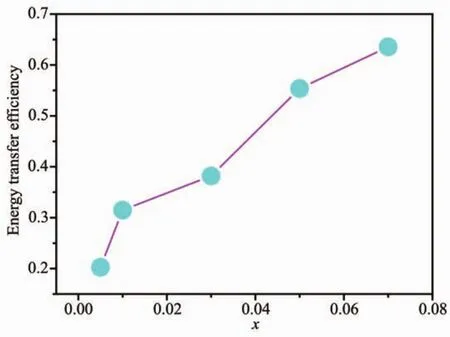
图 7 LiGd(MoO4)2∶0.06Dy3+,xEu3+(x=0.005,0.01,0.03,0.05,0.07)荧光粉的能量传递效率与Eu3+掺杂浓度(x)的关系曲线Fig.7 Dependence of energy-transfer efficiency on Eu3+concentration(x)LiGd(MoO4)2∶0.06Dy3+,xEu3+(x=0.005,0.01,0.03,0.05,0.07)phosphors
图 8 为 LiGd(MoO4)2∶Dy3+,Eu3+荧光粉的能级图,用以说明发光机理和能量传递过程。在354 nm近紫外光激发下,Dy3+吸收了部分近紫外光,从6H15/2能级跃迁到6P7/2能级,处于激发态的稀土离子不稳定,以非辐射形式跃迁到4F9/2能级,然后从4F9/2能级跃迁到基态的6H15/2和6H13/2能级,发射特征蓝光(488 nm)和黄光(575 nm);同时部分能量从 Dy3+的4F9/2能级传递给Eu3+的5D0能级,使Eu3+从5D0能级跃迁到基态的7F2能级,发射特征红光(616 nm)。
适当改变稀土离子的掺杂浓度及掺杂种类有利于实现荧光粉的多色发光,所以对LiGd(MoO4)2∶Dy3+,Eu3+荧光粉进行了色坐标和色温分析。图9为LiGd(MoO4)2∶Dy3+,Eu3+荧光粉的 CIE 色度图,横坐标x表示与红色有关的相对量值,纵坐标y表示与绿色有关的相对量值。对应色坐标和色温详细数据如表1所示。由图9和表1可见,在354 nm激发波长下,样品发光由黄绿光区(点 1、9、10)向暖白光区(点2、3、4、5、6、7、8) 过渡。 暖白光的色温均低于 4 500 K,该色温符合商用暖白光的要求。
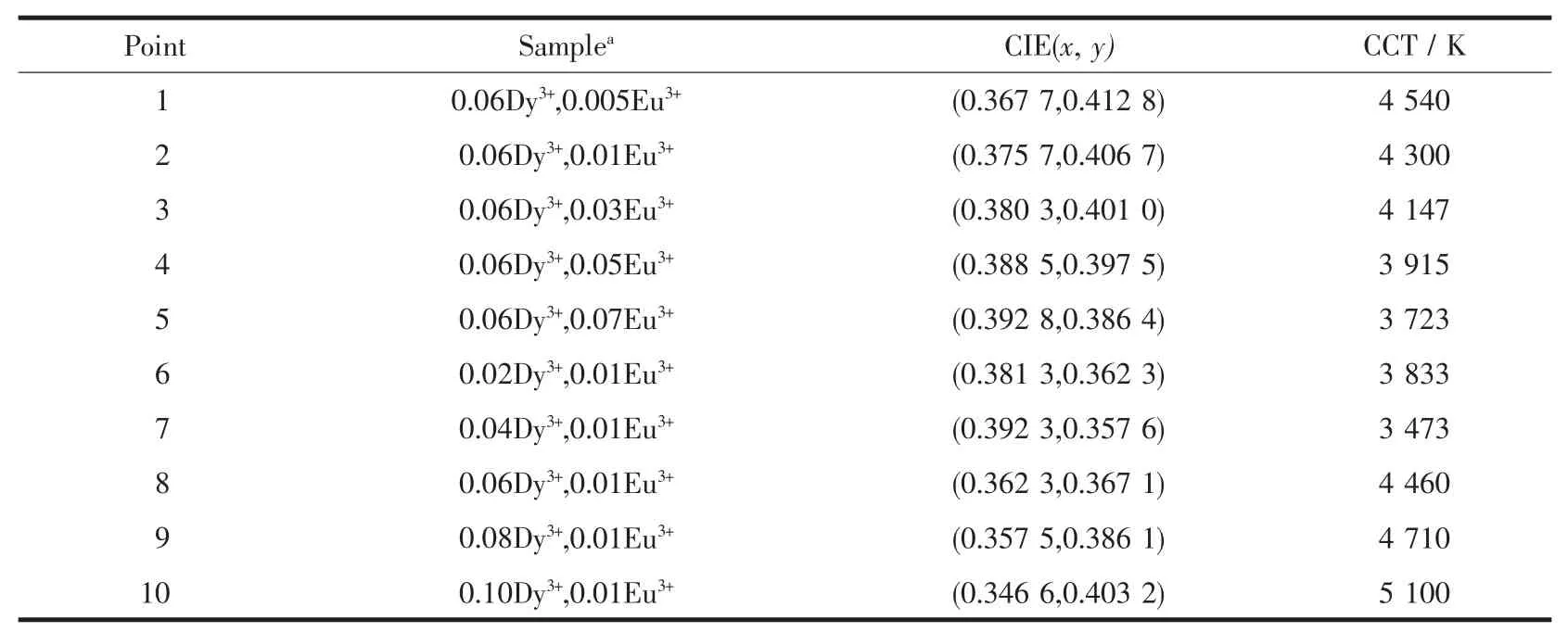
表1 LiGd(MoO4)2∶Dy3+,Eu3+样品的CIE色坐标和相关色温Table 1 CIE chromaticity coordinates and correlated color temperatures for LiGd(MoO4)2∶Dy3+,Eu3+samples

图8 LiGd(MoO4)2∶Dy3+,Eu3+荧光粉的激发发射机理的能级原理图Fig.8 Schematic energy-level diagram showing the excitation and emission mechanism of LiGd(MoO4)2∶Dy3+,Eu3+phosphors
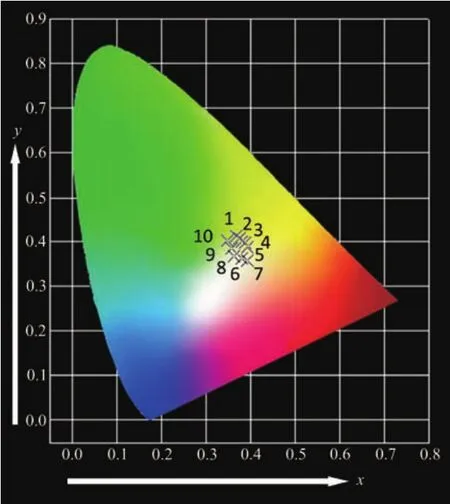
图9 LiGd(MoO4)2∶Dy3+,Eu3+荧光粉在354 nm激发下的色度坐标图Fig.9 CIE chromaticity diagram of the LiGd(MoO4)2∶Dy3+,Eu3+phosphors under 354 nm excitation
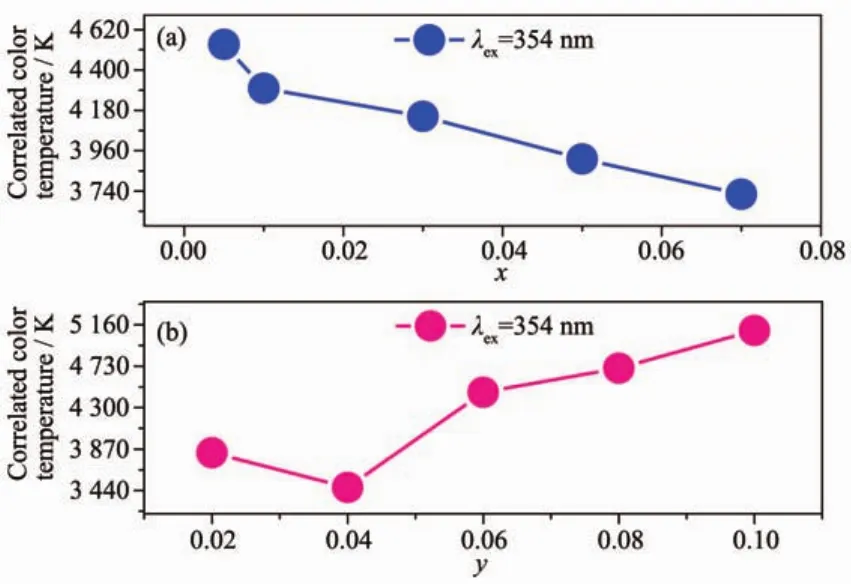
图 10 LiGd(MoO4)2∶0.06Dy3+,xEu3+(a)和 LiGd(MoO4)2∶yDy3+,0.01Eu3+(b)荧光粉在354 nm激发波长下的色温值Fig.10 Correlated color temperature of LiGd(MoO4)2∶0.06Dy3+,xEu3+(a)and LiGd(MoO4)2∶yDy3+,0.01Eu3+(b)phosphors under 354 nm excitation
为了研究Dy3+和Eu3+掺杂浓度对荧光粉色温的影响,图10给出了一系列LiGd(MoO4)2∶0.06Dy3+,xEu3+和 LiGd(MoO4)2∶yDy3+,0.01Eu3+荧光粉在不同掺杂浓度下的色温值。由图10(a)可见,LiGd(MoO4)2∶0.06Dy3+,xEu3+(x=0.005,0.01,0.03,0.05,0.07)所对应的色温值逐渐降低,随着Eu3+的掺杂浓度的增加,提供红色成分增多,从而有效的降低了荧光粉的色温值。由图10(b)可见,随着Dy3+浓度的增加,LiGd(MoO4)2∶yDy3+,0.01Eu3+(y=0.02,0.04,0.06,0.08,0.10)荧光粉的色温值先降低。当y=0.04时,色温值降到最低(图4(b),此时Eu3+的发光最强,提供更多的红色成分),而后色温值逐渐升高,是由于Dy3+提供黄色成分。所以,通过调节Dy3+和Eu3+掺杂浓度,可以有效调节色温以及发光颜色。
3 结 论
采用溶胶-凝胶法合成了一系列LiGd(MoO4)2∶Dy3+,Eu3+荧光粉。XRD和FESEM分析表明:样品结晶良好,属于四方晶系,荧光粉为球形颗粒状,平均粒径为1.8 μm。荧光光谱表明:在354 nm近紫外光激发下,发射光谱中同时出现Dy3+的特征黄、蓝光发射和Eu3+的特征红光发射。Dy3+和Eu3+之间能够发生能量传递,临界距离为1.383 nm,能量传递机理是偶极-四极相互作用,能量传递效率接近70%。CIE色度坐标分析表明:合成的荧光粉可实现暖白光发射,暖白光荧光粉的色温值与Dy3+,Eu3+的掺杂浓度相关。该荧光粉在暖白光LED领域具有潜在的商业价值。
参考文献:
[1]Guan H X,Sheng Y,Song Y H,et al.RSC Adv.,2016,6(77):73160-73169
[2]Zhang Y,Gong W T,Yu J J,et al.RSC Adv.,2015,5(117):96272-96280
[3]Du P,Guo Y,Lee S H,et al.RSC Adv.,2017,7(6):3170-3178
[4]Li J H,Yan J,Wen D W,et al.J.Mater.Chem.C,2016,4(37):8611-8623
[5]Singh B P,Ramakrishna P V,Singh S,et al.RSC Adv.,2015,5(69):55977-55985
[6]Gupta S K,Ghosh P S,Sudarshan K,et al.Dalton Trans.,2015,44(44):19097-19110
[7]Feng X,Feng W L,Xia M,et al.RSC Adv.,2016,6(18):14826-14831
[8]Lim C S,Aleksandrovsky A S,Molokeev M S,et al.Phys.Chem.Chem.Phys.,2015,17(29):19278-19287
[9]Li A M,Xu D K,Lin H,et al.RSC Adv.,2015,5(57):45693-45702
[10]Laguna M,Nuez N O,Becerro A I,et al.CrystEngComm,2017,19(12):1590-1600
[11]Du P,Yu J S.RSC Adv.,2015,5(74):60121-60127
[12]Zhou L,Hu S S,Zhou X J,et al.CrystEngComm,2016,18(39):7590-7600
[13]Luitel H N,Chand R,Hamajimah,et al.J.Mater.Chem.B,2016,4(37):6192-6199
[14]Sun W F,Chen Z H,Zhou J L,et al.Phys.Chem.Chem.Phys.,2016,18(48):33320-33328
[15]LIU Yan(刘艳),JIANG Ying-Ying(姜营营),LIU Gui-Xia(刘桂霞),et al.Chinese J.Inorg.Chem.(无机化学学报),2013,29:277-282
[16]WU Jin-Xiu(吴 锦 绣),LI Mei(李 梅),CUI Song-Song(崔 松松),et al.Chinese J.Inorg.Chem.(无机化学学报),2017,33(2):219-226
[17]ZHOU Xian-Ju(周贤菊),CHEN Jia(陈加),YANG Xiao-Dong(杨小东).Chinese J.Inorg.Chem.(无机化学学报),2012,28(5):932-936
[18]Laguna M,Nuez N O,Rodnguez V,et al.Dalton Trans.,2016,45(41):16354-16365
[19]Wang Z L,Liang H B,Gong M L,et al.J.Alloys Compd.,2007,432(25):308-312
[20]Wang Z L,Liang H B,Gong M L,et al.Opt.Mater.,2007,29(7):896-900
[21]Soni A K,Rai V K.Dalton Trans.,2014,43(36):13563-13570[22]Nadort A,Zhao J G,Goldys E M.Nanoscale,2016,8(27):13099-13130
[23]Qin D,Tang W J.RSC Adv.,2016,6(51):45376-45385
[24]Liu J,Kaczmarekam,Billet J,et al.Dalton Trans.,2016,45(30):12094-12102
[25]Xie W,Liu G X,Dong X T,et al.RSC Adv.,2015,5(95):77866-77872
[26]Liu Y,Liu G X,Dong X T,et al.RSC Adv.,2014,4(102):58708-58716
[27]Cheng F R,Xia Z G,Molokeev M S,et al.Dalton Trans.,2015,44(41):18078-18089
[28]Ren Q,Lin F,Wu X L,et al.Mater.Res.Bull.,2017,90:66-72
[29]Li L L,Zhang J J,Zi W W,et al.Solid State Sci.,2014,29:58-65
[30]Liu Y,Wang Y,Wang L P,et al.RSC Adv.,2014,4(9):4754-4762
[31]Hu W J,Hu F F,Li X Y,et al.RSC Adv.,2016,6(88):84610-84615
[32]Li T,Guo C F,Wu Y R,et al.J.Alloys Compd.,2012,540:107-112
[33]Paulose P I,Jose G,Thomas V,et al.J.Phys.Chem.Solids,2003,64(5):841-846
[34]Dexter D L.J.Chem.Phys.,1953,21(5):836-850
[35]Huang C H,Wu P J,Lee J F,et al.J.Mater.Chem.,2011,21(28):10489-10495

