炔桥联不对称苯基取代双二茂铁衍生物的设计合成和电化学性质
张骁勇 韩利民 高媛媛 贾慧劼 索全伶*,
(1内蒙古工业大学化工学院,呼和浩特 010051)
(2包头师范学院化学学院,包头 014030)
0 引 言
具有特殊夹心结构的二茂铁已被发现60多年,由于二茂铁及其衍生物在光电[1-15]、离子识别[16-17]、催化剂[18-19]等领域均表现出优异的性能,金属茂合物方面的研究工作一直非常活跃。为了探究2个二茂铁基之间的电子交互能力,许多研究者设计构建了多种桥联双二茂铁衍生物。一般来说,在桥联双二茂铁衍生物中,2个二茂铁基之间的氧化电位差值(ΔE)越大,其电子交互作用越强。然而,2个二茂铁基之间的电子交互作用还会受到多种因素影响,它与桥联原子的种类[20-23]、数目[24-25]、分子拓扑结构[26]及环戊二烯环上取代基的种类[27-28]有关(图1)。近年来的研究结果表明,在桥联双二茂铁衍生物中,通过改变桥联基团或取代基的类型,能够调节2个二茂铁基之间的电子交互作用。通过设计合成不同电子传递功能的桥联双二茂铁衍生物,可实现特定功能分子器件(分子开关、分子导线和晶体管等)的制造。一些学者利用偶联反应,制备了系列炔桥联双二茂铁化合物(Fc-(C≡C)n-Fc,n=1,2,3,6),并研究了2个二茂铁基之间的电子交互作用[29-34]。研究结果表明,炔桥接双二茂铁化合物的电子交互能力与2个二茂铁基间炔桥长短有关。n=1时的电子交互作用大于n=2,而当n≥3时,2个二茂铁基之间的电子交互作用消失。迄今为止,通过改变桥接基团类型来调节2个二茂铁基之间电子交互作用的研究较多,而在桥联二茂铁基的环戊二烯环上引入不同数目与种类取代基团,从而调节2个二茂铁基之间电子交互作用的研究相对较少。造成这种结果的主要原因是引入取代基的反应合成步骤长、产率低、副产物多、分离困难。
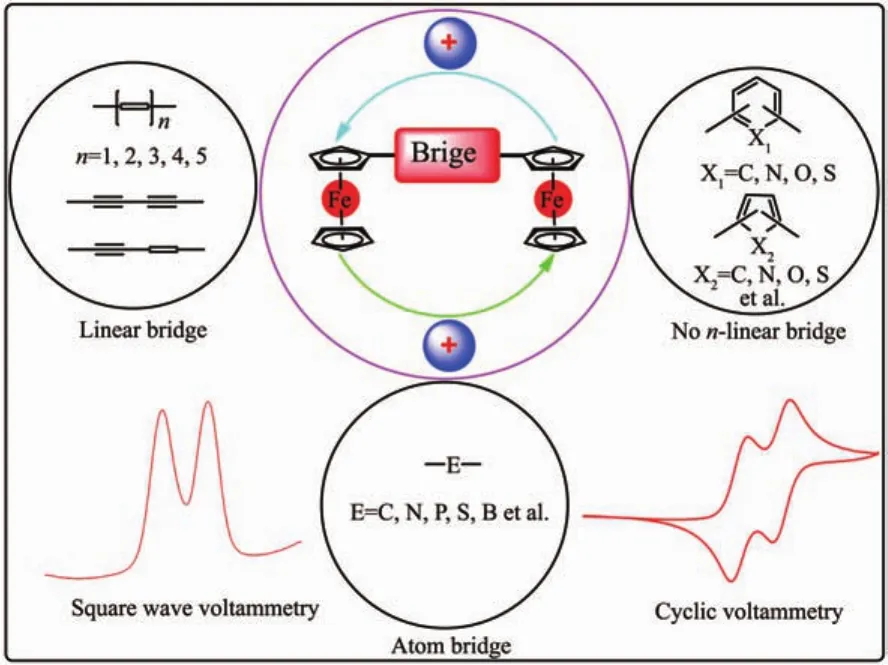
图1 桥接类型对双二茂铁化合物电子交互作用的影响Fig.1 Effect of bridged modality on electrochemical interaction in diferrocenyl compounds
取代二茂铁衍生物的合成和性质研究始于上个世纪中叶。早在1967年,十甲基二茂铁[35]就被人们合成出来。到了1983年,十苯基二茂铁也被发现[36]。由于不对称取代二茂铁衍生物的合成条件较为苛刻,直到1985年,不对称五甲基取代二茂铁衍生物的合成和性质才见报道[37]。1993年,合成了不对称五苯基取代二茂铁衍生物,并研究了它的晶体结构[38]。与二茂铁的电化学氧化电位值(0.511 V)相比,5个供电子的取代甲基会使二茂铁衍生物的氧化电位值(0.420 V)减弱[39],而具有共轭作用的苯取代基则使十苯基取代二茂铁衍生物的氧化电位值(0.743 V)升高[40]。本文研究结果进一步证实,苯基取代也会提高不对称五苯基二茂铁(Fc′H)的电化学氧化电位值(0.658 V)。
为了研究炔桥联双二茂铁衍生物中取代基对2个铁中心电子交互作用能力的影响,本文选择四苯基环戊二烯酮为起始原料,通过7步连续反应,得到了一个未见报道的五苯基不对称取代二茂铁乙炔化合物(7)。再以化合物7为原料,通过交叉偶联反应,设计合成了2种炔桥联五苯基取代双二茂铁衍生物 Fc′-C≡C-Fc(1)和 Fc′-C≡C-C≡C-Fc(2);再利用化合物7的自偶联反应,又得到了一个炔桥联双五苯基取代二茂铁衍生物 Fc′-C≡C-C≡C-Fc′(3)。电化学研究结果表明,不对称取代苯基可提高炔桥联双二茂铁衍生物中2个铁中心之间的电子交互作用能力。本文研究结果可为炔桥联取代双二茂铁衍生物的分子器件设计和相应功能材料的开发提供有价值的基础研究数据。
1 实验部分
1.1 试剂与仪器
实验所用溶剂二氯甲烷、N,N-二甲基甲酰胺(DMF)、石油醚、环己烷等均经脱水、脱氧处理,使用前蒸馏使用。四苯基环戊二烯酮、碘代二茂铁、二茂铁乙炔、叔丁基醇钾、五羰基铁等为市售分析纯试剂。化合物4~7参考文献方法合成[38,41](制备过程见Supporting information)。除特别说明外,反应均在空气中进行,采用TLC技术监测反应进程。选用200~300目硅胶,通过柱层析技术进行反应产物的分离与纯化。
所用仪器包括:Bruker D8 VENTURE X射线单晶衍射仪;美国Nicolet公司FT-IR红外光谱仪(KBr压片);Agilent 500 MHz DD2核磁共振仪 (CDCl3为溶剂,TMS为内标);CH I760C型电化学综合分析仪,三电极系统是由铂丝工作电极、铂对电极(半径1.6 mm)和Ag/AgCl参比电极组成,正四丁基六氟磷酸铵((n-C4H9)4NPF6,NBAPF)为支持电解质。
1.2 化合物1~3的合成
1.2.1 1-二茂铁基-2-五苯基二茂铁基乙炔(1)
在氩气保护下,向25 mL Schlenk反应瓶中依次加入254 mg(0.6 mmol)五苯基二茂铁乙炔Fc′-C≡CH,200 mg(0.6 mmol)碘代二茂铁 FcI,59 mg(0.5 mmol)叔丁基醇钾t-BuOK,然后加入12 mL DMF和2 mL H2O,搅拌、升温,于80℃反应1.5 h。反应结束后,用饱和氯化钠水溶液洗涤3次反应液(每次20 mL),用100 mL二氯甲烷进行萃取,合并有机相。用无水硫酸镁干燥有机相,减压蒸馏除去溶剂。用少量二氯甲烷溶解残余固体,并进行柱层析分离(淋洗剂:V二氯甲烷∶V石油醚=1∶2)。收集橘黄色带, 最终获得107 mg(23%)的橘黄色固体产物 Fc′-C≡C-Fc(1)。 化合物 1 的分析数据:m.p.270~272℃;1H NMR(500 MHz,DMSO):δ 7.16~7.12(m,5H),7.10~7.06(m,10H),7.04~7.02(m,7H),7.00~6.98(m,3H),4.58(s,2H),4.53(s,2H),4.43(s,2H),4.36(s,2H),4.24(s,5H);13C NMR(125 MHz,CDCl3):δ 134.43(5C,Ph),131.58(10C,Ph),126.87(10C,Ph),126.09(5C,Ph),87.56(1C,≡C-Fc′),87.21(1C,≡C-Fc),71.22(1C,Fc′),703.2(2C,Fc′),69.46(2C,Fc′),69.25(5C,Fc′),68.55(1C,Fc),68.13(2C,Fc),68.12(2C,Fc),65.91(5C,Fc);IR(KBr disk,cm-1):3 052(νC-H,Ph and Cp(Fc′and Fc)), 2 166(νC≡C)。
1.2.2 1-二茂铁-4-五苯基二茂铁-1,3-丁二炔 (2)
将84 mg(0.4 mmol)二茂铁乙炔Fc-C≡CH,226 mg(0.4 mmol)五苯基二茂铁乙炔 Fc′-C≡CH,10 mg(0.05 mmol)醋酸铜和10 mL吡啶依次加入到25 mL三口圆底烧瓶中,然后搅拌、升温,于95℃反应5 h。反应结束后,减压除去溶剂,用少量二氯甲烷溶解残余固体,并进行柱层析分离 (淋洗剂:V二氯甲烷∶V石油醚=1∶5)。 收集黄色带,最终获得 121 mg(38%)黄色固体产物Fc′-C≡C-C≡C-Fc(2)。化合物2的分析 数 据 :m.p.256 ~258 ℃ ;1H NMR (500 MHz,DMSO):δ 7.18(t,J=7.5,5H),7.11~7.08(m,10H),7.01(d,J=7.5,10H),4.58(s,2H),4.53(s,2H),4.43(s,2H),4.36(s,2H),4.24(s,5H);13C NMR(125 MHz,DMSO):δ 134.42(5C,Ph),131.96 (10C,Ph),127.37(10C,Ph),126.59(5C,Ph),88.24(1C,Fc′-C≡),79.74(1C,Fc′-C≡C),77.63(1C,Fc′-C ≡C-C≡),77.58(1C,Fc-C≡),76.63(1C,Fc′),74.48(2C,Fc′),72.10(2C,Fc′),70.23(5C,Fc′),69.71(1C,Fc),68.43(2C,Fc),63.24(2C,Fc),62.55(5C,Fc);IR(KBr disk,cm-1):3 060(νC-H,Ph and Cp(Fc′and Fc)),2 213(νC≡C,Fc′-C≡C),2 151(νC≡C,Fc-C≡C)。
1.2.3 1,4-双五苯基二茂铁基-1,3-丁二炔(3)
将226 mg(0.4 mmol)五苯基二茂铁乙炔Fc′-C≡CH,42 mg(0.2 mmol) 碘化亚铜 CuI,26 mg(0.1 mmol)醋 酸 钯 Pd(OAc)2,49 mg(0.2 mmol)三 苯 基 磷PPh3,2 mL二异丙胺和 10 mL 1,4-二氧六环依次加入到25 mL三口圆底烧瓶中,向反应瓶中通入氧气,室温下搅拌反应7.5 h。反应结束后,减压除去溶剂,用少量二氯甲烷溶解残余固体,并进行柱层析分离(淋洗剂:V二氯甲烷∶V石油醚=1∶7)。 收集橘黄色带,最终获得61 mg(26%)橘黄色固体产物Fc′-C≡C-C≡C-Fc′(3)。 化合物 3 的分析数据:m.p.383~385℃;1H NMR(500 MHz,CDCl3):δ 7.13~7.10(m,10H),7.05~7.02(m,40H),4.34(d,J=24.5,1H);13C NMR(125 MHz,CDCl3):δ 134.39(5C,Ph),131.92(10C,Ph),126.88(10C,Ph),125.85(5C,Ph),88.23(4C,-C≡C-C≡C-),77.77(2C,≡C-C≡),77.01(2C,Fc′),76.88(4C,Fc′),75.15(10C,Fc′);IR(KBr disk,cm-1):3 052(νC-H,Ph and Cp(Fc′and Fc)),2 155(νC≡C)。
2 结果与讨论
2.1 合成方法

图2 化合物1~3和5~7的合成Fig.2 Synthesis of compounds 1~3 and 5~7
化合物1~3和5~7的合成反应见图2,已知化合物4的合成反应见Supporting information图S2。在优化文献方法的基础上,合成了中间化合物5~7。首先通过五苯基二茂铁(4)的乙酰化反应,制备得到了乙酰基五苯基二茂铁(5);在POCl3和DMF的作用下,经过Vislsmeier反应,由化合物5得到了五苯基二茂铁氯丙烯醛(6);在氢氧化钠催化下进行烯炔化反应,成功地获得了偶联反应的制备原料五苯基二茂铁乙炔(7)。最后以铜或钯为催化剂,通过传统的偶联反应,制备了目标化合物1~3。在偶联反应中,会同时生成自偶联和交叉偶联产物,导致分离纯化较为困难。
2.2 化合物1、2、5、7的晶体结构
将化合物1、2、5、7的晶体分别溶解于二氯甲烷和正己烷的混合溶剂中,室温下自然挥发,获得了化合物1、2、5、7的单晶。选取大小合适的单晶,置于Bruker D8 VENTURE X射线单晶衍射仪上,用石墨单色器单色化的Mo Kα射线(λ=0.071 073 nm)照射单晶,用φ-ω扫描方式收集单晶衍射数据。采用ApexⅢ软件包进行衍射数据的收集、处理和晶胞参数的确定。利用SHELXS-97程序,经直接法解出晶体结构[42]。用SHELXL-97程序[43]对全部非氢原子坐标及其各向异性温度因子进行全矩阵最小二乘法精修至收敛。化合物1、2、5、7的氢原子全部为理论加氢。化合物1、2的主要晶体数据见表1,主要键长和键角见表2,分子结构分别见图3和图4。化合物5、7的主要晶体学数据见Supporting information的表S1,主要键长和键角见Supporting information的表S2,分子结构分别见Supporting information的图S4和图S5。
CCDC: 1542614, 1; 1542615,2;1546347, 5;1546346,7。
图3A和图4A分别是化合物1和2的分子结构图。由分子结构可知,Fc′基的未取代环戊二烯环(C1-C2-C3-C4-C5)与Fc基的一个环戊二烯环(C8-C9-C10-C11-C12、C10-C11-C12-C13-C14) 分别通过单炔桥(-C6≡C7-)和双炔桥(-C6≡C7-C8≡C9-)相联,构成了炔桥联不对称苯基取代双二茂铁化合物1和2。在化合物1中,通过单炔桥(-C6≡C7-)相连接的2个环戊二烯环(C1-C2-C3-C4-C5、C8-C9-C10-C11-C12) 所在平面夹角为 55.542°(图 3B),2 个金属中心 Fe1到 Fe2的距离为 0.717 6 nm(图 3C),C5-C6-C7与 C6-C7-C8的键角分别为 163.8(6)°和168.6(5)°(表 2)。在化合物 1 中,Fc′与 Fc 基的空间取向趋于反式结构(图3A),而在化合物2中,Fc′与Fc基的空间取向趋于顺式结构 (图4A)。在化合物2中,由双炔桥所连接的2个环戊二烯环所在平面夹角及2个金属中心Fe1到Fe2的距离分别参见图4B和图4C。化合物1和2的键角数据表明,受到两端Fc′与Fc基的空间位阻影响,单炔桥链C5-C6-C7-C8比双炔桥链C5-C6-C7-C8-C9-C10偏离直线型炔链(180°)的程度更大。
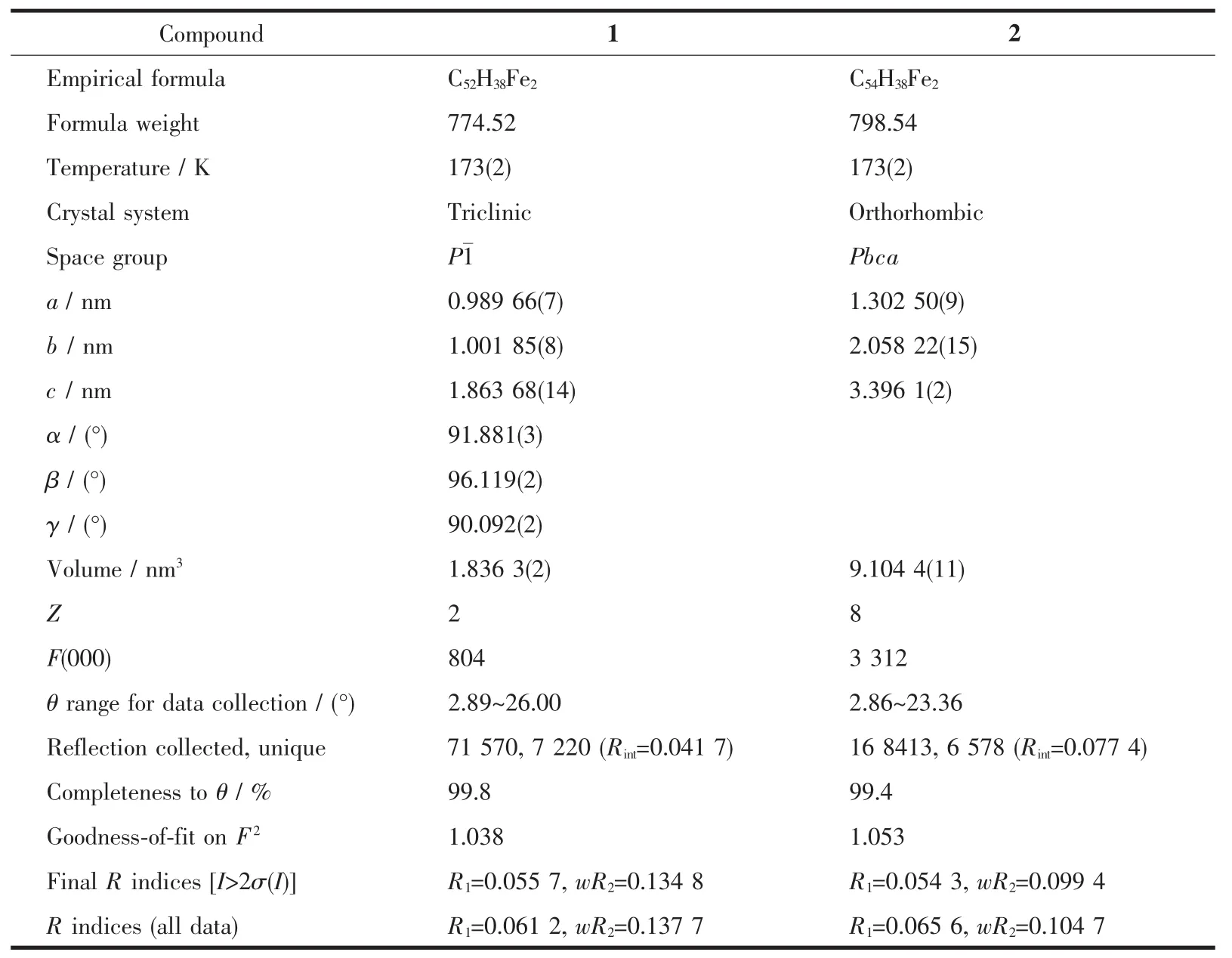
表1 化合物1和2的晶体数据Table 1 Crystallographic data for compounds 1 and 2

表2 化合物1和2的主要键长和键角Table 2 Selected bond lengths(nm)and angles(°)for compounds 1 and 2
通过晶体数据分析可知,在化合物1和2中,由于二茂铁基的一个环戊二烯环被5个苯基取代,导致其分子内均存在较大的空间位阻。由于化合物1和2中2个炔桥长短不一 (化合物2大于化合物1),致使2个化合物分子内的空间位阻不同(化合物2的空间位阻小于化合物1)。由表3可知,在化合物1和2的晶体中,分子间均存在C-H…π键相互作用(图5、图6)。在化合物1中,存在分子间的C-H…π键相互作用(C1-H1…Cg(3)(C13-C14-C15-C16-C17)),同时也存在分子内的C-H…π键相互作用

图3 化合物1的分子结构Fig.3 Molecule structure of compound 1
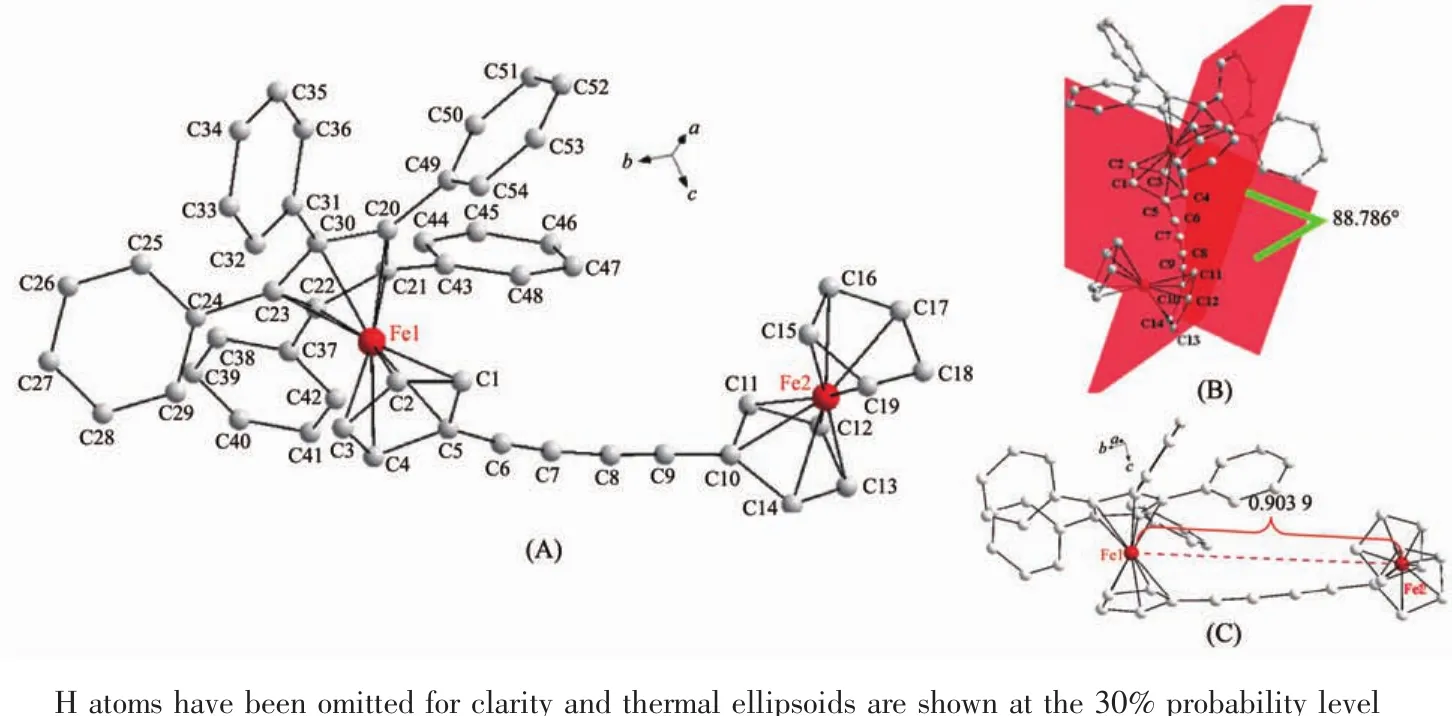
图4 化合物2的分子结构Fig.4 Molecule structure of compound 2
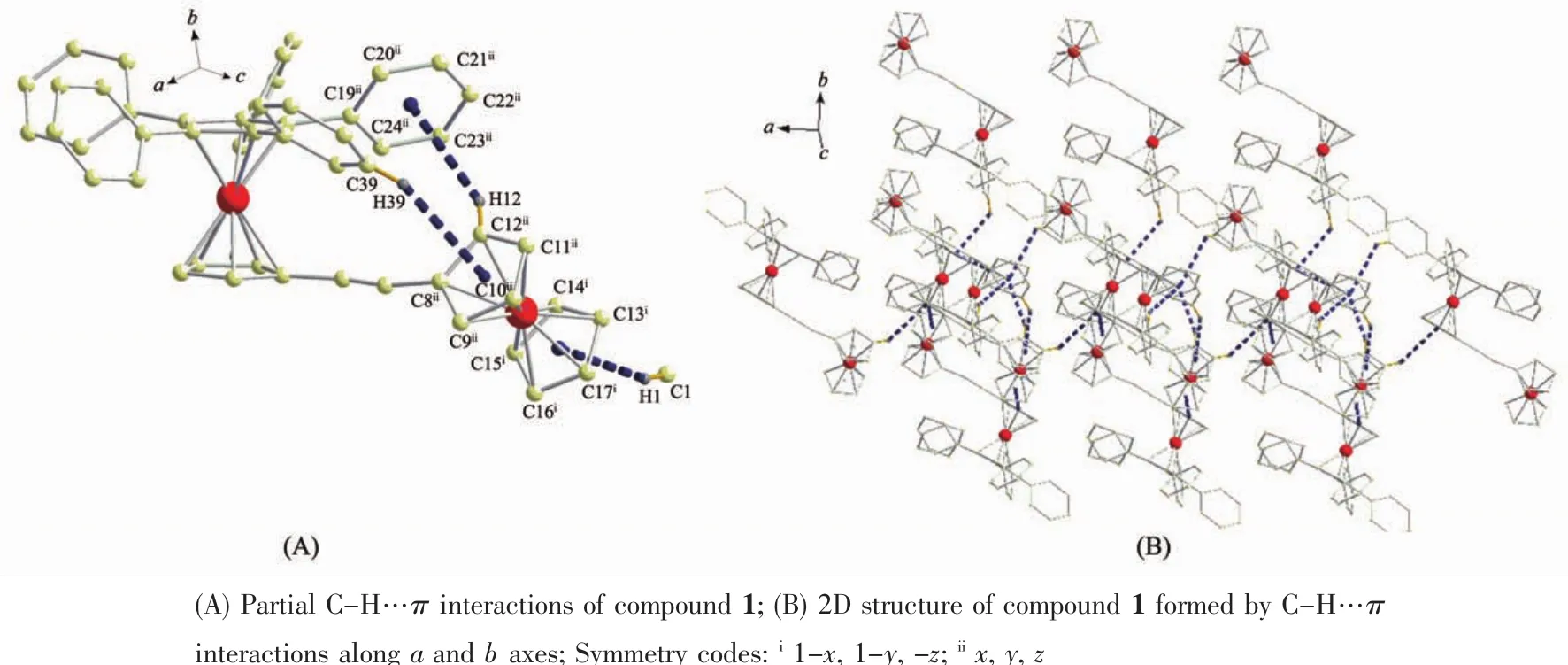
图5 化合物1的C-H…π键相互作用Fig.5 C-H…π interactions of compound 1

图6 化合物2的C-H…π相互作用Fig.6 Partial C-H…π interactions of compound 2

表3 化合物1和2的C-H…π相互作用Table 3 C-H…π interactions geometry for 1 and 2
(C12-H12…Cg(5)(C19-C20-C21-C22-C23-C24)、C39-H39…Cg(2)(C8-C9-C10-C11-C12))(图 5A)。 通过 C-H…π键相互作用,化合物1形成了平行于ab平面的2D结构(图5B)。在化合物2中,由于空间位阻较小,不存在分子内的C-H…π键相互作用,只存在分子间的C-H…π键相互作用 (C16-H16…Cg(6)(C31-C32-C33-C34-C35-C36)、C2-H2 … Cg(3)(C15-C16-C17-C18-C19)、C13-H13…Cg(1)(C1-C2-C3-C4-C5)和 C19-H19…Cg(2)(C10-C11-C12-C13-C14))(图6A)。通过分子间的C-H…π键相互作用,化合物2平行于bc平面的2D网络结构见图6B。
由于分子间与分子内C-H…π键相互作用及空间位阻的共同作用,导致化合物1中的2个Fc′与Fc基团呈现反式结构。而分子间的C-H…π键相互作用与空间位阻共同作用,是导致化合物2分子中Fc′与Fc基团接近垂直,趋向于顺式结构的主要影响因素。
2.3 电化学性质
利用循环伏安法,分别以铂电极(半径1.6 mm)为对电极、Ag/AgCl电极为参比电极及铂丝为工作电极,以NBAPF(0.5 mol·L-1)为支持电解质,在 298 K测定了化合物1~4和二茂铁的电化学性质,测定结果及循环伏安图分别见表4和图7。
化合物 1~3(Fc′-C≡C-Fc、Fc′-C≡C-C≡C-Fc、Fc′-C≡C-C≡C-Fc′)的电化学反应方程式见图 8。 与已知化合物(Fc-C≡C-Fc、Fc-C≡C-C≡C-Fc)[29,34]的循环伏安曲线类似,在0~1.4 V范围内,化合物1~3均呈现2对氧化还原峰(图7)。由于每对氧化还原峰的峰电流值之比(Ipa/Ipc)均接近于1(表4),表明在化合物1~3中,其二茂铁基的氧化还原过程可逆,并经历了2步两电子的氧化还原过程(图8)。由于五苯基取代二茂铁(4)的氧化电位值(0.658 V)高于二茂铁的电位值(0.511 V)(表4),表明Fc′比Fc基难于氧化。我们推测,在化合物1~2的电化学氧化还原过程中,炔桥两端的二茂铁基首先被氧化,然后,五苯基取代二茂铁基才被氧化(图7)。
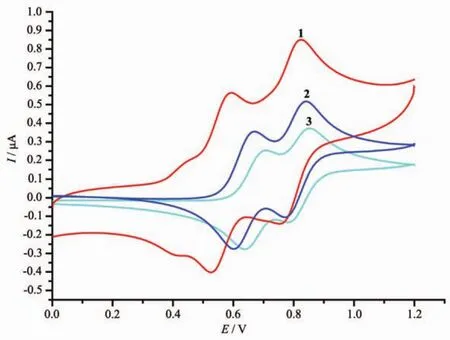
图7 化合物1~3的循环伏安曲线Fig.7 Cyclic voltammetry curves of compounds 1~3
与已知化合物Fc-C≡C-Fc的晶体结构数据[44]相比,由于苯基的不对称引入,导致化合物1中的单炔桥(C5-C6-C7-C8)偏离线性。在炔桥联双二茂铁衍生物 Fc-C≡C-Fc 和 Fc′-C≡C-Fc(1)中,前者的共平面性更好。据文献报道[45],共面性越好,炔桥联两端二茂铁基之间的电子交互作用越强。但是,我们的电化学测定结果(表 4)显示,Fc′-C≡C-Fc(1)之间的氧化电位差值ΔE(0.236 V)要大于共平面性较好的化合物Fc-C≡C-Fc(ΔE=0.215 V)。导致这种结果的主要原因是化合物1中2个铁中心的距离(0.717 6 nm)小于Fc-C≡C-Fc中2个铁中心的距离(0.731 1 nm)。
当炔桥延长变为双炔桥时,其两端所桥联的2个二茂铁单元之间仍存在电子交互作用。电化学测定结果表明,化合物 Fc′-C≡C-C≡C-Fc(2)和 Fc′-C≡C-C≡C-Fc′(3)的氧化电位差值 ΔE(2,0.236 V;3,0.146 V)(表4)均大于已知化合物 Fc-C≡C-C≡CFc的ΔE值(0.134 V)[46]。我们推测,这一结果与2个化合物中铁原子中心间距(2,0.903 9 nm;Fc-C≡CC≡C-Fc,0.977 9 nm)有关,2个铁原子的中心间距越短,ΔE值越大,电子交互作用越强。当炔桥两端桥联不同的二茂铁单元 (Fc′-C≡C-Fc与Fc′-C≡CC≡C-Fc)时,其相应的ΔE值较大。炔桥联苯基取代双二茂铁化合物 Fc′-C≡C-C≡C-Fc′(3)的 ΔE 值大于未取代的炔桥联双二茂铁化合物Fc-C≡C-C≡C-Fc。

表4 化合物1~4的电化学数据Table 4 Electrochemical data for compounds1~4
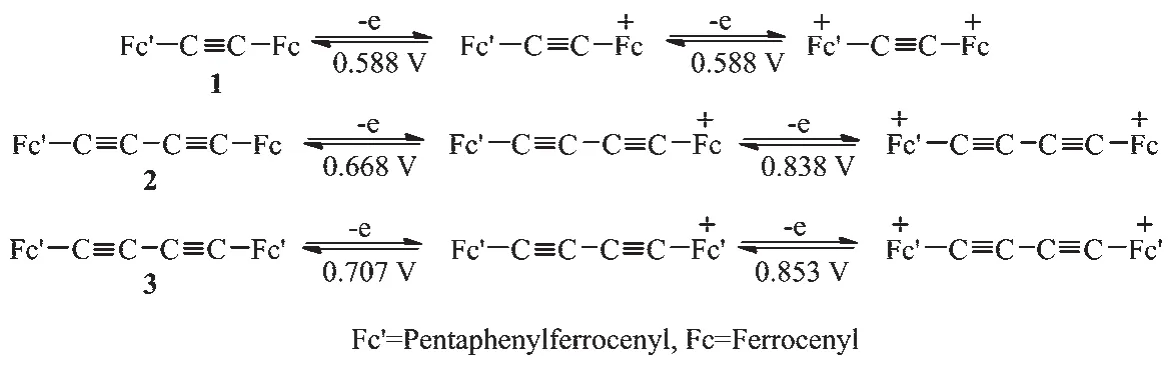
图8 化合物1~3的可逆氧化还原反应Fig.8 Reversible redox reactions of compounds 1~3
3 结 论
以四苯基环戊二烯酮为起始原料,经过8步精心设计的连续反应,合成了3种炔桥联苯基不对称取代双二茂铁衍生物1~3,并利用循环伏安法,研究了所制备化合物的电化学性质。利用X射线单晶衍射技术,测定了化合物1、2、5、7的晶体结构,并研究了晶体结构与电化学性质之间的关系。研究结果表明,晶体分子中的C-H…π相互作用和空间位阻共同作用导致了化合物1分子中Fc′和Fc基团采用反式空间排布,而化合物2分子中Fc′和Fc基团采取顺式空间排布。在炔桥联双二茂铁衍生物中,当炔桥两端桥接不同的二茂铁单元时,其电子交互作用较强;当炔桥两端桥接相同的二茂铁单元时,其电子交互作用较弱。炔桥联双二茂铁衍生物中2个铁中心的距离是影响其电子交互能力的关键因素。
Supporting information is available at http://www.wjhxxb.cn
参考文献:
[1]CAI Wen-Fei(蔡文飞),ZHANG Xin(张鑫),YAN Lu(颜璐),et al.Chinese J.Inorg.Chem.(无机化学学报),2014,30(9):2225-2230
[2]Muratsugu S,Kume S,Nishihara H.J.Am.Chem.Soc.,2008,130(23):7204-7205
[3]Celedón S,Fuentealba M,Roisnel T,et al.Eur.J.Inorg.Chem.,2016(18):3012-3023
[4]Ding Y,Zhao Y,Li Y T,et al.Energy Environ.Sci.,2017,10(2):491-497
[5]Ding Y,Zhao Y,Yu G H.Nano Lett.,2015,15(6):4108-4113
[6]Park K S,Schougaard S B,Goodenough J B.Adv.Mater.,2007,19(6):848-951
[7]Su C,Ji L L,Xu L H,et al.RSC Adv.,2015,5(18):14053-14060
[8]PAN Rui-Long(潘瑞龙),WANG Hui(王慧),ZOU Yan(邹艳),et al.Chinese J.Inorg.Chem.(无机化学学报),2014,30(2):251-256
[9]Zhong H,Wang G F,Song Z P,et al.Chem.Commun.,2014,50(51):6768-6770
[10]Evans N H,Beer P D.Angew.Chem.Int.Ed.,2014,53(44):11716-11754
[11]Evans N H,Serpell C J,White N G,et al.Chem.Eur.J.,2011,17(44):12347-12354
[12]ZHU Jia-Li(朱佳丽),ZHANG Xiu-Feng(张秀风),FANG Yuan-Yuan(房媛媛),et al.Chinese J.Inorg.Chem.(无机化学学报),2013,29(2):199-205
[13]Otón F,Tárraga A,Espinosa A,et al.J.Org.Chem.,2006,71(12):4590-4598
[14]Jayaprakash K N,Ray P C,Matsuoka I,et al.Organometallics,1999,18(19):3851-3858
[15]Novoa N,Roisnel T,Hamon P,et al.Dalton Trans.,2015,44(41):18019-18037
[16]Zapata F,Caballero A,Espinosa A,et al.J.Org.Chem.,2008,73(11):4034-4044
[17]Beer P D,Hayes E J.Coord.Chem.Rev.,2003,240(1/2):167-189
[18]Han L M,Ke C L,Zhang D Z,et al.Polyhedron,2015,85:621-626
[19]Hayashi T,Konishi M,Kobori Y,et al.J.Am.Chem.Soc.,1984,106(1):158-163
[20]Xie R J,Han L M,Suo Q L,et al.J.Coord.Chem.,2010,63(10):1700-1710
[21]Dwadnia N,Allouch F,Pirio N,et al.Organometallics,2013,32(20):5784-5797
[22]Herrero M,Sevilla R,Casado C M,et al.Organometallics,2013,32(20):5826-5833
[23]Brua S,Perles J,Nieto D,et al.J.Organomet.Chem.,2014,751:769-780
[24]Ribou A C,Launay J P,Sachtleben M L,et al.Inorg.Chem.,1996,35(13):3735-3740
[25]Skibar W,Kopacka H,Wurst K,et al.Organometallics,2014,23(5):1024-1041
[26]Patoux C,Coudret C,Launay J P,et al.Inorg.Chem.,1997,36(22):5037-5049
[27]Kaufmann L,Vitze H,Bolte M,et al.Organometallics,2008,27(23):6215-6221
[28]Venkatasubbaiah K,Doshi A,Nowik I,et al.Chem.Eur.J.,2008,14(2):444-458
[29]Shah H H,Al-Balushi R A,Al-Suti M K,et al.Inorg.Chem.,2013,52(9):4898-4908
[30]Donoli A,Bisello A,Cardena R,et al.Inorg.Chim.Acta,2011,374(1):442-446
[31]Xu G L,Xi B,Updegraff J B,et al.Organometallics,2006,25(22):5213-5215
[32]Adams R D,Qu B,Smith M D.Organometallics,2002,21(19):3867-3872
[33]Wang D,Li J H,Li N,et al.Green Chem.,2010,12(1):45-48
[34]Levanda C,Bechgaard K,Cowan D O.J.Org.Chem.,1976,41(16):2700-2704
[35]King R B,Bisnette M B.J.Organomet.Chem.,1967,8(2):287-297
[36]Slocum D W,Johnson S,Matusz M,et al.Polym.Mater.Sci.Eng.,1983,49:353-357
[37]Bunel E E,Valle L,Manriquet J M.Organometallics,1985,4(9):1680-1682
[38]Aroney M J,Buys I E,Dennis G D,et al.Polyhedron,1993,12:2051-2056
[39]Bildstein B,Hradsky A,Kopacka H,et al.J.Organomet.Chem.,1997,540(1/2):127-145
[40]Schumann H,Lentz A,Weimann R,et al.Angew.Chem.Int.Ed.,1994,33(17):1731-1733
[41]Polin J,Schottenberger H.Org.Synth.,1996,73:262
[42]Sheldrick G M.SHELXS-97,UniversityofGöttingen,Germany,1997.
[43]Sheldrick G M.SHELXL-97,UniversityofGöttingen,Germany,1997.
[44]Kotora M,Necˇas D, Štěpnicˇka P.Collect.Czech.Chem.Commun.,2003,68(10):1897-1903
[45]Hildebrandt A,Schaarschmidt D,Claus R,et al.Inorg.Chem.,2011,50(21):10623-10632
[46]Rodriguez J G,Oñate A,Martin-Villamil R M.J.Organomet.Chem.,1996,513(1/2):71-76

