联合化疗与光动力治疗于一体的水溶性铜ギ、镍ギ酞菁的合成及体外抗癌活性
潘佳宝 陈 曦 方文娟 刘 伟 于光伟
(山东大学晶体材料国家重点实验室,济南 250100)
0 引 言
当今,集多效于一体的抗癌药物是现代肿瘤治疗的新兴研究热点。 通过将不同治疗机理应用到同一药物中,可以发挥不同治疗手段的协同作用,从而达到高效抗癌活性[1-6]。
光动力治疗(photodynamic therapy,PDT)是一种20世纪70年代发展起来的癌症治疗手段,它利用光激发癌细胞内部吸收的光敏剂,产生高细胞毒性的单线态氧,从而在细胞内部杀死癌细胞,以达到治疗肿瘤目的[7-8]。与传统癌症治疗手段相比,这种疗法可以避免对正常组织造成伤害,且不会在体内积累,可以反复治疗,并能与其他疗法同时使用。PDT光敏剂中,酞菁由于其理化性质稳定,在红光有强吸收,单线态产率高以及皮肤光敏作用短等特点,是继临床应用最广泛的卟啉类光敏剂之后最具有应用潜力的新生代光敏剂之一[9-11]。其中,部分酞菁类配合物已经应用到一期和二期临床试验中,并表现出良好的抗肿瘤效果。
另一方面,自从20世纪60年代末顺铂被发现具有良好的肿瘤抑制作用以来,基于金属配合物的抗癌药物的研究日益引起人们的重视。近年来众多研究结果已证实铜、镍、锗、钼、钯、镍等金属及其配合物同样具有良好的抗肿瘤、抗菌等活性[12-14]。其中,铜和镍作为生命必须微量元素,参与到多项生命活动中,扮演着重要的角色。因此,关于铜和镍配合物的抗菌及抗癌活性的研究已经成为抗肿瘤药物的研究重点之一,并逐渐吸引愈来愈多的药物工作者的研究兴趣。但是,迄今为止,关于酞菁类抗癌药物的研究主要集中在锌、硅等酞菁上,对于铜、镍、锗、钼、钯、镍等过渡金属酞菁的抗癌活性的研究至今鲜见报道[15]。
鉴于铜、镍金属配合物的抗菌和抗肿瘤效应,我们首次合成水溶性铜(CuPc)、镍酞菁(NiPc)配合物,在对其进行了表征的基础上研究了其光化学物理特性以及对肿瘤细胞杀伤力。以期将金属配合物的抗癌活性与光动力治疗特性相结合,得到集多效为一体的抗癌药物。
1 实验部分
1.1 仪器和试剂
所用仪器有:Bruker AVANCE 300 MHz核磁共振仪;Thermo NEXUS 670 IR Spectrometer红外光谱仪;Vario EIⅢ元素分析仪;PerkinElmer Diamond TG/DTA Analyzer热重分析;Perkin Elmer Lambda 35紫外-可见光谱仪;Shimadzu AXIMA-CFR PLUS质谱仪;Bio-TEK ELX 800 microplate reader酶标仪。
实验中所用试剂均为分析纯,反应中所有溶剂都按照溶剂手册进行蒸馏除水。
1.2 合 成
1.2.1 前置配体3的合成[16]
称取 4,5-二氯邻苯二腈(2.0 g,10.2 mmol),与 5-羟基间苯二甲酸甲酯(4.3 g,20.4 mmol)混合、加入碳酸钾(16.6 g,0.12 mol)、DMF(45 mL),65 ℃条件下反应16 h。减压抽干DMF,加水过滤得浅棕色固体。将粗产物在甲醇中重结晶,真空干燥,得到白色固体即为化合物 3。1H NMR(300 MHz,CDCl3,TMS):δ 8.56 ~8.55(br,2H,Ar-H),7.83 ~7.82(br,4H,Ar-H),7.33~7.26(br,2H,Ar-H),3.97(s,12H,CH3)。
1.2.2 铜酞菁4的合成
将化合物 3(0.52 g,0.96 mmol)、100 μL 的 DBU、10 mL正戊醇混合,升温至150℃,氮气保护下反应15 h,得到墨绿色溶液后,往体系中加入乙酸铜(0.85 g,4.40 mmol),5 h后停止反应。减压蒸馏,60 ℃条件下抽干戊醇。加入适量甲醇超声后,过滤得到绿色固体,将得到的固体使用硅胶柱进行柱色谱分离提纯,洗脱剂为氯仿+乙酸乙酯(20∶1,V/V)。 得到铜酞菁 4为 255 mg, 产率为 34%。MALDI-TOF/MS:C176H208N8O40Cu[M+],m/z: 计算值 3 136.37,实验值3 136.61。元素分析按C176H208N8O40Cu计算值(%):C 67.34;H,6.68 N,3.57;实验值(%):C 67.1;H 6.0;N 3.1;UV-Vis(CHCl3,λmax/nm):344,610,646,677。
1.2.3 镍酞菁5的合成
将化合物 3(0.52 g,0.96 mmol)、乙酸镍(0.08 g,0.45 mmol)混合,加入 100 μL的 DBU和 10 mL正戊醇,氮气保护下升温至150℃反应10 h。反应结束后进行减压蒸馏,60℃ 条件下抽干戊醇,在反应瓶中加满甲醇,超声过滤,收集到的滤渣,以氯仿+乙酸乙酯(10∶1,V/V)为洗脱剂进行柱色谱分离提纯。得到绿色固体5为304 mg,产率为40%。1H NMR(300 MHz,CDCl3,TMS):δ 8.60(s,8H,Ar-H),8.15(s,8H,Ar-H),7.99(s,16H,Ar-H),4.19(m 32H,16OCH2),1.69~1.65(m,32H,16CH2),1.31~1.20(m,64H,16CH2CH2),0.76~0.73(t,J=5.3 Hz,48H,16CH3);MALDI-TOF/MS:C176H208N8O40Ni[M+],m/z: 计算值 3 131.38, 实验值3 131.39;元素分析按 C176H208N8O40Ni计算值(%):C 67.4,H 6.7,N 3.4;实验值:C 67.6,H 6.7,N 3.4;UVVis(CHCl3,λmax/nm):297,603,641,667。
1.2.4 水溶性铜酞菁6和镍酞菁7的合成

Scheme 1
按照甲醇+水 (10∶1,V/V)的比例配制溶液400 mL,往其中加入50.0 g氢氧化钠配成饱和氢氧化钠溶液。将配好的饱和溶液转移到反应釜中,将CuPc 4或者NiPc 5(0.10 mmol)用少量THF(5 mL)溶解,逐滴加入到上述的碱溶液中,搅拌升温至 45℃,氮气保护下反应6 h。反应结束后过滤,粗产物用100 mL去离子水溶解后用1 mol·L-1的稀盐酸溶液调节pH值为2~3,溶液中有大量蓝色沉淀出现,将得到的沉淀离心收集,用水反复冲洗。真空下除去残留的溶剂,得到目标产物。CuPc 6:MALDI-TOF/MS:C96H48N8O40Cu[M+H+],m/z:计算值 2 016.13,实验值2 016.51;IR(cm-1):2 918,2 805,2 567,1 699,1 591,1 508,1 455,1 407,1 273,1 221,1 173,1 144,1 092,1 042,1 001,971,892,827,759,747,667;元素分析按 C96H48N8O40Cu 计算值(%):C 57.2,H 2.4,N 5.6;实验值:C 59.6,H 2.2,N 5.3;UV-Vis(DMF,λmax/nm):351,612,647,685。 NiPc 7:1H NMR(400 MHz,DMSO-d6,TMS):δ 13.04(br,16H,COOH),8.63(s,8H,Ar-H),7.97(s,8H,Ar-H),7.84(s,16H,Ar-H);MALDI-TOF/MS:C96H48N8O40Ni[M+H+],m/z:计算值2 011.13,实验值2 011.32;IR(cm-1):3 076,2 607,1 706,1 593,1 536,1 458,1 417,1 354,1 278,1 147,1 094,1 054,1 001,973,887,831,753,668; 元素分析按 C96H48N8O40Ni计算值 (%):C 57.30,H 2.40,N 5.57; 实验值 (%):C 57.6,H 2.1,N 5.5。UV-Vis(DMF,λmax/nm):303,608,645,672 nm。
1.3 单线态氧测试
以1,3二苯基异苯并呋喃(DPBF)为单线态氧捕获剂,光源使用150 W配有610 nm截止型滤波片(λ>610 nm)的卤素灯。以30 s为一个时间间隔使用光源照射,记录溶液的紫外可见光谱。单线态氧量子产率计算公式如下:
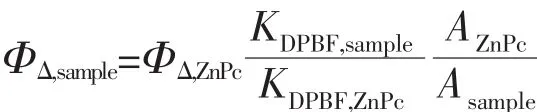
其中,KDPBF,sample和KDPBF,ZnPc分别为样品和ZnPc存在时DPBF分解速率常数,Asample和AZnPc分别为样品和ZnPc在610~720 nm波长范围内的Q带吸收峰的面积,ΦΔ,ZnPc=0.56。
1.4 生物测试
1.4.1 细胞培养条件
实验所用细胞为宫颈癌细胞Hela,培养条件为:培养环境为温度37℃,5%(V/V)二氧化碳的恒温培养箱,培养基使用添加了10%小牛血清和1%双抗(青霉素 100 units·mL-1,链霉素 100 μg·mL-1)的DMEM高糖培养基。使用细胞计数板对培养基中的细胞进行计数,使得培养基中细胞浓度105mL-1。取培养基加入96孔板,每孔100 μL,将加好细胞的孔板放入恒温培养箱培养过夜。
1.4.2 抗癌活性实验
合成的CuPc 6和NiPc 7酞菁样品溶于磷酸盐缓冲溶液(PBS)中配制成母液,然后用细胞培养液稀释到所需要的浓度。金属盐对比组CuCl2、NiCl2溶于PBS中。不同浓度的样品在96孔培养板中与细胞共同培养4 h、24 h后移除,以PBS洗细胞3次,光照组加入培养基后用LED光源连续照射20 min(总能量24 J·cm-2),然后继续恒温培养24 h;避光组、金属盐对照组除光照外,其他步骤相同。最后,每孔中加入 20 μL 浓度 5 mg·mL-1MTT 的 PBS,再次恒温培养4 h后,每孔加入200 μL DMSO,在水平摇床上晃动20 min。使用酶标仪测试孔板在492 nm处的吸光度。作图并计算细胞的成活率。1.4.3 细胞吸收实验
将培养好的Hela细胞利用细胞计数板对培养基中细胞进行计数,使培养基中的细胞数目约为3×104mL-1。稀释好的细胞液加入直径为35 mm的6孔板中,每孔加1 mL,每个样品平行培养3组作为平行实验。接着将孔板放入恒温培养箱中培养过夜,使得细胞贴壁。将细胞完全贴壁的孔板取出,吸出培养基,向培养皿中加入含样品 (浓度为10 μmol·L-1)的培养基 1 mL,恒温培养4 h。 取出孔板,吸出其中的培养基,用PBS冲洗3次,利用细胞刮板将细胞小心刮起,分别转移到2 mL的离心管中冷冻干燥。细胞液冻干后,向每个离心管中加入DMF溶液400 μL,超声30 min。随后用离心机离心,设置转速13 000 r·min-1离心4 min,将细胞器以及细胞碎片完全除去,随后测定上清液的紫外吸收光谱并计算细胞中样品的含量。
2 结果与讨论
2.1 合 成
通过在酞菁骨架上引入水溶性基团,可以减弱酞菁分子间的π-π相互作用,有效改善溶解性能。本文首先以金属盐为模板,通过配体4,5-(3,5二甲氧基羰基)苯氧基邻苯二腈3的对称合成得到金属酞菁。在合成CuPc 4时发现,不同于以往配体、DBU、溶剂、金属盐同时加入的模板反应,铜酞菁的产率极低。然后,我们将反应步骤改为在无金属盐存在下,以前置配体、DBU、溶剂先合成非金属酞菁,然后再加入金属盐合成金属酞菁,这种方法较大地提高了铜酞菁的纯度和产率。 分析原因为,前置配体3中的大量酯基会参与到Cuギ的配位中,从而影响到铜离子的模板的作用,降低了前置配体的成环率。然而,同样的情况下,在镍酞菁5的合成过程中,同时加入原料、催化剂和金属盐,对镍酞菁的成环率影响不大。
水溶性酞菁的合成则是分别以铜酞菁4和镍酞菁5原料,在强碱性条件下发生水解反应,粗产物再用盐酸调节pH值为2~3,由于羧基在酸性溶液中被质子化,从而从水中沉淀出来,最后得到CuPc 6 和 NiPc 7(Scheme 1)。
2.2 紫外-可见光谱分析
图1为未水解的CuPc 4和NiPc 5在CHCl3溶液中和水解后CuPc 6和NiPc 7在水中的紫外可见吸收谱图对比。可以看出,6在水中与4在CHCl3中表现出相似的峰型,为非常典型的酞菁非聚集态谱图(图1a)[8-9],证明其能够在无任何助溶剂存在下就能以单体的形式存在,是一类全水溶性酞菁。铜酞菁4和6的B带吸收峰分别位于344和351 nm,Q带吸收峰位于677和685 nm,显示水解后酞菁6在水中的吸收峰具有约10 nm的红移。镍酞菁相比较于铜酞菁,其吸收峰值发生了一定量的蓝移。镍酞菁5和7的B带吸收峰位都位于300 nm,Q带吸收峰分别位于668和672 nm(图1b),显示水解后的镍酞菁在水中的吸收峰同样发生红移。与铜酞菁6一样,镍酞菁7在水中同样以单体形式存在,是一类水溶性酞菁。而生物所用的培养液与生理环境相匹配,其pH=7.4,在该pH值下,酞菁上的羧基被水解成为羧酸根,所以该类酞菁具有优异的水溶性。
另外,浓度-吸收关系测试说明,CuPc 6和NiPc 7溶液的吸光度与样品浓度满足朗伯-比尔定律(图2),所以在细胞吸收实验中我们可以依据该线性关系,通过吸收值来确定细胞对的样品的吸收。

图1 (a)水解前铜酞菁4和水解后铜酞菁6的紫外光谱;(b)水解前镍酞菁5和水解后镍酞菁7的紫外光谱Fig.1 (a)UV-Vis absorption spectra of CuPc 4 and 6;(b)UV-Vis absorption spectra of NiPc 5 and 7
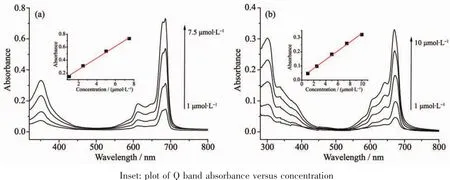
图2 铜酞菁6(a)和镍酞菁7(b)在DMF中的紫外吸收光谱Fig.2 Electronic absorption spectra of CuPc 6(a)and NiPc 7(b)in DMF
2.3 单线态氧测试
将 DPBF 配制成浓度为 40 μmol·L-1的 DMF 溶液,分别加入样品CuPc 6或NiPc 7,使酞菁最终浓度为 5 μmol·L-1,以 30 s为一个时间间隔使用光源照射,测试溶液的紫外可见光谱。如图3所示,随着光照时间的延长溶液中DPBF吸收峰逐渐减小,而酞菁的吸收峰没有明显的变化,这说明在这一光照条件下,铜酞菁都能够有效产生单线态氧,同时自身不会分解。图4为铜酞菁6和镍酞菁7单线态氧产率比较,从图中可以看出,CuPc 6的单线态氧产率明显高于NiPc 7。

图4 DPBF在CuPc 6或NiPc 7存在时吸收峰值(415 nm)随时间的变化Fig.4 Absorbance of DPBF(415 nm)changes over time in the presence of CuPc 6 or NiPc 7
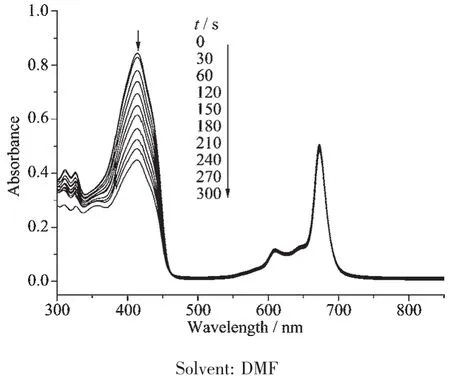
图3 单线态氧测试过程中DPBF中加入CuPc 6时吸收峰随光照时间的变化Fig.3 Absorption changes of DPBFupon exposure to red light in the presence of CuPc 6 for determination of singlet oxygen generation
2.4 稳定性测试
2.4.1 光稳定性测试
在光照下酞菁如果能保持自身结构的完整性,具有良好的稳定性,那么在光动力治疗过程中酞菁就不发生分解,保证药物作用的持续性,所以光稳定性是光敏剂的重要指标之一。将CuPc 6、NiPc 7和ZnPc分别溶于DMF中,使用配有610 nm截止型滤波片(λ>610 nm)的卤素灯光源进行测试。每隔10 min测定酞菁溶液的吸光度的变化,以ZnPc作为对照组,可以判断CuPc 6和NiPc 7两种样品的光稳定性。测试结果表明,在相同的实验条件下,用来作为对比的ZnPc随着光照时间的延长大量分解,60 min时已经分解50%,而合成的CuPc 6和NiPc 7在光照60 min后没有明显分解,具有更强的光稳定性(图5)。
2.4.2 热稳定性测试
为了分析该类酞菁的热稳定性,我们对其做了热重分析。以铜酞菁为例,水解前和水解后的铜酞菁热重曲线如图6所示。可以看出,铜酞菁4由于大量烷基碳链的存在,开始分解温度大约为370℃。对于水解后的铜酞菁6,在400℃以后才开始分解,比铜酞菁4初始分解温度有提高。总的来说,该类酞菁对热是十分稳定的。

图5 铜酞菁6(a)和镍酞菁7(b)在DMF溶液中不同光照时间下的紫外可见光谱图Fig.5 UV-Vis absorption spectra of CuPc 6(a)and NiPc 7(b)under different illumination times in DMF

图6 铜酞菁4(a)与6(b)和镍酞菁5(c)与7(d)的热重分析(TG-DTA)曲线Fig.6 TG-DTA curves of CuPc 4(a),6(b)and NiPc 5(c),7(d)
2.5 细胞实验
2.5.1 避光肿瘤细胞抑制测试
在该部分实验中选用了宫颈癌细胞Hela作为细胞主体。为了更好的比较该类铜酞菁6和镍酞菁7对癌细胞的抑制作用,同时测试了铜离子(Cu2+)和镍离子(Ni2+)对hela细胞的毒性。从图7a可以看出,铜离子(Cu2+)和镍离子(Ni2+)样品与细胞共同培养时间为 4 h 后,即使浓度达到 50 μmol·L-1,2 种金属离子对于癌细胞抑制效果仍然很微弱。这主要是由于在生理pH=7.4下,铜和镍离子都几乎以沉淀形式析出,所以直接利用金属离子进行抗癌是不可行的。与之对比,2种酞菁的金属配合物表现出随浓度增加而增强的肿瘤细胞抑制作用。从图中可以看出24 h 培养后,铜酞菁 6 的 IC50值为 23.31 μmol·L-1,镍酞菁 7 的 IC50值为 19.73 μmol·L-1, 类似于文献报道联吡啶类和甲醛缩氨基硫脲铜、镍配合物48 h的细胞实验数据[17-18]。证实本文合成的金属酞菁类化合物具有良好抗肿瘤活性。这从另一方面也可以说明,铜镍离子与酞菁形成的配合物不仅水溶性好、生物相容性高,而且更有利于肿瘤细胞的吸收,从而表现出对肿瘤细胞良好的抑制效果。
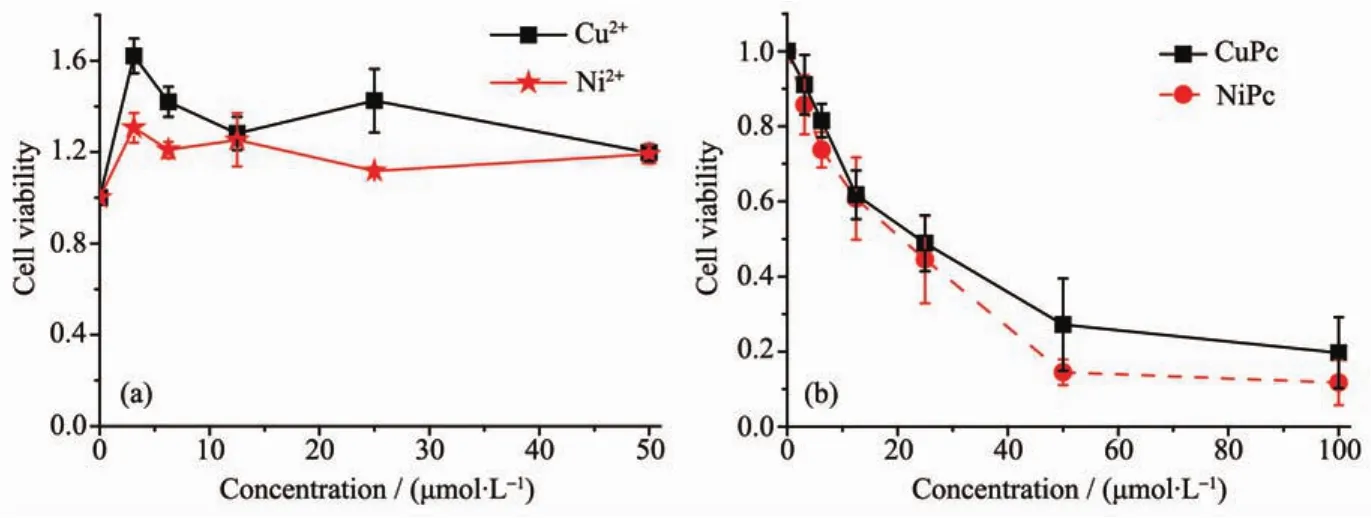
图7 (a)铜、镍离子和(b)铜、镍酞菁配合物6、7对Hela细胞的浓度-抑制关系曲线Fig.7 Comparison of cytotoxic effect of Cu2+,Ni2+(a)and CuPc 6,NiPc 7(b)towards Hela cells
2.5.2 光照下肿瘤细胞抑制测试
为了有效地显示该类铜、镍酞菁对肿瘤细胞的抑制作用和光动力治疗的联合效应,测试了光照条件下铜酞菁6和镍酞菁7对癌细胞的抑制作用。从图8可以看出,培养4 h后,铜、镍酞菁在避光条件下的细胞抑制作用依然表现出随浓度增加而增强的肿瘤细胞抑制作用。只是与培养24 h的结果相比,CuPc 6和NiPc 7的IC50值均显著提升。表明避光下,铜、镍酞菁的细胞的抑制作用与培养时间同样具有依赖关系。所以,延长培养时间是提高该类配合物肿瘤细胞抑制作用的有效途径。
在共同培养4 h后,样品被移除,以PBS洗细胞3次,光照组加入培养基后用660 nm LED光源连续照射20 min。当在红光的照射下,2种样品表现出相应的光毒性,较低浓度下均能有效杀死细胞,20 μmol·L-1时CuPc 6和NiPc 7均能够杀死70%左右的肿瘤细胞。光照下,CuPc 6 的 IC50为 14.9 μmol·L-1,NiPc 7 的 IC50值为 18.5 μmol·L-1,与避光 IC50相比,均表现出了显著的降低。同时,该数值同样低于避光下24 h的暗毒性的IC50结果。所以,光照能明显提升铜、镍酞菁杀死癌细胞的能力,说明该类化合物具有化疗与光动力治疗抗癌的协同作用。
需要提及的是,从前面的单线态氧测试数据上看,镍酞菁的单线态氧产率明显小于铜酞菁。但是光照实验却表明在相同的培养浓度下,它们却具有很相近的光动力治疗效果。因此,对该类铜、镍酞菁在细胞中的吸收进行了对比。测试结果表明,Hela细胞对NiPc 7的吸收量明显高于CuPc 6,前者约为后者的3倍,这可能是镍酞菁具有良好的光动力治疗效应的一个原因。

图8 不同浓度下的 CuPc 6(a)和NiPc 7(b)在光照(☆)和避光(★)条件下对Hela细胞的毒性Fig.8 Comparison of cytotoxic effect of CuPc 6(a)and NiPc 7(b)toward Hela cells in the presence(☆)and absence(★)of light
3 结 论
以邻苯二腈法合成了全水溶性铜酞菁6与镍酞菁7。由于铜ギ与前置配体中的酯基有较强的配位作用,先加入前置配体和催化剂待其反应成环后,再加入金属盐,是提高铜酞菁的纯度和产率的有效方法。同样的情况下,加料顺序对镍酞菁的成环反应影响较小。
铜酞菁6与镍酞菁7在水溶液中能够以单体形式存在,水溶性好、生物相容性好,并具有很强的光稳定性和热稳定性。单线态氧测试结果表示铜酞菁6与镍酞菁7均能有效的产生单线态氧,其中铜酞菁的单线态氧产率明显高于镍酞菁。细胞实验显示,铜酞菁6与镍酞菁7在避光下均表现出对肿瘤细胞的有效抑制作用。同时光照条件下IC50值明显小于避光条件,这说明铜酞菁6与镍酞菁7表现出较强的光动力治疗效果,进一步证实合成的金属酞菁具有化疗-光动力治疗协同作用,是一类具有潜在应用价值的多功效抗癌药物。
参考文献:
[1]Bio M,Rajaputra P,Nkepang G,et al.J.Med.Chem.,2014,57(8):3401-3409
[2]Canti G,Nicolin A,Cubeddu R,et al.Cancer Lett.,1998,125(1/2):39-44
[3]Conte C,Ungaro F,Maglio G,et al.J.Controlled Release,2013,167(1):40-52
[4]Vivero-Escoto J L,Elnagheeb M.Nanomaterials,2015,5(4):2302-2316
[5]Lu H L,Syu W J,Nishiyama N,et al.J.Controlled Release,2011,155(3):458-464
[6]Liang R Z,You S S,Ma L N,et al.Chem.Sci.,2015,6(10):5511-5518
[7]Beverina L,Abbotto A,Landenna M,et al.Org.Lett.,2005,7(19):4257-4260
[8]Gu H W,Xu K M,Yang Z M,et al.Chem.Commun.,2005,34:4270-4272
[9]Ke M R,Chen S F,Peng X H,et al.Eur.J.Med.Chem.,2017,127:200-209
[10]Luan L Q,Ding L L,Shi J W,et al.Chem.Asian J.,2014,9:3491-3497
[11]DING Lan-Lan(丁兰兰),LUAN Li-Qiang(栾立强),SHI Jia-Wei(施佳伟),et al.Chinese J.Inorg.Chem.(无机化学学报),2013,29(8):1591-1598
[12]Zhou W,Wang X,Hu M,et al.J.Inorg.Biochem.,2013,121:114-120
[13]GAO Ping-Zhang(高平章),CHEN Ya-Xin(陈雅心),ZHANG Min-Min(郑敏敏),et al.Chinese J.Inorg.Chem.(无机化学学报),2016,32(9):1572-1578
[14]ZHANG Qi-Long(张奇龙),WANG Huan-Yu(王焕宇),JIANG Feng(江峰),et al.Chinese J.Inorg.Chem.(无机化学学报),2016,32(3):464-468
[15]Mantareva V,Angelov I,Kussovski V,et al.Eur.J.Med.Chem.,2011,46:4430-4440
[16]Liu W,Jensen T J,Fronczek F R,et al.J.Med.Chem.,2005,48(4):1033-1041
[17]Deka B,Sarkar T,Banerjee S,et al.Dalton Trans.,2017,46(2):396-409
[18]Belicchi F M,Bisceglie F,Pelosi G,et al.J.Inorg.Biochem.,2002,90(3/4):113-126

