马铃薯早疫病拮抗菌的筛选及其代谢产物的抑菌活性
杨继业杨 帆,3崔冠慧孙劲冲程辉彩张丽萍*王雅娜刘洪伟
(1河北省科学院生物研究所,河北石家庄 050081;2河北省主要农作物病害微生物控制工程技术研究中心,河北石家庄 050081;3河北工业大学,天津300130)
自我国启动马铃薯主粮化战略,马铃薯栽培面积随之增加,成为仅次于水稻、小麦、玉米的第四大粮食作物。与此同时,马铃薯倒茬困难、连作障碍等问题日益严重(原霁虹,2015),使得土壤养分不足,有机质含量下降,导致植株衰弱,土传病害增加,如马铃薯早疫病病原菌茄链格孢菌(Alternaria solani),更易侵染衰弱植株的叶片、茎秆以及块茎,危害严重,是马铃薯的主要病害之一(郭润婷 等,2016)。
目前国内外对马铃薯早疫病的防治主要通过化学防治,常用药剂如丙森锌、代森锰锌、霜脲锰锌等,化学农药虽然方便、快速,但长期使用易造成生态环境污染严重,菌株抗药性增加,同时农产品农药残留危害人类健康,因此亟须寻找环境友好型生物防治的方法(Wharton et al.,2007;漆文选,2017)。王爱军等(2013)筛选出2株萎缩芽孢杆菌,对马铃薯黑痣病、干腐病病原菌具有较强抑制作用。姚彦坡(2015)筛选出2株木霉菌株HNA14和HNA12,对马铃薯晚疫病和辣椒疫病具有较好的防病效果。
目前芽孢杆菌对马铃薯早疫病的防治研究较少,因芽孢抗逆性强,具有耐高温、紫外线,易储存等优点,本试验以马铃薯早疫病病原菌茄链格孢菌作为指示菌,从河北省科学院生物研究所微生物实验室保存的生防菌株中筛选对马铃薯早疫病具有较强抑制效果的芽孢杆菌,对菌株进行生理生化及16S rDNA鉴定,同时对菌株代谢产物性质进行研究,以期得到代谢产物抑菌活性稳定的芽孢杆菌,为进一步研制马铃薯早疫病新型生防制剂奠定前期基础。
1 材料与方法
1.1 试验材料
供试病原菌为马铃薯早疫病病原菌茄链格孢菌,由河北农业大学植物保护学院朱杰华教授提供。供试生防菌株为河北省科学院生物研究所微生物研究室保藏的600多株生防菌株。
供试培养基:PB培养基、NB培养基、PDA培养基,配制方法参照细菌鉴定手册(布坎南和吉本斯,1984;东秀珠和蔡妙英,2001)。
1.2 拮抗菌筛选
1.2.1 拮抗菌初筛 取活化好的直径为8 mm的茄链格孢菌菌饼,点种于PDA培养基(直径90 mm)中央,26 ℃培养2 d,在菌块四周点种生防菌株,培养4 d后观察菌株抑菌效果。
1.2.2 拮抗菌复筛 将初筛所得拮抗菌经二级摇床培养后,发酵液12 000 r·min-1离心10 min去除菌体,经0.22 μm无菌滤膜过滤得到无菌滤液。吸取30 mL茄链格孢菌悬浮液(1×106cfu·mL-1)于300 mL融化的PDA培养基中,混匀后倒入培养皿中,待培养基凝固后,打孔并点入100 μL上述无菌滤液,3~4 d后观察抑菌效果。
1.3 菌株鉴定
1.3.1 形态特征及生理生化特性 在PB平板上接种菌株,32 ℃培养24 h后观察菌株菌落形态,复红染色后于显微镜镜检。菌株生理生化特性参照《伯杰细菌鉴定手册》(布坎南和吉本斯,1984)和《常见细菌系统鉴定手册》(东秀珠和蔡妙英,2001)进行鉴定。
1.3.2 基因组提取及16S rDNA序列扩增与分析 采用生工生物工程(上海)股份有限公司DNA提取试剂盒提取菌株的基因组DNA,选用16S rDNA基因通用引物进行PCR扩增。27F:5'-AGAGTTTGATCCTGGCTCAG-3',1492R:5'-CTACGGCTACCTTGTTACGA-3'。PCR 反 应 体系为50 μL:DNA模板2.5 μL,上下游引物各2 μL,2×Mix 25 μL,ddH2O 18.5 μL。PCR反应程序:94 ℃ 5 min;95 ℃ 30 s,55 ℃ 40 s,72 ℃ 90 s,30个循环;72 ℃ 10 min。PCR产物经1%琼脂糖凝胶电泳检测,并于生工生物工程(上海)股份有限公司进行测序,将所得序列与GenBank数据库中序列进行Blast分析比对,并构建系统发育树。
1.4 代谢产物的抑菌活性
1.4.1 热稳定性 将菌株BAF-6的发酵液经0.22 μm无菌过滤器进行除菌,得到发酵滤液,分别在60、70、80、90、100、121 ℃下热处理 30 min,冷却至室温后,采用打孔法在含有茄链格孢菌的平板上打孔,并于孔中分别点入100 μL各处理的发酵滤液,3~4 d后测量各处理抑菌圈的大小,以未经热处理的发酵滤液为对照,以对照抑菌圈大小为活性100%,计算各处理的相对抑菌活性(杨艳红 等,2017),每个处理3次重复。
1.4.2 蛋白酶稳定性 分别用质量浓度50 mg·L-1胰蛋白酶、胃蛋白酶、蛋白酶K于37 ℃处理菌株BAF-6发酵滤液2 h(胡忠亮 等,2017),以未经蛋白酶处理的发酵滤液为对照,采用1.4.1中的方法测定并计算各处理的相对抑菌活性,每个处理3次重复。
1.4.3 紫外稳定性 将菌株BAF-6的发酵滤液放置在紫外灯下(20 W)20 cm处,分别照射2、4、6、8 h,以未经紫外灯照射的发酵滤液为对照,采用1.4.1中的方法测定并计算各处理的相对抑菌活性,每个处理3次重复。
1.4.4 酸碱稳定性 用1 mol·L-1盐酸和1 mol·L-1氢氧化钠溶液分别将菌株BAF-6的发酵滤液pH值调节为 2、3、4、5、6、7、8、9、10、11、12,静置12 h后,调节pH至中性,以未经处理的发酵滤液为对照,采用1.4.1中的方法测定并计算各处理的相对抑菌活性,每个处理3次重复。
1.5 数据处理
采用MEGA 5.0软件对所筛菌株进行系统发育树的构建,采用SPSS软件进行数据差异显著性分析,并用Excel软件进行统计性分析及柱形图的制作。
2 结果与分析
2.1 拮抗菌筛选结果
通过平板对峙法筛选出对茄链格孢菌有较强抑制作用的菌株11株,通过测定菌株无菌滤液的抑菌活性,菌株BAF-6抑菌圈直径较大,为2.4 cm(图1、2),说明菌株及菌株发酵滤液均对病原菌抑制作用较强。

图1 拮抗菌初筛

图2 拮抗菌复筛
2.2 菌种鉴定
2.2.1 菌株BAF-6的形态特征 菌株BAF-6菌落呈白色,不透明,近圆形,边缘不规则,菌体杆状,菌体长约1.8 μm,宽约0.6 μm(图3),产生椭圆形芽孢,芽孢中生。
2.2.2 菌株BAF-6的生理生化特性 通过2.2.1中菌株形态观察及生理生化特性鉴定(表1),初步鉴定该菌株属于芽孢杆菌属(Bacillus)。
2.2.3 菌株BAF-6的分子鉴定 将菌株BAF-6的16S rDNA序列和NCBI网站中与其基因序列同源性较高的菌株进行比对,构建系统发育树(图4),结合菌株的形态特征、生理生化鉴定结果以及16S rDNA分子鉴定结果,将菌株BAF-6鉴定为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)。
2.3 菌株BAF-6的代谢产物性质
2.3.1 热稳定性 从图5可以看出,60~80 ℃热处理菌株BAF-6的发酵滤液后,滤液对茄链格孢菌的相对抑菌活性均与对照无显著差异,抑菌活性均在95%以上。90~121 ℃处理下,发酵滤液的相对抑菌活性显著降低,但100 ℃处理下发酵液的相对抑菌活性仍在85%以上,121℃下的相对抑菌活性在50%以上,说明菌株发酵滤液具有较高的热稳定性。

图3 菌株BAF-6菌体形态

表1 菌株BAF-6的生理生化鉴定结果

图4 菌株BAF-6的16S rDNA的系统发育树
2.3.2 蛋白酶稳定性 从图6可以看出,采用蛋白酶K、胃蛋白酶、胰蛋白酶处理菌株BAF-6发酵滤液后,滤液对茄链格孢菌的相对抑菌活性均显著降低,但仍在50%以上,说明菌株具有抑菌活性的物质可能不是蛋白质,也可能是蛋白质但不包含芳香族、脂族氨基酸的羧基肽键,不含赖氨酸、精氨酸及疏水残基肽键。
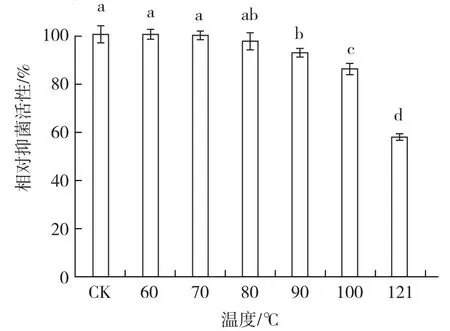
图5 菌株BAF-6发酵滤液的热稳定性
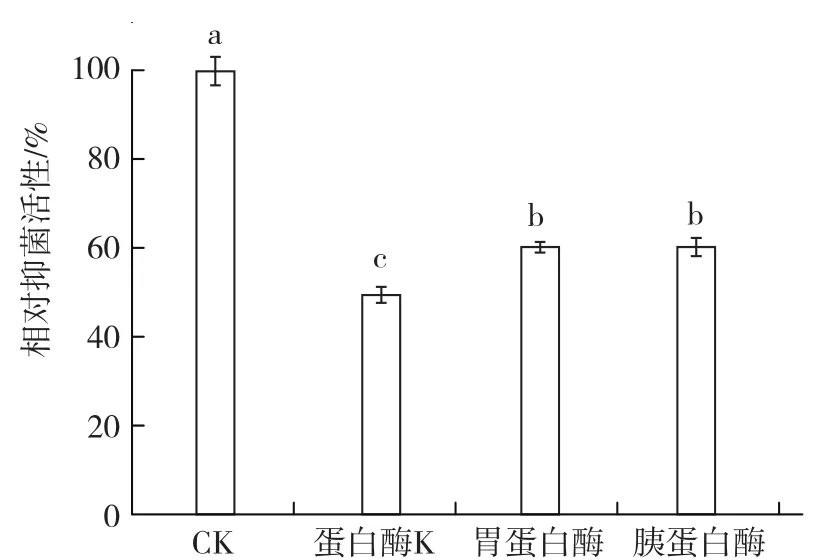
图6 菌株BAF-6发酵时滤间液的蛋白酶稳定性

图7 菌株BAF-6发酵滤液的紫外稳定性
2.3.3 紫外稳定性 从图7可以看出,经紫外线照射后,菌株BAF-6发酵滤液对病原菌的相对抑菌活性均无显著变化。说明菌株发酵滤液抑菌活性不因紫外照射而降低,适合于田间应用。
2.3.4 酸碱稳定性 从图8可以看出,菌株BAF-6发酵滤液在pH值为2~9时的相对抑菌活性与对照均无显著差异,当pH值为10时,菌株的相对抑菌活性仍为80%以上,说明菌株发酵滤液具有较高的酸碱稳定性。
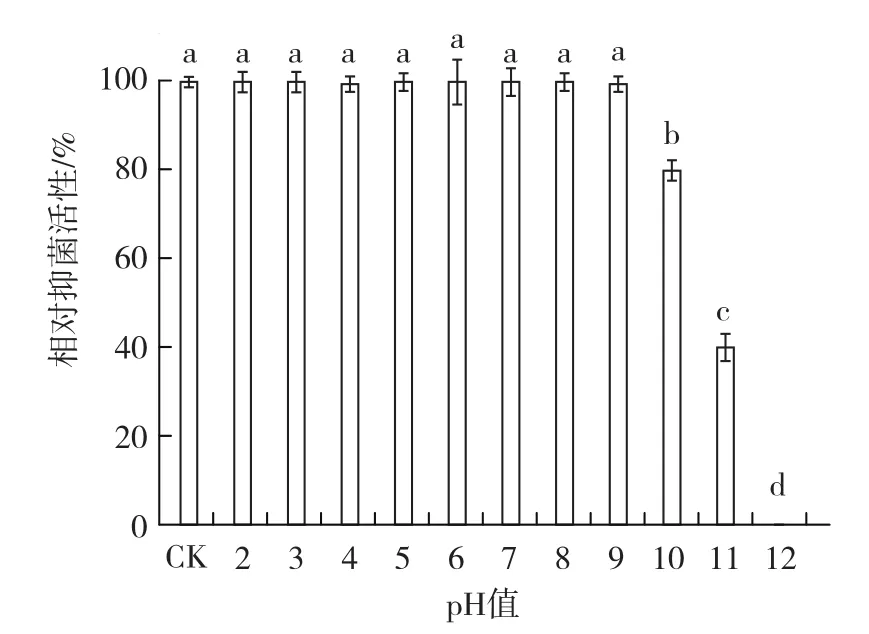
图8 菌株BAF-6发酵滤液的酸碱稳定性
3 结论与讨论
利用对病原菌具有拮抗作用的细菌等有益微生物及其代谢产物进行生物防治是防治农作物病害的有效方法与技术(邱德文,2010),既响应农药减施及化肥零增长的政策,同时有益于环境、生态和人类健康。寻找高效生防菌资源,是生物防治途径中最重要的环节。
目前防治马铃薯早疫病的生物菌剂主要为放线菌、木霉菌,芽孢杆菌的应用很少。芽孢杆菌可产生耐热抗逆的芽孢,生存能力强,同时是土壤和植物微生态区系优势种群,有利于在环境中存活、定殖和繁殖,因此具备较好的生防特性及开发前景(齐爱勇 等,2011)。本试验以马铃薯早疫病病原菌茄链格孢菌为指示菌,通过平板对峙法筛选到1株对其具有较强抑制效果的菌株BAF-6,经鉴定该菌株为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)。
解淀粉芽孢杆菌是植物病害防治中一大类芽孢杆菌类群,在生长过程中可产生肽类、聚酮类、脂肽类等具有抗菌活性的代谢产物(Chen et al.,2009)。薛鹏琦等(2011)从解淀粉芽孢杆菌YBWC43菌株中提取出可抑制油菜菌核病菌的杆菌霉素D和芬枯草菌素。本试验对BAF-6菌株发酵滤液性质进行研究,结果表明菌株BAF-6发酵滤液具有较高的热稳定性,且经蛋白酶K、胰蛋白酶、胃蛋白酶处理后,发酵滤液的相对抑菌活性仍在50%以上,说明抑菌活性物质可能有一部分并不是蛋白质,需要进一步对有效抑菌物质进行分离纯化;菌株BAF-6发酵滤液对紫外线照射具有较强的抗性,在后期菌株田间应用过程中,发酵滤液中的活性物质可以有效保留;发酵滤液在pH值2~10时,相对抑菌活性仍在80%以上,说明菌株发酵滤液具有较高的酸碱稳定性。可见菌株BAF-6具有开发成马铃薯早疫病新型生防制剂的潜力。
布坎南,吉本斯.1984.伯杰细菌鉴定手册.中国科学院微生物研究所《伯杰细菌鉴定手册》翻译组译.8版.北京:科学出版社.
东秀珠,蔡妙英.2001.常见细菌系统鉴定手册.北京:科学出版社.
郭润婷,王惟萍,谢学文,李宝聚.2016.马铃薯早疫病的诊断与防治.中国蔬菜,(11):80-82.
胡忠亮,郑催云,田兴一,李警保,韩正敏,樊奔.2017.解淀粉芽孢杆菌HZM9菌株发酵液的抑菌谱及稳定性测定.南京林业大学学报,3(41):65-70.
齐爱勇,赵绪生,刘大群.2011.芽孢杆菌生物防治植物病害研究现状.中国农学通报,27(12):277-280.
漆文选.2017.高寒山区马铃薯种薯主要病虫害调查与防治方法.中国蔬菜,(9):93-98.
邱德文.2010.我国植物病害生物防治的现状及发展策略.植物保护,36(4):15-18.
王爱军,柴兆祥,李金花,郭庆刚,王蒂.2013.马铃薯干腐病菌和黑痣病菌拮抗芽胞杆菌的筛选及鉴定.中国生物防治学报,29(4):586-594.
薛鹏琦,刘芳,乔俊卿,伍辉军,冯致科,高学文.2011.油菜菌核病生防芽孢杆菌的分离鉴定及其脂肽化合物分析.植物保护学报,38(2):127-132.
杨艳红,余瑛,胡永强,余溪,李青青.2017.解淀粉芽孢杆菌AF1发酵液的抗菌活性与抗菌机理.生物技术通报,33(9):233-230.
姚彦坡.2015.防治马铃薯晚疫病和辣椒疫病木霉菌的筛选及生防机制研究〔博士论文〕.北京:中国农业大学.
原霁虹.2015.马铃薯连作障碍的研究进展.中国马铃薯,29(1):46-50.
Chen X H,Koumoutsi A,Scholz R,Borriss R,Schneider K,Vater J,S ü ssmuth R,Piel J,Borriss R.2009.Genome analysis ofBacillus amyloliquefaciensFZB42 reveals its potential for biocontrol of plant pathogens.Journal of Biotechnology,140(1):27-37.
Wharton P S,Kirk W W,Berry D,Tumbalam P.2007.Seed treatment application-timing options for control of Fusarium decay and sprout rot of cut seedpieces.American Journal of Potato Reseach,84(3):237-244.

