植物根际促生菌普城沙雷菌A21-4对黄瓜生长及土壤微生态的影响
丁方丽李 嫚刘东平张忠良孙治强朴凤植*申顺善*
(1河南农业大学植物保护学院,河南郑州 450002;2河南农业大学园艺学院,河南郑州 450002)
植物根际促生细菌(plant growth promoting rhizobacteria,简称PGPR)是指自由存在于植物根际范围中的一类可促进植物生长、防治病害、增加产量的细菌的统称(Kloepper et al.,1980)。PGPR菌株可通过溶磷、解钾、固氮、产生植物激素等作用,直接促进植物生长,提高产量;还可以通过产生嗜铁素和抗生素等抑制病原物的生存与繁殖,进而减轻作物病害,改善植物根际土壤微生态环境,间接促进植物生长(Jung et al.,2007;李冰 等,2015)。如:从辣椒根际分离得到的具有产生IAA能力的枯草芽孢杆菌NJAU-G10能显著促进辣椒幼苗的生长和根系发育(张杨 等,2015);枯草芽孢杆菌QM3能显著增加番茄植株叶片数,促进番茄株高及根系发育,且有效防治番茄早疫病(胡青平 等,2011);在大豆根际同时接种慢生大豆根瘤菌和胶质类芽孢杆菌后,土壤酶活性显著提高(刘
丽 等,2015)。由于PGPR具有促进植物生长、防治植物病害和改善植物根际土壤微生态环境的优良特性,因此,很多学者都积极投入到PGPR的开发、应用研究中。邱勤等(2011)研究指出,将PGPR菌剂施于土壤后,能显著促进苜蓿的生长,同时增加土壤中细菌、真菌、放线菌等微生物的数量,进而提高土壤养分。普城沙雷菌(Serratia plymuthica)A21-4是从洋葱根际土壤中分离出的辣椒疫病生防菌,能有效定殖在辣椒根系及根际土壤,抑制辣椒疫病的发生(Shen et al.,2005),同时,能显著促进辣椒生长,改善辣椒根际土壤微生态环境(吕雅悠 等,2016)。在前期A21-4对辣椒的促生作用研究的基础上,本试验探究了A21-4对黄瓜生长及根际土壤微生态环境的影响,以期为A21-4在黄瓜实际生产中的应用提供理论依据。
1 材料与方法
1.1 试验材料
A21-4的利福平标记菌株(100 μL·mL-1)由河南农业大学植物病害生物防治研究室在-80 ℃超低温冰箱保存备用;黄瓜品种为寒育6号(河南豫艺种业科技发展有限公司选育);供试培养基为TSA培养基(Tryptic Soy Broth Difco. 30 g,琼脂 18 g,蒸馏水1 000 mL)、AIA培养基(Actinomycete Isolation Agar Difco. 22 g,蒸馏水1 000 mL)和PDA培养基(Potato Dextrose Broth Difco. 24 g,琼脂18 g,蒸馏水1 000 mL)。
1.2 试验方法
本试验于2017年1~6月在河南省郑州市毛庄绿园蔬菜基地进行。1月17日在日光温室穴盘播种育苗,2月17日移栽到大棚,施肥按照蔬菜基地常规管理进行,6月15日拉秧结束。
1.2.1 A21-4菌悬液的配制及处理 将A21-4在TSA培养基上培养48 h后,用0.1 mol·L-1MgSO4无菌溶液配制成108cfu·mL-1的A21-4菌悬液。黄瓜育苗期和田间生育期分别用A21-4菌悬液处理,在育苗期,第1片真叶展开时,用A21-4菌悬液进行灌根处理(50 mL·株-1);移栽10 d后再用A21-4菌悬液进行灌根处理(200 mL·株-1),以清水处理为对照,每个处理设3次重复,每个重复150株(6行·重复-1,25 株·行-1)。
1.2.2 黄瓜生育指标和生理指标的测定 2月17日,即黄瓜播种后30 d,每个重复选9株,每个处理3次重复,测定黄瓜苗期株高、茎粗、地上部鲜质量、根鲜质量和第3片真叶的叶绿素含量;3月19日,即移栽后30 d,每个重复取5株,每个处理3次重复,测定黄瓜开花期株高、茎粗、叶片数、叶面积和开花数;在黄瓜苗期(2月17日)、开花期(3月19日)、初果期(4月7日)、盛果期(5月2日)和采收后期(6月7日)分别测定根系活力。叶绿素含量的测定采用分光光度法,根系活力的测定采用氯化三苯基四氮唑法(高俊凤,2006)。
1.2.3 黄瓜产量和品质相关指标的测定 黄瓜采收期,每个重复选取30株(6行·重复-1,5株·行-1),每个处理3次重复,采集黄瓜果实,采用称重法测定单株黄瓜果实质量,直至结果期完结后,计算单株产量和每667 m2产量。黄瓜初果期、盛果期和采收后期分别测定品质相关指标,VC含量采用2,6-二氯酚靛酚滴定法测定,蛋白质含量采用考马斯亮蓝G250法测定,可溶性糖含量采用蒽酮比色法测定(苍晶和赵会杰,2013)。
1.2.4 黄瓜根际土壤酶活性的测定 在黄瓜开花期、初果期、盛果期和采收后期分别测定根际土壤脲酶、磷酸酶、过氧化氢酶和蔗糖酶活性。黄瓜根际土壤样品的采集:轻轻拨开黄瓜表层土壤,收集黄瓜根际土壤,过60目筛,每处理3次重复。脲酶活性采用苯酚钠-次氯酸钠比色法测定,磷酸酶活性采用磷酸苯二钠比色法测定,过氧化氢酶活性采用高锰酸钾滴定法测定,蔗糖酶活性采用3,5-二硝基水杨酸比色法测定(关荫松,1986)。
1.2.5 黄瓜根际土壤微生物数量的测定 在黄瓜开花期、初果期、盛果期和采收后期分别测定黄瓜根际土壤细菌、真菌和放线菌的数量。土壤样品的采集方法同1.2.4,根际土壤微生物的测定采用稀释平板涂布法。称取1 g土样,倒入装有100 mL无菌水的三角瓶中,充分振荡,然后用无菌水进行梯度稀释,配制成一系列浓度梯度的稀释液,将0.1 mL的稀释液均匀涂布在含PCNB的TSA平板上,置于28 ℃恒温箱中培养3 d后调查细菌数量;将0.1 mL的稀释液均匀涂布在含乳酸的PDA平板上,置于26 ℃恒温箱中培养5 d后调查真菌数量;将0.1 mL的稀释液均匀涂布在含乳酸的AIA平板上,置于28 ℃恒温箱中培养7 d后调查放线菌数量。调查细菌和真菌采用新鲜土样,调查放线菌采用自然风干的土样。
1.2.6 黄瓜根际土壤速效氮、磷、钾的测定 在黄瓜开花期、初果期、盛果期和采收后期分别测定黄瓜根际土壤速效氮、磷和钾的含量。土壤样品的采集方法同1.2.4,速效氮含量的测定采用碱解扩散法,速效磷含量的测定采用碳酸氢钠法,速效钾含量的测定采用乙酸铵浸提,火焰光度法(鲍士旦,1999)。
1.3 数据处理与分析
采用Excel 2003和SPSS 13.0软件进行数据分析,采用Duncan氏新复极差法(SSR法)进行显著性检验。
2 结果与分析
2.1 A21-4对黄瓜生育指标和生理指标的影响
A21-4处理能显著促进苗期和田间生育期黄瓜生长发育。在苗期,株高、茎粗、地上部鲜质量和根鲜质量分别比对照增加48.17%、3.62%、111.25%和53.03%,叶绿素含量比对照增加27.84%(表1);在开花期,黄瓜株高、茎粗、叶片数、叶面积和开花数分别比对照增加27.57%、13.63%、22.35%、36.64%和23.42%(表2)。同时,A21-4处理显著提高了黄瓜各生育期的根系活力,在苗期、开花期、初果期、盛果期和采收后期,分别比对照提高70.83%、40.50%、73.58%、112.61%和50.00%(表3)。
2.2 A21-4对黄瓜产量和果实品质相关指标的影响
A21-4显著提高了黄瓜产量,每667 m2产量达到2 512.74 kg,比对照增产32.22%(表4)。同时,A21-4显著增加了黄瓜果实的蛋白质、可溶性糖和VC含量,在黄瓜初果期、盛果期和采收后期,蛋白质含量分别比对照增加150.51%、17.51%和25.65%,可溶性糖含量分别比对照增加1.07%、3.51%和13.75%,VC含量分别比对照增加123.44%、11.76%和59.06%(表5)。

表1 A21-4对黄瓜苗期生育指标和叶绿素含量的影响

表2 A21-4对黄瓜开花期生育指标的影响

表3 A21-4对黄瓜根系活力的影响

表4 A21-4对黄瓜产量的影响
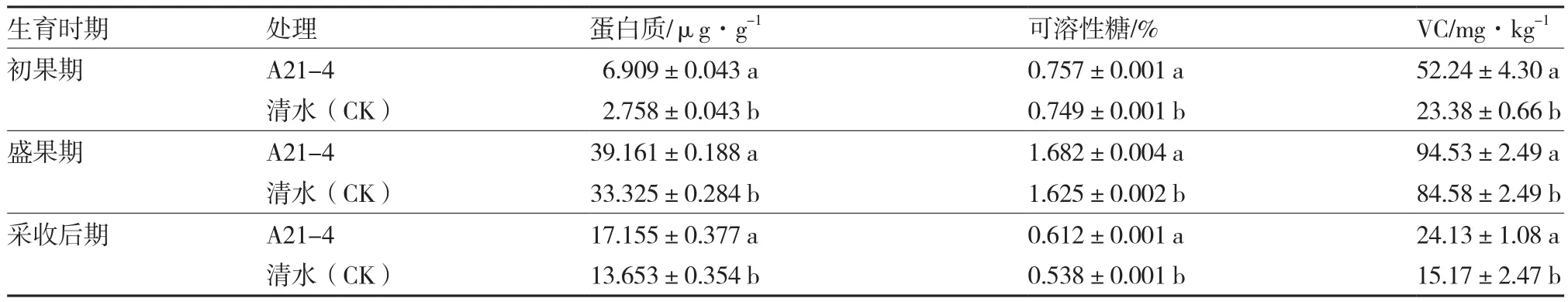
表5 A21-4对黄瓜果实品质相关指标的影响
2.3 A21-4对黄瓜根际土壤酶活性的影响
A21-4显著提高了黄瓜根际土壤酶活性。在黄瓜开花期、初果期、盛果期和采收后期,A21-4处理的黄瓜根际土壤脲酶活性分别比对照提高15.05%、20.05%、14.37%和29.29%,磷酸酶活性分别比对照提高36.28%、57.77%、146.02%和115.74%,蔗糖酶活性分别比对照提高10.26%、25.69%、208.33%和55.56%,过氧化氢酶活性分别比对照提高70.00%、62.50%、14.77%和20.97% (图1)。
2.4 A21-4对黄瓜根际土壤微生物数量的影响
A21-4能显著增加黄瓜根际土壤细菌(采收后期除外)和放线菌的数量,显著减少真菌的数量。在黄瓜开花期、初果期、盛果期和采收后期,A21-4处理的黄瓜根际土壤细菌的数量分别比对照增加25.75%、26.19%、18.31%和10.49%,放线菌的数量分别比对照增加63.00%、64.86%、11.66%和106.75%,而真菌的数量分别比对照减少36.40%、36.81%、26.55%和45.81%(表6)。
2.5 A21-4对黄瓜根际土壤速效氮、磷、钾含量的影响
A21-4显著增加了黄瓜根际土壤速效氮(开花期除外)、磷和钾的含量(图2)。在黄瓜开花期、初果期、盛果期和采收后期,A21-4处理的黄瓜根际土壤速效氮含量分别比对照增加1.47%、8.86%、61.12%和22.59%,速效磷含量分别比对照增加35.16%、26.94%、6.98%和10.02%,速效钾含量分别比对照增加27.84%、9.66%、13.71%
和29.33%。
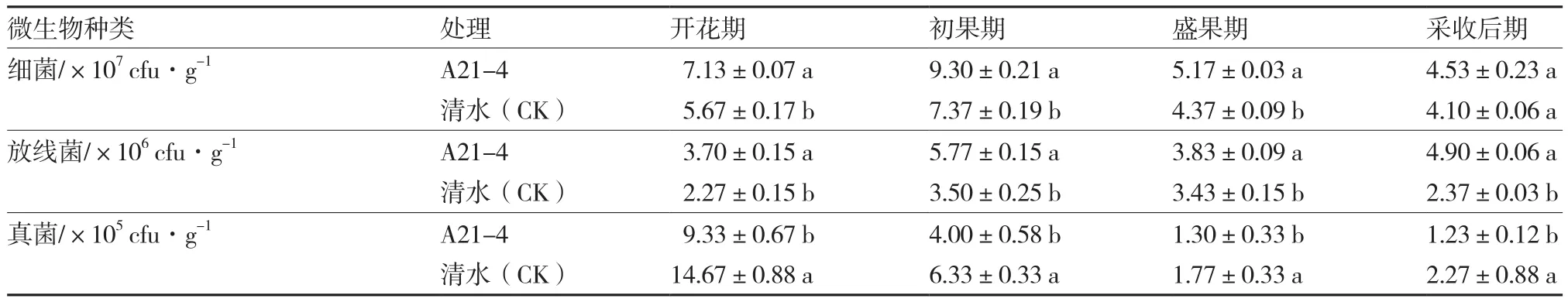
表6 A21-4对黄瓜根际土壤微生物的影响
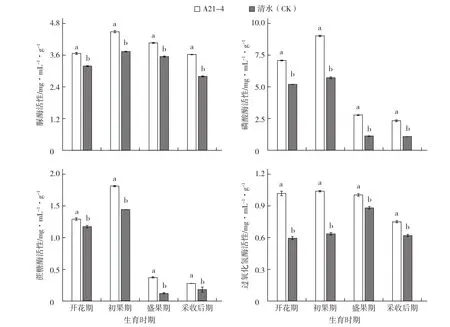
图1 A21-4对黄瓜根际土壤酶活性的影响
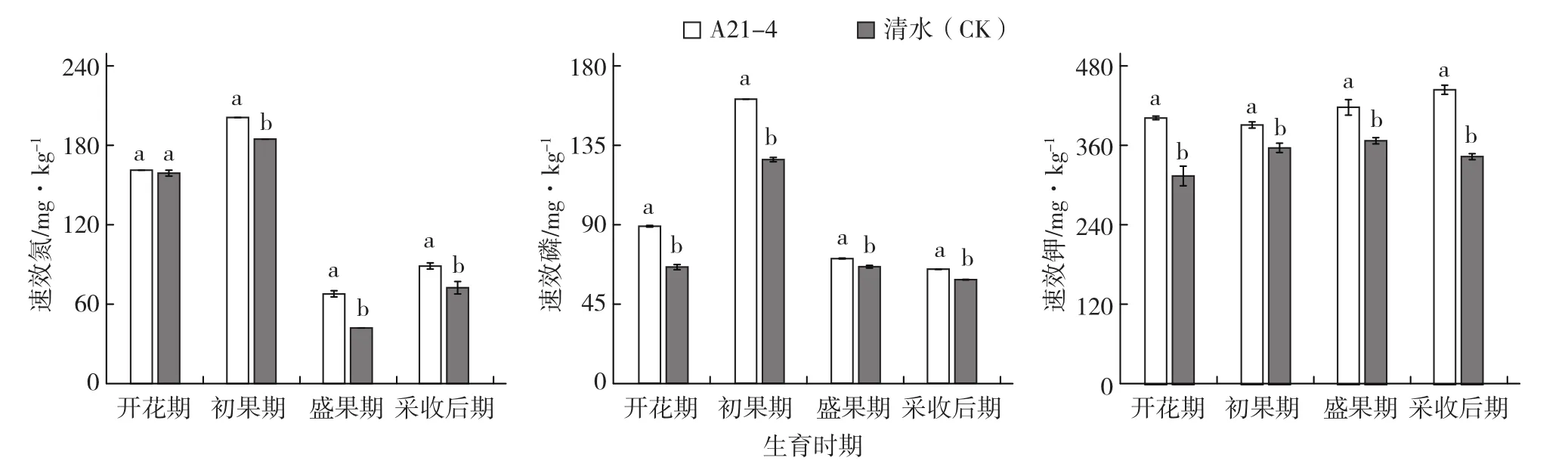
图2 A21-4对黄瓜根际土壤速效氮、磷、钾含量的影响
3 结论与讨论
PGPR是定殖于植物根际环境中的一类能够促进植物生长、提高作物产量和减轻植物病害等的有益细菌。一般认为,PGPR菌株通过溶磷、固氮、分泌生长激素等直接作用促进植物生长,也通过抑制有害微生物而间接促进植物生长(田婧 等,2016)。李想等(2017)的研究表明,枯草芽孢杆菌LX-4、地衣芽孢杆菌LX-5和解淀粉芽孢杆菌LX-7不仅能通过产生生长素、细胞分裂素和赤霉素等有效促进烟草的生长,还具有广谱抑菌效果。环状芽孢杆菌XD-K-2能通过解钾作用显著促进小白菜地上部生长,同时增加根际土壤中全钾含量(陈易 等,2016)。多黏类芽孢杆菌Cp-S316能够通过产生肽类活性物质强烈抑制烟草赤星病菌菌丝生长,进而促进烟草的健康生长(王智文 等,2007)。A21-4对辣椒具有促生长和增产效果,同时能改善辣椒根际土壤微生态环境,并有效防治辣椒疫病的发生(吕雅悠 等,2016)。本试验结果表明,A21-4对黄瓜生长同样具有显著的促进效果,可以提高黄瓜品质、调节黄瓜根际土壤微生态环境,是具有应用潜力的微生物资源。另外,之前的室内试验结果表明,A21-4具有解磷和产生吲哚乙酸的功能(张维娜,2013),能降低黄瓜根际土壤疫霉菌和腐霉菌的密度,但A21-4发挥促生作用的具体机制及其应用技术还需要进一步探讨。
植物根际土壤酶活性、土壤微生物、土壤理化性质与寄主植物生长有密切关系。土壤酶活性反映了土壤的健康状况,土壤过氧化氢酶能转化土壤中有机质,土壤脲酶能促进氮素循环,土壤磷酸酶与土壤有机磷的转化有关。土壤速效养分可直接被植物吸收利用,与土壤酶活性密切相关(陈志芳 等,2014)。本试验中,A21-4显著提高了黄瓜根际土壤过氧化氢酶、蔗糖酶、脲酶和磷酸酶的活性,进而提高了辣椒根际土壤速效氮、磷和钾含量。另外,土壤微生物也直接参与植物根际有机质的分解和养分的转化,且和土壤酶活性密切相关。吴传万等(2014)的研究结果表明,土壤磷酸酶活性与细菌和放线菌数量具有显著正相关;脲酶、蔗糖酶和过氧化氢酶活性与真菌数量极显著负相关,并与放线菌数量极显著正相关。本试验结果表明,A21-4提高了黄瓜根际土壤细菌和放线菌的数量,而减少了真菌的数量,这与土壤酶活性和速效氮、磷、钾含量的提高具有一定的正相关关系。A21-4对土壤酶活性、土壤速效养分和土壤微生物的具体影响,及其相关性有待进一步研究。
鲍士旦.1999.土壤农化分析.北京:中国农业出版社.
苍晶,赵会杰.2013.植物生理学实验教程.北京:高等教育出版社.
陈易,程永毅,郭涛,申鸿.2016.一株具紫色土亲和性解钾菌的筛选及促生效应.西南大学学报:自然科学版,38(5):58-65.
陈志芳,刘金福,吴则焰.2014.不同海拔土壤理化性质与酶活性研究.河北北方学院学报:自然科学版,30(1):38-42.
高俊凤.2006.植物生理学实验指导.北京:高等教育出版社.
关荫松.1986.土壤酶及其研究方法.北京:中国农业出版社.
胡青平,徐建国,程丽萍,田呈瑞.2011.枯草芽胞杆菌QM3防治番茄早疫病和促进幼苗生长的研究.植物保护,37(4):95-100.
李冰,龚文秀,李清,孙乐妮,曹媛媛,唐欣昀.2015.植物根际促生菌株对小麦根系发育的影响.安徽农业大学学报,42(2):276-282.
李想,刘艳霞,夏范讲,蔡刘体,张恒,石俊雄.2017.烟草根际促生菌(PGPR)的筛选、鉴定及促生机理研究.中国烟草学报,23(3):111-118.
刘丽,马鸣超,姜昕,关大伟,杜秉海,曹凤明,李俊.2015.根瘤菌与促生菌双接种对大豆生长和土壤酶活的影响.植物营养与肥料学报,21(3):644-654.
吕雅悠,于迪,丁方丽,朴凤植,申顺善.2016.促植物生长根际细菌A21-4对田间辣椒生长及根际土壤微生态环境的影响.中国生物防治学报,32(1):86-92.
邱勤,张磊,韩光,石杰,胡正峰.2011.使用PGPR菌剂及苜蓿培肥新垦地土壤研究.西南大学学报:自然科学版,33(5):109-115.
田婧,李邵,连青龙,鲁少尉,马宁,鲍顺淑.2016.植物根际促生菌在蔬菜种植中的应用进展.北方园艺,(6):181-185.
王智文,刘训理,何亮,夏尚远,崔萍,吴凡.2007.Cp-S316菌株发酵培养基的优化及其对烟草赤星病菌的抑制作用.农业环境科学学报,26(2):723-728.
吴传万,杜小凤,顾大路,杨文飞,文廷刚,王伟中.2014.植物源药肥对温室黄瓜生长发育和土壤环境的影响.江苏农业学报,30(1):92-99.
张维娜.2013.普城沙雷菌A21-4诱导辣椒抗性作用及其机理的初步研究〔硕士论文〕.郑州:河南农业大学.
张杨,文春燕,赵买琼,张苗,高琦,李荣,沈其荣.2015.辣椒根际促生菌的分离筛选及生物育苗基质研制.南京农业大学学报,38(6):950-957.
Kloepper J W,Leong J,Teintze M,Schroth M N.1980.Enhanced plant growth by siderophores produced by plant growth-promoting rhizobacteria.Nature,286(2):885-886.
Jung H K,Kim J R,Woo S M,Kim S D.2007.Selection of the auxin,siderophore,and cellulose-producing PGPR,Bacillus licheniformisK11 and its plant growth promoting mechanisms.Journal of the Korean Society for Applied Biological Chemistry,50(1):23-28.
Shen S S,Choi O H,Park S H,Kim C G,Park C S.2005.Root colonizing and biocontrol competency ofSerratia plymuthicaA21-4 against Phytophthora blight of pepper.Plant Pathology Journal,21(1):64-67.

