EID3参与调控人脐带间充质干细胞转分化为类神经干细胞过程的研究
陈文锦 罗亮 张丽 殷勤伟 徐如祥
神经前体细胞(neural progenitor cells,NPCs)具有在特定微环境下分化为多种成熟神经细胞的干细胞特点,是细胞移植治疗神经退行性疾病的一种理想细胞系。由于通过人脑组织内直接获取NPCs进行原代培养受器官捐献及伦理学限制而难以实施,因此,通过人间充质干细胞 (mesenchymal stem cells,MSCs)转分化为神经干细胞(neural stem cells,NSCs)便成为一种理想的替代方式。MSCs是细胞移植治疗神经退行性病变等中枢神经系统疾病的理想细胞来源[1-3]。然而,这类MSCs在体内或体外特定环境下诱导转分化为类神经干细胞 (neural stem-like cells,uNSCLs)的分子机制尚不明确[4]。表观遗传学的调控是MSCs诱导转分化为uNSCLs的关键,如DNA甲基化、基因组印记、母体效应以及基因沉默等[5-7]。表观遗传学将基因型与表现型相互联系,对干细胞命运决定、生长分化都起到了关键的调控作用[8]。MSCs转分化过程中,组蛋白乙酰化转移酶P300和DNA甲基化转移酶 3A (DNA methyltransferase,DNMT3A)分别对组蛋白修饰和DNA甲基化起到关键性的调控[9]。
E1A样转分化抑制蛋白3(E1A-like inhibitor of differentiation 3,EID3)能够绑定P300/CBP并通过直接结合细胞核受体小异二聚体伴侣分子(small heterodimer partner,SHP)及 SRC1 来抑制 P300/CBP依赖性基因转录过程从而调控细胞的转化、生长和凋亡。DNA甲基化中,DNMT3A参与DNA的从头甲基化,DNMT3A的功能缺失通常导致小鼠胚胎期死亡,而DNMT3A基因敲除的小鼠则表现为发育缺陷,在发育成熟前死亡[13]。同时DNMT3A作为甲基化转移酶,具有甲基化与去甲基化的双重作用[14]。研究表明,DNMT3A参与了NPC分化和胚胎期中枢神经系统发育过程,DNMT3A能够精确地控制中枢神经系统内NPCs的分裂、分化以及细胞的增殖过程[15-17]。然而,对DNMT3A的调控干细胞分裂分化等生理过程的详细机制尚未明确,同时其与EID3之间可能存在的相互关系也尚未有研究,本研究目的是研究EID3在人脐带间充质干细胞转分化为uNSCLs过程关系发挥的作用以及过程中EID3和DNMT3A之间的。
材料与方法
一、UMSCs的获取和培养
该研究中人脐带来源于产妇捐赠,脐带的使用和实验目的产妇均知情理解,签字同意。产妇分娩后捐赠的新鲜脐带用75%的乙醇消毒30 s,放入Hanks平衡盐溶液中浸泡1 ~6 h。将脐带动静脉去除,然后转入装有DMEM/F12培养基的培养皿中,用无菌眼科剪将脐带剪成2 ~4 mm3的小块,加入组织消化液(含0.5 mg/mL胶原酶、0.5%胰蛋白酶和0.5 mg/mL透明质酸酶),37℃培养箱中消化45 ~60 min。消化完毕后,用5 mL枪头缓和吹打30 s,在用45 μm的滤网过滤消化后的组织,去除消化不完全的大块组织。滤液经离心机250×g离心5 min,用新鲜的DMEM/F12培养基 [含10%胎牛血清 (fetal bovine serum,FBS)、1%双抗 (100 U/mL 青霉素、0.1 mg/mL 链霉素)]重悬细胞。
二、抗体
实验所用抗体:(1)一抗:DNMT3A 抗体(Cell Signaling Technology,Beverly,美国),beta-Actin 抗体(Abcam Inc,Cambridge,MA,美国),EID3 抗体(Abcam Inc,Cambridge,MA,美国),CBP/P300 抗体(Cell Signaling Technology,MA,美国),甘油醛-3-磷酸脱氢酶 (glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗 体 (Abcam Inc,Cambridge,MA,美 国 ),FITC-CD34 抗体、FITC-CD29 抗体、FITC-CD106、PECD45、PE-CD44、PE-CD90 抗 体 (BD Biosciences,Piscataway,NJ,美国),根据厂家推荐浓度稀释使用;(2)二抗:驴抗兔免疫球蛋白 G(immunoglobulin G,IgG)Alexa Fluor 488、驴抗鼠 lgG Alexa Fluor 568(Thermo Life,Pittsburg,PA,美国)。
三、细胞的培养
UMSCs用含10%FBS、4.5 g/L葡萄糖的DMEM/F12培养基培养,细胞融合度达80%时进行细胞传代(0.25%trypsin-EDTA消化细胞,含血清的培养基终止消化),UMSCs在下一步实验前先传代2 ~4次。
HEK293用含10%FBS、2 mmol/L谷氨酰胺和1%双抗 (100 U/mL青霉素、0.1 mg/mL链霉素)的DMEM/F12培养基培养。
NSCs(SCC007,Millipore,美国)的培养和扩增根据生产商提供的方案进行。细胞培养皿用层粘连蛋白和多聚赖氨酸包被,用含20 ng/mL碱性成纤维生长因子(basicfibroblastgrowthfactor,bFGF)(PeproTech,美国)、20 ng/mL表皮生长因子 (epidermal growth factor,EGF)(PeproTech,美国)的 ReNCell培养基培养。NSCs种板密度为5×105/mL,实验中所使用的NSCs均在3 ~10代内。
四、UMSCs转分化为uNSCL
UMSCs经过0.05%的胰酶消化后,以(1.5 ~2.0)×105/cm2密度种植于低粘附培养瓶 (Corning Inc,Lowell,MA,美国),用含 1×N2B27、20 ng/mL bFGF、20 ng/mL EGF的NSC细胞培养基培养,培养3 ~4 d时,离心收集细胞,用细胞消化液Accutase(Sigma,美国)消化细胞,然后再以(1.5 ~2.0)×105/cm2密度种植于低粘附培养瓶。培养7 ~10 d呈神经球样生长的细胞便可用于相关实验使用。
五、流式细胞实验
UMSC细胞经胰蛋白酶-EDTA处理后,用含1%新生胎牛血清和0.02%叠氮钠的磷酸缓冲液(phosphate buffer saline,PBS)溶液清洗 2 遍。样品采用FACSCalibur流式细胞仪和相应软件(Becton Dickinson,Franklin Lakes,NJ,美国)进行分析,每个样品纳入分析数目不少于20 000个细胞。
六、质粒
含质粒 EID3(pcDNA3.1-Flag-EID3)和DNMT3A(pcEGFP-C1-DNMT3A)大肠杆菌菌液(Ampicillin 耐药)购置于北京和元生物科技公司。菌液复苏后,摇菌24 h,质粒大提试剂盒(上海碧云天生物技术有限公司)提取质粒(实验步骤根据厂家说明)。
七、Western blot
总蛋白的提取使用含蛋白酶抑制剂成分RIPA细胞裂解液(Thermo Fisher,Pittsburg,PA,美国),蛋白浓度的测定使用BCA蛋白质检测试剂盒(上海碧云天生物技术有限公司)。等量蛋白经十二烷基硫酸钠聚丙烯酰胺凝胶电泳电泳分离后,电转至聚偏二氟乙烯膜(Milipore,美国)。5%牛血清白蛋白溶液(bovine serum albumin,BSA)抗原封闭,一抗(EID3、DNMT3A、GAPDH、Flag、EGFP)孵育 4℃过夜,二抗孵育室温摇床反应1 h,PBS吐温洗膜液洗膜。条带使用ECL检测试剂盒显影 (GE Healthcare Life Science,Pittsburgh,PA,美国),暗室曝光分析结果。
八、免疫共沉淀实验
研究uNSCLs细胞内源性EID3和DNMT3A是否能够免疫共沉淀时,收集uNSCLs细胞总蛋白后,分2组,各500 μg,对照组加入免疫球蛋白G磁珠(Milipore,美国),实验组中加入 1.5 μL EID3 抗体,混匀4°C冰箱摇过夜,各加入20 μL A/G蛋白磁珠(Santa Cruz,CA,美国)混匀,4℃摇 4 h。 取出后离心小心吸出全部上清,PBS充分洗涤珠子,2×上样缓冲液 (上海碧云天生物技术有限公司)混匀珠子后95℃煮样10 min,冷却后各吸取15 μL进行western blot实验,检测DNMT3A。相同方法加入DNMT3A抗体检测EID3是否被共沉淀。
研究外源性EID3和DNMT3A在HEK293细胞中能够发生免疫共沉淀时,向HEK293中转染pcDNA-EID3(带Flag标签)和pcEGFP-DNMT3A(EGFP标签)质粒,加入Flag抗体后检测DNMT3A,同理加入EGFP抗体检测Flag。其他方法步骤同内源性检测。
九、免疫细胞化学染色和激光共聚焦
细胞以1.5×104/cm2的密度种在已放入经多聚赖氨酸包被细胞爬片的12孔细胞培养板中,细胞染色前,以4%多聚甲醛细胞固定液(1×PBS配置)进行细胞固定处理10 min。PBS浸润洗涤3次,0.25%Triton-X100(5%BSA配置)细胞破膜处理5 min,室温下5%BSA溶液抗原封闭处理1 h后去除封闭液,加入适量现配工作浓度一抗(EID3、DNMT3A),4℃过夜,一抗洗涤后进行二抗染色,室温下避光孵育2 h。二抗洗涤,封片。激光共聚焦显微镜下观察染色结果和分析亚细胞结构染色情况。
十、RNA提取及RT-PCR和qRT-PCR分析
RNA 的提取利用 TRIzol(Invitrogen,美国),实验步骤根据厂家说明。提取UMSCs、NSCs和uNSCLs细胞中的总RNA后,再用无RNA酶的DNA酶试剂处理,操作步骤根据厂家说明。为了评价mRNA的表达水平,总RNA经逆转录处理,逆转录操作试剂盒使用 PrimeScript RT Reagent Kit(TaKaRa,Otsu,日本)。500 ng总RNA用于合成第一条cDNA。逆转录系统为Applied Biosystems ViiATM7 System,后续扩增使用SYBR Green PCR Master mix(TaKaRa,Otsu,日本)。
十一、统计学分析
采用SPSS20.0软件进行统计学处理,实验结果均以均数±标准差(±s)表示,2组组间比较采用两独立样本的t检验,以P<0.05为差异有统计学意义。
结 果
一、诱导转分化后的uNSCLs表现出NSC的细胞特点
UMSC经过4 ~6代后,通过特定培养条件下(见实验方法),细胞逐渐表现出NSCs的成球成长特征,体外培养的uNSCLs细胞倍增时间约为2.6 d,连续体外培养细胞形态学至少能维持8周时间 (图1A ~B)。同时,相比较UMSCs,uNSCLs高表达NSCs的 相 关 mRNA: 在 NESTIN、PAX6、VIMENTIN、GFAP、MUSASHI1和NEUROD1基因mRNA的水平上增加了3 ~13.2倍,差异具有统计学意义(t=9.925、14.089、4.303、8.994、10.122、22.327、1.876;P=0.018、0.0005、0.026、0.0003、0.017、0.002、0.258,图 1C)。
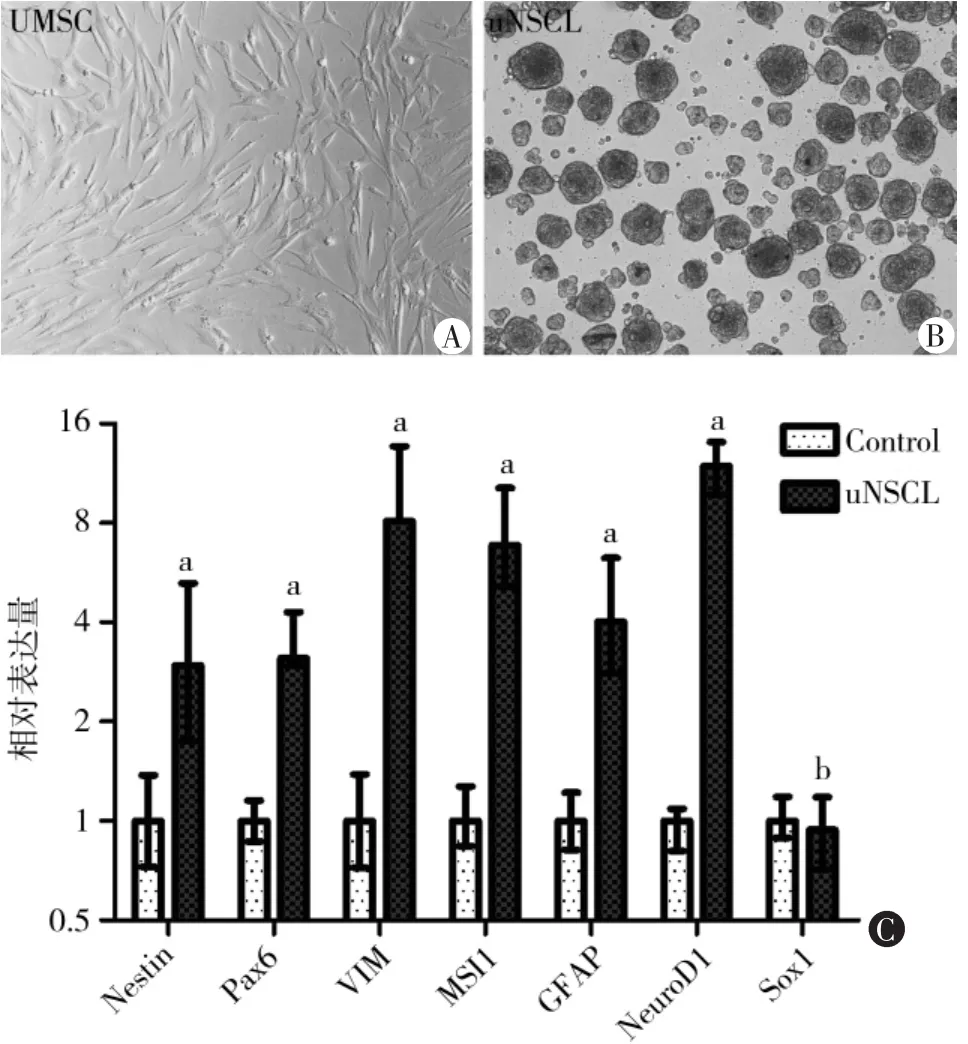
图1 UMSCs和由UMSCs转分化而来的uNSCLs细胞形态及免疫学特征
二 、EID3 和 DNMT3A 在 uNSCL、UMSCs 和NSCs细胞中的表达变化
为了研究uNSCLs细胞中甲基化和乙酰化酶之间的关系,通过qRT-PCR检测相关表观遗传学基因的表达情况, 包括 DNMT1、DNMT3A、DNMT3B、HDAC1、P300、EID1和 EID3。结果显示 DNMT3A 在uNSCLs和NSC中的表达量明显高于UMSCs,具有统计学差异 (tuNSCLs=7.453,PuNSCLs=0.006;tNSCs=12.924,PNSCs=0.001)(图 2A)。 随后,检测 UMSC、uNSCLs和NSC细胞中DNMT3A和EID3的蛋白表达水平。结果显示,DNMT3A和EID3在上述细胞中的蛋白表达量呈现相反的趋势,在UMSC中,EID3高表达而DNMT3A低表达;经过诱导转化后的uNSCLs与UMSC比较,EID3表达量降低而DNMT3A的表达量升高;NSCs与uNSCLs比较,EID3的表达量进一步降低,并且DNMT3A的表达量进一步升高(图2B ~C)。

图2 UMSCs、uNSCLs、NSCs中表观遗传基因mRNA水平比较及EID3和DNMT3A蛋白水平比较

图3 EID3和DNMT3A在UMSCs、uNSCLs、NSCs中免疫荧光情况
亚细胞水平表达定位研究发现,EID3和DNMT3A都优先在细胞核中富集,而后,EID3在细胞浆和细胞核中均有表达,而DNMT3A则大部分表达在细胞核中,与EID3存在共定位表达现象(图3)。
三、EID3直接结合DNMT3A
通过免疫共沉淀实验进一步检测EID3和DNMT3A之间确切关系,EID3抗体能够将uNSCLs细胞总蛋白中DNMT3A蛋白沉淀下来,并且DNMT3A抗体也能够将uNSCLs细胞总蛋白中EID3蛋白沉淀下来 (图4A)。这部分实验证明,在uNSCLs细胞中,EID3和DNMT3A之间存在直接结合作用。
为了进一步验证细胞内EID3与DNMT3A蛋白之间能够直接结合,本研究在HEK293细胞系中共转染表达EID3(Flag标签)和DNMT3A(EGFP标签)的外源性质粒,外源性转染基因表达蛋白的免疫共沉淀实验结果发现,外源性Flag-EID3与pEGFPDNMT3A之间同样能够相互沉淀下来。这就说明,外源性EID3和DNMT3A蛋白同样存在直接结合的现象(图 4B)。
讨 论
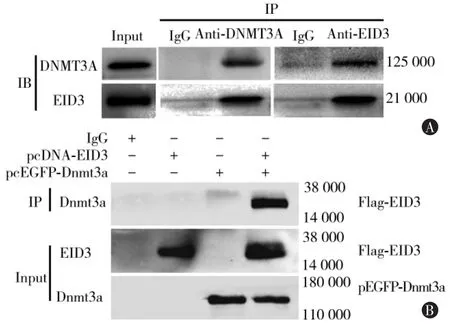
图4 EID3和DNMT3A免疫共沉淀
成熟神经细胞因其有限的自我更新能力,移植NSCs成为神经退行性病变的一种理想可行的治疗方案。目前,NSCs移植治疗在再生医学领域实际应用尚存在许多未能解决的难题,其中最大难题在于如何快速获取大量的NSCs[18]。直接提取uNSCLs进行原代培养扩增因存在诸多限制,实际操作无法实现。幸运的是,人类干细胞转分化领域大量研究成果表明,MSCs为NSCs的大量获取提供了可能。MSCs来源丰富,容易分离培养,细胞增殖速度快,并且研究已经表明MSCs能够在较短的时间内通过人工诱导转分化,从而获取大量具有NSCs功能特性的一种uNSCLs样细胞[19,20]。然而,关于MSCs是否能够在不引入外源性转录因子而自然的转分化为uNSCLs的问题,仍然存在许多争论。
在本研究中,由UMSCs转分化而来的uNSCLs,能够6次以上进行传代而保持自身细胞特征的稳定性。笔者认为,uNSCLs体现的是MSCs转分化为NSCs的一种中间状态,理由如下:(1)在无血清培养基中,UMSCs倾向聚集成球生长,但是这并不等同于NSC/NPC神经球,因为后者成球生长的原因是因其自身的细胞增殖所致;(2)尽管uNSCLs细胞表达许多NSCs的细胞表面蛋白和转录因子标记物,但是一些重要的NSCs标记物并没有显著表达,如SOX2。虽然存在以上的问题,uNSCLs仍然表现出了类似NSCs的诸多特性,uNSCLs细胞能够成球状增殖,并且表达NSCs相关标记蛋白,同时能够进一步分化为不同类型的神经细胞。因此,笔者认为uNSCLs细胞作为MSCs转分化为NSCs研究的细胞模型具有重大的价值。
在体细胞的重编码的过程中,DNA甲基化和去甲基化平衡能够维持DNA的甲基化谱,但其中去甲基化的机制尚不明确。相关研究已经发现,DNMT3A作为一个从头甲基化酶,却能表现出脱羟基甲基化酶活性[21,22]。然而,在细胞的转分化过程中,DNMT3A是如何协调自身甲基化和去甲基化双重作用尚不得知。笔者检测EID3和DNMT3A分别在uNSCLs、UMSCs和NSCs中的表达水平,结果发现,EID3和DNMT3A之间的表达水平存在相关关系,在UMSCs转分化为uNSCLs之前,细胞高表达EID3而低表达DNMT3A;UMSCs转分化为uNSCLs之后,细胞低表达EID3而高表达DNMT3A。随后,本研究进一步发现了EID3在UMSCs转分化的过程中直接结合了DNMT3A。因此,EID3很可能参与调控了DNMT3A所表现出的甲基化和去甲基化双重功能的转变过程,调控了UMSCs转分化为uNSCLs过程中DNA重编码中的甲基化和去甲基化平衡。
EID3作为组蛋白乙酰化酶P300抑制蛋白,能够直接结合甲基化转移酶DNMT3A,并调控DNMT3A的功能状态,反映了MSCs转分化过程中存在复杂的外源性调控,且需要更加全面地进行多种因素研究来进一步探索干细胞转分化机制。
[1] Zuk PA,Zhu M,Ashjian P,et al.Human adipose tissue is a source of multipotent stem cells[J].Mol Biol Cell,2002,13(12):4279-4295.
[2] Buzanska L,Jurga M,Stachowiak EK,et al.Neural stem-like cell line derived from a nonhematopoietic population of human umbilical cord blood[J].Stem Cells Dev,2006,15(3):391-406.
[3] Hsueh YY,Chiang YL,Wu CC,et al.Spheroid formation and neural induction in human adipose-derived stem cells on a chitosan-coated surface[J].Cells Tissues Organs,2012,196(2):117-128.
[4] 彭钢,陈建泉,朱剑虹.异体神经干细胞脑移植后免疫排斥反应的研究[J].中华神经医学杂志,2010,9(8):785-788.
[5] Mung KL,Tsui YP,Tai EW,et al.Rapid and efficient generation of neural progenitors from adult bone marrow stromal cells by hypoxic preconditioning[J].Stem Cell Res Ther,2016,7(1):146.
[6] Hermann A,Gastl R,Liebau S,et al.Efficient generation of neural stem cell-like cells from adult human bone marrow stromal cells[J].J Cell Sci,2004,117(Pt 19):4411-4422.
[7] 张永彪,褚嘉祐.表观遗传学与人类疾病的研究进展[J].遗传,2005,27(3):466-472.
[8] 高亮,章小清.神经干细胞与创伤性颅脑损伤后的神经修复[J].中华神经创伤外科电子杂志,2015,1(3):41-44.
[9] Ozkul Y, Galderisi U. The Impact of Epigenetics on Mesenchymal Stem Cell Biology[J].J Cell Physiol,2016,231(11):2393-2401.
[10] Miyake S,Sellers WR,Safran M,et al.Cells degrade a novel inhibitor of differentiation with E1A-like properties upon exiting the cell cycle[J].Mol Cell Biol,2000,20(23):8889-8902.
[11] Ji A,Dao D,Chen J,et al.EID-2,a novel member of the EID family of p300-binding proteins inhibits transactivation by MyoD[J].Gene,2003,318:35-43.
[12] Båvner A,Matthews J,Sanyal S,et al.EID3 is a novel EID family member and an inhibitor of CBP-dependent co-activation[J].Nucleic Acids Res,2005,33(11):3561-3569.
[13] Okano M,Bell DW,Haber DA,et al.DNA methyltransferases Dnmt3a and Dnmt3b are essential for de novo methylation and mammalian development[J].Cell,1999,99(3):247-257.
[14] MétivierR,GallaisR,TiffocheC,etal.CyclicalDNA methylation of a transcriptionally active promoter[J].Nature,2008,452(7183):45-50.
[15] Wu Z,Huang K,Yu J,et al.Dnmt3a regulates both proliferation and differentiation of mouse neural stem cells[J].J Neurosci Res,2012,90(10):1883-1891.
[16] Colquitt BM,Markenscoff-Papadimitriou E,Duffie R,et al.Dnmt3a regulates global gene expression in olfactory sensory neurons and enables odorant-induced transcription[J].Neuron,2014,83(4):823-838.
[17] Tatton-Brown K,Seal S,Ruark E,et al.Mutations in the DNA methyltransferase gene DNMT3A cause an overgrowth syndrome with intellectual disability[J].Nat Genet,2014,46(4):385-388.
[18] 贺晓生.神经干细胞移植在创伤性脑损伤再生与修复中的作用和影响因素[J].中华神经外科疾病研究杂志,2012,11(1):1-3.
[19] Leite C,Silva NT,Mendes S,et al.Differentiation of human umbilical cord matrix mesenchymal stem cells into neural-like progenitor cells and maturation into an oligodendroglial-like lineage[J].PLoS One,2014,9(10):e111059.
[20] Shahbazi A,Safa M,Alikarami F,et al.Rapid induction of neural differentiation in human umbilical cord matrix mesenchymal stem cells by cAMP-elevating agents[J].Int J Mol Cell Med,2016,5(3):167-177.
[21]Chen CC,Wang KY,Shen CK.The mammalian de novo DNA methyltransferases DNMT3A and DNMT3B are also DNA 5-hydroxymethylcytosine dehydroxymethylases[J].J Biol Chem,2012,287(40):33116-33121.
[22] Kangaspeska S,Stride B,Métivier R,et al.Transient cyclical methylation of promoter DNA[J].Nature,2008,452(7183):112-115.

