抗旱番茄种质资源筛选及抗旱性评价
李景富,崔亚男,姜景彬,杨欢欢,赵婷婷,许向阳
(东北农业大学园艺园林学院,哈尔滨 150030)
番茄(Lycopersicum esculentum Mill)是目前种植面积最广蔬菜作物之一[1]。番茄在营养、生殖生长过程对水分需求居茄果类蔬菜之首[2],干旱可直接威胁番茄植株生长发育、产量和品质,阻碍番茄产业发展[3]。番茄栽培品种在全生育期均表现为对干旱敏感,尤其是在发芽期和幼苗期[4]。
本研究为筛选抗旱性番茄材料,对番茄材料苗期模拟干旱处理并测定相关生理指标,反映干旱对番茄苗期影响,全面评价番茄抗旱性,为筛选抗旱番茄品种提供新思路。以抗旱品种为研究材料,进一步研究番茄抗旱机理并挖掘抗旱基因,通过杂交育种,培育抗旱性番茄材料。
1 材料与方法
1.1 试验材料
本试验所用番茄材料由东北农业大学园艺园林学院番茄课题组提供。6份具有抗旱性番茄材料基本性状如表1所示。

表1 6份番茄材料基本性状Table 1 Basic traits of six tomato materials
1.2 试验方法
1.2.1 抗旱优良番茄种质资源筛选方法
2017年5月26日将200份番茄材料定植于东北农业大学向阳实习实验基地大棚,通过调查番茄材料生长类型、成熟果色、单果重、熟性等重要田间农艺性状,筛选100份优良番茄材料。选取100份番茄材料功能叶片,20%PEG-6000溶液胁迫处理离体叶片[6]。根据叶片萎蔫程度,初步筛选6份抗旱番茄材料,采籽留种。
1.2.2 抗旱番茄材料处理方法
2017年11月20日,在东北农业大学园艺实验站温室大棚内将6份番茄材料播种于盛有灭菌土育苗盘中,待长至两叶一心时,挑选长势一致番茄幼苗,自来水冲洗根部,放在盛有1/2 Hoagland营养液锥形瓶中,标记,每2 d更换1次营养液。适应生长2周后,用含有20%PEG-6000的1/2Hoagland营养液模拟干旱胁迫处理,将只含营养液作为空白对照,每个材料处理5株苗,每个处理重复3次。分别在0、24、48 h后测定相关抗旱生理指标并采集样品,每个生理指标测3次,每个样品重复取样3次。
1.3 生理指标测定方法
1.3.1 叶片相对含水量测定
采用常规的饱和、烘干、称重方法测定,参照文献[7]方法。
1.3.2 叶绿素相对含量测定
利用SPAD-502叶绿素仪测定,测定每份材料同位置叶片,相同部位,每个叶片3次。
1.3.3 叶面积测定
利用LAI叶面积仪,选取相同尺寸叶片测定。每个植株测3个叶片,每个叶片3次。
1.3.4 PⅡ最大光转化效率Fv/Fm测定
利用荧光仪(IMAGING-PAM)测定叶绿素荧光参数Fv/Fm,先将叶片黑暗处理30 min,测定参照文献[8]方法。
1.3.5 DAB与NBT组织染色
利用DAB可与植物组织中H2O2反应生成红棕色沉淀,NBT可与植物组织中O2-反应生成深蓝色沉淀原理。通过DAB和NBT染色方法观察番茄叶片H2O2和O2-积累情况。染色方法参照文献[9]。
1.4 抗旱性方法综合评价
为消除不同品种间各生理指标对照值及不同抗旱生理指标单位不同影响,将测定原始数据换算成抗旱指数,利用抗旱指数作主成分分析[10],得出综合指标作隶属函数分析[11],对不同品种隶属函数值聚类分析[12],涉及公式参照文献[7]方法。
1.5 数据分析
利用Microsoft Excel 2007统计原始数据、处理并作相关图表,运用SPSS 22.0对处理后数据作方差分析、相关性分析、主成分分析及聚类分析。
2 结果与分析
2.1 PEG胁迫对番茄材料形态影响
PEG胁迫下番茄植株形态变化见图1。

图1 PEG胁迫下番茄植株形态变化Fig.1 Changes of plant morphology in tomato plants under PEG stress
由图1可知,随胁迫程度加深,植株萎蔫程度越来越严重。当胁迫处理24 h后,与对照相比,植株叶片萎蔫,叶色加深;胁迫处理48 h后,植株叶片焦枯状、茎弯曲,整株表现倾斜。
2.2 PEG胁迫对6份番茄材料叶片相对含水量影响
由图2可知,与对照组相比,随胁迫程度加深,6份番茄材料叶片相对含水量均出现不同程度降低。与对照组相比,各份材料经胁迫处理24 h后,相对含水量分别降低17%、35%、27%、43%、42%、31%;与对照组相比,各份材料经胁迫处理48 h后,相对含水量分别降低42%、45%、37%、58%、50%、42%;各份材料胁迫处理48 h与24 h相比,相对含水量分别下降25%、10%、10%、15%、8%、11%。方差分析结果表明,仅材料‘955982’经24和48 h胁迫处理后相对含水量差别显著(P≤0.05),其他5份材料,对照组、胁迫处理24 h及胁迫处理48 h相对含水量差异达极显著(P≤0.01)。
2.3 PEG胁迫对6份番茄材料叶片叶绿素相对含量影响
由图3可知,材料‘895’‘982’‘955982’与对照组相比,随胁迫程度加深,叶绿素相对含量呈现不同程度增加。材料‘897’和‘955’,与对照组相比,随胁迫程度加深,叶绿素相对含量先增后降。材料‘895897’随胁迫程度加深,叶绿素相对含量先降后增。材料‘895’‘982’‘955982’,与对照组相比,两种不同程度胁迫下,分别增加4.6%、0.4%、2.9%、3.8%、8.2%、0.1%。经方差分析,材料‘895’,对照与两处理间,差异不显著(P>0.05),材料‘982’差异达极显著(P≤0.01),材料‘955982’,对照组与两处理间差异均达显著(P≤0.05),两处理间差异不显著(P>0.05)。材料‘982897’和‘955’,与对照组相比,两种不同程度胁迫下,先分别增加12.6%、9.2%,再分别降低8.6%、9.2%。
经方差分析,两种材料,对照组与胁迫处理24 h,差异均极显著(P≤0.01);与胁迫处理48 h相比,差异不显著(P>0.05),两处理间,差异分别达显著(P≤0.05)及极显著(P≤0.01)。材料‘895897’,与对照组相比,先降低2.85%,又升高5.2%。经方差分析,材料‘895895’,对照组与两种处理间差异不显著(P>0.05)。

图2 PEG胁迫下番茄叶片相对含水量变化Fig.2 Changes of relative water content in tomato leaves under PEG stress

图3 PEG胁迫下番茄叶片叶绿素相对含量变化Fig.3 Changes of chlorophyll relative content in tomato leaves under PEG stress
2.4 PEG胁迫对6份番茄材料叶面积影响
由图4可知,随干旱胁迫程度加深,各材料叶面积均呈下降趋势。各材料对照组与处理24 h相比,分别下降54%、64%、74%、72%、62%、80%,各材料对照组与处理48 h相比,分别下降70%、75%、88%、75%、71%、87%,各材料处理48 h与24 h相比,分别下降34%、27%、54%、9%、23%、33%。经方差分析,各材料对照组,与两种胁迫处理差异均达极显著(P≤0.01),只有材料‘897’‘895897’和‘955982’,两个处理间差异达极显著(P≤0.01),材料‘895’两处理间差异显著(P≤0.05),材料‘955’和‘982’,两个处理间差异不显著(P>0.05)。
2.5 PEG胁迫对6种番茄材料叶绿素荧光参数Fv/Fm影响
由图5可知,随胁迫程度加重,各番茄材料Fv/Fm均呈下降趋势。各材料对照组与处理24 h相比,分别下降17.7%、6.3%、21.3%、16.2%、15.6%、17.4%,各材料对照组与处理48 h相比,分别下降26.6%、17.6%、27.3%、29.5%、19.6%、29.3%,各材料处理24 h与48 h相比,分别下降8.8%、11.3%、6%、13.2%、4%、13.6%。经方差分析,材料‘895’‘895895’‘955’‘982’及‘955982’,对照组与胁迫处理24 h间差异分别达极显著(P≤0.01),材料‘897’对照组与胁迫处理24 h间差异显著(P≤0.05)。各材料对照组与胁迫处理48 h间差异均达极显著(P≤0.01)。材料‘895’‘897’‘895897’‘955’及‘955982’胁迫处理24与48 h间差异达极显著(P≤0.01)。对于材料‘982’,两处理间差异不显著(P>0.05)。
2.6 PEG胁迫对6种番茄材料叶片活性氧含量影响
由图6a~c可知,随干旱程度加深,叶片呈红棕色面积越大,特别是萎蔫叶边缘。说明H2O2生成量增多。
由图6d~f可知,随胁迫程度加深,叶片中深蓝色区域增多,主要集中在主叶脉及其附近处。表明O2-生成量增多。
2.7 PEG胁迫下各项生理指标间相关性分析
由表2可知,胁迫处理24 h后,叶绿素相对含量与叶绿素荧光参数Fv/Fm间显著相关(P<0.05);胁迫处理48 h后,叶面积与相对含水量关系显著相关(P<0.05)。一般认为,相关系数0.8~1.0极强相关、0.6~0.8强相关、0.4~0.6中等程度相关、0.2~0.4弱相关以及0.0~0.2极弱相关或无相关。不同胁迫程度下,其他各生理指标间相关系数0.4~0.6,其间呈中强度关系。
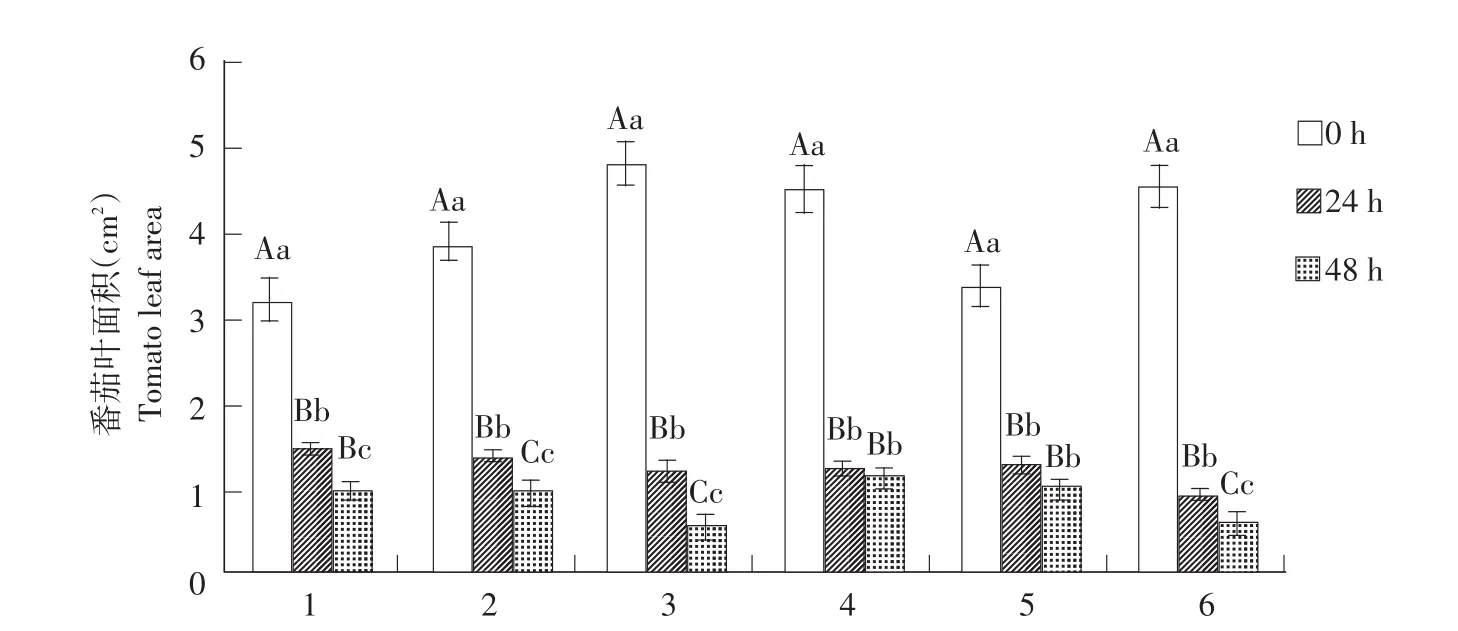
图4 PEG胁迫下番茄叶面积变化Fig.4 Changes of tomato leaf area under PEG stress
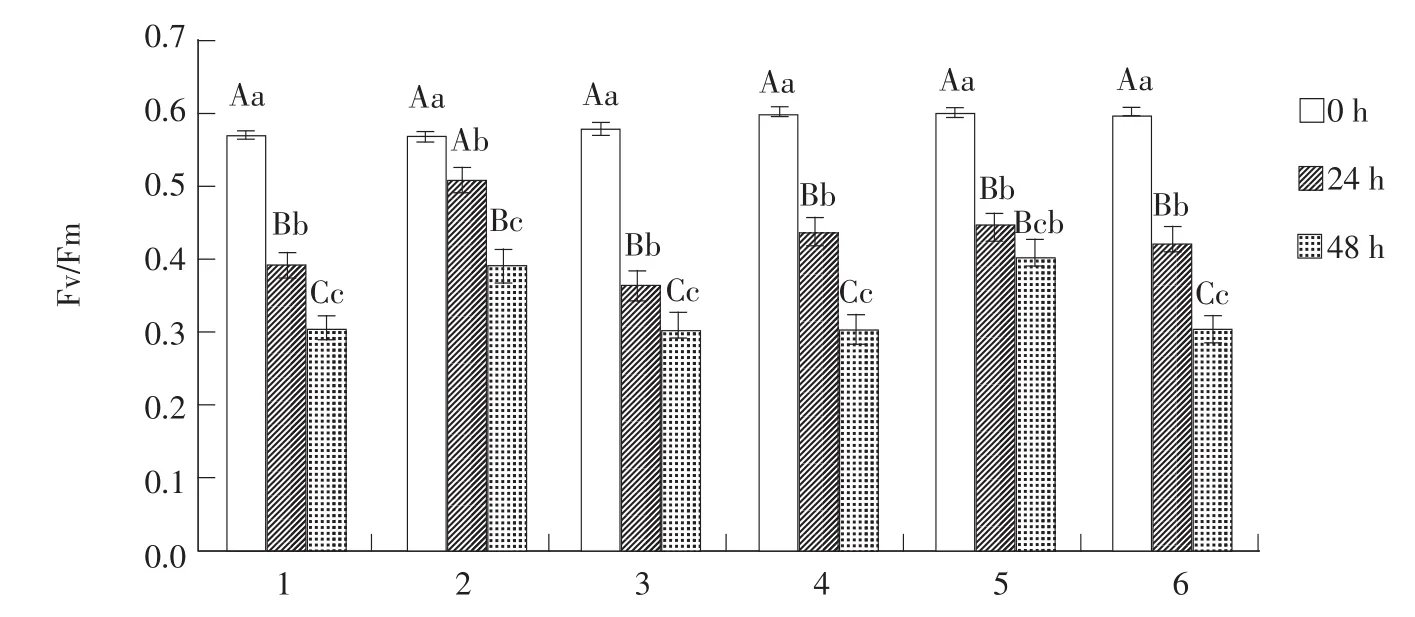
图5 PEG处理下番茄叶片Fv/Fm变化Fig.5 Changes of Fv/Fm in tomato leaves under PEG stress

图6 PEG胁迫下番茄叶片中H2O2与O2-生成量变化Fig.6 Changes of H2O2and O2-contents in tomato leaves under PEG stress

表2 不同胁迫程度下各项番茄材料生理指标相关性分析Table 2 Correlation analysis of tomato physiological indices under different stress
2.8 PEG胁迫下各番茄材料生理指标主成分分析
经相关性分析可知,各生理指标存在中等强度以上相关关系。说明其在番茄抗旱性上表达重叠信息。本试验对不同胁迫程度下各番茄材料4个生理指标作主成分分析,将具有相互关系4个生理指标转化为互不影响综合生理指标。由表3可知,根据特征值大于1,将在胁迫处理24和48 h各番茄材料生理指标转化成2个综合指标,其累计贡献率分别为85.821%和88.446%,故可代替原来4个生理指标表征植物抗旱性。
2.9 各番茄材料抗旱性综合评价
2.9.1 综合主成分分析结果和隶属函数值综合评价各番茄材料
根据1.4中公式,求出不同胁迫程度下番茄材料综合评价值D。胁迫处理24 h后,各番茄材料抗旱 性 :‘897’>‘895’>‘955’>‘982’>‘955982’>‘895897’;胁迫处理48 h后,各番茄材料抗旱性:‘895897’>‘955982’>‘982’>‘897’>‘895’>‘955’。综合两次胁迫程度,抗旱性:‘897’>‘895897’>‘955982’>‘982’>‘895’>‘955’(见表4)。
2.9.2 不同番茄材料聚类分析
根据主成分分析及隶属函数,得出不同胁迫下番茄材料综合评价值D及抗旱性。利用平均D值,运用Ward方法,分析各材料聚类[14],划分不同番茄材料抗旱性等级。根据平均D值,结合聚类结果,参照文献[15]方法。将6种番茄材料划分为3类:强抗旱材料‘897’;中等抗旱材料‘895’‘895897’‘982’‘955982’;弱抗旱材料‘955’。
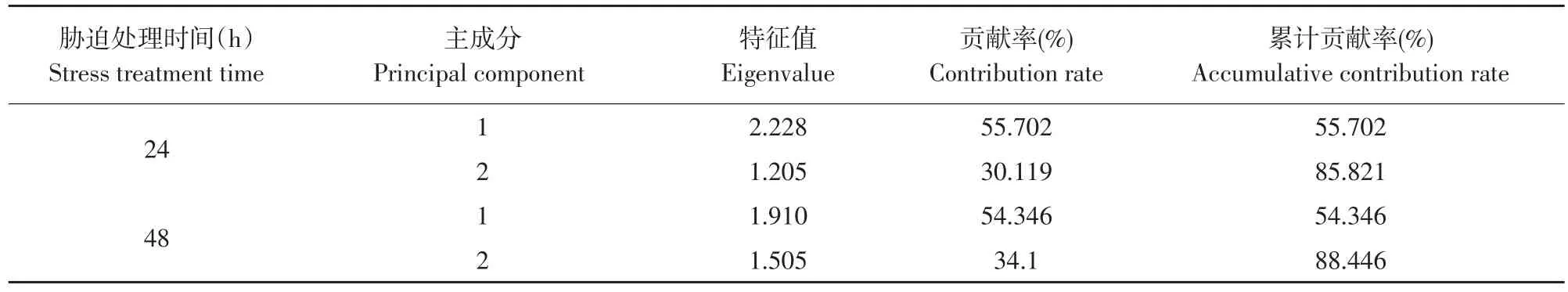
表3 不同胁迫下各番茄材料主成分分析结果Table 3 Principal component analysis results of tomato materials under different stress
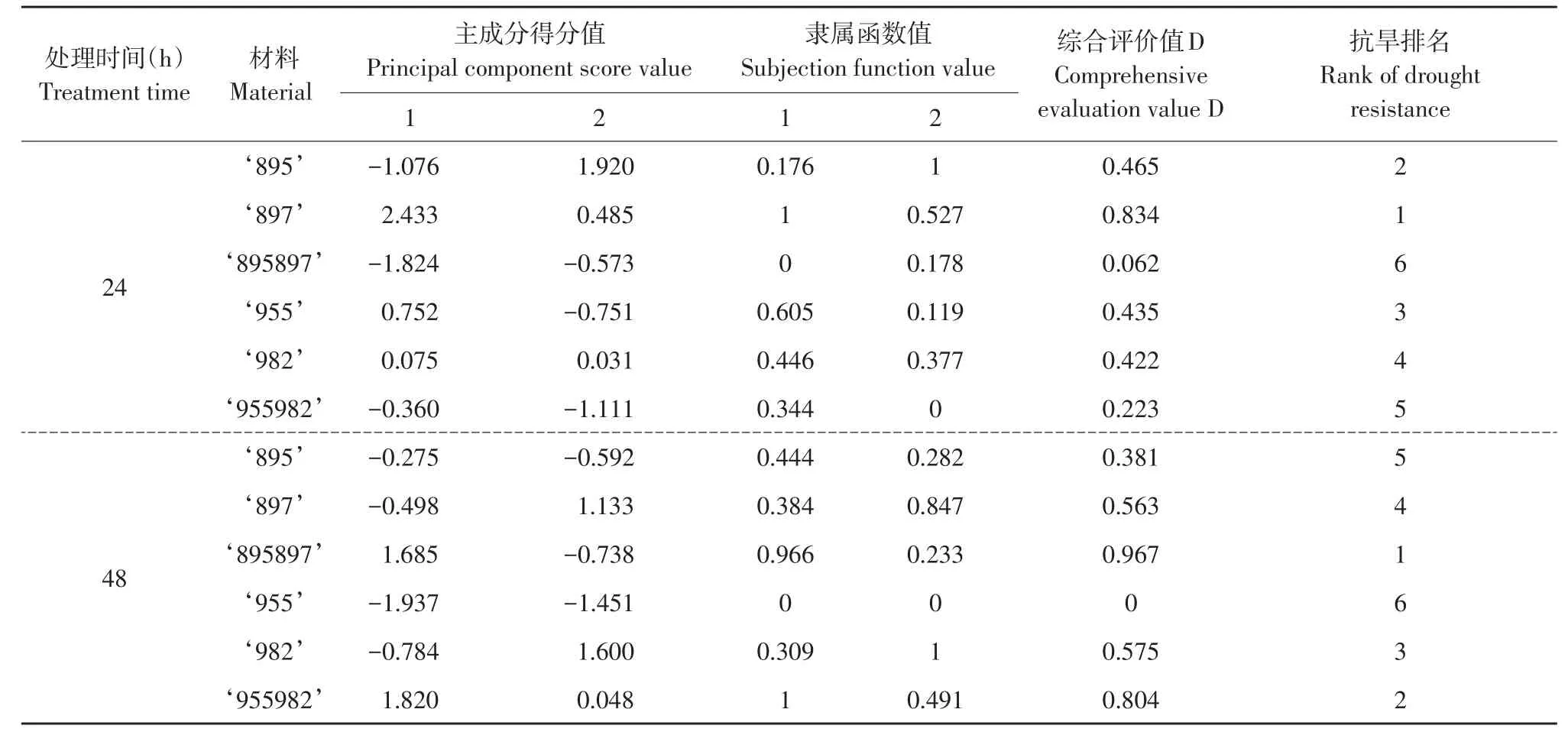
表4 不同番茄材料抗旱性综合评价Table 4 Comprehensive evaluation results of drought resistance of tomato materials

图5 各番茄抗旱性聚类分析结果Fig.5 Cluster analysis on drought resistance of tomato materials
3 讨论与结论
3.1 干旱对番茄各生理指标影响
植物抗旱性是受多因素影响的复杂数量性状,干旱对植物影响表现在生长发育各阶段,如种子萌发、营养生长和生殖生长,直至开花结实[16]。干旱主要影响植物形态及生理生化过程,植株萎蔫,含水量降低,影响光合作用等生化反应。叶绿素是参与植物光合作用重要物质,含量变化反映植物受干旱胁迫程度[17]。叶绿素荧光与光合作用中各反映过程紧密相关,可通过体内叶绿素荧光诱导动力学变化反映干旱影响。因此叶绿素荧光参数可作为逆境条件下植物抗逆反应指标之一[18]。水分胁迫降低植物生长速度、叶片伸展速度,减小植株叶面积,叶面积可反应植物受干旱胁迫影响[19]。当植物遭受干旱胁迫时,植物体内会产生过量活性氧,打破植物体内活性氧生成和清除平衡机制,多余活性氧使植物细胞质膜、叶绿素及蛋白质等受损,植物体内活性氧生产量反映植物抗旱能力。
本研究干旱胁迫处理苗期番茄,番茄相对含水量、叶面积及叶绿素荧光参数Fv/Fm随胁迫程度加深不断降低,与前人研究结果一致[20-21]。当植物受干旱胁迫时,植物细胞失水,细胞体积变小,叶片萎蔫,叶面积减小,叶片相对含水量降低[22],光合器官受损,光合作用受阻,影响PⅡ最大光转化效率。随胁迫程度加深,叶绿素相对含量逐渐降低,与彭强等试验结果一致[23-25]。李芳兰等研究表明,随胁迫程度加深,叶绿素含量逐渐增加[26-28],与材料‘895’‘982’‘955982’相对叶绿素含量变化一致。杨燕等研究表明,胁迫处理初期叶绿素含量升高,随胁迫程度加深,叶绿素含量会降低[29-30],与材料‘897’和‘955’叶绿素含量变化一致。王晶英等研究表明,植物叶片中叶绿素含量先降低,随胁迫程度加深,叶绿素含量升高,与材料‘895897’中叶绿素含量变化一致[31]。当植物受到干旱胁迫时,叶片含水量降低,短时间内不会使叶绿素受损,仅随叶片含水量变化,叶绿素浓度发生变化。表现为含量增多或降低。本试验利用DAB和NBT组织染色方法观察叶片中H2O2与O2-生产量。由图6可知,随胁迫程度加深,叶片中呈红棕色和蓝色面积增加,表明叶片中积累H2O2与O2-含量增多,与徐应杰试验结果一致[32]。
3.2 抗旱性综合评价
干旱胁迫对植物形态、渗透势、光合作用、活性氧及抗氧化酶系统、内源激素等均有影响,需采用多指标综合评价抗旱性。曾红等采用模糊数学隶属函数方法,综合分析相对含水量及荧光参数,综合评价4种轻型屋顶绿化植物抗旱性[33]。何海旺等采用主成分分析,将脯氨酸、丙二醛及各种酶等生理指标转化为3个综合指标,综合评价5份香蕉种质抗旱性[34]。张庆华等采用主成分分析、隶属函数及聚类分析综合评价抗旱性[12]。本试验利用隶属函数、主成分分析及聚类分析,比较6种番茄材料抗旱性依次为‘897’>‘895897’>‘955982’>‘982’>‘895’>‘955’。经聚类分析,可将 6份番茄材料分为3类,‘897’为强抗旱性番茄材料,‘982’‘895’‘955982’‘895897’为中等抗旱番茄材料,‘955’为弱抗旱性番茄材料。为全面研究干旱胁迫对番茄影响,未来应对番茄各生长时期,特别是成熟期,从产量、含糖量、维生素C等品质性状研究干旱对番茄影响,系统、全面评价番茄抗旱性。
[参考文献]
[1] 高美玲.磷对番茄产量和品质影响的研究[D].哈尔滨:东北农业大学,2003.
[2] 张丽英,柴敏,姜立纲.番茄苗期抗旱性鉴定及其评价方法的研究[J].中国蔬菜,2008(2):15-20.
[3]弓鹏娟.基于潘那利番茄渐渗系发掘干旱胁迫响应基因及功能分析[D].武汉:华中农业大学,2010.
[4] 张冬野,赵婷婷,李景富,等.水杨酸和氯化钙对干旱胁迫下番茄幼苗生理特性的影响[J].浙江农业学报,2016,28(10):1687-1694.
[5] 李景富.中国番茄育种学[M].北京:中国农业出版社,2011.
[6] 赵媛媛.马铃薯抗旱资源的筛选及抗旱相关基因的鉴定[D].哈尔滨:东北农业大学,2017.
[7]张冬野.外源水杨酸和氯化钙对番茄抗旱性及差异基因表达的影响[D].哈尔滨:东北农业大学,2016.
[8] 杨万基,于锡宏,蒋欣梅,等.弱光胁迫对番茄幼苗光合特性和根系生长的影响[J].江苏农业科学,2017,45(17):112-114.
[9] Kumar D,Yusuf M A,Singh P,et al.Histochemical detection of superoxide and H2O2accumulation in Brassica juncea seedlings[J].Bio-protocol,2014,4(8):1-4.
[10] 何海旺,武鹏,林茜,等.基于主成分分析的5份香蕉种质抗旱性评价[J].种子,2017,36(6):67-71.
[11] 王丽娟,马刚,张岚翠.利用水分亏缺处理鉴定番茄品种抗旱性[J].华北农学报,2011,26(2):203-206.
[12] 张庆华,向发云,曾祥国,等.干旱胁迫下不同品种草莓生理响应及抗旱性评价[J].北方园艺,2018(2):30-37.
[13] 杨志恒.基于Ward法的区域空间聚类分析[J].中国人口·资源与环境,2010,20(3):382-386.
[14] 张龙龙.三个小麦新品种抗旱性的综合评价[D].杨凌:西北农林科技大学,2016.
[15] 李志燕.PEG-6000胁迫下马铃薯耐旱指标的筛选[D].哈尔滨:东北农业大学,2015.
[16] 彭玉梅,石国亮,崔辉梅.PEG-6000模拟干旱胁迫下不同加工番茄种子萌发期抗旱性评价[J].种子,2013,32(7):44-49.
[17] 裴宗平,余莉琳,汪云甲,等.4种干旱区生态修复植物的苗期抗旱性研究[J].干旱区资源与环境,2014,28(3):205-208.
[18] 陈建明,俞晓平,程家安.叶绿素荧光动力学及其在植物抗逆生理研究中的应用[J].浙江农业学报,2006,18(1):51-55.
[19] 梁银丽,康绍忠,张成娥.不同水分条件下小麦生长特性及氮磷营养的调节作用[J].干旱地区农业研究,1999,17(4):59-63.
[20] 李清明.温室黄瓜(Cucumis sativus L.)对干旱胁迫与CO2浓度升高的响应与适应机理研究[D].杨凌:西北农林科技大学,2008.
[21] 陈文荣,曾玮玮,李云霞,等.高丛蓝莓对干旱胁迫的生理响应及其抗旱性综合评价[J].园艺学报,2012,39(4):637-646.
[22] 姚允聪,王有年,张瑞,等.水分亏缺条件下草莓幼苗几个水分生理指标的变化[J].果树科学,1992,9(4):208-212.
[23] 彭强,梁银丽,陈晨,等.土壤水分对辣椒叶片光合特性及保护酶系统的影响[J].灌溉排水学报,2010,29(4):101-104.
[24] 张庆华,曾祥国,向发云.干旱胁迫对草莓苗期叶片光合特性的影响[J].湖北农业科学.2016,55(23):6148-6150.
[25] 袁小环,刘潇红,武菊英,等.亏缺灌溉对青绿苔草生理与生长的影响[J].西北林学院学报,2015,30(3):61-65.
[26]李芳兰,包维楷,吴宁.白刺花幼苗对不同强度干旱胁迫的形态与生理响应[J].生态学报,2009,29(10):5406-5416.
[27] Gallé A,Haldimann P,Feller U.Photosynthetic performance and water relations in young pubescent oak(Quercus pubescens)trees during drought stress and recovery[J].New Phytologist,2007,174:799-810.
[28] 黎燕琼,刘兴良,郑绍伟,等.泯江上游干旱河谷四种灌木的抗旱生理动态变化[J].生态学报,2007,27(3):870-878.
[29] 杨燕,刘庆,林波,等.不同施水量对云杉幼苗生长和生理生态特性的影响[J].生态学报,2005,25(9):2152-2158.
[30] 邹春静,韩士杰,徐文铎,等.沙地云杉生态型对干旱胁迫的生理生态响应[J].应用生态学报,2003,14(9):1446-1450.
[31] 王晶英,赵雨森,王臻,等.干旱胁迫对银中杨生理生化特性的影响[J].水土保持学报,2006,20(1):197-200.
[32] 徐应杰.凉山引进油橄榄品种幼苗抗旱性比较[D].成都:四川农业大学,2015.
[33] 曾红,温庚金,罗旭荣,等.4种轻型屋顶绿化植物抗旱能力的综合评价[J].草业科学,2016,33(6):1084-1093.
[34] 何海旺,武鹏,林茜,等.基于主成分分析的5份香蕉种质抗旱性评价[J].种子,2017,36(6):67-71.

