多拷贝脂肪酶基因在黑曲霉中表达研究
李 杰,张 贺,王 欣,黄超群,徐 玥,张 会,刘天奇
(东北农业大学生命科学学院,哈尔滨 150030)
脂肪酶(EC 3.1.1.3)是最稳定水解酶之一,参与多种合成与水解反应,广泛应用于食品、造纸和洗涤等行业[1-3]。
脂肪酶来源广、应用领域多、需求量大,目前采用多拷贝启动子[4-5],多拷贝目的基因[6],融合表达[7],密码子优化[8],加入分子伴侣[9-10],选择高效表达系统[11]等方法提高脂肪酶基因表达量。杨江科等将黑曲霉脂肪酶基因经密码子优化在毕赤酵母中诱导表达72 h后,发酵液酶活力达176.0 U·mL-1[12]。Chen等运用RSM试验和单因子试验优化Aspergillus sp.F044产脂肪酶发酵条件,结果表明,在最优培养条件下,脂肪酶经72 h发酵酶活力达32.15 U·mL-1,比出发菌株提高2.88倍[13]。李秀鹏等通过降低背景蛋白及构建多拷贝耐热脂肪酶(TII)基因表达载体在黑曲霉SH-2中表达,转化子发酵上清液酶活力最高为150·U·mL-1[14]。国内目前脂肪酶产量仍无法满足工业生产需求,尤其是食品级脂肪酶生产成本高,产量低,纯化困难,提高食品级脂肪酶产量是现代工业生产难题之一。黑曲霉是最重要工业生产和基础遗传研究菌株[15],用于食品级酶制剂生产,高效生产表达食品级脂肪酶发展前景良好。
试验拟用多拷贝策略,利用同源重组技术将1~2拷贝脂肪酶基因整合到黑曲霉CICC2462中高表达酸稳定α-淀粉酶基因(asAA)位点,以期获得高分泌黑曲霉脂肪酶食品级工程菌。同时,研究拷贝数对目的基因在黑曲霉中高效表达影响,为提高脂肪酶表达量提供参考。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
A.niger CICC2462(ΔpyrGΔasAA::pyrG)、农杆菌AGL1、载体pSZHA由东北农业大学真菌遗传学实验室构建并保存。
1.1.2 主要试剂
Primer STAR DNA Polymerase、限制性内切酶(购自TaKaRa公司);质粒提取试剂盒、凝胶回收试剂盒(购自康为世纪生物科技有限公司);橄榄油(Olive oil)、聚乙烯醇(Poly vinyl alcohol)、尿苷(Uridine)(购自北京博奥拓达科技有限公司);5-FOA(5-Fluoroorotic acid)(购自美国Sigma公司);抗生素:氨苄霉素、卡那霉素、利福平等(购自Sangon公司)。其他试剂均为分析纯。
1.1.3 主要仪器
DK-8D三温三控水槽(购自上海百典仪器有限公司);高速离心机(购自美国Thermo Fisher Scien⁃tific);PCR仪(购自北京比朗实验设备有限公司);震荡培养箱(购自哈尔滨东联电子技术开发有限公司);立式压力蒸汽灭菌器(购自上海博迅实业有限公司);FSH-2A高速可调匀浆机(购自上海旌派仪器有限公司);pH计(购自沈阳瑞丰精细化学品有限公司)。
1.2 方法
1.2.1 黑曲霉基因组提取
根据康为世纪生物科技公司生产基因组提取试剂盒提供说明书提取黑曲霉基因组,具体步骤如下:
①吸取培养基中新鲜黑曲霉菌丝,离心10 min,称量菌丝湿重0.1 g。
②加液氮于菌丝中充分研磨至粉末后,加400 μL Buffer LP1和 6 μL RNase A,旋涡震荡60 s,室温静置10 min,再加130 μL LP2,混合均匀后,旋涡震荡1 min。
③高速离心10 min,取上清液至新EP管中,加入1.5倍体积LP3,混匀后加DM吸附柱中,离心,弃废液。
④加500 μL GW2(加入无水乙醇)于吸附柱中,离心,弃废液。此步骤重复两次。
⑤将吸附柱离心2 min后,倒掉收集管中废液,将吸附柱置于室温数分钟,彻底将酒精晾干。
⑥50 μL ddH2O加到吸附柱中,室温静置2~5 min后,12 000 r·min-1,离心2 min,收集DNA,于-20℃冰箱保存。
1.2.2 基因克隆
根据黑曲霉脂肪酶AnlipA(Gene ID:4988581)序列,用软件Primer 5.0设计黑曲霉脂肪酶基因特异引物(见表1)。
以黑曲霉基因组为模板,用引物P1和P2作PCR扩增,将扩增产物克隆至pMD-19T(TaKaRa)并测序。
1.2.3 表达载体构建
将本实验室已有质粒pT-6R与pT-6R-Tgla分别用ApaⅠ,HindⅢ和ApaⅠ,Bam HⅠ双酶切并回收载体片段,上述相同限制性内切酶双酶切质粒pT-AnlipA,回收目的基因片段,将载体与目的基因相连接,得质粒pT-6R-AnlipA和pT-6R-Anli⁃pA-Tgla。再分别用XbaⅠ,HindⅢ和NheⅠ,HindⅢ双酶切pT-6R-AnlipA和pT-6R-AnlipA-Tgla,将两片段相连,即得质粒pT-6R-AnlipA-Tgla-6R-Anli⁃pA。将表达载体pSZHA用XbaⅠ,HindⅢ双酶切,纯化后载体片段与AnlipA单拷贝与双拷贝表达框相连(见图1),即得表达载体pSZHA6R-AnlipA与pS⁃ZHA6R-2AnlipA。

表1 引物名称及其序列Table 1 Primer name and sequence

图1 pSZHA6R-AnlipA与pSZHA6R-2AnlipA表达阅读框Fig.1 Expression cassette of pSZHA6R-AnlipA and pSZHA6R-2AnlipA
1.2.4 黑曲霉脂肪酶共培养和转化子鉴定
重组质粒通过冻融法转入农杆菌AGL1后,初次活化农杆转化子菌按1∶10比例接种于新鲜YEB培养基(100 mg·L-1利福平,100 mg·L-1卡那霉素和200 μmol·L-1乙酰丁香酮)中,当OD600达 0.4~0.6时,取200 μL农杆菌离心后沉淀与50 μL破碎黑曲霉菌丝混合,涂布于覆盖在PDA平板玻璃纸上(200 μmol·L-1乙酰丁香酮)。30℃孵育2 d后,将含菌丝体玻璃纸倒置于新CD平板上(200 mmol·L-1头孢、20 g·L-1麦芽糖、1 mol·L-1尿苷和1 mol·L-15-FOA)培养1 d后,取出玻璃纸,30℃培养至菌落形成。将平板上菌落接种在CD液体培养基(200 mmol·L-1头孢、20 g·L-1麦芽糖、1 mol·L-1尿苷和1 mol·L-15-FOA)中培养5~7 d,收集黑曲霉菌丝提取其基因组DNA[16]。用引物P3和P4(见表1)鉴定黑曲霉纯合转化子。
1.2.5 荧光定量PCR检测
提取黑曲霉脂肪酶发酵第5天菌体RNA并合成反转录cDNA。用Premix Ex Taq在SYBR's Strata⁃gene Mx3000P仪器(美国)作实时定量PCR。每个样品反应体系50 μL,设3个重复,用表1中列出引物P5,P6和P7,P8作Quantitative real time PCR分析。PCR程序步骤如下:95℃初始变性10 min,95℃,15 s,60℃,60 s,40个循环,在每个延伸步骤结束时,95℃测量荧光信号。内部定量标准是同一样品actin转录数[17]。
1.2.6 SDS-PAGE
发酵上清液和2×protein loading buffer按1∶1比例混合,加热煮沸10 min。SDS-PAGE,用5%浓缩凝胶和12%分离凝胶对样品处理。加考马斯亮蓝R-250染液过夜染色后,再作1~2 h脱色处理。
1.2.7 酶活测定
将培养5~7 d黑曲霉纯合转化子接种到工业发酵培养基中(2%豆饼粉,2%玉米浆,10%葡萄糖,pH 5.5~6.0),30 ℃,250 r·min-1摇瓶振荡培养,收集4~10 d发酵液。配置0.05 mol·L-1氢氧化钠储备液,稀释为0.01 mol·L-1氢氧化钠标准溶液待用。取2个100 mL三角瓶,分别于瓶1与瓶2加入4 mL底物溶液(称取聚乙烯醇40 g加800 mL蒸馏水在沸水浴中加热、搅拌至全部溶解,加蒸馏水定容至1 L,冷却至室温后,干净双层纱布过滤,留滤液备用。量取上述溶液240 mL,加80 mL橄榄油,高速匀浆机处理6 min,共2次,间隔10 min,每次处理3 min。即得乳白色底物混合液,该底物溶液现用现配)和pH为7.5磷酸缓冲溶液5 mL(分别称取磷酸二氢钾3.92 g和79.24 g磷酸氢二钠,用蒸馏水溶解并定容至1 L),再于瓶1中加入95%乙醇15 mL,40℃水浴锅中预热5 min,两瓶中加入适当稀释倍数酶液1 mL,立即混匀计时,准确反应15 min后,瓶2中立刻补加15 mL 95%乙醇终止反应[18]。1、2两瓶中各加两滴酚酞指示剂,氢氧化钠标准溶液滴定,直至微红色并保持30 s不褪色为滴定终点,记录氢氧化钠标准溶液消耗体积。每个样品作3组平行。
脂肪酶制剂活力按如下公式计算:

X1:样品酶活力(μ·g-1);
V1:滴定瓶2时消耗氢氧化钠标准溶液体积(mL);
V2:滴定瓶1时消耗氢氧化钠标准溶液体积(mL);
c:氢氧化钠标准溶液浓度(mol·L-1);
n1:样品稀释倍数。
1.2.8 脂肪酶酶学性质测定
最适pH:将酶液稀释到适当倍数,调节缓冲溶液pH范围为4~11,在40℃条件下,测定脂肪酶酶活。
最适温度:将酶液稀释到适当倍数,调节温度范围25~55℃,在磷酸缓冲溶液pH 7.5条件下,测定脂肪酶酶活。
2 结果与分析
2.1 黑曲霉脂肪酶AnlipA克隆
以黑曲霉基因组为模板,用引物P1、P2作PCR扩增为1 055 bp目的条带(见图2),将AnlipA基因片段克隆至pMD-19T转入大肠杆菌中,摇瓶提取质粒,然后作测序比对,比对结果表明该基因序列与黑曲霉CBS513.88相似度为100%。
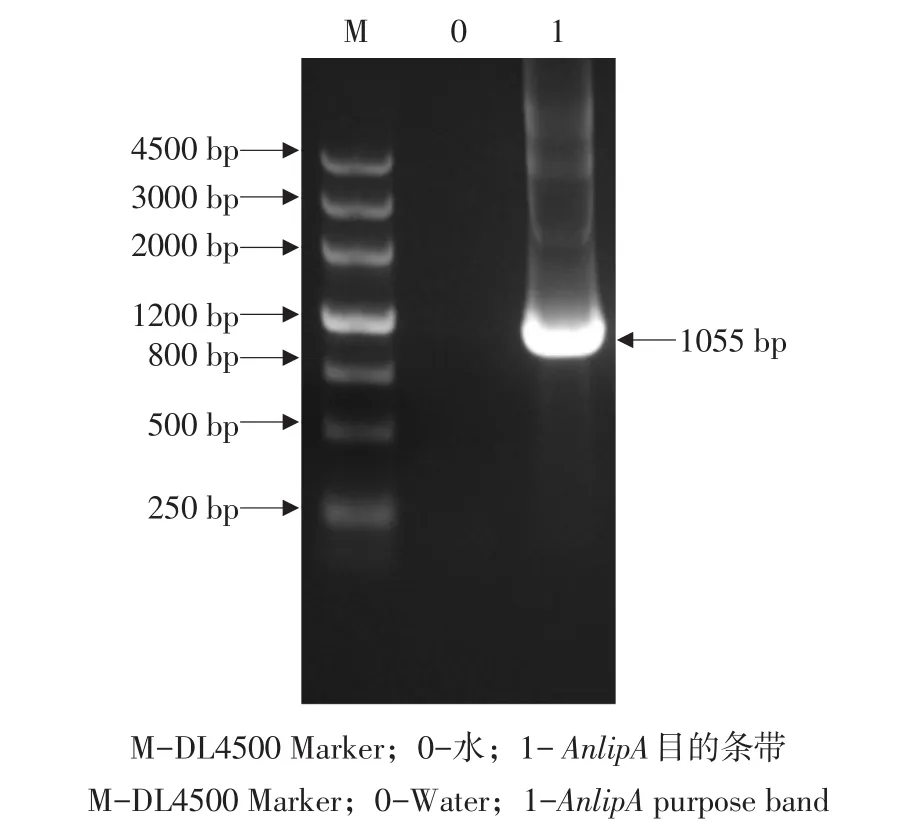
图2 AnlipA基因扩增结果Fig.2 Cloning of AnlipA by PCR
2.2 多拷贝脂肪酶表达载体构建
用XbaⅠ和HindⅢ双酶切黑曲霉表达载体pSZHA6R-AnlipA和pSZHA6R-2AnlipA,分别得2 600 bp基因片段,15 280 bp载体片段和5 950 bp基因片段,15 280 bp载体片段(见图3)。
2.3 冻融法转化农杆菌AGL1
将表达载体pSZHA6R-AnlipA,pSZHA6R-2AnlipA通过冻融法转入农杆菌AGL1感受态中,在含卡那霉素和利福平抗性YEB培养基中28℃培养,直至长出大小适宜单菌落(见图4)。
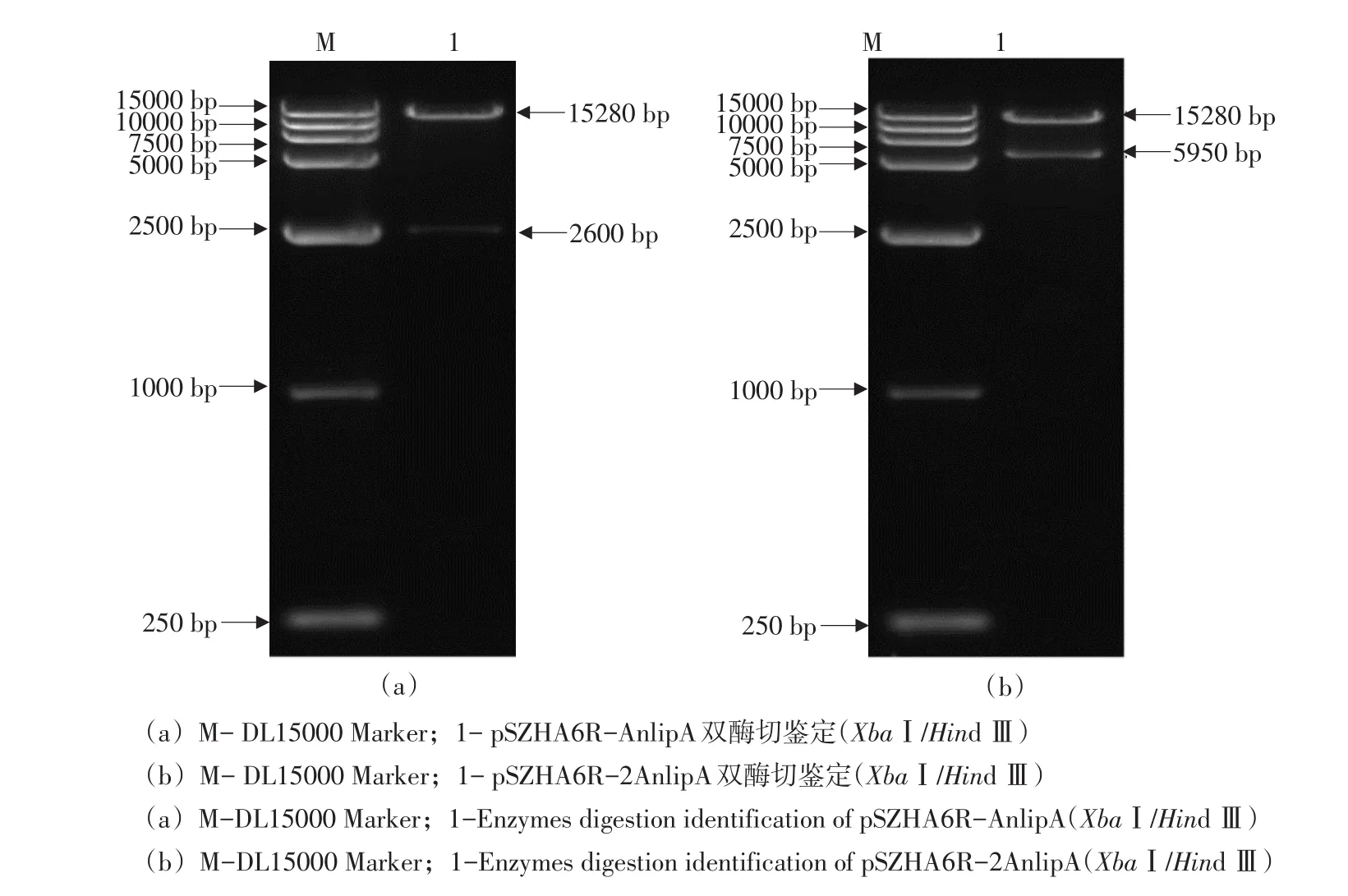
图3 pSZHA6R-AnlipA,pSZHA6R-2AnlipA双酶切鉴定结果Fig.3 Double enzymes digestion results of vectors pSZHA6R-AnlipA and pSZHA6R-2AnlipA

图4 重组表达载体转入农杆菌Fig.4 Expression vectors transferred into AGL1
2.4 黑曲霉转化子筛选和鉴定
使用出发菌株以pyrG为筛选标记且重组菌株中不含抗生素抗性基因,符合食品级要求。挑取筛选培养基上黑曲霉转化子单菌落,接种于液体CD培养基(200 mmol·L-1头孢、20 g·L-1麦芽糖、1 mol·L-1尿苷、1 mol·L-15-FOA)中,置于培养箱中培养4~5 d,提取黑曲霉菌丝体基因组DNA。用引物5'asAA-sense和3'asAA-antisense作PCR扩增,鉴定黑曲霉纯合转化子。以水和出发菌株为阴性对照,pSZHA6R-AnlipA和pSZHA6R-2AnlipA质粒分别为阳性对照,黑曲霉转化子均扩增出与质粒对照相同目的条带,见图5~6。结果表明,CICC2462(pSZHA6R-AnlipA)、CICC2462(pSZHA6R-2Anli⁃pA)均为纯合转化子。
2.5 重组脂肪酶荧光定量PCR分析
将重组菌株 CICC2462(pSZHA6R-AnlipA)和CICC2462(pSZHA6R-2AnlipA)作摇瓶发酵,取发酵第5天菌体提取RNA,用引物P5,P6和P7,P8作Real-time PCR,在转录水平上比较不同拷贝数AnlipA基因表达量,如图7所示。结果表明CICC2462(pSZHA6R-2AnlipA)中脂肪酶基因转录水平为CICC2462(pSZHA6R-AnlipA)1.26倍。
2.6 SDS-PAGE分析
取重组菌株摇瓶发酵4~10 d上清液用于SDSPAGE蛋白电泳,结果如图8所示。箭头所指为重组脂肪酶蛋白条带,约为37.0 ku。

图5 pSZHA6R-AnlipA黑曲霉重组转化子PCR酶切鉴定结果Fig.5 Single enzyme digestion result of identification pSZHA6R-AnlipA recombinant transformants by PCR

图6 pSZHA6R-2AlipA黑曲霉重组转化子PCR酶切鉴定结果Fig.6 Single enzyme digestion result of identification pSZHA6R-2AnlipA recombinant transformants by PCR
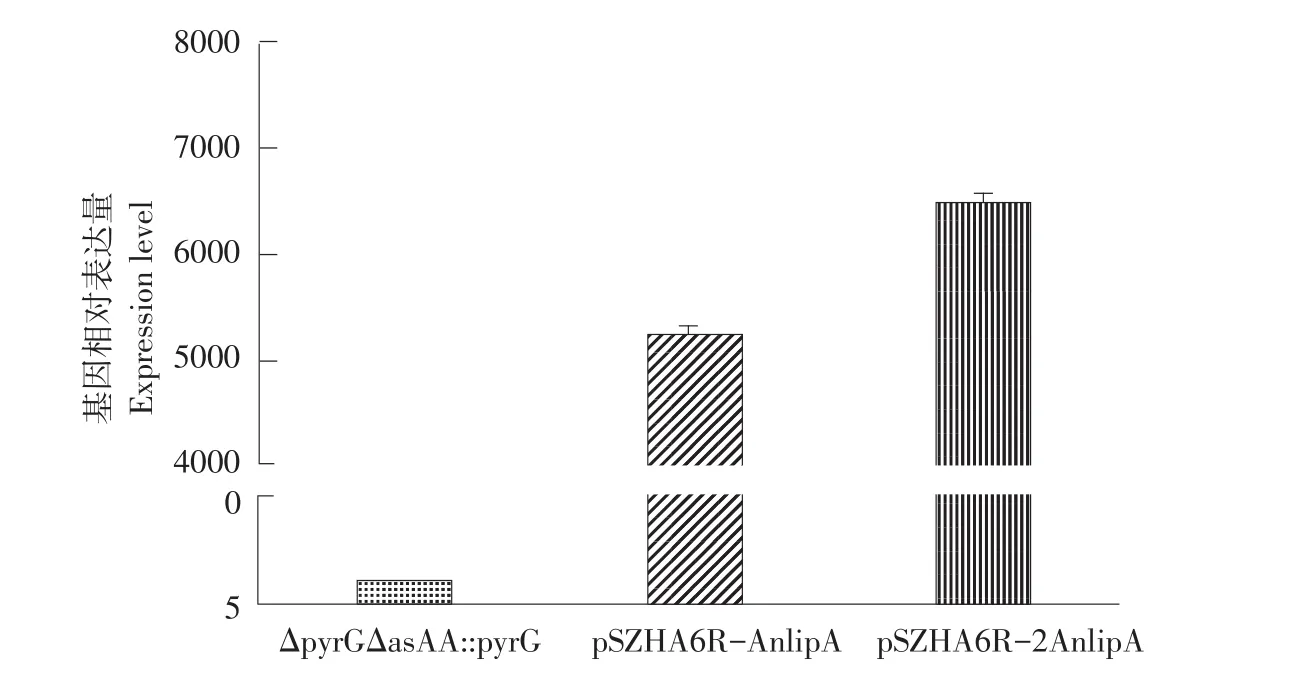
图7 CICC2462(pSZHA6R-AnlipA)和 CICC2462(pSZHA6R-2AnlipA)荧光定量PCR结果Fig.7 Transcription level of CICC2462(pSZHA6R-AnlipA)and CICC2462(pSZHA6R-2AnlipA)

图8 重组脂肪酶菌株SDS-PAGE蛋白电泳Fig.8 SDS-PAGE of recombinant AnlipA strains
2.7 重组脂肪酶酶活检测
将重组菌株摇瓶发酵,取4~10 d上清液测定脂肪酶活性(见图9)。重组菌株CICC2462(pS⁃ZHA6R-AnlipA),CICC2462(pSZHA6R-2AnlipA)在第8天达最高酶活性,分别为1 120 U·mL-1,1 480 U·mL-1。至第9天由于培养基中营养物质消耗和次级代谢物大量积累,发酵条件不适合菌体分泌蛋白,故酶活性下降。

图9 CICC2462(pSZHA6R-AnlipA)与CICC2462(pSZHA6R-2 AnlipA)4~10 d酶活检测结果Fig.9 Enzyme activities of recombinant AnlipA strains at 4-10 d
2.8 重组脂肪酶最适pH
取重组脂肪酶菌株CICC2462(pSZHA6R-2An⁃lipA)发酵表达量最高第8天发酵液,分别在pH 4~11条件下作酶活检测,结果如图10所示。pH为6时重组脂肪酶酶活最高,确定该脂肪酶最适pH为6,酶活为2 135 U·mL-1,且该重组脂肪酶在pH 6~7时酶活较高。随pH增高,酶活迅速下降,pH>9时酶活趋于平稳但已丧失大部分活性。
2.9 重组脂肪酶最适温度
取重组脂肪酶菌株CICC2462(pSZHA6R-2An⁃lipA)发酵表达量最高第8天发酵液,分别在25~55℃作酶活检测,见图11。温度为35℃时,重组脂肪酶酶活最高,即35℃为该脂肪酶最适温度,且在25~45℃酶活均较高,说明其适合温度范围较大。
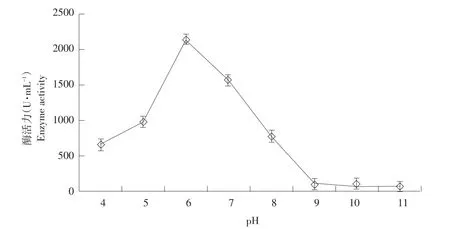
图10 CICC2462(pSZHA6R-2AnlipA)在不同pH下酶活检测结果Fig.10 Enzyme activities of CICC2462(pSZHA6R-2AnlipA)at different pH

图11 CICC2462(pSZHA6R-2AnlipA)在不同温度下酶活检测结果Fig.11 Enzyme activities of CICC2462(pSZHA6R-2AnlipA)at different temperature
3 讨论与结论
黑曲霉作为食品级安全受体菌株可分泌大量同源和外源蛋白,对分泌蛋白作正确翻译后修饰,发酵产物安全。研究利用黑曲霉表达系统分泌表达AnlipA基因转录水平,结果表明,摇瓶发酵后含2个拷贝AnlipA重组菌株最高酶活力达1 480 U·mL-1,比1拷贝重组菌株最高酶活力提高32%。与林俊涵等研究结果相符,证明增加目的基因拷贝数可增强转录水平,提升目的基因表达产量[19-21]。但与Vas⁃sileva等结果不同,2拷贝酶活力未呈线性增加,仅为1拷贝1.32倍[22],推测可能是引入多拷贝正调控元件强启动子和过多基因拷贝数引发调控蛋白滴定效应[23],在其他整合位点引入正调控蛋白amyR与目的基因共表达是解决问题有效途径[24]。另一方面也可能因过大基因剂量,使内质网中发生部分非折叠蛋白响应[25-26],蛋白表达量下降、平稳或增加幅度减缓,加入具有协同作用辅助因子,可能是降低或消除负反馈作用手段之一[27]。
徐苏炜等在毕赤酵母中表达RML基因,其酶活为102 U·mL-1[28]; Garcíasilvera等在粘质沙雷氏菌中表达胞外脂肪酶,酶活为124 U·mL-1[29];本研究中2拷贝AnlipA重组黑曲霉菌株的酶活力达1 480 U·mL-1,符合食品级要求,安全优势和生产潜力显著。
实验室建立黑曲霉表达系统中,将目的基因整合到高表达asAA基因整合位点,在分泌目的蛋白同时也产生大量背景蛋白,主要包括葡糖淀粉酶和α-淀粉酶,且目的蛋白与背景蛋白均由amyR基因调控[17],在amyR表达转录因子一定情况下,目的蛋白与背景蛋白存在竞争关系,故敲除背景蛋白,会相应减少或解除竞争机制,间接增加目的基因表达。后续研究将敲除葡糖淀粉酶和α-淀粉酶基因,以利目的蛋白高效表达,提高目的蛋白纯度、减少生产成本;同时利用RSM统计学方法,优化接种量、培养温度,发酵时间等条件,提高脂肪酶表达量[30]。
试验采用多拷贝脂肪酶基因表达框策略构建黑曲霉重组菌株CICC2462(pSZHA6R-AnlipA)和CICC2462(pSZHA6R-2AnlipA)。结果表明含2个拷贝AnlipA较含1拷贝AnlipA黑曲霉转化子表达量有所提高。研究为黑曲霉高效表达重组蛋白提供有效途径,为食品级黑曲霉脂肪酶工业化生产提供工程菌株。
[参考文献]
[1] Kaushik R,Saran S,Isar J,et al.Statistical optimization of medi⁃um components and growth conditions by response surface meth⁃odology to enhance lipase production by Aspergillus carneus[J].Journal of Molecular Catalysis B Enzymatic,2006,40(3):121-126.
[2] 骆晓敏,霍丽斯.脂肪酶在食品工业中的应用[J].广东化工,2014,41(15):141-142.
[3] 姜澎涛.酶的固化及在造纸白水中的应用[D].青岛:青岛科技大学,2017.
[4] Liu L L J,Qiu R X,Zhu X G,et al.Improving heterologous gene expression in Aspergillus niger by introducing multiple copies of protein-binding sequence containing CCAAT to the promoter[J].Letters in Applied Microbiology,2003,36(6):358-361.
[5] 吴志伟.启动子多拷贝策略增强Escherichia coli RB3乙酰酯酶基因表达研究[D].长春:吉林大学,2016.
[6] 吴志伟,徐立新,佟金,等.多拷贝策略在增强目的基因表达中的应用[J].生命科学研究,2016,20(2):166-170.
[7] 潘剑茹,吴伦巧,何火聪,等.GST-SOD1-R9融合蛋白的表达、纯化、稳定性与跨膜效应[J].生物工程学报,2017,33(5):828-837.
[8] 崔丹,温洁霞,霍珊珊,等.密码子优化提高猪IL-7在HEK293T细胞表达的研究[J].河北农业大学学报,2017,40(6):88-92.
[9] 聂忠清,吴永刚,蒙建洲.分子伴侣的功能和应用[J].生命科学,2006,18(1):84-89.
[10] Wu Z L,Zhang Z G,Guengerich F P,et al.Enhanced bacterial expression of several Mammalian Cytochrome P450s by codon optimization and molecular chaperones[C].Bangkok:Asian Pacif⁃ic Regional International Society for the Study of Xenobiotics Meeting.2009:1589-1593.
[11] 李杰,吴婷,马南,等.白曲霉酸性蛋白酶在黑曲霉中表达[J].东北农业大学学报,2016,47(5):29-35.
[12] 杨江科,严翔翔,张正平,等.二步法黑曲霉脂肪酶基因lipA的全基因合成及其在毕赤酵母中的高效表达[J].生物工程学报,2009,25(3):381-387.
[13] Chen H,Yang J,Liu M,et al.Optimization of lipase production conditions for Aspergillus sp.F044 by response surface methodolo⁃gy[J].Industrial Microbiology,2007,31(1):47-52.
[14] 李秀鹏.无孢黑曲霉SH-2菌株改造及疏棉状嗜热丝孢菌耐热脂肪酶表达的研究[D].广州:华南理工大学,2015.
[15] Kushiro M,Nakagawa H,Nagashima H,et al.Fumonisin B2 pro⁃duction on agar media by Aspergillus niger of Japanese origin[J].Jsm Mycotoxins,2011,61(2):47-52.
[16] 李杰,李双,于盛竹,等.凤尾菇(Pleurotus sajor-caju)漆酶Lac4基因在黑曲霉中表达研究[J].东北农业大学学报,2017,48(4):7-14.
[17] Hui Z,Shuang W,Xiang X Z,et al.The amyR-deletion strain of Aspergillus niger CICC2462 is a suitable host strain to express se⁃creted protein with a low background[J].Microbial Cell Factories,2016,15(1):1-11.
[18]舒正玉.黑曲霉脂肪酶的酶学性质、基因克隆与表达及结构预测[D].武汉:华中科技大学,2007.
[19]林俊涵.多拷贝基因工程菌的构建及低温脂肪酶的定点突变[D].福州:福建师范大学,2006.
[20] Yang H,Zhai C.Yu X,et al.High-level expression of Proteinase K from Tritirachium album Limber in Pichia pastoris using multicopy expression strains[J].Protein Expression and Purification,2016,122:38-44.
[21] Min S,Wei S,Yang S,et al.High-level expression and character⁃ization of a novel serine protease in Pichia pastoris,by multi-copy integration[J].Enzyme and Microbial Technology,2016,92:56-66.
[22] Vassileva A,Chugh D A,Swaminathan S,et al.Effect of copy number on the expression levels of hepatitis B surface antigen in the methylotrophic Yeast Pichia pastoris.[J].Protein Expression and Purification,2001,21(1):71-80.
[23] 刘德辉,黄毓茂,徐蕙.丝状真菌异源蛋白高效表达的研究进展[J].中国生物制品学杂志,2010,23(2):221-224.
[24] Zhang L,Teng K,Wang J,et al.CerR,a Single-domain regulatory protein of the LuxR family,promotes the Cerecidin production and immunity in Bacillus cereus[J].Applied and Environmental Micro⁃biology,2017,84(5):5-17.
[25] 刘倜.多拷贝策略构建瑞氏木霉外源基因系列表达载体[D].济南:山东大学,2005.
[26] Li X,Liu Z,Wang G,et al.High overexpression of Candida rugosa lipase Lip1 via combined strategies in Pichia pastoris[J].Enzyme and Microbial Technology,2016,82:115-124.
[27] Yu X W,Sun W H,Wang Y Z,et al.Identification of novel factors enhancing recombinant protein production in multi-copy Kom⁃agataella phaffii based on transcriptomic analysis of overexpres⁃sion effects[J].Scientific Reports,2017(7):16249.
[28] 徐苏炜,林影,韩振林,等.米黑根毛霉脂肪酶基因在毕赤酵母中的高效表达[J].食品与发酵工业,2008,34(11):10-14.
[29] Garcíasilvera E E,Martínezmorales F,Bertrand B,et al.Produc⁃tion and application of a thermostable lipase from Serratia marce⁃scens in detergent formulation and biodiesel production[J].Bio⁃technology and Applied Biochemistry,2018,65(2):156-172.
[30] 张谦,贾佳,林智,等.产脂肪酶黑曲霉摇瓶发酵条件优化研究[J].生物技术通报,2015,31(12):227-233.

