PGRMC1在乳腺癌组织中的表达及其与临床病理特征的相关性
王利娟 阮祥燕 赵 越
(首都医科大学附属北京妇产医院妇科内分泌科,北京 100026)
乳腺癌是中国女性最常见的癌症,中国乳腺癌人数占全球所有新诊断乳腺癌人数的12.2%,占全球因乳腺癌死亡人数的9.6%[1]。随着人们对更年期认识的不断提高,越来越多的绝经前后妇女开始进行激素替代治疗用于预防或治疗由慢性雌激素缺乏引起的绝经相关症状。更年期激素替代治疗多采取雌孕激素联合治疗,用于预防单独使用雌激素带来的子宫内膜增生和子宫内膜癌的发生风险。而一些大型临床研究[2-4]结果表明,雌孕激素联合治疗与单独雌激素治疗相比,乳腺癌的发生风险增加了。体外实验[5-6]证实,合成孕激素可促进乳腺癌细胞增殖,尤其是孕激素受体膜组分1(progesterone receptor membrane component 1, PGRMC1)过表达乳腺癌细胞的增生,最新的体内实验[7]结果也证实了这个观点。这些体内外实验结果表明PGRMC1也许在乳腺癌的发生发展过程中起着重要作用。
PGRMC1是一种参与多种细胞进程的多功能蛋白,属于膜相关孕激素受体蛋白家族,广泛存在于真核生物中,能够结合并调节细胞色素P450酶(cytochrome p450 enzyme),参与调节细胞周期、P4(progesterone, P4)信号通路和类固醇的应答[8]。研究[9]显示,致癌物质二噁英更够使PGRMC1表达上调,PGRMC1在一些肿瘤中过表达,如肺、结肠、和甲状腺[10-11]。虽然有研究[12]显示PGRMC1在正常乳腺组织和乳腺癌组织中有表达,但PGRMC1表达水平和乳腺肿瘤的良恶性关系还未确立。本研究旨在分析PGRMC1和乳腺肿瘤相关免疫组织化学指标在乳腺癌组织、乳腺良性肿瘤组织和正常乳腺组织中的表达情况,并评估PGRMC1与这些指标的相关性,探索PGRMC1与乳腺癌发生风险的关系。
1 对象与方法
1.1 研究对象
纳入2015年9月至2017年1月间乳腺癌组织标本60例,年龄24~68岁,平均年龄(46.0±6.5)岁。乳腺良性肿瘤30例,正常乳腺组织30例(来自经乳腺麦默通微创旋切良性肿瘤周围1 cm左右的正常组织,病理证实乳腺组织无异常者),年龄26~64岁,平均年龄(41.0±4.7)岁,来源均为女性患者,分别来自首都医科大学附属北京妇产医院乳腺外科,中国医学科学院肿瘤医院乳腺外科以及陆军总医院263临床部乳腺外科,所有组织来源者在术前经空心针活检或经术后病理组织学检查确诊。纳入试验的患者均已签署知情同意书。
1)纳入标准:乳腺癌:①病理诊断乳腺癌(无论有无淋巴结转移);②无其他恶性肿瘤治疗史;③所有患者均未经过任何术前针对性治疗;④足够可利用的组织标本。乳腺良性肿瘤:①乳腺纤维腺瘤;②乳腺导管内乳头状瘤;③乳腺囊性增生病。
2)排除标准:①男性乳腺癌;②术前接受任何形式新辅助化学药物治疗和靶向治疗等的患者;③近1个月内接受激素替代治疗者。
1.2 主要试剂
无水乙醇、二甲苯购自国药集团化学试剂有限公司, PGRMC1 兔抗人单克隆抗体(购自 Abcam 公司, 编号:ab48012,美国); ER鼠抗人单克隆抗体 (购自Abcam 公司,编号: ab32063,美国); PR 鼠抗人单克隆抗体(购自Abcam公司,编号:ab2764,美国); Ki67 兔抗人单克隆抗体 (购自武汉谷歌生物科技有限公司,编号:GB13030)。免疫组织化学试剂盒DAB显色剂K5007(购自美国DAKO公司)。苏木素染液、中性树胶(购自武汉谷歌生物科技有限公司)。
1.3 免疫组织化学结果判定
苏木素染细胞核为蓝色,DAB(3, 3′-diaminobenzidine)显出的阳性表达为棕黄色。雌激素受体(estrogen receptor, ER)、孕激素受体(progestogen receptor, PR)、Ki-67表达产物主要为核着色,呈棕黄色或黄褐色分布。PGRMC1、human epidermal growth factor receptor-2 (Her-2)主要定位于细胞膜或细胞质,肿瘤细胞质出现棕黄色或黄褐色均匀颗粒为阳性细胞。采用组织切片扫描仪(Pannoramic MID, 3D HISTECH)对组织切片进行扫描和分析。图片扫描完成后进入Quant center 中的Densito quant软件自动识别并设置组织切片上所有的深棕色为强阳性,棕黄色为中度阳性,浅黄色为弱阳性,蓝色细胞核为阴性。进而对每个组织进行识别分析出强阳性,中度阳性,弱阳性及阴性的面积(单位:像素),阳性的百分比。ER、PR及Her-2的免疫组织化学结果判读依据ASCO-CAP指南[13-14];PGMC1的结果判定采用半定量积分法,对组织切片中的染色强度打分,无色为0分,<1/3为1分,1/3~2/3为2分,>2/3为3分;再按照阳性细胞百分率打分:阳性细胞<5%为0分,5%~25%为1分,25%~50%为2分,50%~75%为3分,>75%为4分。二者乘积≤2分的定为阴性,>2分的定为阳性。Ki-67仅计数阳性细胞数,方法同上,评分≤1为阴性,>1为阳性[15]。
1.4 统计学方法
采用SPSS17.0对数据进行统计分析。各免疫组织化学指标的表达情况比较采用χ2检验,相关性分析采用二分类的Logistic回归分析并控制相关混杂因素对PGRMC1结果的影响,以P<0.05为差异有统计学意义。
2 结果
2.1 各免疫组织化学指标在乳腺癌组织、乳腺良性肿瘤组织和正常乳腺组织中的表达
乳腺癌组PGRMC1的表达率(68.3%)显著高于乳腺良性肿瘤组(26.7%)和正常对照组(6.7%),组间差异有统计学意义(P<0.01)。乳腺癌组中ER和Ki-67的表达率显著高于乳腺良性肿瘤组和正常对照组,组间差异有统计学意义(P<0.01)。PR和Her-2在3组间的表达差异无统计学意义(P>0.05),详见表1、图1。
2.2 PGRMC1表达在乳腺癌和乳腺良性肿瘤组织中与其余各指标表达的相关性分析
因PGRMC1在正常乳腺组织中的阳性表达率很低(6.7%),故只分析其在乳腺癌和乳腺良性肿瘤组织中与其余各指标表达的相关性。经Logistic回归分析发现,乳腺癌组PGRMC1的表达与ER表达呈正相关(OR=3.593,95%CI:1.131~11.418),与PR、Ki-67和Her-2的表达无相关性;乳腺良性肿瘤组PGRMC1的表达与其他各免疫组织化学指标均无相关性,详见表2和表3。
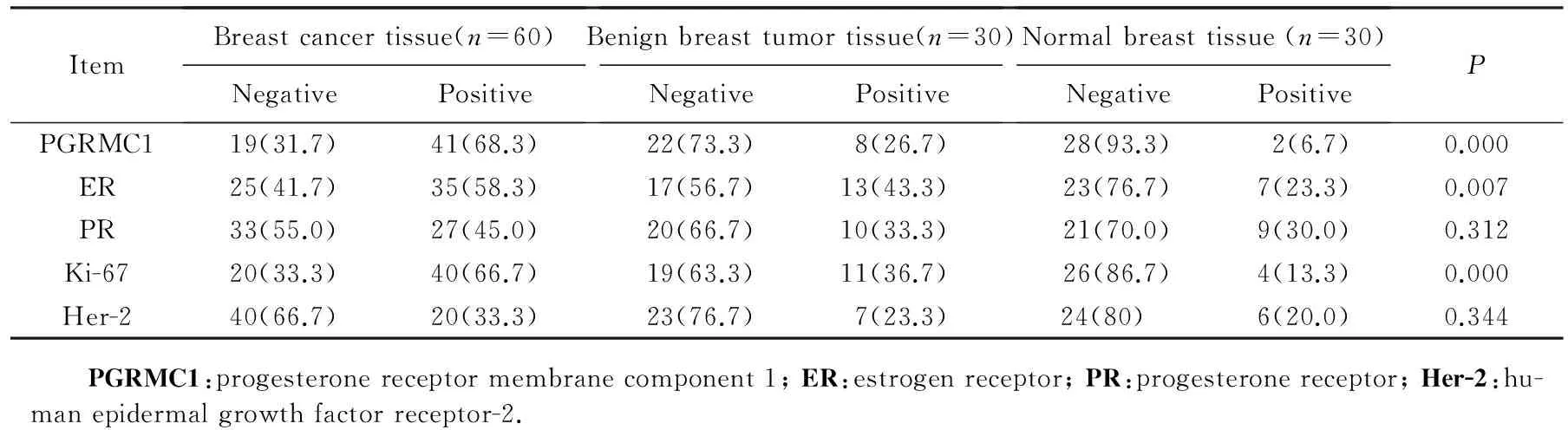
表1 乳腺癌组织、乳腺良性肿瘤组织、正常乳腺组织中各免疫组织化学指标的表达情况Tab.1 Expression profile of some immunohistochemical indicators in breast cancer tissue, benign breast tumor tissue and normal breast tissue [n(%)]
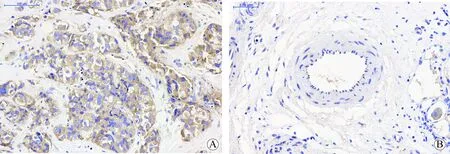
图1 PGRMC1在乳腺癌组织和乳腺良性肿瘤组织中的阳性表达 Fig.1 Positive expression of PGRMC1 in breast cancer tissue and benign breast tumor tissue(HE,30×)
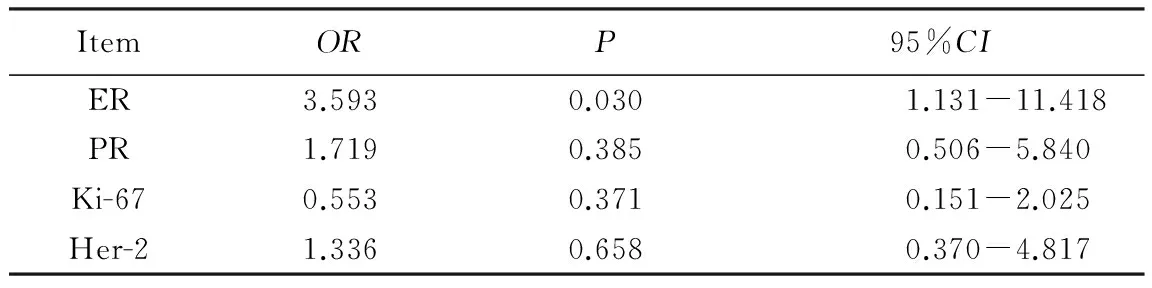
表2 PGRMC1表达在乳腺癌组织中与其余各指标表达的相关性分析Tab.2 Correlations analysis between the expressions of PGRMC1 and other indicators in breast cancer tissue
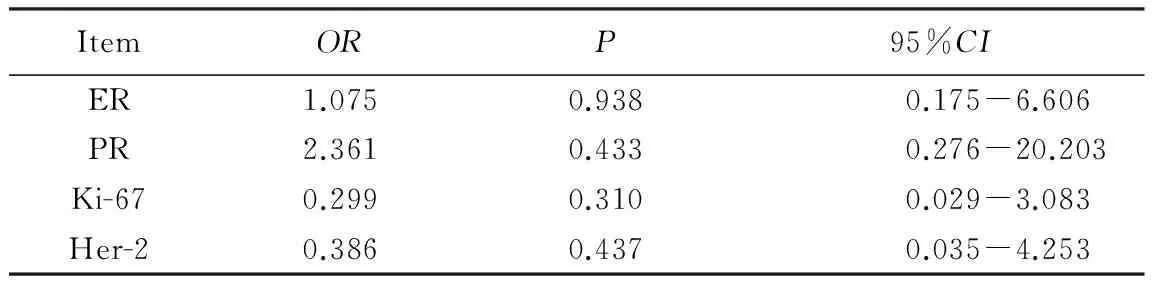
表3 PGRMC1表达在乳腺良性肿瘤组织中与其余各指标表达的相关性分析 Tab.3 Correlations analysis between the expressions of PGRMC1 and other indicators in benign breast tumor tissue
3 讨论
本研究采用免疫组织化学检测方法分析了PGRMC1、ER、PR、Ki-67和Her-2在乳腺癌组织、乳腺良性肿瘤组织和正常乳腺组织中的表达情况,结果显示PGRMC1在乳腺癌组织、乳腺良性肿瘤组织和正常乳腺组织中均有表达,且乳腺癌组PGRMC1的表达水平显著高于其他两组。关于PGRMC1在乳腺癌组织、乳腺良性肿瘤组织和正常乳腺组织中的表达情况,不同研究间结果差异较大。依据人类蛋白质表达谱(www.proteinatlas.org),PGRMC1在正常乳腺上皮组织中表达强度中等,在大约1/3的被调查乳腺癌组织中强烈表达。Crudden等[16]的研究表明,与周围非恶性组织相比,PGRMC1在乳腺肿瘤组织中过表达。Ji等[17]的研究发现正常乳腺组织中没有PGRMC1的表达,但免疫组织化学结果显示PGRMC1在乳腺癌组织中的表达强弱不等。张颖等[15]研究结果表明PGRMC1 与常见预后因子肿瘤直径、淋巴结转移、患者疾病复发、远期生存情况存在关联, 其很有可能成为乳腺癌患者预后的独立预测因子。而另一RelqPCR(relative quantitative polymerase chain reaction, RelqPCR)结果[18]显示PGRMC1的mRNA水平和乳腺癌患者年龄呈负相关。导致这些不同结果的原因可能是因为检测方式不同,或者和种族有关。为了整合PGRMC1在乳腺癌组织、乳腺良性肿瘤组织和正常乳腺组织中的表达情况,明确表达关系,需要在更多的国家采取相同检测方式做更多的研究。
之前的研究[5-7]结果体现了PGRMC1在乳腺癌发生发展中的重要作用,而Marina等[19]的研究结果显示乳腺肿瘤组织PGRMC1高表达的患者相较于低表达的患者对以蒽环类为基础的化疗反应差。此结果表明,PGRMC1还可能在人类乳腺癌的进展和治疗中起着重要作用,并可能成为抗癌治疗的目标。纪术峰[20]的研究还显示PGRMC1参与了乳腺癌细胞增生及化疗敏感性的调控。鉴于ER是他莫昔芬极其相似药物的靶点,ER状态是乳腺癌的一个重要生物指标。本研究结果显示乳腺癌中PGRMC1的表达和ER呈正相关,此结果和之前的研究[15]结果一致,但是和Neubauer等[21]的研究结果相反,后者的结果表明ER阴性的乳腺癌组织中PGRMC1的表达水平较高,而PGRMC1在ER阳性表达的肿瘤组织中被磷酸化,这些结果表明PGRMC1可能是乳腺癌组织中ER状态的一个生物标志物。有研究[22]还分析了PGRMC1在三阴乳腺癌组织中的表达情况,PGRMC1在三阴乳腺癌中的表达率为55.6%,且与肿瘤转移、临床分期以及Ki-67 的表达呈正相关。本研究未见PGRMC1表达和Ki-67有相关性。研究结果差异可能和样本量有关,后续扩大样本量的研究十分有必要。在乳腺良性肿瘤中未发现PGRMC1的表达和其他免疫组织化学指标有相关性。目前关于PGRMC1表达状态与乳腺癌相关免疫组织化学指标的关系尚未形成统一,需进一步扩大研究。
国内外对PGRMC1在乳腺癌中的表达及其促乳腺癌发生、发展机制的研究较少,鉴于PGRMC1在体内外实验中对乳腺癌发生、发展的影响,开展关于PGRMC1的研究将对乳腺癌的预防、治疗和预后有重要意义。
[1] Fan L, Strasser-Weippl K, Li J J, et, al. Breast cancer in China[J]. Lancet Oncol,2014,15(7):e279-289.
[2] Beral V. Million women study collaborators. Breast cancer and hormone-replacement therapy in the million women study[J]. Lancet, 2003, 362(9382): 419-427.
[3] Chlebowski R T, Hendrix S L, Langer R D, et al. Inuence of estrogen plus progestin on breast cancer and mammography in healthy postmenopausal women: the Women’s Health initiative randomized trial[J]. JAMA, 2003,289: 3243-3253.
[4] Fournier A, Berrino F, Clavel-Chapelon F.Unequal risks for breast cancer associated with different hormone replacement therapies: results from the E3N cohort study[J]. Breast Cancer Res Treat, 2008, 107(1): 103-111.
[5] Jeng M H, Parker C J, Jordan V C. Estrogenic potential of progestins in oral contraceptives to stimulate human breast cancer cell proliferation[J]. Cancer Res, 1992,52(23):6539-6546.
[6] Neubauer H, Ruan X, Schneck H. Overexpression of progesterone receptor membrane component 1: possible mechanism for increased breast cancer risk with norethisterone in hormone therapy[J]. Menopause, 2013,20(5):504-510.
[7] Ruan X, Neubauer H, Yang Y, Progestogens and membrane-initiated effects on the proliferation of human breast cancer cells[J]. Climacteric, 2012,15(5):467-472.
[8] Cahill M A. Progesterone receptor membrane component 1: an integrative review[J]. J Steroid Biochem Mol Biol, 2007, 105(1-5): 16-36.
[9] Selmin O, Lucier G W, Clark G C, et al. Isolation and characterization of a novel gene induced by 2,3,7,8-tetrachlorodibenzo-p-dioxin in rat liver[J]. Carcinogenesis,1996, 17(12):2609-2615.
[10] Crudden G, Loesel R, Craven R J. Overexpression of the cytochrome p450 activator hpr6(heme-1 domain protein/human progesterone receptor) in tumors[J]. Tumour Biol,2005, 26(3):142-146.
[11] Mir S U, Ahmed I S, Arnold S, et al. Elevated progesterone receptor membrane component 1/sigma-2 receptor levels in lung tumors and plasma from lung cancer patients[J]. Int J Cancer, 2012, 131(2): E1-9.
[12] Clark N C, Friel A M, Pru C A, et,al. Progesterone receptor membrane component 1 promotes survival of human breast cancer cells and the growth of xenograft tumors[J]. Cancer Biol Ther, 2016,17(3): 262-271.
[13] Hammond M E, Hayes D F, Wolff A C, et al. American society of clinical oncology/college of american pathologists guideline recommendations for immunohistochemical testing of estrogen and progesterone receptors in breast cancer[J]. J Oncol Pract, 2010,6(4):195-197.
[14] Wolff A C, Hammond M E, Hicks D G, et al. Recommendations for human epidermal growth factor receptor 2 testing in breast cancer: American Society of Clinical Oncology/College of American Pathologists clinical practice guideline update[J]. J Clin Oncol,2013,31(31):3997-4013.
[15] 张颖,阮祥燕,米鑫,等.孕激素受体膜组分1(PGRMC1)对预测乳腺癌预后作用的研究[J].首都医科大学学报,2015,36(4):548-552.
[16] Crudden G, Loesel R, Craven R J.Overexpression of the cytochrome p450 activator hpr6 (heme-1 domain protein/human progesterone receptor) in tumors[J]. Tumour Biol,2005,26(3):142-146.
[17] Ji S F, Wu A G, Yang H F. Expression of progesterone receptor membrane component-1 is associated with the malignant phenotypes of breast cancer[J].Nan Fang Yi Ke Da Xue Xue Bao, 2012,32(5):635-638.
[18] Causey M W, Huston L J, Harold D M,et al. Transcriptional analysis of novel hormone receptors PGRMC1 and PGRMC2 as potential biomarkers of breast adenocarcinoma staging[J]. J Surg Res,2011,171(2):615-622.
[19] Marina W, Isabel W, Christoph M, et al. High Level of progesteron receptor membrane component 1 (PGRMC 1) in tissue of breast cancer patients is associated with worse response to anthracycline-based neoadjuvant therapy[J]. Horm Metab Res,2017,49(8):595-603.
[20] 纪术峰. PGRMC1调节乳腺癌细胞化疗敏感性的研究[D].广州: 南方医科大学,2012.
[21] Neubauer H, Clare S E, Wozny W, et, al. Breast cancer proteomics reveals correlation between estrogen receptor status and differentialphosphorylation of PGRMC1[J]. Breast Cancer Res,2008,10(5):R85.
[22] 杨华锋,纪术峰,李占文,等.PGRMC1在三阴性乳腺癌中的表达及其与ki-67的相关性[J].中国现代医生,2016,54(34):8-12,169.

