miR-29s通过下调大麻素受体1抑制ACEA促J774A.1细胞迁移的活性
段向辉 常 娜 李丽英
(首都医科大学基础医学院细胞生物学系,‘肝脏保护与再生调节’北京市重点实验室,北京 100069)
肝纤维化严重危害着人类的健康,但迄今为止却没有一个有效的治疗手段。在纤维化早期阶段,骨髓来源的单核细胞会向肝脏浸润,并分化成炎性巨噬细胞,分泌一些炎性反应因子,如肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、人巨噬细胞炎性蛋白1β(macrophage inflammatory protein-1β,MIP-1β)、白细胞介素-1β (interleukin-1β,IL-1β)、IL-6、IL-10等。炎性细胞因子可以清除有害物质并启动组织修复过程,然而,炎性细胞因子的持续存在可能加重肝损伤[1]。在小鼠肝纤维化模型中,笔者观测到了大量的骨髓来源单核巨噬细胞(bone marrow-derived macrophage,BMMs)浸润于肝损伤区域,而减少这些细胞的数量,可以明显改善肝功能,减轻炎性反应和纤维化[2],说明减少巨噬细胞的浸润可作为改善肝脏炎性反应和纤维化的有效手段。本研究中,笔者将采用巨噬细胞的细胞系J774A.1,在体外探究其迁移功能。
大麻素受体1(cannabinoid receptor type 1,CB1)是一种七次跨膜的G蛋白偶联受体,其配体为花生四烯酸乙醇胺(anandamide,AEA)和2-花生四烯酸甘油(2-arachidonoylglycerol,2-AG)。生理情况下,CB1主要表达在中枢神经系统,在外周组织低表达。有研究报道CB1可以影响多种细胞的迁移,包括神经元[3-4]、非小细胞肺癌细胞[5]、前列腺癌细胞[6]等。笔者之前的研究[2]表明,在肝损伤时,CB1介导了骨髓来源单核巨噬细胞向肝受损区域的募集,使用AM281(CB1拮抗剂)抑制CB1功能后,BMMs向肝受损区域浸润减少,炎性反应因子水平和肝纤维化程度均减轻;同时,小鼠损伤肝组织中CB1 mRNA水平明显升高,使用siRNA敲减CB1表达,巨噬细胞的迁移能力明显下降。以上结果表明,CB1表达的上调是其介导巨噬细胞迁移的重要前提,但是分子机制尚不明确。
MicroRNAs (miRNAs)是一类小非编码核酸,长度约为22 nt,对多种病生理过程有重要的调节作用。miRNAs通过碱基互补配对与靶基因mRNA的3′UTR区进行结合,抑制mRNA的翻译或者使mRNA降解,进而降低靶基因的表达水平[7-8]。目前,已有文献[9]报道,miRNAs可以参与多种细胞的迁移过程,如miR-1301通过调节p53/UBE4B通路可以抑制肿瘤细胞的迁移,另外miR-449家族则通过调节SOX4表达而阻断了转化生长因子-β(transforming growth factor-β, TGF-β)诱导的肝癌细胞的迁移[10]。同时miRNAs也是肝纤维化的重要参与者[11]。但是miRNA是否可以通过调控CB1表达来阻断巨噬细胞向损伤肝脏区域浸润目前尚不得而知。为了解决这一问题,笔者通过生物信息学的方式从TargetScan数据库里预测了可能靶向CB1的3个miRNAs:miR-29a-3p、miR-29b-3p和miR-29c-3p。因此,本研究将在J774A.1细胞中探讨这3个miRNAs是否可以降低CB1的表达,进而影响巨噬细胞的迁移。
1 材料与方法
1.1 实验材料
小鼠单核巨噬细胞J774A.1细胞株购自中国医学科学院基础医学研究所细胞资源中心细胞库。
1.2 试剂与仪器
Opti-MEM培养基、DMEM培养基(Gibico 公司,美国); 胎牛血清(Excell 公司,中国);青霉素/链霉素、β-巯基乙醇、胰蛋白酶(Gibico公司,美国);ACEA(Arachidonyl-2′-chloroethylamide, TOCRIS/R&D 公司,美国);M-MLV反转录试剂盒(Invitrogen 公司,美国);SYBR Green PCR Master Mix(ABI 公司,美国);Lipofectamine RNAiMAX(Invitrogen 公司,美国);microRNA mimic(锐博,中国);Bulge-LoopTMmiRNA qRT-PCR Kit(锐博,中国);Boyden chamber(BD 公司,美国)。
CO2细胞培养箱 BB16(Heraeus公司,德国);荧光倒置显微镜(Leica公司,德国);Real-time PCR仪 ABPrism 7300(ABI公司,美国)。
1.3 细胞培养
J774A.1细胞采用含10%(体积分数)胎牛血清、1%(质量分数)青霉素/链霉素的DMEM培养基,放于37℃、5%(体积分数) CO2细胞培养箱中培养。接种密度为1×106/大皿(R=10 cm)或3×105/中皿(R=6 cm)。当细胞汇合度至90%时进行传代,取处于对数生长期的细胞用于实验。
1.4 MicroRNA mimic的转染
转染前一天接种3×105个细胞于60 mm培养皿,当细胞汇合度达到50%~60% 时进行转染;转染过程参照Lipofectamine RNAiMAX Reagent转染步骤。6~8 h后换为完全培养基。所转染的miRNAs的成熟序列如表1所示。

表1 成熟miRNAs序列Tab.1 Sequences of mature miRNAs
1.5 RT-qPCR
采用Gene JET RNA Purification Kit对细胞总RNA进行提取。定量后取1g RNA进行反转录(不加反转录酶作为阴性对照,即No-RT)。取反转后的cDNA原液进行稀释,然后进行qPCR。使用的全部引物序列见表2。检测的临界点设定在PCR扩增过程中,荧光信号由本底进入指数增长阶段的拐点所对应的循环数(Ct)作为模板初始浓度的间接指标,溶解曲线分析采用默认条件。结果以18S rRNA 进行校正,用ΔΔCt 法计算相对基因表达量。
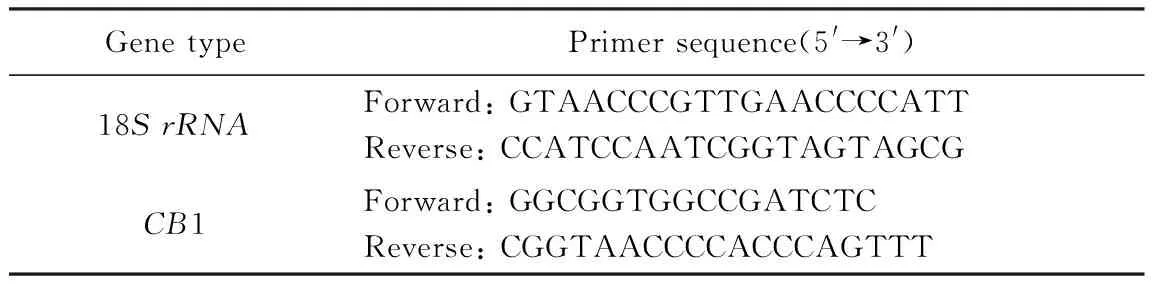
表2 引物序列Tab.2 Sequences of primers for real-time RT-PCR
1.6 Boyden chamber迁移实验
迁移实验前24 h,对J774A.1细胞更换无血清DMEM培养基饥饿处理,胰蛋白酶消化并收集细胞,用无血清DMEM培养基重悬,准确计数。以4104/孔(体积为200L)的细胞密度接种到Boyden chamber小室中,小室下层加入700L无血清DMEM培养基(ACEA作为刺激因子加入下室,终浓度为1mol/L),置于37℃、5%(体积分数)CO2培养箱里迁移6 h。迁移结束后,弃培养基,加入预冷的甲醇固定30 min,PBS清洗3次。用苏木精染色1 h,PBS清洗3次,然后用医用棉签轻轻擦去上层未迁移至底面的细胞。于倒置荧光显微镜下观察并拍照,每孔拍取5个视野,对迁移的细胞计数,进行统计分析。
1.7 统计学方法
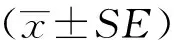
2 结果
2.1 miR-29a-3p、miR-29b-3p和miR-29c-3p与CB1 mRNA 可能的结合关系
采用TargetScan数据库预测到了3个最有可能靶向CB1的miRNAs:miR-29a-3p、miR-29b-3p和miR-29c-3p。它们的评分(Context+ score percentile)均高于90(参见http://www.targetscan.org/mmu_71/),表明这3个miRNAs靶向CB1 mRNA的可能性较大。miR-29a-3p、miR-29b-3p和miR-29c-3p与CB1 mRNA 3′UTR的结合关系如图1所示。
2.2 miR-29a-3p、miR-29b-3p和miR-29c-3p抑制了ACEA诱导的CB1表达上调
为了研究这3个miRNAs是否可以影响CB1的表达,笔者分别转染了J774A.1细胞的mimics,转染第2天,对细胞饥饿4 h后,再使用1μmol/L ACEA处理8 h,收集细胞,通过RT-qPCR检测CB1 mRNA表达及miRNAs表达。结果显示,转入相应miRNAs mimics后,J774A.1细胞里miR-29a-3p、miR-29b-3p和miR-29c-3p的水平分别上升了1 457.61倍、257.13倍和11 418.38倍(P<0.05),其倍数的差异与这3个miRNAs的基础表达有关,正常J774A.1细胞里miR-29b-3p表达最高,miR-29a-3p其次,miR-29c-3p最低;这些结果表明转染是有效的,足以满足后续实验要求。同时,ACEA上调了J774A.1细胞内的CB1表达水平,而转染了miR-29a-3p、miR-29b-3p或miR-29c-3p的mimics均可以明显抑制ACEA的作用(图2)。

图1 miR-29a/b/c-3p与CB1 3′UTR的预测结合位点Fig.1 The predicted binding sites betweenmiR-29a/b/c-3p and CB1 3′UTR
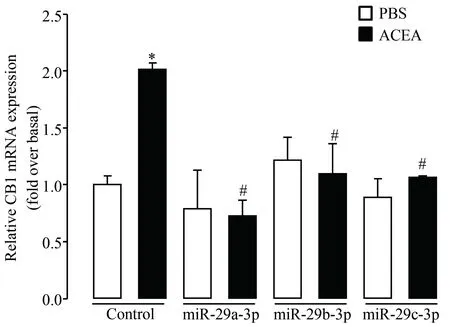
图2 miR-29a/b/c-3p mimics 抑制了ACEA诱导的CB1 mRNA的上调Fig.2 miR-29a/b/c-3p mimics inhibit the upregulation of CB1 mRNA expression
2.3 miR-29a-3p、miR-29b-3p和miR-29c-3p抑制了ACEA诱导的J774A.1细胞的迁移
接下来,笔者检测了miR-29a-3p、miR-29b-3p和miR-29c-3p是否可以影响J774A.1细胞的迁移。为了解决这一问题,笔者分别转染了J774A.1细胞的miRNAs mimics,48 h后收集细胞,重新接种到Boyden chamber小室中,下室加入ACEA(终浓度为1μmol/L)。6 h后进行细胞固定、染色操作,然后观察拍照计数。对照组的结果显示,1μmol/L 的ACEA可以明显促进J774A.1细胞的迁移,为对照组的1.94倍,而转染了miR-29a-3p mimic之后,ACEA便失去了促迁移的作用。同样,在转染miR-29b-3p mimic和miR-29c-3p mimic的细胞中,结果也是如此(图3)。这表明这3个miRNAs通过影响CB1的表达,抑制了ACEA诱导的J774A.1细胞的迁移。
3 讨论
过去十几年来,越来越多的文献[12-14]报道内源性大麻素系统参与了急性与慢性肝脏疾病,并扮演着重要的角色。内源性大麻素系统包括两个受体(CB1和CB2),两个配体:花生四烯酸乙醇胺(AEA)和2-花生四烯酸甘油(2-AG),以及相应的合成酶与降解酶。其中CB1参与了酒精性肝病、非酒精性脂肪肝、肝纤维化、肝硬化等肝病的病理过程以及肝再生过程[12]。有文献[13]报道抑制肝脏CB1表达后,可以改善糖和脂质代谢,减少肝脏脂肪变性。还有文献[14]报道,药理学上阻断CB1功能后,可以改善肝脏纤维化,即便是已经出现了肝硬化的情况下。可见阻断CB1可以作为治疗一些肝病的手段,但其中的机制尚不完全清楚。
目前,有大量报道[15-16]表明CB1可参与多种细胞的迁移。例如,CB1可激活PI3K/Akt和ERK1/2信号通路,进而影响子宫内膜基质细胞的迁移[15]。而CB1激动剂也可以浓度依赖的方式诱导人胚肾293细胞的迁移,且AMPK信号通路的激活可能参与其中[16]。在本研究中,笔者证明了CB1激动剂ACEA可以诱导J774A.1细胞的迁移,而miR-29a/b/c的mimics可以通过降低CB1的表达来抑制这一过程。另外,本研究显示CB1激动剂ACEA可以上调CB1的表达,且该过程依赖于miR-29a/b/c-3p。
近些年来,miRNAs引起了越来越多的关注。做为转录后调控因子,miRNAs参与了诸多生物学过程。
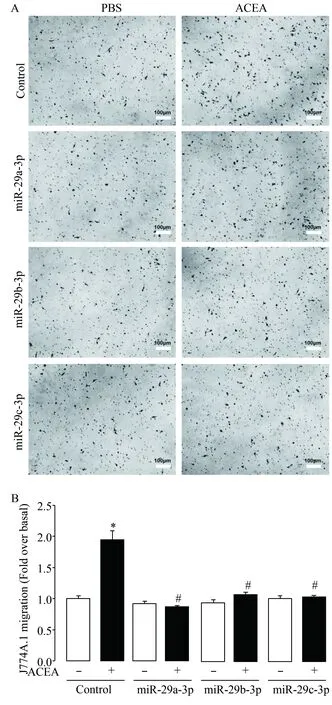
图3 miR-29a/b/c-3p mimics阻断了ACEA诱导的J774A.1细胞的迁移Fig.3 miR-29a/b/c-3p mimics blockACEA-induced J774A.1 cells migration.
人类的基因组可以编码超过1 000种miRNAs,它们可以靶向约60%的人类基因[17-18]。miRNAs可以靶向和调控所有的生物过程和细胞类型,并影响几乎所有细胞中基因的表达。有研究[19]报告已经证明,在肝脏中,miRNAs水平的改变与各种肝病,包括病毒性肝炎、酒精和非酒精性脂肪性肝炎,药物诱发的肝损伤、自身免疫性肝病和缺血再灌注损伤相关。植物的miRNAs发挥作用时,通常与其靶mRNA具有近乎完美的配对[20-21],而动物的miRNA能够通过在miRNA的5′末端使用少至6~8个核苷酸(种子区域)来识别其靶mRNA[21],因此在动物中种子序列也是区分miRNAs之间不同功能的一个标志。本研究中所关注的miR-29a-3p、miR-29b-3p以及miR-29c-3p,它们的种子序列均为:5′-ACCACGA-3′,在CB1 mRNA 3′UTR上的结合位点(预测)均为2 343~2 349位碱基。因此,在本研究中三者均可以抑制ACEA诱导的CB1的上调和J774A.1细胞的迁移。目前有许多报道[22-23]指出miR-29家族参与了肝脏纤维化进程,例如miR-29家族可以抑制肝星状细胞的激活[22],另外也可以抑制成纤维细胞内胶原的合成[23]。而笔者的结果第一次证实miR-29a/b/c-3p参与了巨噬细胞的迁移,进一步完善了对于miR-29家族在肝纤维化过程中功能的认识。
巨噬细胞在获得性免疫与固有免疫系统中都发挥着十分重要的作用。当组织受到感染或损伤时,循环系统中的炎性单核细胞(Ly6C+细胞)会受到招募,进入受损组织区域,并分化成巨噬细胞发挥作用[24]。在早期阶段,这些被招募的巨噬细胞常常表现出促炎性反应表型,分泌一些炎性反应因子:TNF-α、IL-1和一氧化氮(nitric oxide, NO),激活抗菌防御机制。在许多慢性炎性反应和自身免疫性疾病中,如果炎性巨噬细胞反应一直存在而得不到控制,反过来还可以促进疾病的进展[25-26]。因此,如果可以控制巨噬细胞向组织的浸润,那么便可以控制炎性反应的进程。本实验室前期结果[2]表明,在四氯化碳造成的小鼠肝损伤模型中,小鼠肝脏中聚集了大量的巨噬细胞,肝脏发生炎性反应及纤维化;而预防性给予小鼠CB1 拮抗剂AM281后,巨噬细胞向受损肝脏部位的浸润被阻断,肝脏的炎性反应及纤维化得到有效缓解[2]。目前已有文献[27]报道CB1拮抗剂(利莫那班)可以缓解急性或慢性肝损伤,但是会引起严重的神经系统的不良反应,比如抑郁等,这表明CB1拮抗剂可能并不适合作为药物应用于临床。因此,是否可以找到其他因子代替CB1拮抗剂抑制CB1表达或功能,从而达到治疗疾病的效果便显得极为重要。基于miRNAs的功能与安全性,其作为药物受到越来越多研究者的青睐,目前已有一些miRNA药物进入了临床试验阶段,如用于治疗肝癌的miR-34a(参见www.clinicaltrails.gov/ct2/show/NCT01829971)[28-29]。笔者着眼于miRNA是否可作为一个替代药物,调控CB1的表达和功能。本研究在体外证明了miR-29-a/b/c-3p可以通过靶向CB1,从而影响J774A.1细胞的迁移。表明miR-29家族或许可以作为药物,达到治疗肝纤维化的效果,但该结果仍需在小鼠和人体内进一步验证。
[1] Wynn T A, Chawla A, Pollard J W. Macrophage biology in development, homeostasis and disease[J]. Nature, 2013, 496(7446): 445-455.
[2] Mai P, Yang L, Tian L, et al. Endocannabinoid system contributes to liver injury and inflammation by activation of bone marrow-derived monocytes/macrophages in a CB1-Dependent manner[J]. J Immunol, 2015, 195(7): 3390-3401.
[3] Zhou Y, Falenta K, Lalli G. Endocannabinoid signalling in neuronal migration[J]. Int J Biochem Cell Biol, 2014, 47: 104-108.
[4] Saez T M, Aronne M P, Caltana L, et al. Prenatal exposure to the CB1 and CB2 cannabinoid receptor agonist WIN 55,212-2 alters migration of early-born glutamatergic neurons and GABAergic interneurons in the rat cerebral cortex[J]. J Neurochem, 2014, 129(4): 637-648.
[5] Preet A, Qamri Z, Nasser M W, et al. Cannabinoid receptors, CB1 and CB2, as novel targets for inhibition of non-small cell lung cancer growth and metastasis[J]. Cancer Prev Res (Phila), 2011, 4(1): 65-75.
[6] Nithipatikom K, Gomez-Granados A D, Tang A T, et al. Cannabinoid receptor type 1 (CB1) activation inhibits small GTPase RhoA activity and regulates motility of prostate carcinoma cells[J]. Endocrinology, 2012, 153(1): 29-41.
[7] Hammond S M. An overview of microRNAs[J]. Adv Drug Deliv Rev, 2015, 87: 3-14.
[8] Mohr A M, Mott J L. Overview of microRNA biology[J]. Semin Liver Dis, 2015, 35(1): 3-11.
[9] Wang B, Wu H, Chai C, et al. MicroRNA-1301 suppresses tumor cell migration and invasion by targeting the p53/UBE4B pathway in multiple human cancer cells[J]. Cancer Lett, 2017, 401: 20-32.
[10] Sandbothe M, Buurman R, Reich N, et al. The microRNA-449 family inhibits TGF-beta-mediated liver cancer cell migration by targeting SOX4[J]. J Hepatol, 2017, 66(5): 1012-1021.
[11] Patel V, Noureddine L. MicroRNAs and fibrosis[J]. Curr Opin Nephrol Hypertens, 2012, 21(4): 410-416.
[12] Mallat A, Teixeira-Clerc F, Lotersztajn S. Cannabinoid signaling and liver therapeutics[J]. J Hepatol, 2013, 59(4): 891-896.
[13] Jourdan T, Demizieux L, Gresti J, et al. Antagonism of peripheral hepatic cannabinoid receptor-1 improves liver lipid metabolism in mice: evidence from cultured explants[J]. Hepatology, 2012, 55(3): 790-799.
[14] Giannone F A, Baldassarre M, Domenicali M, et al. Reversal of liver fibrosis by the antagonism of endocannabinoid CB1 receptor in a rat model of CCl(4)-induced advanced cirrhosis[J]. Lab Invest, 2012, 92(3): 384-395.
[15] Gentilini D, Besana A, Vigano P, et al. Endocannabinoid system regulates migration of endometrial stromal cells via cannabinoid receptor 1 through the activation of PI3K and ERK1/2 pathways[J]. Fertil Steril, 2010, 93(8): 2588-2593.
[16] Song Z H, Zhong M. CB1 cannabinoid receptor-mediated cell migration[J]. J Pharmacol Exp Ther, 2000, 294(1): 204-209.
[17] Li Y, Zhang Z. Computational biology in microRNA[J]. Wiley Interdiscip Rev RNA, 2015, 6(4): 435-452.
[18] Virant-Klun I, Stahlberg A, Kubista M, et al. MicroRNAs: from female fertility, germ cells, and stem cells to cancer in humans[J]. Stem Cells Int, 2016, 2016: 3984937.
[19] Szabo G, Bala S. MicroRNAs in liver disease[J]. Nat Rev Gastroenterol Hepatol, 2013, 10(9): 542-552.
[20] Jones-Rhoades M W, Bartel D P, Bartel B. MicroRNAS and their regulatory roles in plants[J]. Annu Rev Plant Biol, 2006, 57: 19-53.
[21] Lewis B P, Burge C B, Bartel D P. Conserved seed pairing, often flanked by adenosines, indicates that thousands of human genes are microRNA targets[J]. Cell, 2005, 120(1): 15-20.
[22] Matsumoto Y, Itami S, Kuroda M, et al. MiR-29a assists in preventing the activation of human stellate cells and promotes recovery from liver fibrosis in mice[J]. Mol Ther, 2016, 24(10): 1848-1859.
[23] He Y, Huang C, Lin X, et al. MicroRNA-29 family, a crucial therapeutic target for fibrosis diseases[J]. Biochimie, 2013, 95(7): 1355-1359.
[24] Geissmann F, Manz M G, Jung S, et al. Development of monocytes, macrophages, and dendritic cells[J]. Science, 2010, 327(5966): 656-661.
[25] Sindrilaru A, Peters T, Wieschalka S, et al. An unrestrained proinflammatory M1 macrophage population induced by iron impairs wound healing in humans and mice[J]. J Clin Invest, 2011, 121(3): 985-997.
[26] Krausgruber T, Blazek K, Smallie T, et al. IRF5 promotes inflammatory macrophage polarization and TH1-TH17 responses[J]. Nat Immunol, 2011, 12(3): 231-238.
[27] Moreira F A, Crippa J A. The psychiatric side-effects of rimonabant[J]. Rev Bras Psiquiatr, 2009, 31(2): 145-153.
[28] 潘霞,王智慧,雷小勇.microRNAs与ABC转运蛋白介导的肿瘤多药耐药研究进展2015,22(8):644-648.
[29] 童春华,李新建,李志晋.微小RNA在肝癌组织中的表达及其潜在临床价值探讨[J].中华肿瘤防治杂志,2016,23(S1):28-29.

