弥散峰度成像对儿童阻塞性睡眠呼吸暂停综合征脑微结构变化的研究
李文风 文宏伟 刘 玥* 彭 芸 程 华 李宏彬 邰 隽
(1.首都医科大学附属北京儿童医院放射科 国家儿童医学中心,北京 100045;2.西南大学心理部,重庆 400715;3.首都医科大学附属北京儿童医院耳鼻喉科 国家儿童医学中心,北京 100045)
儿童阻塞性睡眠呼吸暂停综合征(obstructive sleep apnea syndrome, OSAS)是睡眠过程中频繁发生部分或全部上气道阻塞,扰乱儿童正常通气和睡眠结构而引起的一系列病理生理变化。已经被发现存在认知障碍[1],但是常规的影像学检查方法无法发现认知造成的脑损伤。目前关于OSAS国内外脑功能影像学研究[2-5]多,而脑结构的影像学研究相对较少。因此本次研究运用基于纤维束空间统计学(tract-based spatial statistics,TBSS)的磁共振弥散峰度成像(diffusional kurtosis imaging,DKI)技术,分析OSAS患者的脑微观结构的变化。
1 对象与方法
1.1 研究对象
OSAS组:选择2015年9月至2017年6月在首都医科大学附属北京儿童医院耳鼻喉科首次就诊未经治疗的OSAS患儿19例,男性13例,女性6例;年龄3~10岁,平均年龄(5.40±1.89)岁;入组标准:①患儿睡眠时张口呼吸、憋气、打鼾;②多导睡眠监测诊断标准:阻塞性呼吸暂停指数 (obstructive apnea index,OAI)>1或者呼吸暂停低通气指数(apnea hypopnea index,AHI)>5伴最低需氧饱和度(lowest oxygen saturation,LSaO2)<92%;③鼻咽镜检查示腺样体肥大。排除标准:①患者有其他夜间睡眠打鼾、持续张口呼吸、呼吸困难、呼吸暂停表现的疾病;②曾有腺样体、扁桃体、喉部、声门、气管、肺部、胸廓手术史;③需使用睡眠或镇静药物维持睡眠;④家长对本研究不认同。正常对照组:招募年龄、性别无统计学差异的正常儿童23例,其中男性10例,女性13例;年龄3~10岁,平均年龄(6.43±1.90)岁。
患儿均采用美国飞利浦伟康公司 Alice5系列睡眠监测仪,入睡前禁用咖啡、 茶、可乐及镇静催眠剂,在本院睡眠中心至少进行有效睡眠时间7 h睡眠监测。脑电电极安装按照国际 10-20 标准。睡眠监测导联包括脑电、眼电、下颌肌电、鼾声、鼻气流、胸部运动、腹部运动、腿动、血氧饱和度,计算AHI,动脉血氧饱和度(oxygen saturation,SaO2),OAI,呼吸暂停指数(apnea index,AI)、睡眠效率(sleep efficiency,SE)等。
1.2 DKI数据采集
采用美国GE Medical Systems Discovery MR750 3.0T磁共振仪,8通道头颅线圈,每个受试者首先进行常规MRI扫描以排除脑实质病变,DKI扫描序列为单次激发自旋回波的平面回波成像序列(spin-echo echo-planar imaging,EPI),TR/TE=5 775/79.9 ms,矩阵128×128,视野240 mm×240 mm,层厚3 mm,30个b=1 000 s·mm-2、b=2 000 s·mm-2的扩散编码方向和 1个b=0的方向,DKI扫描时间8 min 44 s。
1.3 数据处理
通过首先使用FSL (http://www.fmrib.ox.ac.ku/fsl)磁共振影像处理软件进行被试者的DKI数据处理,包括所有弥散图像做涡流校正,然后使用DKE(Diffusional Kurtosis Estimator)(http://www.nitrc.org/projects/dke) 软件估计 DKI 参数部分各向异性(fractional anisotropy,FA)、峰度部分各向异性(kurtosis fractional anisotropy,KFA)[2],而后通过非线性配准方法将每位被试的 FA 图像与 FA 靶图像(FMRIB58_FA)进行配准,将所有配准后的 FA 图像转化为蒙特利尔神经病学研究所(Montreal Neurological Institute, MNI)152模版。再将所有被试的 FA 图进行平均,生成平均 FA 的骨架图,再将所有被试的 FA 图投射到平均 FA 白质骨架内[3]。骨架化FA图病例组与对照组进行基于体素水平的全脑非参数统计比较,P<0.01 则被认为两组间差异有统计学意义。在比较中,无阈值簇增强(threshold-free cluster enhancement,TFCE)方法进行多重比较校正。
在放射冠、上纵束、皮质下脑白质复杂的区域TBSS分析有局限,不能敏感分析出弓形纤维及纤维交叉的走行及数量变化,在MNI里,自动化计算感兴趣区(region of interest, ROI),面积15~30 mm2能更敏感检测这些纤维的FA、KFA值。
1.4 统计学方法
应用SPSS19.0软件,受试者的性别采用卡方检验,年龄、体质量、BMI采用双样本t检验(two samplet-test),将有统计学意义的ROI检测出的FA值及KFA值与临床参数进行相关性分析,以P<0.05 为差异有统计学意义。
2 结果
2.1 一般资料
OSAS组与对照组的人口学特征及临床参数等信息如表1所示,两组性别、年龄、体质量、体质量指数,差异均无统计学意义(P<0.05)。
2.2 全脑基于体素的 TBSS 比较
与正常对照组相比,OSAS患儿表现出双侧脑白质部分区域FA值、KFA值下降,FA值下降区域包括右侧内囊前肢、右侧丘脑辐射、穹窿、胼胝体(表2)。KFA值下降区域包括左后放射冠、右上纵行纤维束、右侧外囊、右侧内囊前肢、胼胝体压部(图1)。
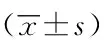
表1 OSAS组与正常对照组人口学与临床资料Tab.1 Demographic and clinical characteristics of OSASpatients and healthy controls
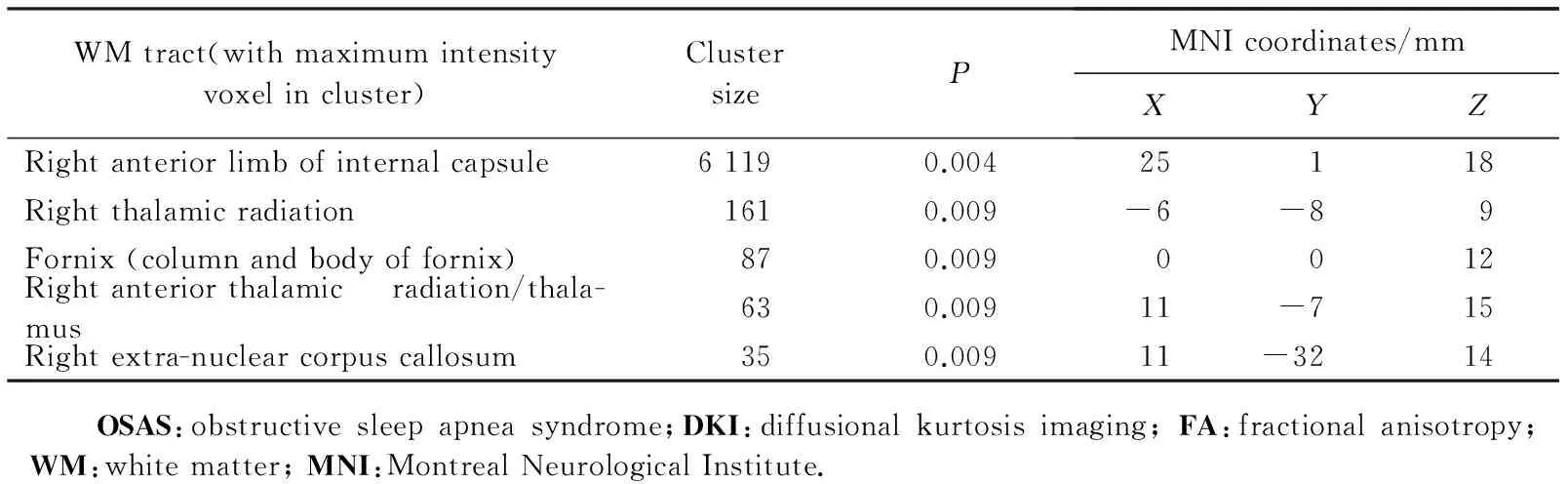
表2 OSAS组纤维骨架DKI FA减低脑区Tab. 2 Skeleton clusters showing significantly decreased DKI FA in OSAS group
2.3 白质纤维束ROI组间差异
与正常对照组相比,OSAS患者的FA值及KFA值在双侧中央后回脑白质差异有统计学意义(P<0.05),KFA值在放射冠、上纵行纤维束、前额叶、中央前后回、顶枕交界、枕叶脑白质差异有统计学意义(P<0.05,表3)。
2.4 FA值、KFA值与临床参数的分析
右侧内囊前肢、左顶叶的KFA值与LSaO2呈正相关,胼胝体压部、右后放射冠、左侧中央后回、左前顶叶DKI参数值FA、KFA与血样饱和度<90%所占比例、低通气指数呈负相关(图2)。
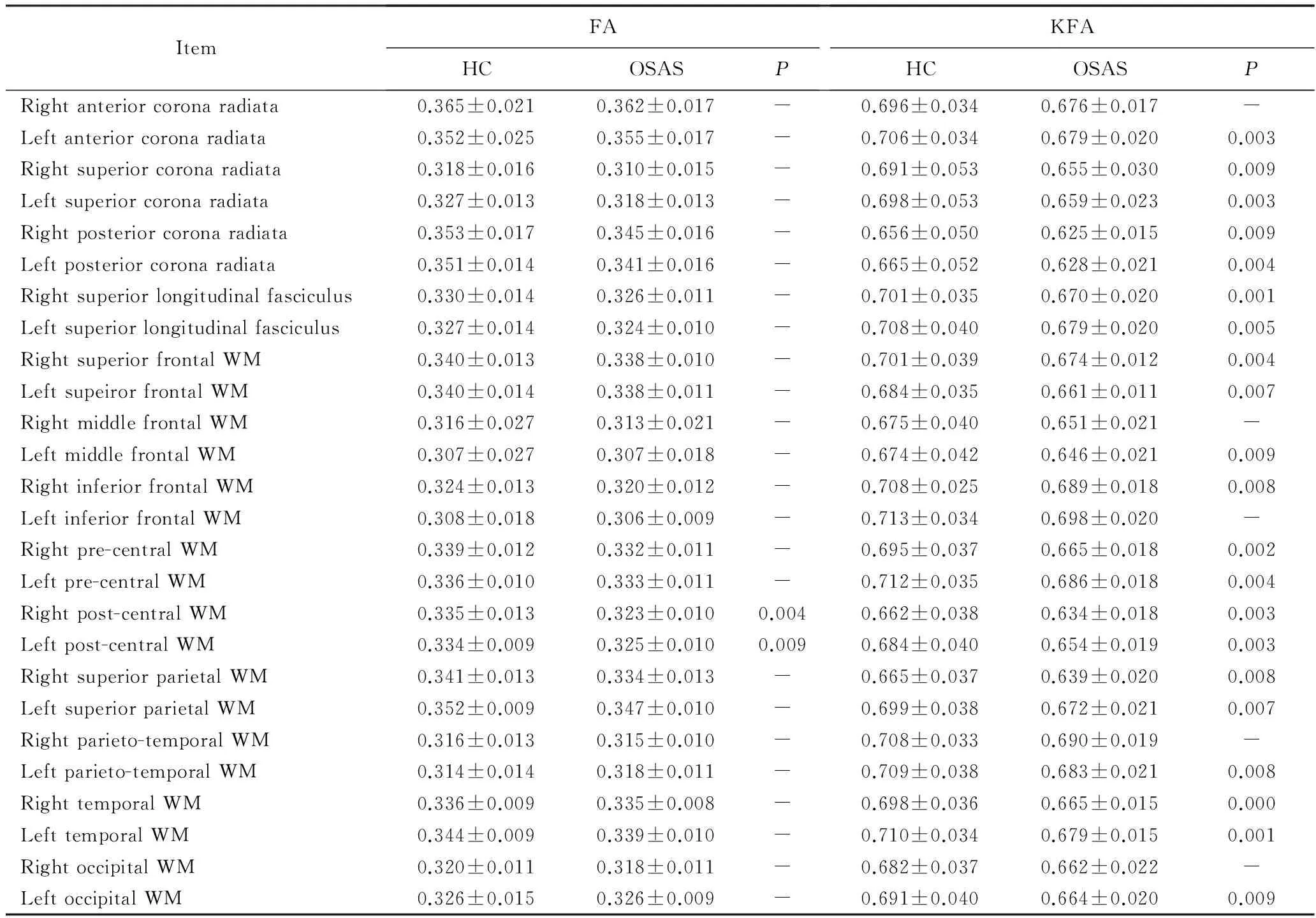
表3 两组纤维束走行脑白质区DKI参数基于图集的ROI分析Tab.3 Comparison of DKI parameters in the WM regions with complex fiber arrangement using atlas-based ROI analysis
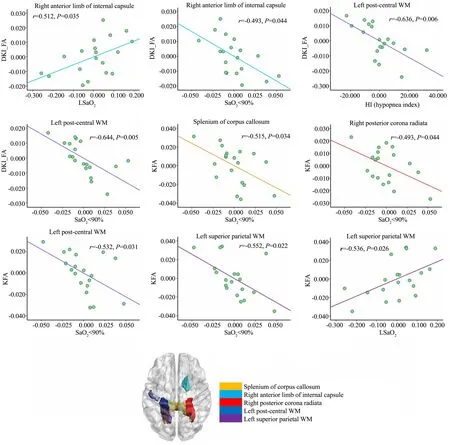
图2 DKI参数(FA和KFA)与临床参数的相关分析Fig.2 Correlations of DKI parameters (DKI_FA and KFA) and clinical parameters
3 讨论
OSAS多发于婴幼儿至青春期这一阶段,尤其是 2~8 岁的儿童,该病产生的主要原因是睡眠过程中呼吸暂停及低通气次数过多,导致儿童的睡眠结构及呼吸出现紊乱,从而出现低氧血症、高碳酸血症等[4]。OSAS中枢神经系统受累的主要表现为认知功能障碍,程度轻者表现为记忆力下降、注意力及执行能力障碍、语言表达能力、视觉空间及抽象思维能力弱化,程度严重者将会导致失语、失认、失用等[5]。
虽然OSAS造成认知损害,但是常规的影像学检查方法无法发现认知造成的脑微观结构损伤。DKI可以显示白质纤维束的走行,观察大脑白质的结构特征,检测脑组织的轻微损伤。其是在磁共振弥散张量成像(diffusion tensor imaging,DTI)基础上发展起来的一种新的成像技术,它的假设前提是水分子在活体组织中的扩散是非高斯的,并用峰度值来测量其偏离高斯运动的轨迹[6]。在此引入了一个概念“峰度” 去衡量水分子扩散分布偏离高斯分布的偏移量,以此来衡量组织结构复杂程度[7],DKI参数部分各向FA值反映自由水分子运动的轨迹,其变异度较小而且具有较高的图像信噪比,常用它来评价病变区白质的微观结构改变。相比于DTI,DKI能为白质和灰质中复杂的微结构提供更具体的信息,对组织的多相性也更敏感。因此,DKI已经被成功应用于对人的年龄研究[8]、脑损伤[9]、阿尔茨海默病[10]、多动症研究[11]以及动物模型研究[12]等。
本次研究发现OSAS患者的受损神经纤维束的白质微结构,包括连接两侧大脑半球皮质的联合纤维如胼胝体、联系大脑皮质及皮质下结构的投射纤维如内囊前肢、后放射冠以及连接同侧大脑半球不同部位联络纤维如上纵束。ROI 分析的结果表明纤维束上损伤的区域广泛分布在顶叶、顶枕交界区。
胼胝体是连接两侧大脑半球的横行的神经纤维束,是大脑半球中最大的联合纤维,胼胝体压部纤维束连接广泛,其纤维向两侧伸展后,部分到达颞上回后部,部分向前于胼胝体膝部,后方向外,抵达额下回;并且胼胝体压部有纤维束向下达脑干,少量纤维束抵达小脑半球。由前联合通路和参与认知和情感处理的、神经环路组成,人类通过胼胝体将存储在大脑皮层的各种不同的信息进行整合,从而学习、掌握各种技能,在调节两侧大脑半球间联系及功能协调上有重要作用,患者胼胝体压部KFA值减低,胼胝体的白质微结构完整性损害,将会导致两侧大脑半球联系减低,促使认知及情感障碍。
内囊包含着通往大脑皮质的运动及感觉神经纤维,人体所感知的各种外界刺激及大脑皮质下达的命令,上下的信息交流,大部分是通过内囊实现的, OSAS的患者较正常对照组通过内囊到达额叶及丘脑的神经纤维减少,造成信息传达障碍。
顶叶是躯体感觉中枢,顶枕交界区为躯体联络区。顶上区的传出纤维还参与顶枕颞桥束和皮质网状束。顶叶纤维结构的复杂性决定了顶叶联合皮质区在认知功能的参与中起到重要的作用,顶叶联合皮质的认知活动涉及到复杂的神经纤维网络构成,并且这些网络不仅包括储存记忆、联络信息的皮质区域,同时包括联系它们的白质纤维束[11];顶叶脑白质纤维微细结构的完整性遭到破坏,势必会影响顶枕颞纤维环路的构成,从而引起相应脑区的认知与联络功能受损。
在静息态脑功能的研究中,顶叶(楔前叶、顶下小叶)是默认网络的核心亚区,默认网络被认为参与信息的收集和评估、自传体记忆、情景记忆的提取、情感、焦虑及做白日梦等功能的信息处理。有研究[13]显示,OSAS患者右侧楔前叶及双侧后扣带回低频振幅值显著减低,并且减低的区域的低频振幅值与MoCA评分呈显著的正相关[14]。Prilipko等[15]发现,OSAS患者在工作记忆任务显示默认网络异常负激活,同时默认网络负激活脑区与临床行为表现存在显著的正相关,表明默认网络脑区在认知障碍中扮演了重要的角色。Peng等[16]采用基于静息状态的功能磁共振成像的ReHo的方法,计算评估25例未经治疗的OSAS男性患者与25例正常对照组的ReHo值,结果发现OSAS患者ReHo值在右额内侧回、右侧额上回,楔前叶和角回,左顶叶显著降低。说明OSAS患者在以上脑区表现出明显的区域自发活动缺陷。同时默认网络活动缺陷脑区与临床行为执行功能存在显著的负相关,表明这些脑区在认知障碍中扮演了重要角色。
中央前、后回为第1躯体皮质运动区,参与支配躯体随意运动。研究[17]显示OSAS患者运动皮质的神经可塑性减低,这影响OSAS患者运动技能的学习、保留及巩固功能,可能是由于片断化睡眠或慢性低氧干扰睡眠,具体机制尚待研究。
总之,本次研究运用基于TBSS的DKI技术,发现OSAS患者胼胝体压部、内囊、中央前后回、顶叶脑区纤维束FA、KFA值存在异常,这可能是OSAS患者认知功能减低的神经机制;同时KFA值减低的脑区(右侧内囊前肢、左顶叶)与最低SaO2、存在显著的正相关,胼胝体压部、右后放射冠、左侧中央后回、左前顶叶与SaO2<90%所占比例存在显著负相关即与缺氧程度存在显著正相关,推测低氧是导致认知功能损害的直接原因,可以为OSAS患者的临床治疗提供影像学客观依据。
[2] Brian H, Nørhøj J S. Kurtosis fractional anisotropy, its contrast and estimation by proxy[J]. Sci Rep, 2016,6:23999.
[3] Tabesh A, Jensen J H, Ardekani B A, et al. Estimation of tensors and tensor-derived measures in diffusional kurtosis imaging[J]. Magn Reson Med, 2011,65(3):823-836.
[4] 畅怡,聂秀红,詹淑琴,等.快速动眼睡眠行为障碍疾病与阻塞性睡眠呼吸暂停综合征关系的多导睡眠监测特征研究[J].首都医科大学学报,2014,35(5):653-656.
[5] Yaffe K, Laffan A M, Harrison S L,et al . Sleep disordered breathing,hypxia,and risk of mild cognitive impairment and dementia in older women[J]. JAMA, 2011, 306(6):613-619.
[6] Chen Y Y, Zhao X, Ni H, et al. Parametric mapping of brain tissues from diffusion kurtosis tensor[J].Comput Math Methods Med, 2012,2012:820-847.
[7] Wu E X, Cheung M M. MR diffusion kurtosis imaging for neural tissue characterization[J]. NMR Biomed, 2010,23(7):836-848.
[8] 赵燕凌,王军,王效春,等.ApoEε4等位基因对认知正常老年人脑微观结构影响的扩散峰度成像研究[J].首都医科大学学报,2017,38(2):304-307.
[9] Grossman E J, Ge Y, Jensen J H, et al. Thalamus and cognitive impairment in mild traumatic brain injury: a diffusional kurtosis imaging study[J]. J Neurotrauma, 2012,29(13):2318-2327.
[10] Ting W K, Fischer C E, Millikin C P, et al. Grey matter atrophy in mild cognitive impairment / early Alzheimer disease associated with delusions: a voxel-based morphometry study[J]. Curr Alzheimer Res, 2015,12(2):165-172.
[11] Helpern J A, Adisetiyo V, Falangola M F, et al. Preliminary evidence of altered gray and white matter microstructural development in the frontal lobe of adolescents with attention-deficit hyperactivity disorder: a diffusional kurtosis imaging study[J]. J Magn ResonImaging, 2011,33(1):17-23.
[12] 张玉珍, 李芳珍, 高煜, 等. 扩散峰度成像在大鼠海人酸癫痫模型中的研究[J] .放射学实践, 2014,29(4):382-386.
[13] Klingberg T. Development of a superior frontal-intraparietal working memory[J].Neuropsychologia,2006,44(11):2171-2177.
[14] Li H J,Dai X J,Gong H H,et al.Aberrant spontaneous low—frequency brain activity in male patients with severe obstructive sleep apnea revealed by resting—state functional MRI[J].Neuropsychiatr Dis Treat,2015,11:207-214.
[15] Prilipko O,Huynh N,Schwartz S,et al.Task positive and default mode networks during a parametric working memory task in obstructive sleep apnea patients and healthy controls[J].Sleep,2011,34(3):293-301.
[16] Peng D C, Dai X J, Gong H. Altered intrinsic regional brain activity in male patients with severe obstructive sleep apnea:a resting-state functional magnetic resonance imaging study[J]. Neuropsychiatr Dis Treat,2014,10 :1819-1826.
[17] Opie G M,Catcheside P G,Usmaniz A,et al.Motor cortex plasticity induced by theta burst stimulation is impaired in patients with obstructive sleep apnoea[J].Eur J Neurosei,2013,37(11):1844-1852.

