胆道出血的诊治进展
罗晓亮 综述,杜国平 审校
佛山市顺德区第一人民医院消化内科,广东 佛山 528300
胆道出血是指由于各种原因导致胆道与血管间形成异常通道(瘘管或病理性通道)引起的上消化道出血,典型临床症状为腹痛、黄疸和消化道出血,即Quincke三联征。1654年,LISSON首次报道胆道出血,他描述了一位年轻的贵族在决斗中被刺伤右上腹,最后因消化道大量出血而死亡。1948年,ANDBLOM首次提出胆道出血(hemobilia)这一名词[1]。出血可源自胆管的任何部位,其中半数来自肝内胆管,源自胆囊和肝外胆管者各占25%。胆道出血的病因主要有医源性、外伤、结石、感染、肿瘤等,随着诊断和治疗技术的进步及经验的积累,治疗效果已有明显提高。为了进一步提高胆道出血的诊治效果,现将其诊治现状作一概述。
1 病因
胆道出血在临床上较少见,总体发病率很难准确统计。在过去,国内胆道出血病因以胆道结石或感染居多,而国外以外伤性为主[2]。而目前由于肝胆系手术、肝胆系影像学穿刺和引流技术的广泛开展,医源性创伤目前已成为胆道出血的首要病因[3]。SANDBLOM[4]在1972年报道了59例(16.6%)医源性胆道出血和137例(38.6%)外伤性胆道出血,其余的案例由其他病因所致。1987年,YOSHIDA等[5]的统计数据显示,医源性创伤(40.8%)成为胆道出血的主要原因,外伤所占比例下降至19.4%,且随着肝胆手术开展的增加,医源性因素成为胆道出血的首要病因。GREEN等[1]统计了1996-1999年的222例胆道出血患者,医源性创伤占65%,其中肝活检30例、经皮经肝胆管造影(percutaneous transhepatic cholangiography, PTC)10例、经皮经肝胆管引流术(percutaneous transhepatic biliary drainage,PTBD)43例、胆管腔内操作23例和胆囊切除术29例等,至于外伤(6%)、肝胆恶性肿瘤(7%)、胆道感染(13%)、血管疾病(9%)等病因已大大减少。一系列的统计[1,4-5]表明,医源性因素已经成为胆道出血的首要原因(见图1)。
1.1医源性胆道出血
1.1.1 经皮肝穿刺活检(percutaneous liver biopsy,PLB):PLB是一种重要的检查手段,它的并发症发生率为2%~4%,其中胆道出血约占并发症的3%[6]。张瑶等[7]统计了5 107例超声引导下PLB,其中只有1例发生胆道出血,提示PLB是一种较为安全的检查手段。肝动脉、门静脉分支及胆管毗邻并伴行,穿刺针贯通这些结构时可能导致假性动脉瘤、动静脉瘘、静脉胆管瘘或动脉胆管瘘形成,在此基础上导致胆道出血。继发于肝活检的大部分瘘都不会出现血流动力学改变,而细针穿刺活检导致的动脉-门静脉瘘在通常情况下能迅速恢复并重建,血液进入胆管后堆积并凝固,可以在胆管腔内形成纤维和血凝块构成的假性动脉瘤,造成反复胆道出血。患者的基础病(肝硬化、腹水、凝血功能障碍)与肝活检后胆道出血的发生有一定相关性[8]。此外,活检针的种类和型号及穿刺针道数目对胆道出血的发生也有影响。
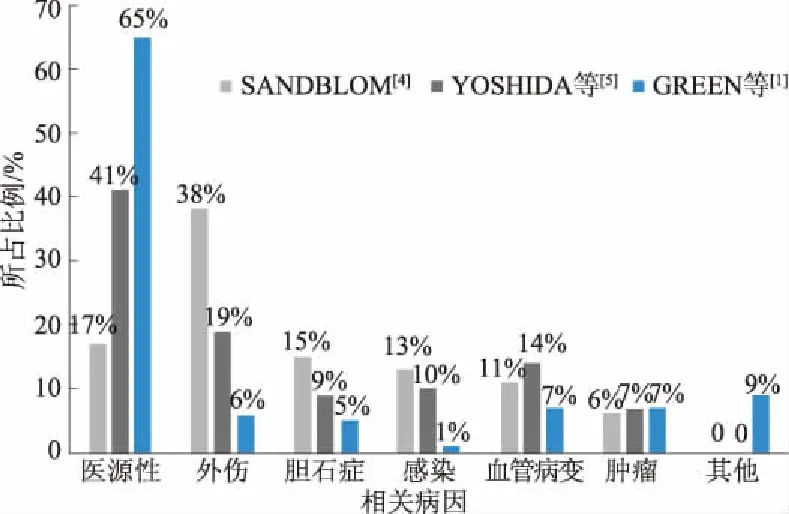
图1 胆道出血病因变化趋势 Fig 1 The change trends of etiology of hemobilia
1.1.2 PTC及PTBD:PTC和PTBD是诊断和治疗胆道梗阻的有效方法,均为有创的诊治手段。其中,PTBD并发胆道出血的概率为2%~10%[2]。行PTC或PTBD,特别是需要放置引流管时,应避免穿刺肝门区的大胆管,因为较大的胆管往往伴行大血管,损伤概率更高,更易造成胆道大出血。在彩色多普勒超声引导下行PTC或PTBD能有效地避开大血管,准确地穿刺胆道,从而减少穿刺过程中血管的损伤。
1.1.3 外科手术:外科手术中,经腹腔镜胆囊切除术(laparoscopic cholecystectomy, LC)并发胆道出血相对多见,MARAKIS等[9]统计了1 225例行LC患者,其中并发胆道出血10例(0.8%)。手术操作造成的动脉-胆瘘、静脉-胆瘘、假性动脉瘤是胆道出血的病理基础。研究[10]认为,LC的胆道损伤率为0.2%~1%,是开腹胆囊切除术(open laparocholecystectomy, OC)的10倍,LC比OC更易并发胆道出血,因为LC除机械胆道损伤外,另对胆道有热损伤、电凝的热损伤是假性动脉瘤形成的主要原因之一;钳闭钛夹时损伤血管,或钛夹放置位置不当也是造成术后胆道出血的因素[11];此外,胆汁对血管壁有刺激,是延缓手术中受损血管的愈合并导致假性动脉瘤形成的因素之一。
理论上,任何与肝胆系统有关的手术均可导致胆道出血。如肝叶切除术、R-Y肝肠吻合术[12]等。
1.1.4 肝移植:肝移植术后并发胆道出血少见,其发病机制尚不明确,可能由血管和胆道系统结构改变、潜在的肝脏疾病(急性或慢性肝衰竭)、潜在的全身性疾病、肝移植类型、胆道吻合方法、血管异常(胆管-动脉瘘,肝动脉创伤和门静脉血栓形成)等引起[13]。
1.1.5 内镜下逆行胰胆管造影术(endoscopic retrograde cholangiopancreatography, ERCP):ERCP是目前诊断治疗胆胰疾病的重要方法,作为侵入性的诊疗技术,其可以导致胆道出血的发生。ERCP术后胆道出血发生率为1.13%~2.0%,MASCI等[14]统计了2 444例行ERCP患者,其中并发胆道出血30例(1.13%),在多变量分析中,认为内镜下乳头括约肌切开术(EST)和乏特氏壶腹乳头堵塞是出血风险增加的危险因素。不当的球囊扩张或支架置入会使狭窄段胆道黏膜撕裂出血[15],而相对于金属支架,塑料支架所致的胆道出血则较为罕见[16]。其他ERCP相关技术也可导致胆道出血,如导丝相关性损伤[17]、内镜超声引导下细针穿刺活检[18]。ERCP所致的胆道出血一般有自限性,患者常能自行恢复,并不影响血流动力学,但也有一些严重或致命的出血案例[19-20]。
1.2非医源性胆道出血
1.2.1 胆石症:胆结石可引起黏膜损伤,但出血量一般较少,症状不明显,可仅表现为大便潜血阳性。当然,胆石症也可以导致较大量的出血,结石长期嵌顿卡压致局部胆管壁形成溃疡,继而穿破临近血管,引起胆管-血管瘘,从而导致胆道出血[21]。另外,胆总管下段结石可致胆汁及胰液的流出受阻,发生胆源性胰腺炎的同时伴发胰源性胆管炎及胆囊炎,被激活的胰酶会腐蚀和消化胆管及胆囊黏膜,黏膜屏障受到破坏,进而腐蚀和消化黏膜下的血管致其破裂出血。
1.2.2 肝胆道感染:感染是非医源性胆道出血的主要病因之一,其病理生理基础是胆道炎症致胆道高压、胆管黏膜糜烂、溃疡形成,并腐蚀管壁和周围血管而致出血,另外,炎症也可以使伴行动脉形成假性动脉瘤,假性动脉瘤破裂时导致出血发生[22]。除急性炎症外,慢性炎症(如慢性胆囊炎[23]、慢性胰腺炎[24])也可导致胆道出血,其机制是慢性炎症并发假性动脉瘤,进而导致胆道出血,且长期的慢性炎症刺激会使胆道出现不同程度的狭窄。肝脓肿波及邻近血管和胆道时也可致胆道出血[25]。其他罕见的感染有寄生虫感染,如蛔虫、包虫、棘球绦虫等。
1.2.3 肝胆道肿瘤:肝癌、胆囊癌、胆管癌、胰腺癌和肝转移癌等均能导致胆道出血[26-27],过去较少见,但随着肝胆道肿瘤发病率的逐年上升,肿瘤所致的出血也呈上升趋势。其机制:肿瘤无序生长侵蚀其周围血管致出血,其出血速度一般不快,但易引起慢性贫血。另外,用于破坏肿瘤组织的射频消融术(radiofrequency ablation, RFA)同样也可使正常组织损伤,因此,胆道出血是RFA的并发症之一[28]。
1.2.4 凝血功能障碍:凝血功能障碍或长期使用抗凝药物的患者,发生胆道出血的概率比正常人高。有报道[29]二尖瓣置换术后发生自发性胆道出血,提示抗凝治疗是胆道出血的危险因素之一。先天性凝血功能障碍的患者,即使经过治疗或纠正,也是胆道出血的易发人群。
1.2.5 血管病变:血管病变导致胆道出血罕见,其中肝动脉瘤为主[30]。也有报道血管发育不良[31]、动静脉畸形[32]致胆道出血。
1.2.6 自身免疫性疾病:这可能与血管炎引起的血管损伤有关,如结节性多动脉炎[33]、系统性红斑狼疮[34]等。
2 临床表现
1871年,QUINCK描述了典型的胆道出血症状,腹痛、黄疸及消化道出血,即Quinckes’三联征,上述症状可间歇发作,其机制:出血后,血凝块形成并堵塞胆管使出血停止,因胆道内压力升高及血凝块刺激,会出现腹痛及黄疸症状;随着血凝块被胆汁溶解,胆道再通,腹痛及黄疸随之缓解,但出血再次出现。此过程反复出现,具有周期性特点(7~14 d)[1]。但文献[3]报道,只有部分患者(22%~37.9%)出现典型的Quinckes’三联征。
胆道出血的临床表现主要与出血量、出血时间和出血速度有关。少量出血时,因血液与胆汁表面张力及比重的差异不能混合,导致血凝块形成,进而使胆道梗阻。根据梗阻部位的不同,可出现胆囊炎、胆管炎或胰腺炎。胆管内的血凝块可使出血自行停止,当血凝块排出或溶解后,出血又可再发,如此周而复始。缓慢的胆道出血可非常隐匿,可无典型的临床表现,仅有黑便或大便潜血试验阳性。缓慢的胆道出血很难被及时发现,最后可导致慢性贫血。残留在胆道中的血凝块可逐渐发展成结石。
大量出血时,患者更多地表现为腹痛、上消化道出血(黑便、呕血等),甚至危及生命。但实际上很少胆道出血病例会出现呕血,除非出血量非常大,因为幽门括约肌可以阻止血液从十二指肠反流进胃,因此也常被误认为是下消化道出血。
胆道出血临床上并不常见,诊断相对困难;若严重肝胆道感染、外伤、肝胆手术、有创胆道介入术后出现腹痛、黄疸或上消化道出血,需警惕胆道出血的可能。
3 诊断
3.1超声超声检查对胆道出血诊断有一定帮助,但仅通过随机某次的超声检查难以与结石等病变鉴别,易出现误诊。周秀芳[35]动态观察了200例胆道出血的超声表现,新鲜出血表现为与肝组织类似的均质回声,胆管内充满均质回声,使胆管难以辨认;24~48 h后,血液凝固表现为类似于软组织的低回声团块,近端胆管扩张;后期凝血块破碎, 回声为低回声或中等回声,呈现出点片状或斑点状。根据超声成像, 可以发现不同出血时期的回声表现有不同的特征,以此为诊断的依据。虽然超声对胆道出血的部位无法定位,但结合病史及追踪复查,可对胆道出血做出辅助诊断,并通过对超声图像变化的监测了解胆道出血的转归。
3.2计算机断层扫描(computedtomography,CT) CT血管造影对胆道出血的定性及定位有一定价值,胆道出血CT表现:出血灶可呈树枝状铸型、不规则形、长条形、小斑片状,周围胆管扩张,近端小胆管扩张不明显;急性期出血灶表现高密度影,进入胆囊时,胆囊内密度增加;血液凝固成凝血块则呈等、低密度表现;合并感染时胆管壁增厚,有强化[36]。CT血管造影不但可以帮助诊断胆道出血,还可以行肝血管重建,有助于为下一步行数字减影血管造影(digital subtraction angiography, DSA)或经导管动脉栓塞术(transcatheter arterial embolization,TAE)提供肝动脉相关资料。虽然TAE可以明确出血病灶,但却无法评估出血量。
3.3磁共振胰胆管造影(magneticresonancecholangiopancreatography,MRCP) 作为一种非侵入性的胰胆管成像技术,MRCP可多方位、多角度显示胆道系统的解剖形态。出血性胆汁在重T2加权图像和脂肪抑制T2加权图像均呈低信号,血凝块则表现为高信号胆汁内的混合信号充盈缺损,以此可以协助诊断[37]。
3.4DSA与超声、CT、MRCP等检查手段相比,DSA对于出血血管的显示具有独特的优势。DSA是诊断原因不明胆道出血的重要方法,对胆道出血的诊断具有很高的敏感性,可准确发现出血部位及其来源, 肝动脉变异情况也一目了然。当出血量>0.5 ml/min时,就可以确定病变的血管,其诊断准确率为88%~100%[3]。胆道出血的直接表现为动脉期造影剂呈团状或柱状外溢, 肝实质内出现片状造影剂影:动脉-胆道瘘征象。间接表现为假性动脉瘤,呈囊状或圆形,显影早,消散晚[38]。DSA不但可以准确地发现出血病灶,还可以立即行TAE止血。但当没有活动性出血时,DSA的敏感性会大大降低[39]。
3.5内镜十二指肠镜可直接观察十二指肠乳头,若看到有血液从十二指肠乳头流出则可诊断为胆道出血,同时也可以排除其他上消化道出血,但十二指肠镜的检出率依赖于出血量和持续时间。
ERCP在胆道出血诊治中有重要作用,首先可评估出血量、出血速度,其次胆道造影可以明确出血原因、充盈缺损类型和位置及胆道扩张的程度[40]。ERCP造影可见特征性的不规则充盈缺损,有时胆道扩张可能是胆道出血的唯一特征影像。充盈缺损的形状是多变的,若血凝块形成胆管铸型可表现为长条状的充盈缺损,有的可表现为较小的球形缺损(这时需注意与胆道结石鉴别)。肝动脉瘤、假性动脉瘤和胆脂瘤表现为胆管上的压迹。胆道寄生虫也可通过ERCP发现。
目前,很少有报道通过超声内镜诊断的胆道出血。超声内镜对诊断胆道出血有一定的辅助作用,特别是肝动脉假性动脉瘤所致的胆道出血。超声图像中表现为起源于动脉的囊性病变,其内有典型的往复流动,可考虑为假性动脉瘤[41];若与肝动脉伴行的胆道中出现异常血流信号,则提示有活动性胆道出血的存在[42];胆道内血凝块则表现为:扩张胆道内有不均匀的中低回声团块,其内没有多普勒信号[43]。当TAE、DSA、ERCP等检查不能明确诊断时,超声内镜可以作为重要补充的辅助检查。
4 治疗
根据1972年SANDBLOM[4]的统计,胆道出血的死亡率高达25%,而现在死亡率已经下降至5%[1]。胆道出血死亡率下降的原因:(1)胆道出血病因的改变。医源性创伤已成为胆道出血的首要病因,而医源性胆道出血相对容易诊断,出血量较少,多可采取保守治疗,且疗效确切;(2)治疗方法的发展。以往治疗胆道出血多采用外科手术治疗,而随着科技的发展,更多的治疗方法(TAE、内镜治疗等)应用于胆道出血。尤其是TAE,术后死亡率明显低于手术治疗[2]。
目前胆道出血的治疗原则是尽快止血,恢复胆道引流。大出血的治疗方法首选TAE,TAE失败后可采取手术治疗,少量缓慢出血主要采取保守治疗及内镜处理。
4.1保守治疗胆道出血缓慢或量小,生命体征平稳者,首先应采取内科保守治疗[44]。根据病情,可联合或单一采取以下措施:(1)扩容、补液以维持循环血容量,维持水电解质平衡;(2)全身应用止血药、生长抑素等治疗;(3)联合、足量应用抗生素治疗;(4)术后带T管的患者可采用经T管注药,如肾上腺素、过氧化氢液、抗生素等。保守治疗的适应证:(1)少量缓慢出血;(2)患者出血后一般情况较好;(3)胆道术后出血;(4)胆道无原发病灶(医源性胆道出血)或原发病灶不严重者。
4.2外科手术治疗在病情许可的情况下,应在有效控制出血后,尽可能清除病灶,解除胆管梗阻,建立通畅的胆道内、外引流。
手术指征[45]:(1)经积极非手术治疗不能控制的胆道出血;(2)胆道大出血而致失血性休克者;(3)胆道大出血,胆管内存在较明确的原发病灶者。
合理选择手术方式是提高疗效的关键。应根据术前检查及术中细致的探查找出原发病灶和出血部位,选择合理的手术方式,常用的方法:(1)胆囊切除术:适用于胆道出血来自胆囊病变者;(2)胆总管切开探查,“T”型管引流术:对于胆道出血合并有明显胆管内病灶者,如胆管结石、胆道严重感染者,可行胆总管探查,直视下缝扎止血“T”型管引流,除去病灶,解除梗阻,充分引流感染的胆汁,还可应用抗菌素局部反复冲洗,从而达到治疗出血的目的;(3)肝门部胆管癌切除胆管空肠R-Y吻合术:适用于肝门部胆管癌致胆道出血,肿瘤未侵犯门静脉者;(4)肝动脉结扎适用于:① 阻断肝动脉出血即停止者;② 术中出血停止不能明确出血灶者;③ 肝内胆管大出血来自动脉、胆管瘘者;④ 患者有肝胆系统原发灶,而一般情况差,不能耐受手术,但阻断肝动脉后出血停止者。肝动脉结扎方法较多,肝固有动脉结扎操作容易,未见引起肝坏死、肝昏迷等。若出血部位明确,肝门解剖方便,而患者全身情况允许,可行肝右或肝左动脉结扎,因肝右或肝左动脉结扎,既能达到止血目的,且对肝功能影响不大;(5)肝叶或肝段切除:肝叶切除是治疗胆道出血的一种有效方法。病灶局限于一侧肝内而其他方法治疗无效时,可行肝叶或肝段切除,既能控制出血,又可去除病灶。肝肿瘤性出血尤适合肝叶切除,无法切除肿瘤时行肝动脉结扎。
4.3TAE在过去,对于胆道出血的确定和定位多通过手术探查。但如果手术时出血已停止,术中不易确定出血部位,故外科治疗,有一定盲目性,疗效不确切。且对于胆道大出血患者来说,手术耐受性差,死亡率及并发症发生率均较高。文献资料[38, 46]显示,经导管动脉栓塞术与手术治疗相比,具有快速、高效、安全、准确等优点:(1)成功率高,TAE治疗胆道出血的成功率为75%~100%[3];(2)栓塞前预先的内脏动脉造影是胆道出血最佳的诊断方法,此法除可肯定诊断明确病灶部位外,尚可了解某些血管病变的局部情况,尤其对剖腹探查时难以发现的肝中央部病变具有特殊的诊断价值;(3)其操作安全、创伤小、可重复使用,无需麻醉及开腹手术,可免除手术痛苦和危险,尤其是休克和黄疸患者,栓塞后再出血等并发症明显低于手术;(4)曾行肝胆系统手术者,腹腔炎症粘连,手术探查并非易事,而栓塞法则可避免手术探查造成的损伤;(5)栓塞可及时可靠地止血,并可留置导管重复栓塞,可有效防止发生再出血。
TAE适用于以下几种情况:(1)胆道大出血,患者不能耐受手术;(2)医源性胆道出血,多见于PLB、PTC、PTBD等处理后的胆道出血;(3)手术后胆道出血,难以承受再次手术;(4)胆道出血经手术止血后再出血,肝动脉造影可以进一步了解有无解剖上的变异,肝动脉结扎是否有效,有无异常的侧支交通,并可选择性地将出血的血管栓塞;(5)在行决定性手术前暂时地控制出血。
不宜行栓塞治疗的情况:(1)不能达到超选择性插管者;(2)栓塞可能导致广泛肝缺血者(门静脉血栓形成);(3)碘过敏者;(4)肝硬化门静脉高压者,栓塞术后可导致肝功能不良者,应慎用;(5)合并肝脓肿者。
尽管血管造影和介入栓塞被公认为是胆道出血决定性的诊断和治疗方法。但介入栓塞只能止血,如仍存在胆管结石或梗阻等原发病,有可能导致顽固性、复发性胆道出血,其根本仍是对原发病的治疗。
4.4ERCPERCP是胆胰疾病的重要诊治手段。对于胆道出血的患者,可根据出血原因、出血速度、出血量、胆道情况等不同,联合或分别采取:去甲肾上腺素盐水冲洗、内镜下十二指肠乳头括约肌切开术(endoscopic duodenal sphincterotomy, EST)、内镜下胆道取石术、内镜下鼻胆管引流术(endoscopic nasobiliary drainage, ENBD)、内镜下胆道支架引流术(endoscopic retrograde biliary stent drainage, ERBD)、RFA、覆膜自扩张金属支架(covered self-expandable metal stent, CSEMS)等,进行止血及原发病治疗,并可动态观察治疗后的病情变化。
多数胆道出血的死亡原因为快速进展的原发病,而非出血本身所致[40]。非医源性胆道出血大多伴有结石、感染、肿瘤等原发病,治疗上不但需要止血,更要对原发病进行处理以改善预后。因此,ERCP在对非医源性胆道出血的治疗上具有明显的优势。如胆石症致胆道出血可予EST+胆道取石术,去除病因后,大部分胆道出血因此而自行停止,必要时可留置鼻胆管引流胆汁;胆道感染致胆道出血,予清理胆道,留置鼻胆管引流胆汁,若合并胆道狭窄,可予球囊扩张胆道或留置支架,既可以保持引流通畅,也可以起到压迫止血的作用;肿瘤引起的胆道出血,可行RFA对肿瘤组织进行烧灼,热凝止血的同时也可以使肿瘤组织坏死脱落,解除部分梗阻[40]。理论上ENBD和ERBD均可保持胆道通畅,但在胆道出血的治疗上,ENBD优于ERBD,因为ENBD可直接观察胆汁引流量、血液颜色、出血速度等,也可冲洗胆道,并可再次造影检查,有助于决定是否再次行ERCP治疗,且费用也较低。
相对于TAE,ERCP不但能进行止血治疗,还能保持胆道引流通畅,对原发病行进一步的处理。虽然一般认为胆道大出血首选TAE或手术治疗,但也有研究[19,47-48]表明,ERCP置入覆膜金属支架治疗大量胆道出血,取得良好的效果,提示ERCP可广泛应用于临床上治疗胆道出血。
4.5PTBDPTBD是一把双刃剑,既可以在操作中引起胆道出血,也可以通过置入引流管解除胆道梗阻,注入去甲肾上腺素、血凝酶、抗生素等药物进行相应的治疗[49]。必要时甚至可置入支架压迫止血或保持胆道通畅引流。
4.6经皮注射血凝酶(percutaneousthrombininjection,PTI) 目前,PTI应用于外周假性动脉瘤预防和治疗的有效性已经得到证实,且已有许多应用于肝动脉假性动脉瘤的案例[50]。若假性动脉瘤位于肝内远端动脉分支,PTI比TAE有明显的优势,因为PTI能到达TAE所不能到达的细小出血血管,能尽量避免栓塞较大的动脉[51-52]。
综上所述,胆道出血是一个复杂的疾病,临床上仍较少见,如能保持高度警惕,诊断并不困难,尤其在外伤、肝胆系手术后、肝胆系影像学穿刺引流术后、严重胆道感染的病例。在做出正确的诊断后,应根据胆道出血的不同病理特点、病因及患者的一般情况,选择合适的治疗方法及措施,才能获得满意的治疗效果。
[1] GREEN M H, DUELL R M, JOHNSON C D, et al. Haemobilia [J]. Br J Surg, 2001, 88(6): 773-786.DOI: 10.1046/j.1365-2168.2001.01756.x.
[2] GANDHI V, DOCTOR N, MARAR S, et al. Major hemobilia--experience from a specialist unit in a developing country [J].Trop Gastroenterol, 2011, 32(3): 214-218.
[3] CHIN M W, ENNS R. Hemobilia [J]. Curr Gastroenterol Rep, 2010, 12(2): 121.DOI: 10.1007/s11894-010-0092-5.
[4] SANDBLOM P. Hemobilia (biliary tract hemorrhage): history, diagnosis, and treatment [M]. Springfield, IL: Charles C Thomas, 1972.
[5] YOSHIDA J, DONAHUE P E, NYHUS L M. Hemobilia: review of recent experience with a worldwide problem [J]. Am J Gastroenterol, 1987, 82(5): 448-453.
[6] ZHOU H B. Hemobilia and other complications caused by percutaneous ultrasound-guided liver biopsy [J]. World J Gastroenterol, 2014, 20(13): 3712-3715. DOI: 10.3748/wjg.v20.i13.3712.
[7] 张瑶, 杨学平, 王连双, 等. 彩色多普勒超声引导下肝脏活组织检查术并发症的防治[J]. 中国肝脏病杂志《电子版》, 2016, 8(2):68-71.DOI: 10.3969/j.issn.1674-7380.2016.02.015.
ZHANG Y, YANG X P, WANG L S, et al.Prevention of complications in liver biopsy guided by color Doppler sonography [J].Chinese Journal of Liver Diseases(Electronic Version), 2016, 8(2): 68-71. DOI: 10.3969/j.issn.1674-7380.2016.02.015.
[8] COPEL L, SOSNA J, KRUSKAL J B, et al. Ultrasound-guided percutaneous liver biopsy: indications, risks, and technique [J]. Surg Technol Int, 2003, 11: 154-160.
[9] MARAKIS G N, PAVLIDIS T E, BALLAS K, et al. Major complications during laparoscopic cholecystectomy[J]. Int Surg, 2007, 92(3): 142-146.
[10] BIN TRAIKI T A, MADKHALI A A, HASSANAIN M M. Hemobilia post laparoscopic cholecystectomy [J]. J Surg Case Rep, 2015, 2015(2): pii: rju159.DOI: 10.1093/jscr/rju159.
[11] PETROU A, BRENNAN N, SOONAWALLA Z, et al. Hemobilia due to cystic artery stump pseudoaneurysm following laparoscopic cholecystectomy: case presentation and literature review [J]. Int Surg, 2012, 97(2): 140-144.DOI: 10.9738/CC52.1.
[12] DEMYTTENAERE S V, HASSANAIN M, HALWANI Y, et al. Massive hemobilia [J]. Can J Surg, 2009, 52(4): E109-E110.
[13] PARK T Y, LEE S K, NAM K, et al. Spontaneous hemobilia after liver transplantation: frequency, risk factors, and outcome of endoscopic management [J].J Gastroenterol Hepatol, 2017, 32(3): 583-588.DOI: 10.1111/jgh.13497.
[14] MASCI E, TOTI G, MARIANI A, et al. Complications of diagnostic and therapeutic ERCP: a prospective multicenter study[J]. Am J Gastroenterol, 2001, 96(2): 417-23. DOI: 10.1111/j.1572-0241.2001.03594.x.
[15] HYUN D, PARK K B, HWANG J C, et al. Delayed, life-threatening hemorrhage after self-expandable metallic biliary stent placement: clinical manifestations and endovascular treatment [J]. Acta Radiol, 2013, 54(8): 939-943.DOI: 10.1177/0284185113485501.
[16] INOUE H, TANO S, TAKAYAMA R, et al. Right hepatic artery pseudoaneurysm: rare complication of plastic, biliary stent insertion [J]. Endoscopy, 2011, 43 Suppl 2 UCTN: E396. DOI: 10.1055/s-0030-1256942.
[17] NAM J G, SEO Y W, HWANG J C, et al. Massive hemobilia due to hepatic arteriobiliary fistula during endoscopic retrograde cholangiopancreatography: an extremely rare guidewire-related complication [J]. J Korean Soc Radiol, 2015, 72(5): 348-351.DOI: 10.3348/jksr.2015.72.5.348.
[18] KAWAKUBO K, ISAYAMA H, TAKAHARA N, et al. Hemobilia as a rare complication after endoscopic ultrasound-guided fine-needle aspiration for hilar cholangiocarcinoma [J]. Endoscopy, 2011, 43 Suppl 2 UCTN: E334-E335.DOI: 10.1055/s-0030-1256783.
[19] BAGLA P, ERIM T, BERZIN T M, et al. Massive hemobilia during endoscopic retrograde, cholangiopancreatography in a patient with cholangiocarcinoma: a case, report [J]. Endoscopy, 2012, 44 Suppl 2 UCTN: E1.DOI: 10.1055/s-0030-1256604.
[20] LAYEC S, D'HALLUIN P N, PAGENAULT M, et al. Massive hemobilia during extraction of a covered self-expandable metal stent in a patient with portal hypertensive biliopathy [J]. Gastrointest Endosc, 2009, 70(3): 555-556. DOI: 10.1016/j.gie.2009.04.051.
[21] LUU M B, DEZIEL D J. Unusual complications of gallstones [J]. Surg Clin North Am, 2014, 94(2): 377-394.DOI: 10.1016/j.suc.2014.01.002.
[22] SIDDIQUI N A, CHAWLA T, NADEEM M. Cystic artery pseudoaneurysm secondary to acute cholecystitis as cause of haemobilia [J]. BMJ Case Rep, 2011, 2011, pii: bcr0720114480. DOI: 10.1136/bcr.07.2011.4480.
[23] DE QUINTA FRUTOS R, MOLES MORENILLA L, DOCOBO DURANTEZ F, et al. Hemobilia secondary to chronic cholecystitis [J]. Rev Esp Enferm Dig, 2004, 96(3): 221-225.
[24] MERSICH T, ZARND A, EGYED Z, et al. Hemobilia as a rare vascular complication of chronic pancreatitis [J]. Magy Seb, 2005, 58(3): 187-189.
[25] ALQAHTANI H H. Hemobilia due to liver abscess. A rare cause of massive upper gastrointestinal bleeding [J]. Saudi Med J, 2014, 35(6): 604-606.
[26] PHILIP S, KAMYAB A, JACOBS M. Biliary cystadenocarcinoma: an unusual cause for recurrent hemobilia [J]. Int Surg, 2015, 100(4):702-704.DOI: 10.9738/INTSURG-D-14-00101.1.
[27] COULIER B, MALDAGUE P, RAMBOUX A, et al. Mass-forming intrahepatic cholangiocarcinoma presenting with painful obstructive hemobilia [J]. JBR-BTR, 2014, 97(6): 366-369.
[28] ZHENG X, BO Z Y, WAN W, et al. Endoscopic radiofrequency ablation may be preferable in the management of malignant biliary obstruction: a systematic review and meta-analysis[J]. J Dig Dis, 2016, 17(11): 716-724.DOI: 10.1111/1751-2980.12429.
[29] CHO S H, LEE H Y, KIM H S. Anticoagulant therapy-induced gallbladder hemorrhage after cardiac valve replacement [J]. Korean J Thorac Cardiovasc Surg, 2015, 48(6):432-434.DOI: 10.5090/kjtcs.2015.48.6.432.
[30] BURNS L, SLAKEY D P. Laparoscopic management of massive hemobilia from an intrahepatic aneurysm [J]. JSLS, 2009, 13(13): 60-63.
[31] EUM J B, BANG S J, HWANG J C, et al. Hemobilia from pancreatic arteriovenous malformation: successful treatment with transportal coil embolization of draining veins [J]. Korean J Gastroenterol, 2007, 50(4): 265-270.
[32] HAYASHI S, BABA Y, UENO K, et al. Small arteriovenous malformation of the common bile duct causing hemobilia in a patient with hereditary hemorrhagic telangiectasia [J]. Cardiovasc Intervent Radiol, 2008, 31(2): 131-134.DOI: 10.1007/s00270-007-9098-2.
[33] BATTULA N, TSAPRALIS D, MORGAN M, et al. Spontaneous liver haemorrhage and haemobilia as initial presentation of undiagnosed polyarteritis nodosa [J]. Ann R Coll Surg Engl, 2012, 94(4):e163-e165.DOI: 10.1308/003588412X13171221590737.
[35] 周秀芳. 胆道出血的超声诊断与分析[J]. 中国卫生产业, 2014,(4): 120, 122.
[36] FENG W, YUE D, ZAIMING L, et al. Hemobilia following laparoscopic cholecystectomy: computed tomography findings and clinical outcome of transcatheter arterial embolization[J]. Acta Radiol, 2017, 58(1): 46-52.DOI: 10.1177/0284185116638570.
[37] CASAZZA I, GUGLIETTA M A, ARGENTO G. Magnetic resonance cholangiopancreatography in the diagnosis of haemobilia [J]. Case Rep Radiol, 2013, 2013: 792109.DOI: 10.1155/2013/792109.
[38] FENG W, YUE D, ZAIMING L, et al. Iatrogenic hemobilia: imaging features and management with transcatheter arterial embolization in 30 patients [J]. Diagn Interv Radiol, 2016, 22(4): 371-377.DOI: 10.5152/dir.2016.15295.
[39] SIBULESKY L, RIDLEN M, PRICOLO V E. Hemobilia due to cystic artery pseudoaneurysm [J]. Am J Surg, 2006, 191(6):797-798. DOI: 10.1016/j.amjsurg.2005.07.041.
[40] KIM K H, KIM T N. Etiology, clinical features, and endoscopic management ofhemobilia: a retrospective analysis of 37 cases [J]. Korean J Gastroenterol, 2012, 59(4): 296-302.
[41] TRAKARNSANGA A, SRIPRAYOON T, AKARAVIPUTH T, et al. Massive hemobilia from a ruptured hepatic artery aneurysm detected by endoscopic ultrasound (EUS) and successfully treated [J]. Endoscopy, 2010, 42 Suppl 2(12): E340-E341.DOI: 10.1055/s-0030-1255940.
[42] KONERMAN M A, ZHANG Z, PIRAKA C.Endoscopic ultrasound as a diagnostic tool in a case of obscure hemobilia [J]. ACG Case Rep J, 2016, 3(4): e170.DOI: 10.14309/crj.2016.143.
[43] SEICEAN A. Endoscopic ultrasound in the diagnosis and treatment of upper digestive bleeding: a useful tool [J]. J Gastrointestin Liver Dis, 2013, 22(4): 465-469.
[44] SIU W T, CHAU C H, KA BO LAW B, et al. Non-operative management of endoscopic iatrogenic haemobilia: case report and review of literature [J]. Acta Gastroenterol Belg, 2005, 68(4): 428-431.
[45] MURUGESAN S D, SATHYANESAN J, LAKSHMANAN A, et al. Massive hemobilia: adiagnostic and therapeutic challenge [J]. World J Surg, 2014, 38(7): 1755-1762. DOI: 10.1007/s00268-013-2435-5.
[46] MARYNISSEN T, MALEUX G, HEYE S, et al. Transcatheter arterial embolization for iatrogenic hemobilia is a safe and effective procedure: case series and review of the literature [J]. Eur J Gastroenterol Hepatol, 2012, 24(8): 905-909. DOI: 10.1097/MEG.0b013e328354ae1b.
[47] LAYEC S, D′HALLUIN P N, PAGENAULT M, et al. Massive hemobilia during extraction of a covered self-expandable metal stent in a patient with portal hypertensive biliopathy [J]. Gastrointest Endosc, 2009, 70(3): 555-556.DOI: 10.1016/j.gie.2009.04.051.
[48] RERKNIMITR R, KONGKAM P, KULLAVANIJAYA P. Treatment of tumor associated hemobilia with a partially covered metallic stent [J]. Endoscopy, 2007, 39 Suppl 1:E225-E225.DOI: 10.1055/s-2007-966555.
[49] NAVULURI R. Hemobilia[J]. Semin Intervent Radiol, 2016, 33(4): 324-331.DOI: 10.1055/s-0036-1592321.
[50] KRUEGER K, ZAEHRINGER M, STROHE D, et al. Postcatheterization pseudoaneurysm: results of US-guided percutaneous thrombin injection in 240 patients [J]. Radiology, 2005, 236(3): 1104-1110.DOI: 10.1148/radiol.2363040736.
[51] LORENZ J M, VAN BEEK D, VAN HA T G, et al. Percutaneous thrombin injection in an infant to treat hepatic artery pseudoaneurysm after failed embolization [J]. Pediatr Radiol, 2013, 43(11): 1532-1535.DOI: 10.1007/s00247-013-2705-2.
[52] FRANCISCO L E, ASUNCIN L C, ANTONIO C A, et al. Post-traumatic hepatic artery pseudoaneurysm treated with endovascular embolization and thrombin injection [J]. World J Hepatol, 2010, 2(2): 87-90.DOI: 10.4254/wjh.v2.i2.87.

