二甲双胍对HER2阳性胃癌细胞的增殖抑制作用
欧阳伟,罗玉君,洪嘉茹
广东省深圳市龙岗区人民医院内科,广东 深圳 518172
作为我国人群中的高发肿瘤,胃癌的检测和治疗已经经历了几十年的发展,但由于胃癌发病的隐秘性,且作为致癌因素的幽门螺杆菌在我国人群的阳性率居高不下,这就导致了胃癌的治疗状况和临床预后差强人意[1]。随着对胃癌致病条件和发病因素研究的不断深入,我们发现部分胃癌患者存在与乳腺肿瘤交叉阳性的肿瘤相关基因HER2,鉴于乳腺肿瘤的治疗经验,已经临床应用了HER2针对性抗体曲妥珠单抗,并取得了一定疗效,但相比乳腺肿瘤的治疗效果疗效较差[2]。以上这种状况促使消化医师寻找能与曲妥珠单抗配伍的药物并提高曲妥珠单抗的抗肿瘤杀伤作用,在此过程中,从对胃癌合并糖尿病患者的治疗资料出现灵感,二甲双胍的使用改善了HER2阳性胃癌患者的临床治疗效果和临床预后。为探讨二甲双胍对HER2阳性胃癌细胞的增殖抑制作用,现进行针对性实验,具体报道如下。
1 材料与方法
1.1材料HER2阳性胃癌细胞株N87系购自中国科学院北京细胞库;DEME培养基购自美国HyClone 公司;二甲双胍购自上海信谊有限公司;曲妥珠单抗购自北京市康德乐药房;盐酸四咪唑购自江苏康乐新材料科技有限公司。
1.2细胞培养将HER2阳性胃癌细胞株N87细胞置于质量浓度为100 g/L胎牛血清的DEME培养基中,将温度调至37 ℃,而后将培养基置于37 ℃、体积分数为5%的CO2条件下的细胞培养箱内培养(温度为37 ℃,湿度为60%)。培养基更换速度为2 d/次。
1.3药物干预对照组:使用PBS缓冲液将曲妥珠单抗溶解配成50 μg/L的液体,按照上述细胞培养方法培养24 h、48 h、72 h后观察细胞增殖情况。研究组:使用PBS缓冲液将曲妥珠单抗溶解配成4 mg/L的液体,而后使用此溶液将二甲双胍溶解稀释配成2 mg/L,而后再稀释成50 μg/L,按照上述细胞培养方法培养24 h、48 h、72 h后观察细胞增殖情况。
1.4观察指标用四唑盐比色法检测24 h、48 h、72 h HER2阳性胃癌细胞存活和生存状况:选择对数期的HER2阳性胃癌细胞制备成单个细胞悬液,调整细胞浓度为(5.0~10.0)×104ml-1,于96孔板中,每孔加入细胞悬液100 ml,外围孔加入100 ml PBS缓冲液,将96孔板置于37 ℃、体积分数为5%的CO2条件下的细胞培养箱内培养,待细胞贴壁后按实验设计的药物干预,在加药后24 h、48 h、72 h更换培养基,加入含有CCK-8的培养基(1∶10的DEME),然后于培育箱中避光孵育2.5 h,以3 000 r/min的转速离心10 min,去除上清,用酶标仪测定各孔吸光度值。Western blotting法检测HER2阳性胃癌细胞株中细胞Cyclin D1、PI3K、mTOR三种蛋白的表达情况,分析二甲双胍对HER2阳性胃癌细胞的增殖抑制作用。

2 结果
HER2阳性胃癌细胞体外培养进行良好。关于肿瘤细胞抑制作用,研究组24 h、48 h、72 h HER2阳性胃癌细胞存活率低于对照组,肿瘤相关蛋白表达情况低于对照组,差异均有统计学意义(P<0.05)(见表1~2)。
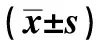
表1 HER2阳性胃癌细胞存活状况对比分析Tab 1 Comparison of survival of HER2 positive %
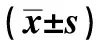
表2 肿瘤相关蛋白表达状况比较Tab 2 Comparison of expressions of tumor associated
3 讨论
胃癌是临床常见的恶性程度较高的恶性肿瘤,早期多无明显临床表现,且具有淋巴转移早、复发率高的临床特点,给人类生命和健康造成了严重威胁[3]。胃癌的发生与癌基因激活、抑癌基因失活等因素有关,且是一个多阶段、多因素逐渐推进的过程[4]。根据对HER2阳性胃癌合并糖尿病患者的治疗资料,治疗过程中为起到降糖效果而使用二甲双胍,与单纯HER2阳性胃癌患者的治疗效果综合比较,合并糖尿病的患者治疗效果优于单纯HER2阳性胃癌患者,因此,我们推断二甲双胍对HER2阳性胃癌细胞存在影响[5]。HER2通常发生于乳腺癌患者,本质为人类表皮生长因子受体,同时具有酪氨酸激酶活性,在接受表皮生长因子刺激后,会继发激活多种促进细胞增殖的局部因子和化学物质,可导致局部细胞的非调控性增长,进而导致肿瘤的出现。目前对于HER2阳性细胞,其针对性抗体曲妥珠单抗已经在临床中得到普遍应用,通过封闭HER2受体,阻断其促进局部细胞非调控性生长增殖的效果,起到肿瘤抑制作用和控制转移作用,其在乳腺癌的使用中,在协同其他肿瘤杀伤化疗药物作用的同时,可提高HER2阳性肿瘤细胞对化疗药物的杀伤作用,提高化疗反应性,并改善临床预后[6]。鉴于二甲双胍可提高曲妥珠单抗治疗HER2阳性胃癌患者的肿瘤抑制作用,考虑二甲双胍可能存在增强曲妥珠单抗与HER2受体之间的结合力,调控HER2阳性胃癌细胞的细胞增殖周期,为其他化疗药物发挥作用提供准备;或是二甲双胍对于HER2阳性胃癌细胞存在某种细胞杀伤作用起到直接抑制作用,这极大地刺激我们加强对二甲双胍对HER2阳性胃癌细胞的作用机制,将更好地应用于临床[7]。
对比分析单纯曲妥珠单抗组与曲妥珠单抗联合二甲双胍组治疗的HER2阳性胃癌细胞的存活状况,发现在24 h、48 h、72 h 3个时间点,后者相比前者肿瘤细胞的增殖得到明显的抑制,并结合两组肿瘤细胞的肿瘤相关蛋白表达结果提示,曲妥珠单抗联合二甲双胍组体外细胞的Cyclin D1、PI3K、mTOR三种物质表达量明显低于单纯曲妥珠单抗组,综合HER2阳性胃癌的发病机制对二甲双胍抑制HER2阳性胃癌细胞作用分析如下:(1)二甲双胍对细胞增殖具有调控作用,从二甲双胍组Cyclin D1蛋白表达量明显降低来看,二甲双胍通过抑制细胞周期蛋白及细胞周期蛋白控制的激酶表达量来看,同时,我们认为,其还可通过诱导细胞分裂从G0期进入S期,但阻止细胞分裂从S期进入G1期,将HER2阳性胃癌细胞阻滞与细胞分裂S期,增大其对曲妥珠单抗及其他化疗药物的敏感性,进而协同提高其他药物的抗肿瘤作用[8];(2)二甲双胍可抑制胞内磷脂醇激酶PI3K,而PI3K又是细胞生长因子HER2受体的重要下游产物,故二甲双胍可通过阻断HER2阳性胃癌细胞的中间产物,阻断HER2受体诱导的多种细胞增殖信号物质的激活和作用,其中,最重要的是丝-苏氨酸激酶mTOR,二甲双胍可通过控制mTOR的表达,同时通过中间物质肿瘤抑制因子tuberin的激活作用间接抑制mTOR的活性,进而抑制蛋白质尤其是细胞骨架蛋白的合成进而影响细胞增长和增殖[9]。
此外,二甲双胍对于HER2阳性胃癌细胞的增殖抑制作用还存在其他作用机制。二甲双胍可通过调控激活AMPK的过程起到磷酸化调节细胞代谢酶,影响细胞增殖复制所需要的酶类,控制细胞增殖所需要的能量和代谢酶,进而起到增殖抑制作用[10]。二甲双胍通过激活调控机体凋亡蛋白的表达对HER2阳性胃癌细胞的增殖起到抑制杀伤作用[11],通过抑制白介素-6和转化生长因子及其上皮间质转化作用阻止肿瘤细胞的增殖作用,此两方面作用可侧面协同二甲双胍对HER2阳性胃癌细胞的增殖抑制作用[12]。
综上所述,在HER2阳性胃癌细胞的作用方面,二甲双胍更能控制肿瘤细胞的增殖状态,降低肿瘤相关蛋白的表达状况,起到肿瘤细胞的增殖抑制作用[10]。随着胃癌发病机制和治疗药理作用研究的不断深入,相信二甲双胍在HER2阳性胃癌细胞增殖抑制方面的优势将被不断发现,二甲双胍在HER2阳性胃癌患者肿瘤治疗中的应用将会得到广泛推广。
[1] 陈敏捷, 吴清明. GRP78 在胃癌中表达水平及沉默表达后对人胃癌 SGC-7901/DDP 细胞增殖和凋亡的影响[J]. 胃肠病学和肝病学杂志, 2017, 26(3): 245-250. DOI: 10.3969/j.issn.1006-5709.2017.03.002.
CHEN M J, WU Q M. Expression of GRP78 in gastric cancer and its effect on proliferation and apoptosisof human gastric cancer cell line SGC-7901/DDP [J]. Chin J Gastroenterol Hepatol, 2017, 26(3): 245-250. 10.3969/j.issn.1006-5709.2017.03.002.
[2] ETO K, IWATSUKI M, WATANABE M, et al. The microRNA-21/PTEN pathway regulates the sensitivity of HER2-positive gastric cancer cells to trastuzumab [J]. Ann Surg Oncol, 2014, 21(1): 343-350. DOI: 10.1245/s10434-013-3325-7.
[3] 汪博, 巨荣侠, 付建华. TPX2 基因在胃癌中的表达及其对胃癌细胞增殖凋亡的影响和机制研究[J]. 胃肠病学和肝病学杂志, 2017, 26(12): 1355-1359. DOI: 10.3969 /j.issn.1006-5709.2017.12.009.
WANG B, JU R X, FU J H. Expression of TPX2 gene in gastric cancer and its mechanism of proliferation andapoptosis in gastric cancer cells [J]. Chin J Gastroenterol Hepatol, 2017, 26(12): 1355-1359. DOI: 10.3969 /j.issn.1006-5709.2017.12.009.
[4] 罗文杰, 刘明华. 靶向抑制胃癌细胞中 TROP2 基因的表达对胃癌细胞增殖及凋亡的影响研究[J]. 胃肠病学和肝病学杂志, 2017, 26(12): 1345-1349. DOI: 10.3969 /j.issn.1006-5709.2017.12.007.
LUO W J, LIU M H. The effect of targeting inhibition of TROP2 gene expression on the proliferation and apoptosis of gastric cancer cells [J]. Chin J Gastroenterol Hepatol, 2017, 26(12): 1345-1349. DOI: 10.3969 /j.issn.1006-5709.2017.12.007.
[5] 王一, 向勇平, 刘丹丹, 等. 二甲双胍对ALDH+胃癌干细胞的抑制作用及其机制[J]. 解放军医学, 2018, 43(1): 7-11.DOI:10.11855/j.issn.0577-7402.2018.01.02.
WANG Y, XIANG Y P, LIU D D, et al.Inhibitory effect of metformin on aldehyde dehydrogenase positive gastric cancer stem cells and its mechanicm [J]. Med J Chin PLA, 2018, 43(1): 7-11.DOI:10.11855/j.issn.0577-7402.2018.01.02.
[6] GOMEZ-MARTíN C, LOPEZ-RIOS F, APARICIO J, et al. A critical review of HER2-positive gastric cancer evaluation and treatment: from trastuzumab, and beyond [J]. Cancer Lett, 2014, 351(1): 30-40. DOI: 10.1016/j.canlet.2014.05.019.
[7] OSHIMA Y, TANAKA H, MURAKAMI H, et al. Lapatinib sensitivities of two novel trastuzumab-resistant HER2 gene-amplified gastric cancer cell lines [J]. Gastric Cancer, 2014, 17(3): 450-462. DOI: 10.1007/s10120-013-0290-6.
[8] HA S Y, LEE J, JANG J, et al. HER2-positive gastric cancer with concomitant MET and/or EGFR overexpression: a distinct subset of patients for dual inhibition therapy [J]. Int J Cancer, 2015, 136(7): 1629-1635. DOI: 10.1002/ijc.29159.
[9] MATSUMOTO T, SASAKO M, MIZUSAWA J, et al. HER2 expression in locally advanced gastric cancer with extensive lymph node (bulky N2 or paraaortic) metastasis (JCOG1005-A trial) [J]. Gastric Cancer, 2015, 18(3): 467-475. DOI: 10.1007/s10120-014-0398-3.
[10] WANG H, WANG W, XU Y, et al. Aberrant intracellular metabolism of T-DM1 confers T-DM1 resistance in HER2-positive gastric cancer cells [J]. Cancer Sci, 2017, 108(7): 1458-1468. DOI: 10.1111/cas.13253.
[11] PARK J, CHOI Y, KO Y S, et al. FOXO1 suppression is a determinant of acquired lapatinib-resistance in HER2-positive gastric cancer cells through MET upregulation [J]. Cancer Res Treat, 2018, 50(1): 239-254. DOI: 10.4143/crt.2016.580.
[12] YI J H, KANG J H, GYU H I, et al. A retrospective analysis for patients with HER2-positive gastric cancer who were treated with trastuzumab-based chemotherapy: in the perspectives ethnicity and histology [J]. Cancer Res Treat, 2016, 48(2): 553-560.DOI: 10.4143/crt.2015.155

