青少年女性乳腺恶性叶状肿瘤内癌的临床病理诊断陷阱分析
秦 艳,陈 莹,周东华
南方医科大学附属佛山妇幼保健院病理科,广东 佛山 52800
乳腺叶状肿瘤(PTs),旧称叶状囊肉瘤[1],直至1981年世界卫生组织正式将其命名为“叶状肿瘤”[2]。2003年WHO新分类将其分为良性、交界性和恶性3个亚型[3]。叶状肿瘤在所有乳腺肿瘤中仅占不足0.5%;好发于中年妇女,中位发病年龄为43~45岁,<20岁很罕见[4];一般无明显症状或有轻度乳房胀痛;在诊断和治疗上都容易造成误诊、过度治疗和治疗不足等问题。PT内的上皮成分癌变称叶状肿瘤内癌,非常罕见,占PTs 0.4%~2%[5-6]。本文总结分析了青少年女性恶性叶状肿瘤内癌的临床病理资料,临床病理特点、诊断与鉴别诊断及治疗,提高对青少年女性恶性叶状肿瘤及恶性叶状肿瘤内癌的认识。
1 资料与方法
1.1 临床资料
患者,女性,18岁,无意中发现右乳中央区一肿块2年余,大小约5.0 cm×5.0 cm,活动度可,不伴红肿热痛,因家庭经济十分困难,未予特殊治疗,肿物缓慢增大,一直未曾就医,于2016年10月24日入住南方医科大学附属佛山市妇幼保健院。临床查体:右侧乳腺明显增大,表面皮肤菲薄,张力显著升高,伴局限性隆起,皮肤无橘皮样改变,无酒窝征,浅表静脉无怒张,无皮疹;右乳头乳晕受压变平,无溢液,未见皮疹及鳞屑;右乳可扪及一明显肿物,范围大小约20 cm×18 cm×15 cm,质韧、边界不清,形状不规则,表面见明显隆起,无压痛,与胸肌无固定,与表面皮肤无粘连。左侧乳腺外观正常,皮肤无橘皮样改变,无酒窝征和局限性隆起,浅表静脉无怒张,无皮疹和红肿;乳头无凹陷,无溢液,未见皮疹及鳞屑;左乳未扪及明显肿物。双侧腋窝、锁骨上窝未扪及肿大淋巴结。行乳腺B超检查示:右侧乳腺液实性包块,性质待定。术后恢复良好,随访至今患者一般情况良好,未见复发,长期疗效有待进一步随访观察。
1.2 方法
大体标本书页状切开并经4%中性福尔马林固定过夜,常规脱水、石蜡包埋、连续切片、HE染色。使用BenchMarkRGX全自动多功能组织病理检测系统,采用Ventana全自动免疫组化法。抗体均购自美国Roche公司。所有结果均经两名副主任医师以上仔细阅片并判读,病理诊断综合HE形态学及免疫组化结果。同时邀请中山大学附属肿瘤医院病理科吴秋良教授会诊。
2 结果
2.1 空芯针穿刺活检标本
巨检:灰白灰黄色细条索状组织一堆,共1.5 cm×0.5 cm×0.1 cm。镜检:镜下见少量乳腺小叶及腺泡结构,其余为均质红染坏死肿瘤细胞影。诊断:少许乳腺组织形态符合纤维上皮性肿瘤,考虑纤维腺瘤局灶梗死可能性大(图1)。
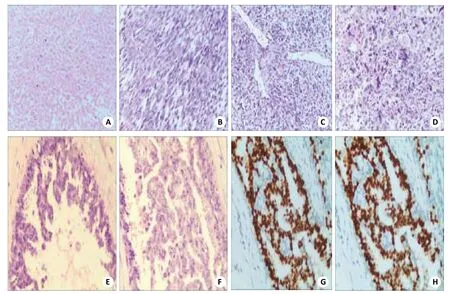
图1 手术标本
2.2 手术标本
巨检:送检灰白灰红色结节状肿物1个,19.5 cm×17.0 cm×15.0 cm,包膜完整,表面附皮肤组织,皮肤大小13.0 cm×2.7 cm,切开呈囊实性,实性为主,多彩状,见大量坏死,质嫩(图1A)。镜检:镜下见过度增生的梭形肿瘤细胞,细胞密度增加,排列致密,呈编织状、束状或漩涡状排列,其间散布单核或多核瘤巨细胞。肿瘤细胞多呈胖梭形,核卵圆形或不规则形、浅染,异型性十分明显,明显多形性,核分裂象多见,细胞丰富区最多可达35个/10 HPF,肿瘤间血管丰富。局灶区可见少量上皮细胞成分,小灶区导管上皮内细胞呈乳头状增生及少量立方或柱状的腺上皮细胞及肌上皮细胞组成的腺体结构。多灶伴有地图状坏死,边缘浸润性生长。肿瘤间质局部散在浆细胞和淋巴细胞为主的炎细胞浸润,并见血管增生和出血,肿瘤边界尚清。未见明显异源性分化(图1B~F)。
2.3 免疫组化
肿瘤细胞P16(+++),Desmin(+/-),Ki67 70%(+),ER(-),PR(+),P53 90%(+),CD10灶(+),Vimentin(+/-),CK5/6、CD34、CD117及S-100均(-)。导管内乳头状增生细胞ER(+++),PR(+++),Ki67(+5%),C-erbB-2(-),CK5/6(-)(图1G、H)
病理诊断:(右乳肿物)恶性叶状肿瘤伴局部乳腺低级别导管原位癌。
3 讨论
本例在空芯针穿刺标本诊断时出现误诊。诊断陷阱分析:患者女性,18岁,一侧乳腺肿物,病程长不伴红肿热痛,一方面由于肿物体积巨大,空芯针穿刺活检局限,正好穿到导管周围间质增生的坏死区域,另一方面由于诊断医师水平思考较局限,鉴于患者十分年轻,国内外报道年轻患者的叶状肿瘤少见,恶性叶状肿瘤更是罕见;当时诊断仅考虑纤维上皮性肿瘤,纤维腺瘤伴梗死可能性大,这个诊断给临床造成了一定困扰,所以考虑欠周全出现误诊。
叶状肿瘤是乳腺比较少见的肿瘤,占所有乳腺肿瘤0.3%~1%和乳腺纤维上皮肿瘤的2.5%。乳腺叶状肿瘤的病因及发病机制尚不十分清楚,任何年龄的女性都可能发生叶状肿瘤,多发的年龄阶段为体内激素分泌易紊乱期,在40多岁的妇女中常见。可能与乳腺纤维腺瘤有相似的发病因素,如雌激素分泌与代谢紊乱等。有研究提示有些叶状肿瘤是由先前存在纤维腺瘤进展而来,提出了叶状肿瘤起源于良性的上皮性纤维肿瘤的假说[7]。有研究认为上皮-间质相互作用在叶状肿瘤进展过程中起着重要作用[8-9],上皮-间质相互作用缺失,间质细胞不能接收来自上皮细胞的信号转导,可以自发地产生细胞信号,激活间质细胞Wnt信号传导通路,引起雌激素受体(ER)抗增生作用消失,导致间质增生、间质结构改变和肿瘤血管形成。有研究表明,叶状肿瘤间质成分能诱导上皮分化,这种分化能力包括上皮的化生及增生[10]。它的间质成分为单克隆性,系肿瘤性病变,而上皮可以是多克隆性也可以是单克隆性,这解释了在叶状肿瘤中可以观察到上皮成分的普通型增生、不典型增生和原位癌,甚至浸润性癌。一般认为,癌与叶状肿瘤来自不同的克隆。Macher等[11]对1例乳腺发生的恶性叶状肿瘤及其内导管原位癌与浸润性癌进行了11个微卫星位点分析,发现其浸润性癌、导管原位癌及间质成分在不同位点发生杂合子缺失,其中浸润性癌显示17q25、17q12和16q23位点,导管原位癌成分仅发生于16q23位点,而间质成分发生在22q13、17q25、17q12和16q23位点,因此认为叶状肿瘤内癌是一种碰撞瘤。
此外,上皮细胞出现染色体异常也可以引起一系列良恶性变化,如:染色体缺失3p14、3p21-p23,插入在染色体1q,涉及12q14、MDM2 基因、8p24和themyc基因等[12];与9p缺失相关的p16INK4A表达缺失[13];位于染色体4的FBXW7基因可重复含蛋白质7[14];TP53和D22S264基因丢失[15]等显示基因不稳定性。有研究认为HOXB13基因蛋白的表达与间质细胞异型性相关,可能参与恶性叶状肿瘤的发展[15]。也有研究显示,Survivin基因在多种恶性肿瘤细胞核和(或)胞浆表达,细胞质Survivin作为凋亡抑制因子,恶性叶状肿瘤的间质细胞比良性叶状肿瘤的间质细胞的细胞核表达Survivin更广泛[16]。
鉴别诊断:(1)乳腺纤维腺瘤:常见于20~35岁年轻妇女。纤维腺瘤与叶状肿瘤有着很多类似的临床特点,如肿瘤通常体积较大、快速生长及外观特点等,有时候与良性叶状肿瘤难以区分。区别在于间质细胞的丰富程度及间质细胞的异型性,纤维腺瘤的间质细胞较稀疏,分布均匀,且细胞无明显异型,核分裂象罕见;同一病例内间质通常是均质的。纤维腺瘤多为单侧发生,亦可见双侧多发,瘤体较小,通常直径1~3 cm,很少>5 cm,界限清楚,常有肉眼可见的裂隙样腔隙。镜下表现为间质和腺体分布规则协调有序,其中的腺体呈特征性扭曲改变,小管被覆的细胞不活跃。因此如果肿瘤镜下出现管腔增大、细胞增生活跃、导管增生、大汗腺化生等则应该慎重考虑纤维腺瘤的诊断。另外由于激素作用,肿瘤可在短期内迅速长大,导致瘤体部分或全部梗死。(2)导管周间质肉瘤:Burga等[17]于2003年报道并命名该类疾病。间质梭形细胞不同程度增生及不典型增生为主的病变,梭形细胞围绕开放的导管周围,缺乏叶状结构;梭形细胞不典型增生,核分裂象≥3个/10 HPF,浸润周围乳腺纤维脂肪组织;免疫组化CD34、Vimentin弥漫阳性。(3)幼年性纤维腺瘤:20岁以下女性多见,肿瘤平均2~3 cm,亦可大至20 cm以上。镜下特点为间质细胞和上皮细胞明显增生并呈束状排列,上皮呈管周型生长方式伴普通型导管增生,常发生旺炽型普通型导管上皮增生。可有少量核分裂象,一般无坏死及钙化。肿瘤与周围组织分界清楚。不要误诊为叶状肿瘤,尤其是恶性叶状肿瘤。(4)乳腺梭形细胞肉瘤:弥漫的异型梭形细胞构成,诊断的唯一依据是是否残留上皮成分,如果存在,更倾向于恶性叶状肿瘤;(5)梭形细胞化生性癌:无叶状肿瘤特征,上皮及梭形细胞之间常有过渡,免疫表型梭形细胞上皮标记阳性。
手术切除是叶状肿瘤及叶状肿瘤内癌主要治疗方式。良性叶状肿瘤一般采取局部广泛切除手术方式[18],美国国家癌症网络指南推荐手术切缘应该≥1 cm[19]。对于恶性叶状肿瘤及叶状肿瘤内癌,既往观点认为应采取乳腺单纯切除术。有研究显示局部扩大切除术可获得与单纯切除术5年生存率基本一致[20-21]。因为叶状肿瘤极少通过淋巴结转移[22-23],一般不需要行腋窝淋巴结清扫术。恶性叶状肿瘤对化疗、放疗均不敏感,一般不考虑术后辅助放化疗。辅助放疗不能提高总生存率和降低远处转移率[24-25],但有研究认为辅助放疗可降低叶状肿瘤局部复发率,因此对于手术切缘不足、不能确保切缘阴性或术后局部复发再行手术后的患者可考虑行术后辅助放疗[19]。
本例肿瘤小部分区域导管上皮显著增生,核具有非典型性,排列成微乳头状,核分裂象可见,即呈低级别导管原位癌改变,大部分区域导管上皮为良性改变,至于导管原位癌成分是叶状肿瘤中腺上皮成分的恶变(即癌肉瘤可能)或是两种肿瘤并存尚需进一步研究。总之,青春期女性出现恶性叶状肿瘤内癌十分罕见,组织学上的异质性是叶状肿瘤的关键病理特点,它也是上皮和间质增生的共同结果,肿瘤增长速度快,易出现肿瘤坏死,熟悉这个组织学特点对避免误诊很重要。
参考文献:
[1]Rosen PP .Rosen' s breast pathology[M].New York: Lippin-Cott-Ray,1996: 155-72.
[2]RO Weller.The International histological classification of tumors[C]//World Health Organization,1981,34(99): 555-74.
[3]Tavassoli F,Devilee P.Pathology&genetics,tumours of the breast and female genital organs[M].lyon: Larc Press,2003.
[4]Rosai J.Problems in breast pathology revisited preface[J].Semin Diagn Pathol,2010,27(1): 2-4.
[5]丁华野,张祥盛,步 宏,等.乳腺病理诊断和鉴别诊断[M].北京:人民卫生出版社,2014: 264-6.
[6]Abdul AM,Sullivan F,Kerin MJ,et al.Malignant phyllodes tumour with liposarcomatous differentiation,invasive tubular carcinoma and ductal and lobular carcinoma in situ:Case report and review of the literature[J].Patholog Res Int,2010,28(1): 501274-9.
[7]Barrio AV,Clark BD,Goldberg JI,et al.Clinicopathologic features and long-term outcomes of 293 phyllodes tumors of the breast[J].Ann Surg Oncol,2007,14(10): 2961-70.
[8]Karim RZ,Scolyer RA,Tse GM,et al.Pathogenic mechanisms in the initiation and progression of mammary phyllodes tumours[J].Pathology,2009,41(2): 105-17.
[9]Kwon JE,Jung WH,Koo JS.Molecules involved in epithelialmesenchymal transition and epithelial-stromal interaction in phyllodes tumors: implications for histologic grade and prognosis[J].Tumour Biol,2012,33(3): 787-98.
[10]金 华,郭红红,丁华野.乳腺叶状肿瘤内的小叶瘤变及微小浸润癌临床病理观察[J].诊断病理学杂志,2013,20(09): 560-3.
[11]Macher GS,Marme F,Goeppert B,et al.Invasive ductal breast cancer within a malignant phyllodes tumor:case report and assessment of clonality[J].Hum Pathol,2010,41(2): 293-6.
[12]Jones AM,Mitter R,Springall R,et al.A comprehensive genetic profile of phyllodes tumours of the breast detects important mutations,intra-tumoral genetic heterogeneity and new genetic changes on recurrence[J].J Pathol,2008,214(5): 533-44.
[13]Muller KE,Tafe LJ,de Abreu FB,et al.Benign phyllodes tumorof the breast recurring as a malignant phyllodes tumor and spindle cell metaplastic carcinoma[J].Hum Pathol,2015,46(2): 327-33.
[14]Hodges KB,Abdul KF,Wang M,et al.Evidence for nsformation of fibroadenoma of the breast to malignant phyllodes tumor[J].Appl Immunohistoehem Mol Morphol,2009,17(4): 345-50.
[15]Ang MK,Ooi AS,Thike AA,et al.Molecular classification of breast phyllodes tumors: validation of the histologic grading scheme and insights into malignant progression[J].Breast Cancer Res Treat,2011,129(2): 319-29.
[16]Hirano H, Matsushita K, Okimura A, et al. Nuclear survivin expression in stromal cells of phyllodes tumors and fibroadenomas of the breast[J].Anticancer Res,2014,34(3,SI): 1251-3.
[17]Burga AM,Tavassoli F.Periducttal stromal tumor:a rare lesion with low-grade sarcomatous behavior[J].Am J Surg Pathol,2003,27(9): 343-8.
[18]Liang MI,Ramaswamy B,Patterson CC,et al.Giant breast tumors:Surgical management of phyllodes tumors, potential for reconstructive surgery and a review of literature[J].World J Surg Oncol,2008,6(9): 117-24.
[19]Jang JH,Choi MY,Lee SK,et al.Clinicopathologic risk factors for the local recurrence of phyllodes tumors of the breast[J].Ann Surg Oncol,2012,19(8): 2612-7.
[20]Macdonald OK,Lee CM,Tward JD,et al.Malignant phyllodes tumor of the female breast:association of primary therapy causespecific survival from the Surveillance,Epidemiology,and End Results(SEER)program[J].Cancer,2006,107(9): 2127-33.
[21]Barth RJ, Wells WA, Mitchell SE, et al. A prospective,multiinstitutional study of adjuvant radiotherapy after resection of malignant phyllodes tumors[J].Ann Surg Oncol,2009,16(8):2288-94.
[22]Wei J,Tan YT,Cai YC,et al.Predictive factors for the local recurrence and distant metastasis of phyllodes tumors of the breast:a retrospective analysis of 192 cases at a single center[J].Chin J Cancer,2014,33(10): 492-500.
[23]Lenhard MS,Kahlert S,Himsl I,et al.Phyllodes tumour of the breast: Clinical follow-up of 33 cases of this rare disease[J].Eur J Obstet Gynecol Reprod Biol,2008,138(2): 217-21.
[24]Bousquet G,Marsiglia H.Phyllodes tumor of the breast[J].Int J Radiat Oncol Biol Phys,2008,70(2): 492-500.
[25]Spitaleri G,Toesca A,Botteri EA,et al.Breast phyllodes tumor: A review of literature and a single center retrospective series analysis[J].Crit Rev Oncol Hematol,2013,88(2): 427-36.