非前哨淋巴结转移预测模型对中国乳腺癌患者的验证价值
陆健伟,吴佩琪,江门市新会区妇幼保健院放射科,广东 江门 5900;深圳市盐田区人民医院放射科,广东 深圳 5808;广东省人民医院放射科,广东 广州 50080
作为乳腺癌患者最重要的预后因素之一,腋窝淋巴结有无转移,对乳腺癌患者的TNM分期十分重要[1]。直到20世纪90年代初,腋窝淋巴结清扫(ALND)仍在几乎所有乳腺癌患者中进行,以进行腋窝淋巴结分期,但ALND存在许多手术并发症,如血肿、感染以及淋巴水肿等[2-3]。前哨淋巴结(SLN)活检术在20世纪90年代初引进后,进行ALND的患者比例大大降低,这是由于SLN活检可以准确预测早期乳腺癌患者的腋窝淋巴结转移情况,减少ALND引起的手术并发症,因此已被广泛接受为临床腋窝触诊阴性乳腺癌患者的标准方法[4-8]。临床上,SLN活检发现转移阳性,则一般会进一步采用ALND[9]。然而,这些因SLN阳性而进行ALND的乳腺癌患者中,有40%~70%的患者在病理检查中没有发现非前哨淋巴结(non-SLN)有癌细胞转移[10-13]。因此,如何将SLN阳性而non-SLN阴性的患者区别开来,以避免ALND,是值得探究的临床问题。目前的一些研究发现,原发性肿瘤状况(如肿瘤大小、分级、脉管癌栓有无和激素受体的表达情况等)和前哨淋巴结的转移状况(阳性SLN的数量、阳性SLN占总切除SLN的比例等)等临床病理学资料可能是预测non-SLN转移的风险因子[10-14]。目前国内外已经建立了一些预测non-SLN转移的模型(如MSKCC模型等)[10-11,13,15],但这些模型大多是以西方国家人群为样本建立的模型,是否适用于中国等亚裔人群尚存在争议[10-15],而目前国内外针对中国乳腺癌患者建立的模型十分罕见[10]。本文的目的是验证这些模型在中国乳腺癌人群中的临床应用价值,并尝试建立基于中国乳腺癌患者人群的新的预测模型。
1 资料与方法
1.1 一般资料
回顾性分析我院2013年1月~2017年6月进行的SLN活检和ALND的乳腺癌患者的临床病理资料。纳入标准为:(1)进行SLN活检前未进行放化疗等治疗;(2)临床资料和病理组织学资料完整;(3)至少有1个SLN有转移;(4)有放化疗或手术等治疗前的钼靶资料。最终纳入220例乳腺癌患者作为研究对象。
1.2 检查方法及临床病理资料收集
采用GE Senographe DS全视野数字系统乳腺机,摄影部位采用标准头尾位(CC位)和内外斜位(MLO位),摄影内容必须包括整个乳房、腺体后脂肪、腋窝、胸大肌。观察淋巴结情况,根据淋巴结是否有形态学改变(如短径增大、纵横比减小)、密度改变(如淋巴门密度增高)和淋巴结融合(淋巴结外侵犯)等特征[16],将患者分为高度可疑转移组和低度可疑转移组。完善影像学检查后进行手术,所有患者均使用亚甲基蓝染料进行SLN标记,SLN是指从原发性肿瘤获得引流的第1站淋巴结,蓝染淋巴结被标记为SLN,其余淋巴结为non-SLN。将切除的SLN新鲜标本送检,经病理组织学检查(冰冻、HE染色或免疫组化检查)确认患者有至少1个SLN转移阳性者,则进一步行ALND,切除的non-SLN送检并进行常规石蜡包埋切片HE染色。病理检查结果的判读根据第6版AJCC乳腺癌分级指南[17]进行,并详细记录病理检查结果,包括原发肿瘤情况和淋巴结情况。
1.3 统计学分析
本研究分析了乳腺癌患者的临床、影像、病理资料中的15个特征变量,包括:年龄、钼靶、原发肿瘤大小、多灶性、组织学类型(浸润性导管癌,浸润性小叶癌等)、组织学分级、脉管癌栓有无、雌激素受体表达、孕激素受体表达、人表皮生长因子受体2受体、Ki 67表达、SLN总数量、阳性SLN数量、阴性SLN数量以及阳性SLN /总SLN的比例。对临床病理资料的单因素分析采用卡方检验(二分类变量)和Kruska l-Wallis秩和检验(等级变量、多分类变量)。然后采用多因素分析logistic回归分析筛选non-SLN转移风险的独立预测因子,并建立模型,计算每个患者的non-SLN的转移概率。本研究所验证的3个预测模型分别为:(1)由Van等[13]建立的MSKCC模型,登录其在线网页(http://nomograms.mskcc.org/breast/BreastAdditionalNonSLNMetastasisPage.aspx),输入患者临床病理指标即可得出患者non-SLN的转移概率;(2)由Chagpar等[11]建立的Louisville模型,根据原始文献报道的模型计算每个患者的non-SLN的转移概率;(3)由Chen等[10]建立的SCH模型,根据原始文献报道的模型计算每个患者的non-SLN的转移概率。绘制各个模型预测non-SLN转移的ROC曲线,并计算各个模型的AUC值和假阴性率(FNR),调整各模型的假阴性率至接近10%,计算各模型将病人归类到低风险组的百分比。使用SPSS 18.0进行上述统计分析,以P<0.05为差异有统计学意义。
2 结果
2.1 乳腺癌患者的临床病理特征及单变量分析的结果
本研究共纳入220例乳腺癌患者,均为女性,年龄24~77岁(48.45±10.9岁);其中97例(44.1%)的患者至少有1个SLN转移阳性。原发肿瘤大小为2.61±1.32 cm;切除的SLN数量为4.05±3.19个,转移阳性SLN数量为1.84±1.56个,转移阴性的SLN数量为2.21±2.48个;切除的non-SLN数量为16.98±6.99个,转移阳性SLN数量为2.64±5.55个。
本研究纳入患者的临床病理资料及单因素分析结果发现,原发肿瘤大小、组织学分级、脉管癌栓、阳性SLN数量、阴性SLN数量以及阳性SLN数/总SLN数比例在non-SLN转移阳性组和阴性组间的差异有统计学意义(P<0.05,表1)。
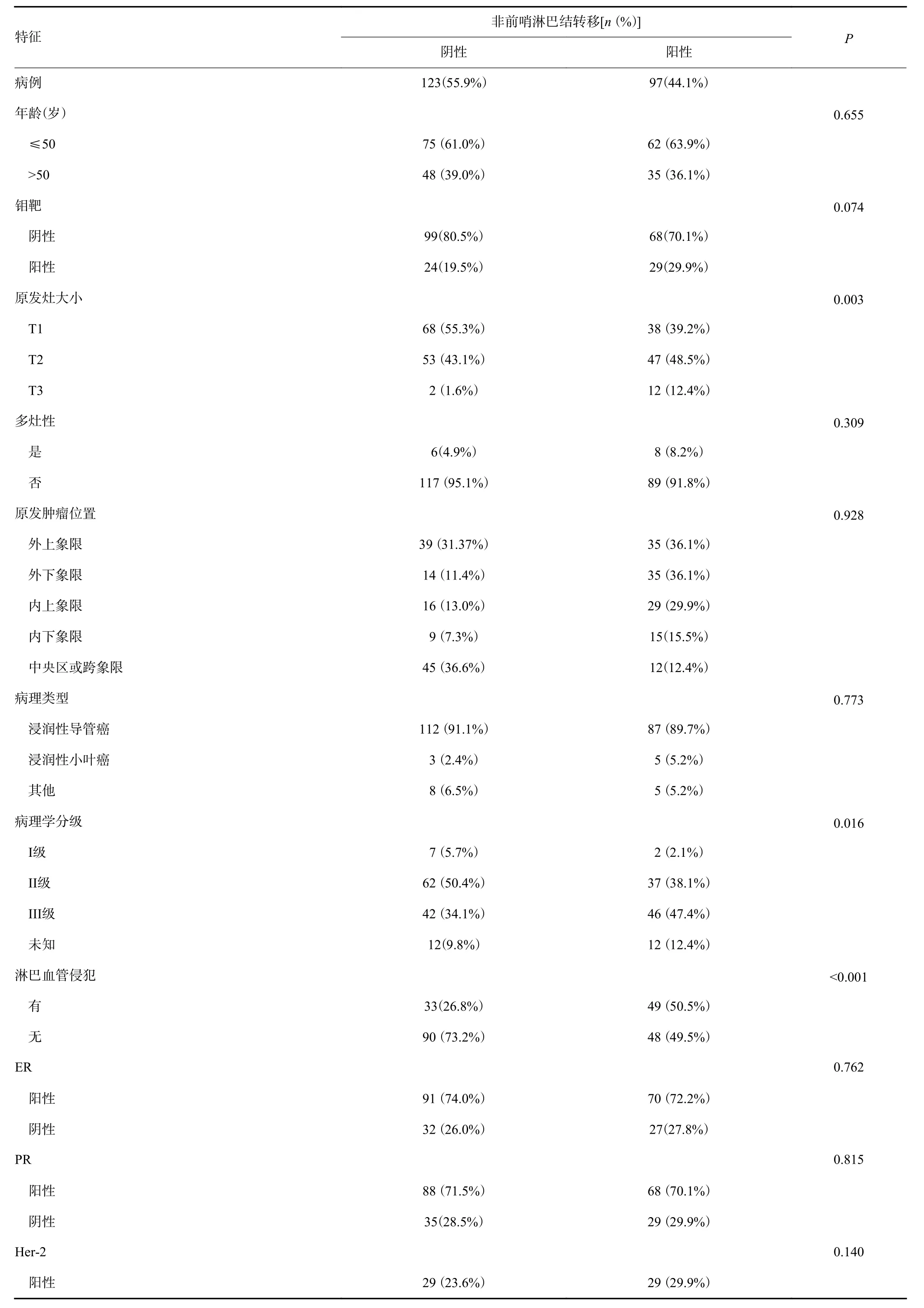
表1 乳腺癌患者临床病理特征的单变量分析
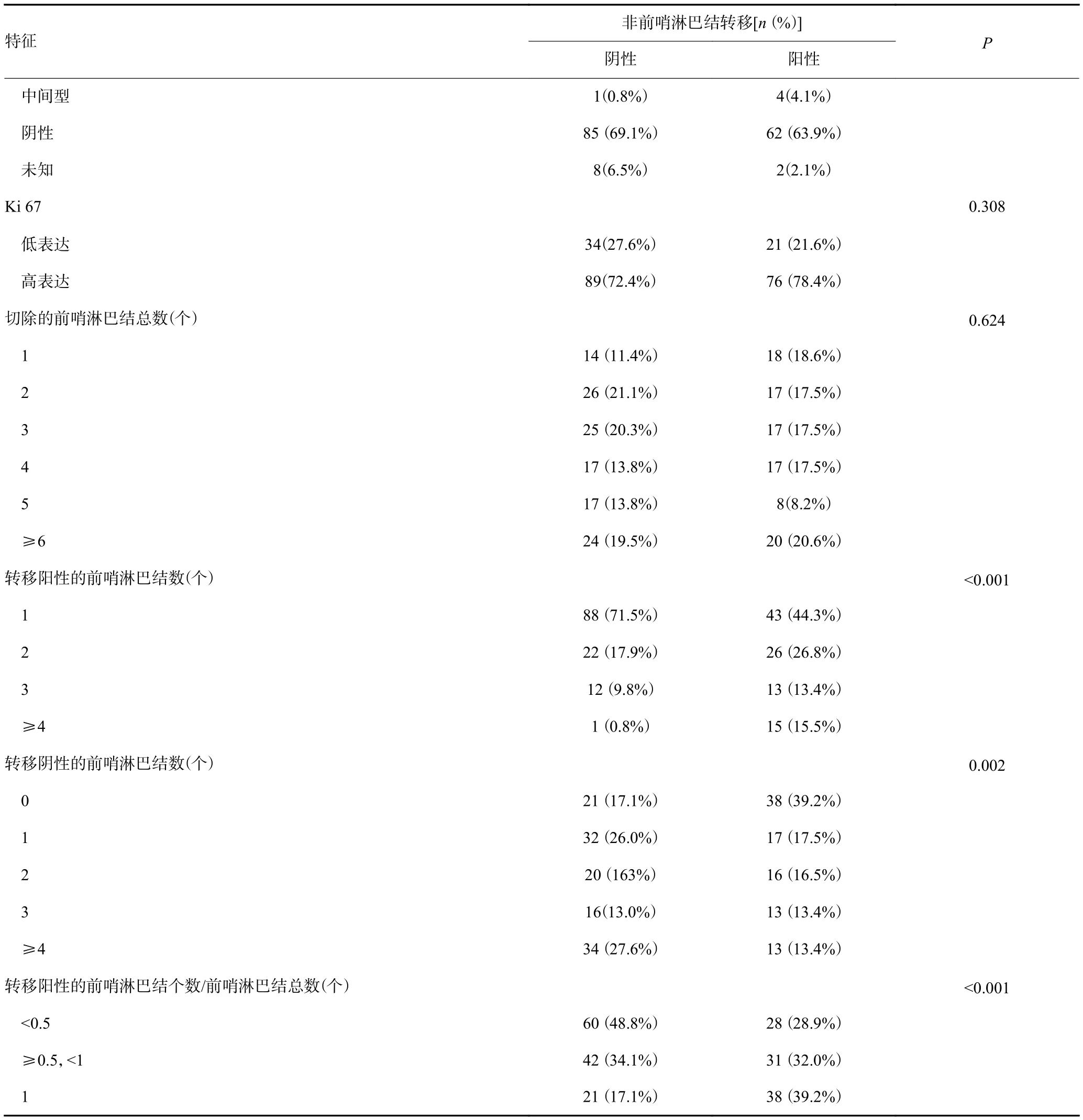
续表1
2.2 乳腺癌患者的多因素logistic回归分析结果及新模型的建立
对以上变量进一步行多因素logistic回归分析,发现组织学分级、阴性SLN数量的差异无统计学意义(P>0.05),剔除以上2个变量,建模结果如表2所示,其中原发肿瘤大小、脉管癌栓、阳性SLN数量以及阳性SLN数/总SLN数比例是non-SLN转移的独立预测因素。
2.3 新模型与MSKCC、Louisville和SCH模型的比较
根据各模型对本研究纳入的乳腺癌患者non-SLN转移的预测概率,绘制ROC曲线,并计算AUC值,结果如图1。MSKCC、Louisville、SCH以及新模型的AUC值及分别为0.683、0.747、0.657和0.762,各模型的AUC值置信区间如表2。以各模型报道的原始截断值为准,所验证的MSKCC、Louisville和SCH三个模型中,Louisville和SCH的FNR均为0,而MSKCC的FNR为2.44%,MSKCC模型将11例(6.01%)乳腺癌患者归类为non-SLN低风险者。当调整各模型的FNR至接近10%(9.27%)时,MSKCC、Louisville、SCH 以 及 新 模 型 分 别 将38(17.27%)、44(20.00%)、33(15.00%)和73(33.18%)例乳腺癌患者归类为non-SLN低风险者,结果显示,新模型明显优于其他3个模型,差异有统计学意义(表3)。
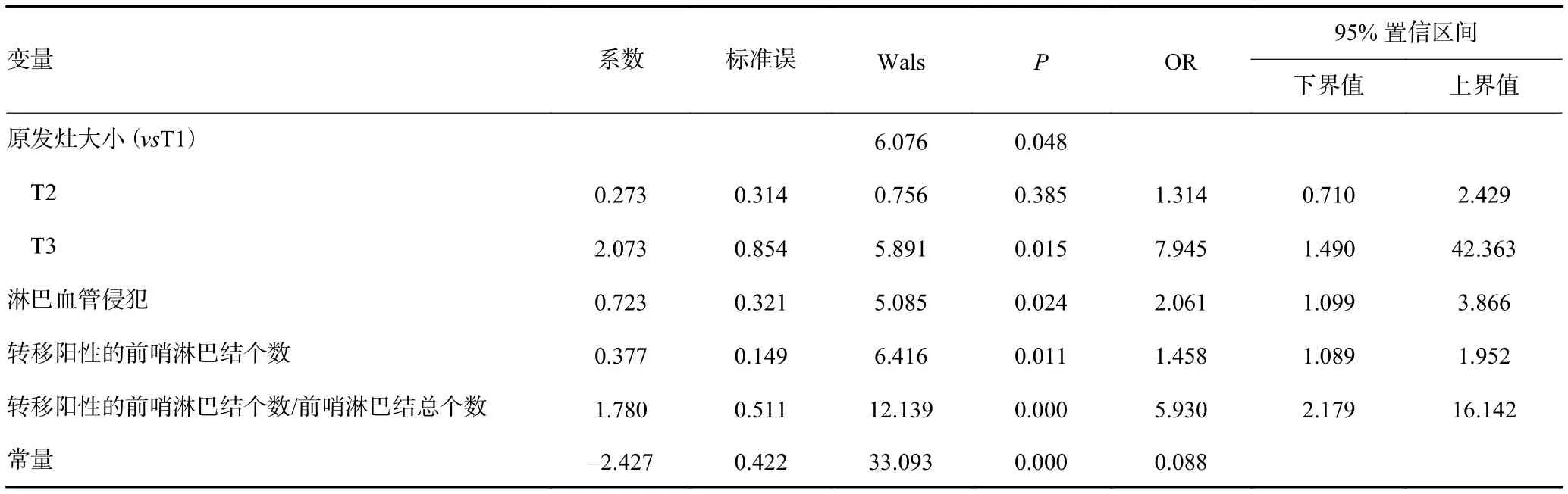
表2 乳腺癌患者non-SLN转移风险因素的Logistic回归分析结果
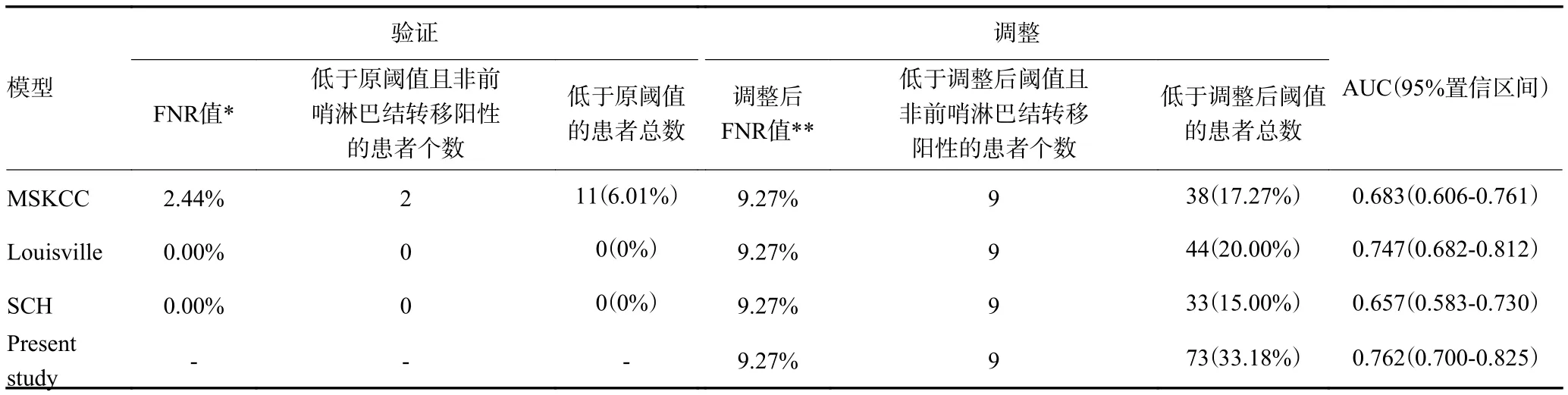
表3 乳腺癌患者non-SLN转移风险预测模型的AUC值和假阴性率比较
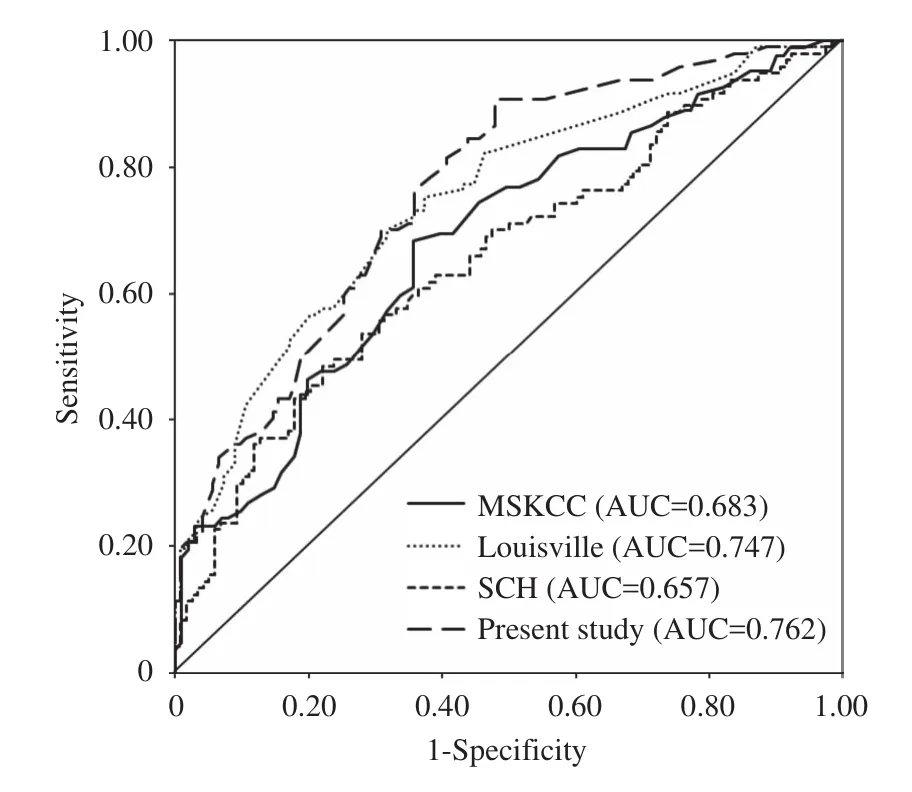
图1 MSKCC、Louisville、SCH以及新模型的ROC曲线及AUC值
3 讨论
ALN有无转移是乳腺癌患者最重要的预后因素之一[18],ALND曾是进行腋窝淋巴结分期的标准方法[2]。近年来,SLN活检已经替代ALND成为早期乳腺癌患者进行腋窝淋巴结准确分期的方法[8-9]。但在SLN中发现转移时,ALND仍然是腋窝的金标准治疗和分期程序,许多学者对此提出疑问[3],因为许多研究表明,这些进行了ALND的乳腺癌患者,有40%~70%的患者未发现non-SLN转移[10-12]。本研究中,仅44.1%(97/220)患者其non-SLN有癌细胞转移,与部分其他研究结果相仿。因此,关于乳腺癌non-SLN转移风险因素的相关研究越来越受到关注,许多研究报道了一些相关的危险因素[10-13,15],这些危险预测因子主要分为两类,一是原发性乳腺肿瘤特征,如肿瘤大小[13,15]和脉管癌栓有无[19-21];二是SLN的特征,如阳性SLN的数量[11,20],阴性SLN的数量[20-21]和阳性SLN的比例[15]等。本研究中原发肿瘤大小,阳性SLN数量和阳性SLN /总SLN的比例被确定为非SLN转移的独立预测因子,这与许多其他研究者的研究结果一致[11,15,19-21]。本研究中纳入的乳腺癌患者均行钼靶检查,但经过分析后该变量被剔除,未纳入模型,可能原因是钼靶视野较小,腋窝淋巴结显示不完全,导致漏诊率和假阴性率过高[16]。目前国内外许多研究机构已经构建了一些列线图或评分系统[10-11,13,15,19-21],可计算SLN阳性时,乳腺癌患者其non-SLN的转移概率,如MSKCC列线图[13]等。本研究对MSKCC、Louisville和SCH等3个国内外机构所建立的模型进行验证和评估。同时,本研究还通过对纳入的乳腺癌患者的临床、影像和病理资料的分析,最终纳入了4个变量(原发肿瘤大小、脉管癌栓有无、阳性SLN的数量以及阳性SLN /总SLN的比值),建立了1个新的预测模型,以计算non-SLN的转移概率。
MSKCC列线图是Van等[13]基于美国纪念斯隆-凯特林癌症中心的1075例乳腺癌患者资料构建的1个non-SLN转移风险预测模型,是目前最著名的预测模型之一,该模型纳入的变量包括:肿瘤分级、脉管癌栓、多灶性、雌激素受体表达、阴性SLN数量、阳性SLN数量、肿瘤大小以及SLN中发现转移灶的病理检查方法。许多研究者[10,12,20,22-23]对该模型进行了验证,结果发现AUC值从0.58到0.84不等。MSKCC应用于本研究所纳入的乳腺癌患者时,AUC为0.683(95%CI,0.606~0.761),低于MSKCC原始文献中报道的0.75[13],与其他部分研究报道结果类似[10,23]。目前认为,采用病理检出方法替代SLN转移灶的大小,是MSKCC模型存在的1个较明显的缺陷,因为不同机构间检测SLN转移的方法可能具有较大差异[19,22]。
Louisville评分系统是由路易斯维尔大学的Chagpar等[11]基于1253例美国和加拿大的患者构建的预测模型,该模型仅纳入3个风险预测因子:原发肿瘤大小、阳性SLN数量以及阳性SLN数总SLN数比例,与本研究纳入的预测因素类似。该模型应用于本研究所纳入的乳腺癌患者时,AUC为0.747(95%CI,0.682~0.812),高于其原始文献报道的0.680(95%CI,0.649~0.711)[11]。
SCH列线图是Chen等[10]基于复旦大学附属肿瘤医院1545例乳腺癌患者建立的预测模型。尽管本研究纳入的也是中国乳腺癌患者人群,但该模型应用于本研究的患者人群时,AUC值仅0.657(95%CI,0.583~0.730),低于MSKCC和Louisville模型。该模型纳入的5个风险预测因子包括:年龄、肿瘤大小、肿瘤位置、肿瘤类型和脉管癌栓。在目前国内外建立的预测模型中,罕见有将年龄和肿瘤位置作为non-SLN转移的独立预测因子。本研究的乳腺癌人群中,年龄、肿瘤位置和肿瘤类型均未发现是预测non-SLN转移的独立预测因子。这可能是该模型应用于本研究乳腺癌患者资料时AUC过低的原因,尽管该模型也是基于中国乳腺癌人群建立的。
本研究建立的新模型纳入了原发肿瘤大小、脉管癌栓有无、阳性SLN的数量以及阳性SLN /总SLN的比值等4个变量作为non-SLN转移的独立预测因素,模型AUC为0.762(95%CI,0.700~0.825),高于MSKCC、Louisville和SCH模型。MSKCC、Louisville和SCH模型应用于本研究纳入的乳腺癌患者时,其Louisville和SCH模型的FNR均为0%,低于MSKCC模型,提示前两个模型可能具有更高的临床应用价值。进一步调整各模型的FNR至接近10%(实际为9.27%)时,新模型可将33.18%(73/220)的患者归类到低风险组,明显优于其他3个模型:Louisville20.00%(44/220)、MSKCC17.27%(38/220)、SCH15.00%(33/220)。提示本研究所建立的新模型可能具有更高的临床应用价值,Louisville次之,而SCH的临床应用价值低于其他3个模型。
近年来,国外许多研究机构已经建立了许多用于SLN转移阳性乳癌患者其non-SLN转移风险的预测模型,并且得到了其他研究机构的验证和评估[10-13,15,19-23]。国内研究机构在non-SLN转移风险的预测模型的相关研究较少,并且国内研究大多仅对国外建立的部分风险模型进行了验证,尤其是对MSKCC模型[24-27],很少进一步探讨建立可能更适合中国乳腺癌人群的风险预测模型[28-29]。本研究验证了2个国外较著名的模型(MSKCC和Louisville模型)和1个国内建立的SCH模型,发现这些已建立的模型在应用于本研究纳入的乳腺癌人群时临床效能低于原始文献的报道。因此我们尝试建立了新的预测模型,发现新模型的各方面表现优于其他3个模型,这提示这些风险预测模型往往在本机构纳入人群中应用价值较高,而在其他研究机构或其他国家人群中的应用价值可能低于在原机构中的发现。这是由于不同机构、地区和国家的乳腺癌人群其临床病理特征可能差异较大,不是每个已建立的风险预测模型都适用于新乳腺癌患者样本,开发对全国或全世界都具有普适性的风险预测模型非常困难。因此,新的风险预测模型,在正式应用于临床前,往往需要大样本的外部验证,并进行修正,才能获得较好的临床应用效能。在选择已有的风险预测模型为本机构乳腺癌人群进行临床决策的辅助前,可能需要对本机构人群的临床病理特征有较为完整的回顾性分析,选择比较贴近本机构乳腺癌人群特征的风险预测模型可能会获得较好的效果,如本研究中Louisville模型中的独立预测因子与本研究发现的乳腺癌患者的独立预测因子接近,该模型在本研究中的临床应用效能也优于MSKCC和SCH模型。本研究用于建立预测模型的样本数(220例)较少,尽管新模型在本研究纳入的乳腺患者中表现优于其他模型,但缺少外部样本的验证,这是本研究的局限性。
总之,本研究的结果显示,新模型较之MSKCC、Louisville模型和SCH模型,在对乳腺癌non-SLN转移风险的预测方面可能具有更高的临床价值,但在应用此模型前仍需更大样本的资料进行验证和修正。对于SLN活检阳性的乳腺癌患者,在应用非前哨淋巴结转移风险预测模型辅助是否进行ALND的临床决策时需谨慎。
参考文献:
[1]Choi HY,Park M,Seo M,et al.Preoperative axillary lymph node evaluation in breast cancer current issues and literature review[J].Ultrasound Q,2017,33(1): 6-14.
[2]Krag DN,Weaver DL,Alex JC,et al.Surgical resection and radiolocalization of the sentinel lymph node in breast cancer using a gamma probe[J].Surg Oncol,1993,2(6): 335-9.
[3]杨翼鹏,嵇健,刘民锋,等.腋窝治疗对于早期乳腺癌患者是否有必要[J].南方医科大学学报,2014,34(7): 1065-7.
[4]Veronesi U,Paganelli G,Galimberti V,et al.Sentinel-node biopsy to avoid axillary dissection in breast cancer with clinically negative lymph-nodes[J].Lancet,1997,349(969): 1864-7.
[5]Chen SL,Iddings DM,Scheri RP,et al.Lymphatic mapping and sentinel node analysis: current concepts and applications[J].CA Cancer J Clin,2006,56(5): 292-309.
[6]Poortmans PM, Struikmans H, Bartelink H. Regional nodal irradiation in Early-Stage breast cancer[J].N Engl J Med,2015,373(19): 1879-80.
[7]Speers C, Pierce LJ. Postoperative radiotherapy after Breast-Conserving surgery for Early-Stage breast cancer a review[J].JAMA Oncol,2016,2(8): 1075-82.
[8]Garcia-Tejedor A,Falo C,Quetglas CA,et al.Feasibility,accuracy and prognosis of sentinel lymph node biopsy before neoadjuvant therapy in breast cancer.A prospective study[J].Int J Surg,2017,39(11): 141-7.
[9]Manca G,Rubello D,Tardelli E,et al.Sentinel lymph node biopsy in breast cancer:indications,contraindications,and controversies[J].Clin Nucl Med,2016,41(2): 126-33.
[10]Chen JY,Chen JJ,Yang BL,et al.Predicting sentinel lymph node metastasis in a Chinese breast cancer population: assessment of an existing nomogram and a new predictive nomogram[J].Breast Cancer Res Treat,2012,135(3): 839-48.
[11]Chagpar AB,Scoggins CR,Martin IR,et al.Prediction of sentinel lymph node-only disease in women with invasive breast cancer[J].Am J Surg,2006,192(6): 882-6.
[12]Qiu PF,Liu JJ,Wang YS,et al.Risk factors for sentinel lymph node metastasis and validation study of the MSKCC nomogram in breast cancer patients[J].Jpn J Clin Oncol,2012,42(11): 1002-7.
[13]Van Zee KJ,Manasseh DM,Bevilacqua JL,et al.A nomogram for predicting the likelihood of additional nodal metastases in breast cancer patients with a positive sentinel node biopsy[J].Ann Surg Oncol,2003,10(10): 1140-51.
[14]Weaver DL, Ashikaga T, Krag DN, et al. Effect of occult metastases on survival in node-negative breast cancer[J].N Engl J Med,2011,364(5): 412-21.
[15]Barranger E,Coutant C,Flahault A,et al.An axilla scoring system to predict non-sentinel lymph node status in breast cancer patients with sentinel lymph node involvement[J]. Breast Cancer Res Treat,2005,91(2): 113-9.
[16]吴佩琪,刘春玲,刘再毅,等.钼靶、CT与DCE-MRI评价乳腺癌淋巴结转移的价值[J].南方医科大学学报,2016,36(4): 493-9.
[17]Singletary SE,Greene FL,Sobin LH.Classification of isolated tumor cells:clarification of the 6th edition of the American Joint Committee on cancer staging manual[J].Cancer,2003,98(12):2740-1.
[18]Kim WG,Lee JS.Axillary skip metastases and the False-Negative rate of sentinel lymph node biopsy in patients with breast cancer are related to negative ALDH-1 expression and Ki-67 expression[J].Int J Surg Pathol,2017,25(5): 397-405.
[19]Kohrt HE,Olshen RA,Bermas HR,et al.New models and online calculator for predicting non-sentinel lymph node status in sentinel lymph node positive breast cancer patients[J].BMC Cancer,2008,8(12): 66-75.
[20]Cho J,Han W,Lee JW,et al.A scoring system to predict nonsentinel lymph node status in breast cancer patients with metastatic sentinel lymph nodes: A comparison with other scoring systems[J].Ann Surg Oncol,2008,15(8): 2278-86.
[21]Perhavec A,Perme MP,Hocevar M,et al.Ljubljana nomograms for predicting the likelihood of non-sentinel lymph node metastases in breast cancer patients with a positive sentinel lymph node[J].Breast Cancer Res Treat,2010,119(2): 357-66.
[22]Gur AS,Unal B,Ozbek U,et al.Validation of breast cancer nomograms for predicting the non-sentinel lymph node metastases after a positive sentinel lymph node biopsy in a multi-center study[J].Eur J Surg Oncol,2010,36(1): 30-5.
[23]Huang J,Chen X,Fei X,et al.Risk factors of non-sentinel lymph node metastasis and performance of MSKCC nomogramin breast cancer patients with metastatic sentinel lymph node[J].Chin J Surg,2015,53(12): 941-6.
[24]陈嘉莹,陈嘉健,杨犇龙,等.MSKCC乳腺癌前哨淋巴结转移预测模型的验证性研究[J].中国实用外科杂志,2011,28(01): 89-93.
[25]黄佳慧,陈小松,费晓春,等.乳腺癌非前哨淋巴结转移危险因素及MSKCC模型预测效能研究[J].中华外科杂志,2015,53(12):941-6.
[26]曹迎明,刘淼,周波,等.MSKCC和SOC模型预测中国乳腺癌患者非前哨淋巴结转移的验证比较研究[J].中国肿瘤临床,2014,33(08): 508-12.
[27]邱鹏飞,刘雁冰,王永胜,等.乳腺癌前哨淋巴结转移相关因素与MSKCC列线图的验证性研究[J].中华内分泌外科杂志,2012,06(5): 307-12.
[28]罗铭.乳腺癌非前哨淋巴结转移风险预测模型的验证及新模型的建立[D].南宁: 广西医科大学,2014.
[29]陈嘉莹.早期乳腺癌前哨淋巴结及非前哨淋巴结转移预测模型的建立和验证[D].上海: 复旦大学,2012.