再生障碍性贫血患者乙型肝炎病毒感染及其与预后的关系*
何秋连,谭 竟,魏 锦,马春蓉,曹 红
1.南充市中心医院 血液内科(南充 637000); 2.川北医学院附属医院 血液内科(南充 637000); 3.四川省第五人民医院 血液内科(成都 610014)
目前,较多文献提示,某些肝炎患者在治疗后期出现血细胞减少,骨髓穿刺检查提示造血能力减低,表现出再生障碍性贫血(aplastic anemia,AA )的临床症状与病理状态,这类患者被定义为肝炎相关再生障碍性贫血(Hepatitis associated aplastic anemia, HAAA)。通过对HAAA患者的病毒检测发现,常见肝炎病毒很少引起HAAA发生,非A-G型肝炎病毒是引起HAAA的主要病因[1-2],文献中A-G型肝炎病毒与AA的发病关系并不明确。目前,国内外大量文献报道了血液肿瘤、器官移植、风湿类疾病及实体肿瘤患者在治疗中出现乙肝病毒(HBV)再激活情况,但同样接受了免疫抑制治疗(IST)的AA患者治疗后HBV再激活情况的报道较少。为探究此现象出现的原因是疾病本身发病风险低还是临床工作者对该风险的重视不足,本研究对南充市中心医院及川北医学院血液内科近十年的AA患者作了队列性研究,探讨该类患者中HBV感染发生情况及治疗后再激活情况,推测HBV感染是否与AA发病相关,同时探讨HBV感染对AA治疗预后的影响。
1 资料与方法
1.1 临床资料
回顾2006年1月至2016年12月在南充市中心医院及川北医学院附属医院血液内科住院治疗的AA患者的病例资料。纳入标准:随访时间>6月;有2次(间隔时间>3个月)HBV感染数据的患者。排除标准:随访时间<6个月;无HBV感染监测数据;未完成随访的患者。纳入AA患者共245例,其中132例患者合并HBV感染:重型再生障碍性贫血(severe aplastic anemia,SAA)45例,极重型再生障碍性贫血(very severe aplastic anemia,NSAA)16例。对所有患者依据病情需要给予支持治疗及免疫抑制剂治疗。
1.2 方法
1.2.1 诊断标准 HBV感染标准:血清抗体检测HBsAg阳性或者HBsAg阴性/抗-HBc 阳性诊断HBV感染;肝炎诊断标准:谷丙转氨酶(ALT)为正常水平上限值3倍;HAAA诊断标准:急性肝炎发病后6个月内发生的SAA[1-2]。AA诊断标准参照国际粒细胞缺乏症和再生障碍性贫血研究小组诊断标准[3]。HBV再激活诊断标准:HBV DNA水平> 1 log IU/L 基线值,或者治疗之前HBV DNA为阴性,IST治疗后HBV DNA为阳性[4]。
1.2.2 分组方法 依据有无HBV感染及感染状况分为:1)乙肝感染组:HBsAg 阳性组(n=36)、HBsAg阴性/抗-HBc阳性组(n=96);2)无乙肝感染组:HBsAg阴性/抗-HBc 阴性组(n=113)。
1.2.3 治疗方法 SAA或NSAA者采用IST方案:22例患者使用猪抗人淋巴细胞球蛋白(ALG),5例患者使用兔抗胸腺细胞免疫球蛋白(ATG)联合甲泼尼龙、环胞霉素治疗。非重型再障者(Non SAA)采用环孢霉素A及益气生血中药、雄激素等治疗。乙肝抗病毒治疗:使用拉米夫定抗病毒治疗。
1.2.4 随访 1)内容及时间:随访时间从AA患者初次住院起,截止2016年12月31日。245例患者中222例均获得>6个月的随访记录。随访内容包括血常规、肝肾功、乙肝表面抗体及HBV-DNA水平。36例HBsAg阳性患者中位随访时间44.5个月(范围6~88个月)。96例HBsAg阴性/抗-HBc阳性患者中位随访时间47.5个月(范围6~94个月)。2)治疗情况:36例HBsAg阳性患者含有11例SAA、4例VSAA、21例Non SAA,共4例患者未接受免疫抑制剂治疗,不纳入数据分析。有8位使用了ATG/ALG联合CsA 疗法,24位使用单独的CsA 治疗。所有患者中有3例使用了拉米夫定预防HBV激活,这3位患者全部完成随访,均未出现病毒再激活。29位未接受预防性抗病毒治疗患者有21位完成随访,出现1例病毒激活。
96例HBsAg阴性/抗-HBc 阳性患者包括34例SAA、12例VSAA、50例Non SAA,16例患者未接受免疫抑制剂治疗,不纳入数据分析。19位使用了ATG∕ALG联合CsA 疗法,61位使用单独的CsA 治疗。80例患者均未接受预防HBV激活,65例完成随访,出现1例病毒激活。
1.3 统计学方法
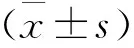
2 结果
2.1 研究对象基本情况
245 例AA患者中,HBsAg阳性36例,年龄(45.26±4.32)岁;HBsAg阴性/抗-HBc 阳性96例,年龄(47.19±4.52)岁;HBsAg阴性/抗-HBc 阴性组113例,年龄(45.85±1.38)岁。有、无HBV感染的两组AA患者分类比较,差异无统计学意义(P>0.05)(表1)。HBsAg阳性组15例诊断为SAA或NSAA,随访结局时生存15例。HBsAg阴性/抗-HBc 阳性组46例诊断为SAA或NSAA,随访结局时生存46例。113例HBsAg阴性/抗-HBc阴性的AA患者中44例诊断为SAA或NSAA,随访结局时生存44例。7例HAAA患者HBsAg和 HBV DNA均为阴性,3例患者抗-HBs阳性。有、无HBV感染的两组AA患者疾病严重程度比较,差异无统计学意义(P=0.635)(表2)。

表1 HBsAg阳性组、HBsAg阴性/抗-HBc 阳性组及无HBV感染组患者分类差异比较


组别VSAA及SAA/例Non-SAA/例VSAA及SAA占比/%HBsAg阳性及HBsAg阴性/抗617146.2-HBc阳性无HBV感染466740.72 0.749P 0.635
注:SAA:重型再障;NSAA:极重型再障:Non-SAA:非重型再障
2.2 HBV感染对AA治疗预后的影响
本研究中,HBsAg阳性AA共36例,随访时间6~88月;HBsAg阴性/抗-HBc阳性AA共96例,随访6~94月。HBsAg阳性组随访7年,总生存期(OS) 为84.4%,HBsAg阴性/抗-HBc阴性组OS 为87.5%,HBsAg阴性/抗-HBc阳性组OS 为81.6%,多组间比较,差异无统计学意义(P=0.8617)(图1)。所有HBV感染者均未出现肝炎相关死亡。

图1不同乙肝病毒感染状态的再生障碍性贫血患者的总体生存率
2.3 HBV再激活情况
没进行病毒预防的36位HBsAg阳性AA患者中有1例27岁女性患者在接受CsA、ATG及甲强龙方案治疗后第6月出现HBV再激活。没有进行抗病毒预防治疗的65例HBsAg阴性/抗-HBc阳性患者,治疗后1例53岁男性出现病毒激活,其使用IST方案为CsA、ALG及甲强龙,治疗前病毒标记显示HBeAb阳性、HBcAb阳性、ALT 36 U/L,但未检测HBV-DNA水平,接受免疫治疗后第11个月,复查乙肝标记、检测HBV-DNA水平,符合HBV再激活诊断标准。2例HBV再激活患者的临床特征见表3。
2位出现HBV再激活患者均及时进行了拉米夫定抗病毒治疗,治疗后HBV DNA均转阴,肝功能恢复正常,未出现肝炎相关死亡。治疗前进行预防性抗病毒治疗患者治疗后均未发生HBV激活,而单独使用环孢素治疗的患者均未出现病毒激活情况。

表3 2例HBV再激活患者的临床特征
注:MP: 甲强龙; ALC: 淋巴细胞计数
3 讨论
1975年有研究首次报道了HBV感染后发生AA的病例,至此,医学工作者就开始关注HBV与AA的发病关系[5]。通过对HAAA的病毒检测发现,常见肝炎病毒很少引起HAAA发生,非A-G型肝炎病毒是引起HAAA的主要病因[1-2]。所以,文献检索中对HBV与AA的关系报道并不多见,通过本次研究,也未发现HBV感染导致的HAAA患者,结果与其他研究者的观点一致。在本研究结果中,AA患者的HBsAg阳性率为14.69%(36/245),远远高于目前所报道的我国普通人群感染率(7.2%)[6]。然而,本研究中AA患者的HBV高感染率能否证明HBV感染与AA发病相关还需进一步扩大样本量、多中心研究来证明。
HBV感染患者在淋巴瘤或免疫系统疾病治疗中发生病毒再激活是治疗相关的、常见的并发症,但目前少有病例报道AA治疗后的HBV激活情况[7-8]。通过本研究得知HBsAg阳性者,接受免疫抑制剂治疗后病毒再激活率是4.17%(1/24),86例没有预防性抗病毒治疗的HBV 感染者再激活2例,比率为2.32%(2/86)。仅2位AA患者出现HBV激活的结果,故不能确定AA治疗是HBV激活的风险因素。纳入本研究的HBV再激活患者使用了ATG/ALG及环孢素(CsA),以及联合甲泼尼龙进行抑制免疫治疗,因ATG 、 ALG 均是非常强的免疫抑制剂,甲泼尼龙又是HBV再激活的主要诱发因素,因此,这些患者都具有了发生HBV再激活的条件。
通过本研究我们还发现使用环孢素进行IST的AA患者未出现HBV激活,这可能和环孢素本身的免疫抑制强度低相关[9]。有报道[10]称环孢素在体外可抑制HBsAg、HBeAg、HBV DNA 表达,并呈剂量依赖性,这可能是CsA作为免疫抑制剂却并不增加激活病毒机会的原因之一。最近还有研究证实,环孢素通过影响NTCP(sodium taurocholate cotransporting polypeptide)系统抑制HBV进入肝脏细胞而起到抗病毒的作用。因此,CsA虽属于免疫抑制剂,但因对HBV的独特作用,提示其用于治疗合并HBV感染的AA患者是安全的,本研究结果进一步证实了这一结论。
报道称HBV持续复制对非霍奇金淋巴瘤患者的预后有负面影响[11],另有研究[12]证实,HBsAg阳性对多发性骨髓瘤患者的OS也有重要影响。在此研究中,也分析了HBV感染对AA患者预后的影响,得出如下结论:各种HBV感染状态对AA患者OS并没有明显区别。本研究出现这种结果可能的理由如下:在HBV感染的AA患者中未出现肝炎相关死亡,在治疗过程中,IST方案并未因HBV感染而受到影响。
乙肝治疗指南提出,对即将进行免疫抑制剂治疗的HBsAg阳性患者,接受预防性抗病毒治疗是阻止病毒激活的有效治疗措施[13]。但本研究提示在AA中,有无HBV感染、是否进行预防性抗病毒治疗均未使该疾病预后发生明显影响。因此,针对使用免疫抑制剂治疗的合并HBV感染的AA患者,建议在疾病治疗中定期监测淋巴细胞计数、肝细胞功能及HBV DNA水平可能是可行的、有较高经济效益的方法,一旦有指针进行抗病毒治疗,应尽快阻止肝脏炎症的出现。本课题组将对启动抗病毒治疗的最佳时间进行进一步研究。
[1]Evens A M, Jovanovic B D, Su Y C,etal. Rituximab-associated hepatitis B virus(HBV) reactivation in lymphoproliferative diseases: meta-analysis and examination of FDA safety reports[J]. Ann Oncol, 2010, 22(5): 1170-1180.
[2]Yeo W, Chan T C, Leung N W,etal. Hepatitis B virus reactivation in lymphoma patients with prior resolved hepatitis B undergoing anticancer therapy with or without rituximab[J]. J Clin Oncol, 2009, 27(4): 605-611.
[3]Lubel J S, Angus P W. Hepatitis B reactivation in patients receiving cytotoxic chemotherapy: diagnosis and management[J]. J Gastroenterol Hepatol, 2010, 25(5): 864-871.
[4]Yun J, Kim K H, Kang E S,etal. Prophylactic use of lamivudine for hepatitis B exacerbation in post-operative breast cancer patients receiving anthracycline-based adjuvant chemotherapy[J]. Br J Cancer, 2011, 104(4): 559-563.
[5]Matsue K, Kimura S, Takanashi Y,etal. Reactivation of hepatitis B virus after rituximab-containing treatment in patients with CD20-positive B-cell lymphoma[J]. Cancer, 2010, 116(20): 4769-4776.
[6]Koo Y X, Tay M, Teh Y E,etal. Risk of hepatitis B virus(HBV) reactivation in hepatitis B surface antigen negative/hepatitis B core antibody positive patients receiving rituximab-containing combination chemotherapy without routine antiviral prophylaxis[J]. Ann Hematol, 2011, 90(10): 1219-1223.
[7]Loomba R, Rowley A, Wesley R,etal. Systematic review: the effect of preventive lamivudine on hepatitis B reactivation during chemotherapy[J]. Ann Intern Med, 2008, 148(7): 519-528.
[8]Lubel J S, Angus P W. Hepatitis B reactivation in patients receiving cytotoxic chemotherapy: diagnosis and management[J]. J Gastroenterol Hepatol, 2010, 25(5): 864-871.
[9]Hammond S P, Borchelt A M, Ukomadu C,etal. Hepatitis B virus reactivation following allogeneic hematopoietic stem cell transplantation[J]. Biol Blood Marrow Transplant, 2009, 15(9): 1049-1059.
[10] Ji D, Cao J, Hong X,etal. Low incidence of hepatitis B virus reactivation during chemotherapy among diffuse large B-cell lymphoma patients who are HBsAg-negative/ HBcAb-positive: a multicenter retrospective study[J]. Eur J Haematol, 2010, 85(3): 243-250.
[12] Takai S, Tsurumi H, Ando K,etal. Prevalence of hepatitis B and C virus infection in haematological malignancies and liver injury following chemotherapy[J]. Eur J Haematol, 2005, 74(2): 158-165.
[13] Tavakolpour S, Alavian S M, Sali S.Hepatitis B Reactivation During Immunosuppressive Therapy or Cancer Chemotherapy, Management, and Prevention: A Comprehensive Review-Screened[J]. Hepat Mon,2016,16(4):e35810.