吴茱萸碱丁酰基衍生物固体脂质纳米粒的体外释放及在体胃肠吸收研究
杨 兰,万 坤,杨建波,晏声蕾,张奇娆,张景勍,胡雪原
(1.重庆医科大学药学院重庆高校药物工程研究中心,重庆 400016; 2.四川省眉山市心脑血管病医院药剂科,四川 眉山 620020)
吴茱萸碱(evodiamine, EDM)主要是从传统中药吴茱萸的成熟果实中提取获得,具有抗癌、减肥、镇痛、抗炎等众多药理功效的一种吲哚喹啉类生物碱[1-2]。据相关研究报道显示,EDM具有广谱的抑癌活性,尤其用于小细胞肺癌的治疗[3-4]。但由于EDM的水溶性极差、生物利用度极低的缺点[5],大大地限制了它在临床上的广泛应用。
大量研究证实,对前体药物进行结构修饰,是改善其理化性质的有效方法之一[6]。本文通过对EDM进行结构修饰,在N13位引入丁酰基,合成了水溶性更强的吴茱萸碱丁酰衍生物(evodiamine butyryl derivative, EBD)。本课题组前期体内外研究证实,EBD具有明显的抗肿瘤作用,但EBD对提高EDM的口服生物利用度有限。固体脂质纳米粒(solid lipid nanoparticles, SLN)是一种新型纳米递药系统,具有磷脂双分子层结构,能提高药物的口服生物利用度,降低毒副作用,尤其适用于难溶性抗肿瘤药物的靶向治疗[7]。所以,本研究对EDM进行结构修饰合成EBD(Fig 1)后,进一步制备了吴茱萸碱丁酰衍生物固体脂质纳米粒(evodiamine butyryl derivative-loaded solid lipid nanoparticles, EBDLN),通过结合结构修饰和纳米制剂的优势,最大限度地提高EDM的生物利用度。本文研究了EBDLN的体外释放和在体胃肠吸收过程,有助于EDM在临床的广泛应用。
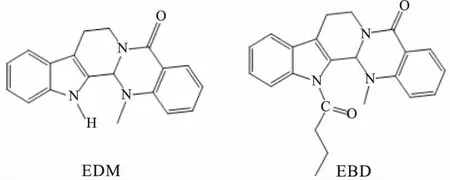
Fig 1 Chemical structural formulas of EDM and EBD
1 材料
1.1实验动物SD大鼠,♂,体质量(250±20)g,由重庆医科大学实验动物中心提供,许可证号:SCXK渝2017-0001。
1.2药品与试剂EDM(纯度>99%,武汉远城科技发展有限公司);单硬脂酸甘油酯(成都科龙化工试剂厂);注射用大豆卵磷脂(上海太伟药业有限公司);葡聚糖凝胶G-50型层析柱(中国医药上海化学试剂公司),其余试剂为分析纯。
1.3仪器Agilent1100液相色谱仪(美国Agilent公司);RE-2000型旋转蒸发仪(上海亚荣有限公司);ZS90 型激光粒度电位仪(英国马尔文公司)。
2 方法
2.1EBD的制备采用一步合成法制备了EBD[8]。取适量EDM溶于15 mL N,N-二甲基甲酰胺(DMF)中,搅拌溶解后,加入少量氢化钠并搅拌0.5 h。滴加0.35 mL正丁酰氯,再缓慢升温至80℃,反应24 h后,在室温下往反应液中加入20 mL水,依次经过萃取、洗涤、干燥、过滤后,将滤液浓缩,用色谱柱分离并旋干溶剂,即得结晶状EBD淡黄色固体。
2.2EBDLN的制备采用薄膜分散法制备EBDLN。称取适量EBD、单硬脂酸甘油酯以及卵磷脂于适量无水乙醇中,充分溶解后除去溶剂,形成均匀分布的薄膜。加入均匀分散至二次蒸馏水中的吐温-80溶液,超声至薄膜完全脱落并溶解,即得乳白色EBDLN混悬液。
2.3粒径和Zeta电位的测定取0.4 mL的EBDLN,用超纯水稀释至4 mL,混匀并经0.45 μm滤膜过滤后,立即用马尔文激光粒度电位仪测定。
2.4包封率和载药量的测定采用凝胶柱层析法测定EBDLN的包封率和载药量。将溶胀好的葡聚糖凝胶G-50装入直径1 cm高度为30 cm的玻璃柱,静置3 h。吸取EBDLN混悬液,过葡聚糖凝胶柱,用20%的乙醇溶液洗脱,收集EBDLN洗脱液,以空白的固体脂质纳米粒作为对照,按照“2.7.2”项下条件,采用HPLC法测定峰面积,计算EBDLN中包封EBD的含量(M1)。吸取等量未过层析柱的EBDLN混悬液,用无水乙醇稀释至相同倍数,按照“2.7.2”项下条件,采用HPLC法测定峰面积,计算EBDLN混悬液中EBD的总含量(M2)。做3次平行实验,且计算制备EBDLN所需材料的总量(M0),按以下公式计算包封率(EE%)和载药量(LE%)。
EE%=M1/M2×100%;LE%=M1/M0×100%。
2.5体外释放实验采用动态透析法考察EBD和EBDLN在两种介质中的体外释药特征。分别以pH 1.20的HCl溶液和pH 6.80的PBS做为释放介质,将分别装有等量相同浓度EBD和EBDLN的密闭透析袋投入到上述两种释放介质中,并置于恒温水浴震荡器中搅拌(37℃,100 r·min-1)。分别于1、2、4、6、8、10、12、24、48、72、96、120、148 h取出1 mL释放介质, 同时补充等温、等体积的释放介质。测定取样中EBD和EBDLN的含量,并绘制体外释药曲线。
2.6在体胃肠吸收实验18只SD ♂大鼠实验前14 h禁食(可饮水),分为3组,每组6只,用水合氯醛将大鼠麻醉并固定。沿大鼠腹中线打开腹部,在胃贲门处小心切合适长度并结扎,再将胃内容物用人工胃液清洗除净,用空气排净人工胃液后,从胃切口处注入药物溶液(EDM或EBD或EBDLN),结扎幽门[9]。2 h后收集胃内药液,再用剩余灌流液冲洗,合并流出的液体并定容[9]。依次找到十二指肠、空肠、回肠、结肠,每个肠段量取10 cm,分别在肠段的两端插管并结扎,并将伤口用蘸有生理盐水的脱脂棉覆盖保湿。先用预热的37℃生理盐水以1 mL·min-1流速灌流,以洗净肠内容物,随即用空气排净生理盐水。再用Krebs-Ringer液冲洗管道10 min,空气排净Krebs-Ringer液后,换用预热到37℃的含药循环液(EDM或EBD或EBDLN),灌流液进入肠段后立即计时,以0.2 mL·min-1流速灌流60 min后,用空气排出药液,并用Krebs-Ringer液冲洗管道数次。将灌流后的流出液、冲洗液及剩余灌流液合并后,用Krebs-Ringer液定容至25 mL。用HPLC方法测定EDM或EBD的质量浓度。实验结束后剪下各实验肠段,并测量各肠段长度与内径。药物在各肠段的有效渗透系数Papp和吸收速率常数Ka分别用以下公式计算[10]:Papp= Q·ln(Xin/Xout)/2πrL;Ka= (X0-Xt)/C0t。
2.7EBD和EBDLN样品分析
2.7.1样品处理 精密量取100 μL经上述操作后得到的样品,加无水乙醇,涡旋,混匀,8 000 r·min-1离心10 min,吸取上清液进行分析测定。
2.7.2色谱条件的建立 色谱柱:Hypersil ODS C18(250 mm×4.6 mm,5 μm);流动相:甲醇-水(80 ∶20),柱温30℃,检测波长为240 nm,流速1.0 mL·min-1,进样量20 μL。
2.7.3标准曲线的绘制 分别精密量取适量EBD溶液,用甲醇稀释,定容得到0.2、0.5、0.8、1.0、1.2、1.5、2.0 mg·L-1的系列浓度的标准溶液。按“2.7.2”的色谱条件进样,记录峰面积并制作标准曲线。
2.7.4方法学验证 分别配制低、中、高(0.8、1.0、1.2 mg·L-1)共3种不同浓度的EBD甲醇溶液,按“2.7.2”的色谱条件进样,计算日内、日间精密度和回收率。
2.8EDM样品分析参照晏声蕾等[1]的方法,对EDM样品进行处理并分析。
3 结果
3.1EBDLN的粒径和Zeta电位测得的EBDLN的平均粒径为(245.00±3.50)nm,多分散性指数PDI为(0.24±0.015),Zeta电位为(-27.51±1.35)mV。
3.2EBDLN的包封率和载药量制备了3批EBDLN,测定得到EBDLN的平均包封率为(86.31±0.32)%,平均载药量为(3.50±0.14)%。
3.3EBD和EBDLN的体外释放以药物的累积释放率为纵坐标,取样时间为横坐标,绘制体外释放曲线。EBD和EBDLN在同一介质释放时,它们的释药趋势完全一致,但EBD有明显的突释效应,而EBDLN相对于EBD而言其释药速度更慢。这表明EBDLN改变了药物的释放行为,显示出缓释效应。由Fig 2、3曲线可见,在两种释放介质(pH 1.20 HCl和pH 6.80 PBS)中,EBD前60 min的累积释放率分别为(81.26±1.96)% 和(92.94±1.68)%,但EBDLN在相应时间段内的累积释放率分别为(61.37±1.31)% 和(65.81±1.68)%。且在120 min时,在两种介质中的EBD已基本释放完全,但EBDLN仍有持续释放的迹象。
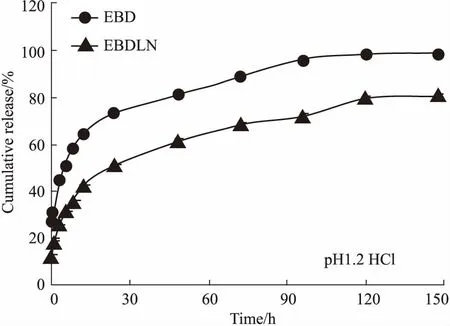
Fig 2 In vitro release behaviors of free EBD and EBDLN in pH 1.2 HCl
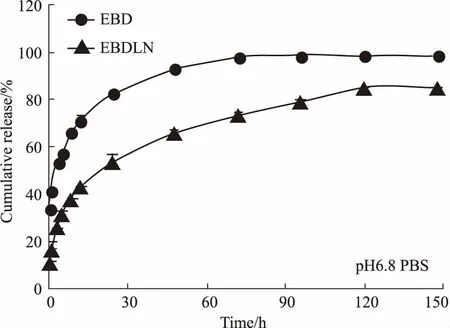
Fig 3 In vitro release behaviors of free EBD and EBDLN in pH 6.8 PBS
3.4EDM、EBD和EBDLN的在体胃肠吸收以EBD的色谱峰面积(A)和它的质量浓度(C)做线性回归,方程为A=897.95C+10.867 3 (r=0.999 3),EBD浓度在0.2~2.0 mg·L-1的范围内线性良好。日内精密度RSD平均值为0.61%,日间精密度RSD平均值为0.82%,以上结果表明精密度符合分析要求。加样回收率平均值分别为99.72%、100.01%、99.89%,RSD为0.56%、0.43%、0.61%,实验结果表明回收率符合分析要求。
在体胃肠吸收实验结果表明,EBDLN明显增强了EDM和EBD在胃肠道的吸收。Fig 4、5结果显示,EBDLN在各个肠道的Ka值和Papp值均明显大于EDM和EBD。且EBDLN在胃、十二指肠、空肠、回肠、结肠共5个肠段中的Ka值分别为EDM的110.14、56.70、51.23、45.70、127.23倍,EBDLN在十二指肠、空肠、回肠、结肠共4个肠段中的Papp值分别为EDM的9.74、4.48、3.82、11.30倍。经样本配对t检验结果显示,EBDLN与EDM在4个肠段中的在体吸收情况差异具有统计学意义(P<0.05)。在灌流的所有肠段中,EDM和EBD在十二指肠中表现出的Ka值和Papp值最大,结果表明EDM和EBD在十二指肠中吸收最好,其次为结肠、空肠、回肠,在胃内吸收最差。而EBDLN在结肠中表现出的Ka值和Papp值最大,结果表明EBDLN在结肠中吸收最好,其次为十二指肠、空肠、回肠,在胃内吸收最差。以上结果也充分表明EBDLN、EBD和EDM的吸收部位主要是在小肠段,而在胃内吸收较少。将EDM经结构修饰再经制剂方法制备成EBDLN后,改变了EDM在小肠段的最佳吸收部位,即由药物在十二指肠吸收最佳变为了在结肠吸收最佳。
4 讨论
EDM具有低水溶性和低渗透性[5],导致胃肠吸收不佳,所以口服生物利用度极低。本文结合结构修饰和纳米制剂的优势,通过EDM合成EBD,并制备成了EBDLN,结果显示明显提高了药物的溶解性和渗透性,提高了EDM在吸收部位的渗透能力,以此达到增加口服生物利用度的目的。
SLN能将难溶性药物吸附或加载于脂质内核中,使其均匀分散在该纳米载体中,以达到增溶目的,形成粒径范围较宽的固体纳米给药体系,且生物机体能较好地容纳SLN,暂未见明显不良反应的报道[11]。与其他SLN的制备方法相比,薄膜超声法具有操作简单、快速可靠、包封率高,且辅料用量低的优点[12],因此,本文采用薄膜超声法来制备EBDLN。由粒径和粒径分布结果可知,应用此法制备得到的纳米粒子粒径较小,且大小分布均匀(PDI<0.50),并能稳定存在,有效保证了抗癌的靶向性能,同时也能实现较高的药物包封率。由累积释放率结果可知,释放介质pH 6.80 PBS比pH 1.20 HCl更有利于EBD的释放,推测pH会影响药物的释放行为,且较大的pH环境可能有利于药物的释放。
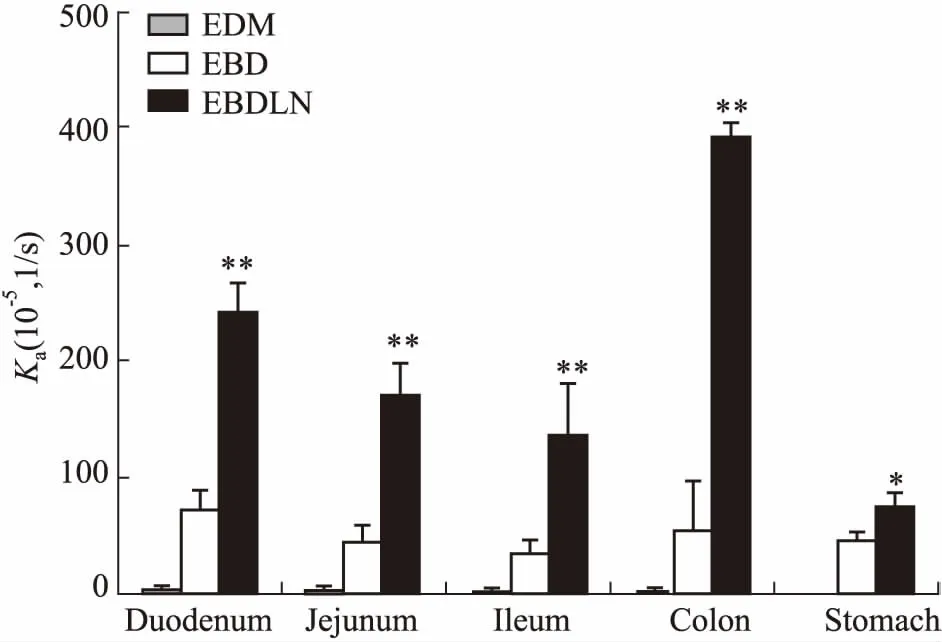
Fig 4 Absorption rate constant Ka of EBD and EBDLN in individual perfusion segments
*P<0.05,**P<0.01vsEDM
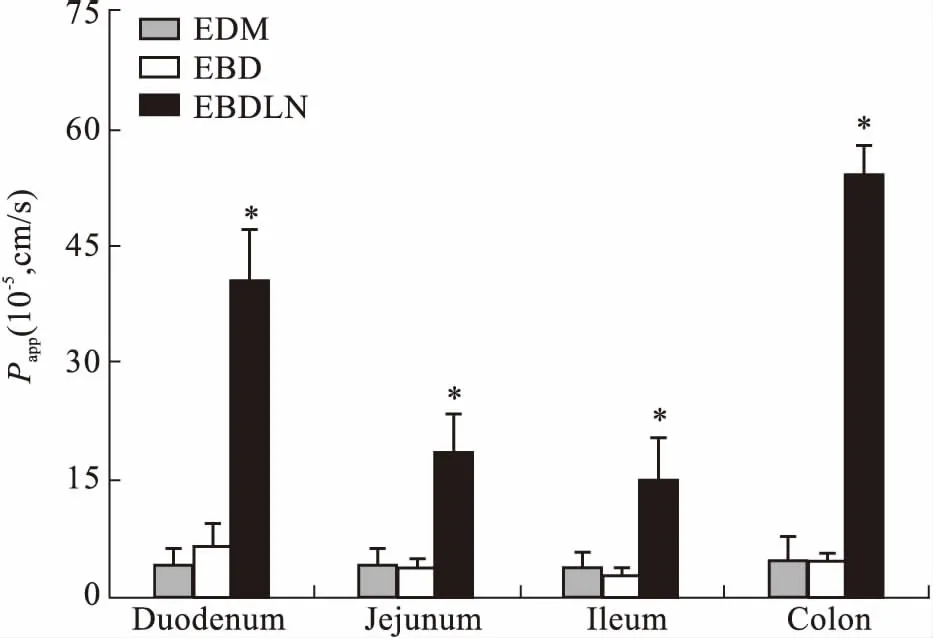
Fig 5 Apparent permeability coefficient Papp of EBD and EBDLN in individual perfusion segments
*P< 0.05vsEDM
EBDLN与晏声蕾等[1]制备的吴茱萸碱油包水型复合纳米乳WECNE的在体胃肠吸收情况相比较显示,EBDLN在各个肠道的Ka值和Papp值均明显大于WECNE。且EBDLN在胃、十二指肠、空肠、回肠、结肠共5个肠段中的Ka值分别为WECNE的72.38、19.86、13.51、11.48、35.18倍,EBDLN在十二指肠、空肠、结肠的Papp值分别为WECNE的1.56、1.02、1.51倍。EBDLN与晏声蕾等[13]制备的吴茱萸碱水包油型复合纳米乳OECNE的在体胃肠吸收情况相比较显示, EBDLN在各个肠道的Ka值和Papp值均明显大于OECNE。且EBDLN在胃、十二指肠、空肠、回肠、结肠共5个肠段中的Ka值分别为OECNE的47.50、20.67、15.23、11.05、46.45倍,EBDLN在十二指肠、空肠、结肠的Papp值分别为OECNE的2.09、1.20、3.09倍。以上结果说明EBDLN增强EDM的在体肠吸收能力远远大于WECNE[1]和OECNE[13]。EBDLN分别与胡江波等[14]制备的复方吴茱萸碱纳米乳和张雪等[15]制备的吴茱萸碱羟丙基-β-环糊精包合物相比较结果显示,EBDLN的Ka值和Papp值明显高于以上两个制剂,这也说明了在目前所能查到的所有关于EDM制剂的文献报道中,EBDLN在各肠段的在体吸收能力是最强的。
EBDLN表现出的高在体吸收能力的原因推测与以下几个因素有关:① EBD与EDM在化学结构上的差异。EBD比EDM多1个丁酰基团,从而使EBD整个分子的极性增大,这有助于化学药物水溶性的提高;② 通过纳米制剂的技术,将EBD包载进入SLN后,由于纳米制剂的优越性能和所用各辅料的作用,如强脂溶性的单硬脂酸甘油酯和注射用大豆卵磷脂作为油相,且单硬脂酸甘油酯是非离子型的表面活性剂,在EBDLN这个制剂中作为乳化剂,使水相和油相能充分混合,形成完全均匀分散的乳浊液,进一步增强EBD的渗透性,使EBD更容易被肠道上皮细胞所吸收,且保持EBDLN的相对稳定性。
综上所述,本实验首次制备了EBDLN,并研究了它的体外释放和在体胃肠道吸收特征。研究发现EBDLN具有缓慢释药的特点,且明显提高了EDM和EBD在胃肠道的吸收,这有助于推广EDM在临床的使用。
(致谢: 本实验在重庆医科大学药学院重庆高校药物工程研究中心完成,在此真诚感谢实验室的所有老师和同学。)
参考文献:
[1] 晏声蕾, 胡江波, 王 薛, 等.吴茱萸碱油包水型复合纳米乳的药代动力学和在体肠吸收[J].第二军医大学学报, 2017,38(2): 249-52.
[1] Yan S L, Hu J B, Wang X, et al.Pharmacokinetics andinsituintestinal absorption of evodiamine eomplex water-in-oil nanoemulation[J].AcadJSecondMilMedUniv, 2017,38(2): 249-52.
[2] 石海莲, 郑沁乐, 吴大正.吴茱萸碱对肥胖并发血管肥厚的作用研究[J].中国药理学通报, 2011,27(12): 1687-92.
[2] Shi H L, Zheng Q L, Wu D Z.The preventive effect of evodiamine on vascular hypertrophy in obese rats[J].ChinPharmacolBull, 2011,27(12): 1687-92.
[3] Mohan V, Agarwal R, Singh R P.A novel alkaloid, evodiamine causes nuclear localization of cytochrome-C and induces apoptosis independent of p53 in human lung cancer cells[J].BiochemBiophysResCommun, 2016,477(4): 1065-71.
[4] Jiang J, Hu C.Evodiamine: a novel anti-cancer alkaloid from Evodia rutaecarpa[J].Molecules, 2009,14(5): 1852-9.
[5] Shyr M, Lin L, Lin T, et al.Determination and pharmacokinetics of evodiamine in the plasma and feces of conscious rats[J].AnalChimActa, 2006,558(1): 16-21.
[6] Xu L, Zhang Y, Dai W, et al.Design, synthesis and SAR study of novel trisubstituted pyrimidine amide derivatives as CCR4 antagonists[J].Molecules, 2014,19(3): 3539-51.
[7] Kharaji M H, Doroud D, Taheri T, et al.Drug targeting to macrophages with solid lipid nanoparticles harboring paromomycin: aninvitroevaluation against L.major and L.tropica.[J].AAPSPharmSciTech, 2016,17(5): 1110-9.
[8] 万 坤.吴茱萸碱衍生物EVB的合成及其纳米粒的初步评价[D].重庆:重庆医科大学, 2014.
[8] Wan K.The synthesis of evodiamine derivative and preliminary evaluation of EVB loaded with nanoparticles[D].Chongqing:Medical University of Chongqing, 2014.
[9] 袁誉铭, 陈学梁, 陈 静, 等.溴吡斯的明新型纳米乳体外释放和大鼠在体胃肠吸收[J].中国药理学通报, 2017,33(2): 276-9.
[9] Yuan Y M, Chen X L, Chen J, et al.Invivorelease and gastrointestinal absorption of novel pyridostigmine bromide nanoemulsion[J].ChinPharmacolBull, 2017,33(2): 276-9.
[10] Shen Q, Li X, Li W, et al.Enhanced intestinal absorption of daidzein by borneol/menthol eutectic mixture and microemulsion[J].AAPSPharmSciTech, 2011,12(4): 1044-9.
[11] Muller R H, Mader K, Gohla S.Solid lipid nanoparticles(SLN) for controlled drug delivery—a review of the state of the art[J].EurJPharmBiopharm, 2000,50(1): 161-77.
[12] 琚 辉, 郝存江, 尹 飞, 等.姜黄素固体脂质纳米粒的制备及表征[J].药物评价研究, 2010,33(6): 420-6.
[12] Ju H, Hao C J, Yin F, et al.Preparation and characterization of curcumin solid lipid nanoparticles[J].DrugEvalRes, 2010,33(6): 420-6.
[13] 晏声蕾, 胡江波, 王 薛, 等.吴茱萸碱水包油型复合纳米乳的体外释放和在体吸收研究[J].重庆医科大学学报, 2018,43(1):135-8.
[13] Yan S L, Hu J B, Wang X, et al.Release profile and intestinal absorption of evodiamine complex oil-in-water nanoemulation[J].JChongqingMedUniv, 2018,43(1):135-8.
[14] 胡江波, 何 丹, 吴建勇, 等.复方吴茱萸碱纳米乳的体外释放和大鼠在体肠吸收的研究[J].华西药学杂志, 2015,30(4): 405-7.
[14] Hu J B, He D, Wu J Y, et al.Study on drug releaseinvitroand intestinal absorption of evodiamine nanoemulsion in the rats[J].WestChinaJPharmSci, 2015,30(4): 405-7.
[15] 张 雪, 刘宏明, 雷婷婷, 等.吴茱萸碱羟丙基-β-环糊精包合物大鼠在体肠吸收特征[J].第二军医大学学报, 2016,37(11): 1387-91.
[15] Zhang X, Liu H M, Lei T T, et al.Intestinal absorption characteristics of evodiamine hydroxypropyl-β-cyclodextrin inclusion complex in rats[J].AcadJSecondMilMedUniv, 2016,37(11): 1387-91.