大鼠腰椎终板软骨干细胞的分离与鉴定
王 效,肖 良,徐宏光,金中行
(皖南医学院第一附属医院 弋矶山医院 脊柱外科,安徽 芜湖 241001)
椎间盘由上下边界椎体终板、中间由外到内依次是纤维环和髓核组成,其退变是由负荷、年龄、外伤等多种因素介导的慢性过程,可以引起椎间隙狭窄、运动阶段失稳、小关节退变,进而引起神经卡压和刺激,进一步导致临床上的腰腿痛和下腰痛症状。临床上内科治疗多以理疗为主,外科手术虽然能解决终末期症状,但是无法改变脊柱在压力负荷下的退变进程。本文利用干细胞自身生长特点,采用单克隆法培养出细胞集落,通过成骨、成脂肪及成软骨的三向诱导,证明了该集落具有干细胞性质,为椎间盘退变的治疗提供了新思路。运用干细胞治疗椎间盘退变不仅能维持脊柱正常的受力形态,而且能大幅度减少手术造成的创伤,具有巨大的潜力和社会经济效益。
1 材料与方法
1.1 主要材料 0.05%透明质酸酶,0.25%EDTA-胰酶(Gibco),0.2%二型胶原酶(Sigma),DMEM/F12(Gebico),干细胞血清(双洳),地塞米松,胰岛素,吲哚美辛,β-磷酸甘油,L-抗坏血酸-2-磷酸酯,甲基异丁基黄嘌呤(IBMX),脯氨酸,丙酮酸钠,胰岛素-转铁蛋白-亚硒酸混合物,肿瘤生长因子-b3。油红O染色剂,茜素红染色剂,甲苯胺蓝染色剂,10 cm培养皿。
1.2 方法
1.2.1 大鼠腰椎终板软骨原代细胞的获取 取4周龄大鼠幼鼠1只,给予颈椎脱臼法处死后,全部浸没于75%的酒精10 min,无菌条件下分离大鼠幼鼠腰椎L1~L5,解剖显微镜下分离终板软骨(图1),然后将分离到的软骨浸泡在含有双抗的PBS中10 min,取出后PBS冲洗3次,剪碎至1 mm×1 mm×1 mm大小。先加入0.05%的透明质酸酶,室温下作用20 min。1000 r/min离心5 min后弃上清,加入0.25%EDTA-胰酶,置于37℃温水浴箱中40 min后再次离心并弃上清,最后加入0.2%二型胶原酶,重新置于水浴箱中消化5 h左右,每30 min震荡一次以加速消化。待组织完全消化后用200目滤网过滤,1500 r/min离心5 min,弃上清,重新加入培养基吹打混匀,备用。

图1 新生4周龄大鼠幼鼠的脊柱标本
1.2.2 单克隆法获取腰椎终板软骨干细胞(stem cells derived from the lumbar endplate cartilage,EPCSCs) 单克隆法已经证实可以获得间充质干细胞[1]及人纤维环干细胞[2]。是否能成功运用此法提取EPCSCs尚未知,故我们按照50、100、200、300个/cm2把细胞接种到10 cm培养皿中并培养10 d,PBS冲洗1遍后用4%的多聚甲醛固定30 min,继续用PBS冲洗2遍后用0.1%的结晶紫染色,并计算细胞集簇形成数目。
1.2.3 成骨方向诱导分化 将用单克隆法得到的细胞,用0.25%EDTA-胰酶消化后,按照2×104个/孔的密度接种于24孔板中,待24 h细胞贴壁后,将一般培养基更换为诱导成骨分化的培养基(包含10% FBS、100 nmol/L地塞米松、10 mmol/L β-磷酸甘油和50 μmol/L L-抗坏血酸-2-磷酸酯)。每3 d换一次液,连续诱导2~3周后用茜素红染色。
1.2.4 成软骨方向诱导分化 按照Micromass法[3]进行成软骨方向分化,按照2×104个/孔的密度接种于24孔板中,待细胞融合达80%时,加入诱导软骨分化培养基(包含10% FBS、1%ITS、100 nmol/L地塞米松、50 mg/L L-抗坏血酸-2-磷酸酯和10 μg/L重组人 TGFβ1),每3 d换液1次,持续诱导3周后用甲苯胺蓝染色。
1.2.5 成脂肪方向诱导分化 按照2×104个/孔的密度接种于24孔板中,待细胞融合达80%~90%时,加入诱导脂肪分化培养基(包含10% FBS、500 μmol/L甲基异丁基黄嘌呤、1 μmol/L地塞米松、60 μmol/L吲哚美辛和 5 mg /L胰岛素),诱导3 d,然后更换为维持脂肪分化培养基(包含 10% FBS、10 mg/L胰岛素),诱导1 d,然后再更换为诱导脂肪分化培养基诱导3 d,如此循环3个周期后用油红O染色,苏木素复染后镜下观察。在此需注意的是将原代融合80%~90%时更利于脂肪诱导分化,2种不同类型的培养基更换时不要使细胞处于无培养基状态。
1.2.6 单克隆形成能力检测 单克隆形成能力是干细胞的一个重要特性,为了验证经过单克隆法获取的细胞集落是否具有这一性质,将原代获得的细胞集落用酶消化法消化后,按照100、200、300个/cm2细胞接种于10 cm的培养皿中,一式三份,加入培养基培养10~12 d,然后用0.1%结晶紫染色,计数肉眼能观察到的细胞集簇。
2 结果
2.1 单克隆法提取EPCSCs 结果显示:当大鼠腰椎终板软骨细胞接种在10 cm培养皿后,大部分细胞在2~3 d之内仍保持原来形态,可见极少数细胞贴壁。在单克隆3 d后,可见培养皿中有细胞集簇形成,5 d后,集簇明显,且大体形态呈梭形,细胞排列有序。培养10 d后细胞接近融合,此时进行传代培养。结晶紫染色可见细胞集簇,按照大于20个/簇的标准计数,发现以200个/cm2的密度接种时,细胞集簇形成最多(图2)。

A.原代细胞经单克隆法培养后形成的细胞集落;B.3 d后观察集落形成(400×);C.5 d后可见明显细胞集落。
图2 单克隆法提取EPCSCs
2.2 腰椎终板软骨细胞与干细胞的形态比较 在倒置相差显微镜下,刚接种的软骨细胞呈圆形,培养24 h后贴壁,呈圆形或椭圆形,继续培养后呈不规则四角形或者三角形,类似铺路石样。而经过单克隆培养获得的细胞,细胞整体形态较软骨细胞小,多呈椭圆形或梭形,且细胞排列方向一致(图3)。
2.3 成骨诱导分化 经过2~3周的成骨诱导后,实验组和对照组经过茜素红染色,显微镜下观察发现,经过单克隆培养获得的细胞可以形成钙结节而被染成红色,对照组无钙结节而不着色(图4)。
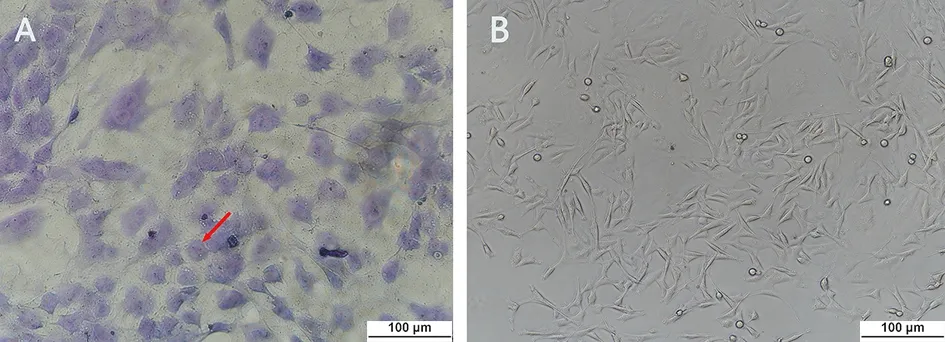
A.软骨细胞正常培养甲苯胺蓝染色(400×);B.细胞集落高倍镜下形态(400×)。
图3 成骨诱导分化

图4 成骨诱导后实验组与对照组经茜素红染色后对比(400×)
2.4 成脂肪诱导分化 经过21 d的成脂肪诱导,显微镜下可以观察到细胞上方出现较明显的脂肪滴,经油红O染色后,可见脂肪滴被染成红色,分布在细胞内。对照组无染色(图5)。

成脂肪诱导后可见脂肪滴形成,油红O染色及苏木素复染后镜下对比(400×)。
图5 成脂肪诱导分化
2.5 成软骨诱导分化 经过21 d成软骨诱导后,实验组被染成深红色,说明有软骨形成,而对照组被染成浅红色(图6)。

成软骨诱导后,实验组被染成深红色,对照组被染成浅红色(400×)。
图6 成软骨诱导分化
2.6 单克隆形成能力检测 将获得的细胞集簇接种于10 cm培养皿,培养12 d,肉眼可见细胞集落形成(图7)。

图7 获得的细胞集簇进行单克隆形成能力检测
3 讨论
腰椎软骨干细胞属于成体干细胞的一种,目前获得成体干细胞的方法主要有:①定向诱导胚胎干细胞分化为成体干细胞,但是诱导条件复杂,现已很少采用。②根据干细胞的生长特性,体外分离培养动物的某些部位来获取特定的细胞。此法采用较多。目前已知干细胞具有单克隆形成能力、成骨、成脂肪及成软骨分化的重要特性[4]。本文先利用单克隆法,将原代接种于培养皿中获得细胞集落,后用三向分化能力[5]、集落的单克隆形成能力检测,验证通过此法获得细胞具有干细胞特性。当然,本文的不足之处就是未通过免疫学方法验证该干细胞。但是通过部位取材、原代染色、单克隆能力检测、三向分化诱导这些严密环节,也能证明出所获取的为腰椎终板软骨干细胞。
干细胞的研究为疾病的临床治疗提供了新思路,早在1743 年hunter[6]就认为软骨损伤不能修复,上个世纪Namba 和Meuli[7]提出软骨的修复只发生在胚胎动物。目前成体动物缺损修复的难点在于难以获取大量的前提增殖细胞。本文提供的单克隆法大大节约了获取的经济成本,简化了获取流程,为今后进一步研究干细胞及其临床应用奠定了基础。
【参考文献】
[1] LIU S,LIANG H,LEE SM,etal.Isolation and identification of stem cells from degenerated human intervertebral discs and their migration characteristics[J].Acta Biochim Biophys Sin (Shanghai),2017,49(2):101-109.
[2] LIU C,GUO Q,LI J,etal.Identification of rabbit annulus fibrosus-derived stem cells[J].PLoS One,2014,9(9):e108239.
[3] MELLO MA,TUAN RS.High density micromass cultures of embryonic limb bud mesenchymal cells:an in vitro model of endochondral skeletal development[J].In Vitro Cell Dev Biol Anim,1999,35(5):262-269.
[4] DOMINIC M,LE BK,MUELLER I,etal.Minimal criteria for defining multipotent mesenchymal stromal cells.The International Society for Cellular Therapy position statement[J].Cytotherapy,2006,8(4):315-317.
[5] LIU LT,HUANG B,LI CQ,etal.Characteristics of stem cells derived from the degenerated human intervertebral disc cartilage endplate[J].PLoS One,2011,6(10):e26285.
[6] HUNTER W.Of the structure and disease of articulating cartilages.1743[J].Clin Orthop Relat Res,1995(317):3-6.
[7] NAMBA RS,MEULI M,SULLIVAN KM,etal.Spontaneous repair of superficial defects in articular cartilage in a fetal lamb model[J].J Bone Joint Surg Am,1998,80(1):4-10.

