樟子松2种块菌属外生菌根形态描述和分子鉴定
张文泉,罗国涛,闫 伟
(1. 凯里学院,贵州 凯里,556011;2. 内蒙古农业大学 林学院,内蒙古 呼和浩特 010019)
块菌(Truffles)是一类地下真菌,其许多种类具有极高的经济价值,是大型真菌中最为珍稀名贵的食用真菌之一,含有丰富的营养物质及多种易被人体吸收的氨基酸和无机盐,如黑孢块菌Tuber melanosporum和意大利白块菌T. magnatum,与鱼子酱、鹅肝酱同被称为三大珍品。国外对块菌的研究有近200 a历史,1985我国的刘波首次对太原块菌T. taiyuanense进行报道[1]。有人对我国的块菌资源开展了大量的研究。至今已报道的中国块菌有近30种,主要分布于我国的国块菌主要分布在四川和云南,此外西藏、新疆、山西、辽宁、吉林、福建、湖南、湖北、甘肃、北京、河北、台湾均有分布,主要集中在100° ~ 105° E,25° ~ 30° N这一条带上[2-4]。
樟子松Pinus sylvestrisvar.mongolica适应性强,抗寒、抗旱、耐贫瘠,防风固沙作用显著,在我国北方地区广泛分布。由于樟子松适应性强而且较速生,目前是我国北方地区主要的造林树种之一[5-6]。对内蒙古樟子松外生菌根真菌多样性的调查中发现[7-8],与樟子松共生的外生菌根真菌中有典型的Tuber属真菌2种块菌,对其类型进行了描述和分子鉴定,为樟子松优良乡土菌种筛选提供理论基础,同时又丰富了我国北方地区块菌菌根真菌资源多样性。
1 试验材料与方法
1.1 材料
采集地点为内蒙古自治区呼伦贝尔大兴安岭林场莫尔道嘎林业站及红花尔基林业站、乌兰察布市凉城林场、赤峰市黄岗梁林场、鄂尔多斯市伊金霍洛旗林场、辽宁章古台林场,每个林场作为一个采集地。在以上采集地的樟子松天然林或人工纯林群落中距樟子松主干0.5 ~ 1.0 m范围内,取长×宽×深为20 cm×20 cm×30 cm 带根土样,每一采集地随机采集9个样品,每一样品的采集地间隔10 m以上,采集时间分别为2014,2015年的5月与10月,每个采集地都采样2次辽东块菌。所采集的样品分别采用密封塑料袋分装,样品取回后与密封塑料袋一起置于4℃冰箱内保存。
1.2 样品处理
样品取回后尽早取样,最迟5 d内处理完毕,将土样浸泡于水中2 ~ 3 h后倒入土筛中流水冲洗,将洗净后的根样剪成小段,置于培养皿中,采用体视显微镜观察,挑选出有菌根的根段。
1. 3 形态分类
根据菌根表面特征对菌根进行初步分类,分类的依据为颜色、外延菌丝、有无根状菌索、菌核、囊状体等特征,并采用Olympus SZX10体视显微镜拍照,记录其显著特征。
对初步分类后的每一菌根类别的菌套进行剥离、制片。在Olympus BX41光学显微镜下对每一菌根类别的菌套特征、外延菌丝特征、菌索特征进行观察并详细记录。
结合菌根的外部形态特征和菌套的解剖结构特征,将菌根分成不同的形态类型,将每一种形态类型的菌根选取新鲜、幼嫩、纯净的同一分支系统菌根一部分采用1/2 FAA固定液,用于形态观察,另一部分置于CTAB缓冲液中保存,用于分子生物学鉴定。菌根系统形态分类和描述参照Agerer[9-10]。
1.4 分子鉴定
1.4.1 DNA的提取 采用 CTAB法[7]提取DNA。
1.4.2 PCR扩增 PCR反应体系(50 u1)中:Template 2 ul;ITS1s,ITS4引物各2 ul,2×Master Mixture 25 ul,不足部分用ddH2O补足,PCR扩增反应在Eppendorf Masetercycler PCR仪上进行,扩增程序:94℃预变性5 min,94℃变性40 s,56℃退火60 s,72℃延伸60 s,35个循环,72℃平展10 min,PCR产物的纯化和测序交由生工生物工程公司。序列的编辑用Bioedit完成。在GenBank(NCBI)将编辑的菌根rDNA ITS序列进行比对分析,根据序列的相似度来确定菌根真菌的分类关系。
2 结果与分析
2.1 形态和解剖结构特征
通过外生菌根的形态比较观察,发现樟子松的外生菌根中有2个类型的形态结构与块菌属相似,对这2个块菌属的樟子松外生菌根形态和解剖结构特征描述如下。
类型1。
菌根系统为单轴或羽状分支,分支1 ~ 2级,亲水。未分支的末端细尖状,末端未见明显膨大,长1 ~ 2 mm,直径0.7 mm,幼时为浅褐色,老时颜色略有加深,为黄褐色。未分支末端有少量稀疏的外延菌丝,外延菌丝较短,无根状菌索,无囊状体,无菌核(图1A,图1B)。
外层菌套为拟薄壁组织,菌套类型为M型[9-10],菌丝细胞的细胞壁较薄,菌丝有隔,无锁状联合,菌丝互相连接呈表皮细胞状,菌丝表面较光滑,弯曲分支形成网状。内层菌套与外层菌套一致(图1C,图1D)。菌套7 ~ 8 μm厚,由椭圆形细胞规则排列组成,哈蒂氏网伸入皮层细胞2 ~ 3层(图1E,图1F)。
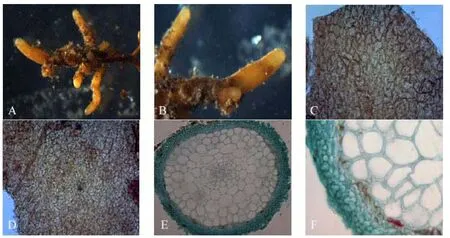
图1 类型1菌根外部形态和解剖结构图Figure 1 External morphology and anatomical features of type 1

图2 类型2菌根外部形态和解剖结构图Figure 2 External morphology and anatomical features of type 2
类型2。
菌根系统为二叉分支,分支1 ~ 2级,亲水。菌根的末端圆棒状,末端可见明显膨大,长1.0 ~ 1.5 mm,直径为1 mm,幼嫩时为浅黄色,老时为黄白色,由菌根基部至顶端颜色逐渐变淡,菌根顶端透明,发亮。菌根末端有少量绒毛状的外延菌丝,外延菌丝稀疏,较细,无根状菌索,无囊状体,无菌核(图2A,图2B)。
外层菌套为拟薄壁组织,菌套类型为Q型,菌丝细胞无规则膨大,排列整齐,紧密,菌丝细胞的细胞质均匀,细胞壁较薄,弯曲后相互缠绕形成网纹状,内层菌套为密丝组织,菌套类型为E型,菌丝细胞细胞壁薄,菌丝分支较多,且膨大,卷曲盘绕,比外层菌套的菌丝缠绕更紧密,形成网眼状(图2C,图2D)。平面观哈蒂氏网呈网状,菌丝有隔,无锁状联合,菌丝细胞呈圆形,哈蒂氏网深入到整个外皮层细胞,达内皮层细胞的外层(图2E)。
2.2 分子鉴定
将类型1,类型2所测的DNA序列在NCBI中进行比对,在可比较的碱基范围内进行DNA序列同源性比较时,自动滤除了低复杂性序列(Low-complexity sequence)和未命名的序列,BLAST查询的结果表明:类型1与编号为gi|323903052|gb| GU979037.1|的辽东块菌T. liaotongenseITS区段DNA序列同源性为500/504(99%),两者相比较的score值为905 bits,空位值Gaps=3/504(1%),E值为0.0。因此确定类型1为此种。
类型2与编号为gi|315666394|gb| HM485403.1|的卡斯蒂利亚块菌T. castilloiITS区段DNA序列同源性为518/553(94%)。两者相比较的score值为815 bits,空位值Gaps=14/553(0%),E值为0.0。BLAST查询结果中列出的100个E值为0.0的主要同源序列中所有都属于Tuber属,所以可确定类型2为块菌属的一个种。
3 结论与讨论
从菌根的外部形态观察得知:类型1与类型2两个类型菌根的颜色均比较浅,其中类型2菌根顶端呈透明状;菌根系统的分支不多,均只是在菌根表面有少量的外延菌丝而且比较稀疏。从解剖结构上可知:类型1与类型2两个类型菌根的外层菌套均为拟薄壁组织,菌丝细胞的细胞壁较薄,两个类型的菌丝均有隔,无锁状联合,内外层菌套的菌丝均出现不同程度的弯曲,形成网纹状。类型1与类型2在形态和解剖结构特征上与之前在白桦Betula platyphylla上发现的菌根Tuberaceaesp[11]十分相似,具有块菌属外生菌根区别于其他属外生菌根的典型外部形态特征及解剖结构特点,初步可确定为块菌属的外生菌根。
进一步进行分子鉴定可知:类型1,类型2均为块菌属的外生菌根真菌,类型1可鉴定到种,为辽东块菌。
目前,对块菌的研究主要集中在系统分类学、生态学、生物化学及人工栽培等方面,因块菌属子囊果生于地下,采集困难,大多数种类的地理分布尚不明确,该属大多数种类的遗传多样性研究还存在一定的困难,此方面的研究鲜见报道[12-16]。本文通过分子鉴定后对与樟子松共生的2种块菌类型外生菌根的外部形态及解剖结构进行了描述,既扩大了樟子松外生菌根类型的多样性,为樟子松优良乡土菌种筛选提供理论基础,又为块菌属外生菌根的鉴定及块菌属种类的遗传多样性分析提供依据,并丰富了我国北方地区块菌菌根真菌资源多样性。
块菌属分类鉴定大多是依据其子囊果的形态特征进行区分,但许多形态相似的或相近的种的区分成为难题,能否通过其所形成的外生菌根的特征及提取 DNA依靠分子生物学等现代研究手段来寻找更多更可靠的分类证据?新近的报道指出:我国的块菌属资源丰富,而且独特,尚存在着大量的新分类群未被发现[17-19],诸多已知的种类通过研究与比对虽与欧洲及北美地区的某些种类极其相似,但其分布范围却不尽相同,如:樊永军等[20]人在贺兰山发现冬块菌Tuber brumale在内蒙古地区的新记录种。因此,针对我国块菌属系统完整的分类描述及大量的资源调查工作还有待进一步加强。
参考文献:
[1] 刘波. 中国地下真菌新种和新记录[J]. 真菌学报,1985,4:84-89.
[2] CHEN J,GUO S X,LIU P G. Species recognition and cryptic species in theTuberindicum complex[J]. PLoS One,2011,6(1):1-10.
[3] 陈应龙,弓明钦. 块菌资源多样性及其地理分布[J]. 中国食用菌,2000,19(6):25-26
[4] 万山平,郑毅,刘培贵,等. 攀枝花块菌-华山松菌根根际土壤可培养细菌的多样性研究[J]. 植物分类与资源学报,2015,37(6):861-870.
[5] 张文泉,闫伟. 樟子松愈伤组织诱导及植株再生的初步研究[J]. 中南林业科技大学学报,2012,32(11):37-41.
[6] 张文泉,闫伟. 外生菌根菌对樟子松苗木生长的影响[J]. 西北植物学报,2013,33(5):0998-1003.
[7] 张文泉. 樟子松外生菌根真菌多样性及菌根生物技术研究[D]. 呼和浩特:内蒙古农业大学,2013:78-80..
[8] 魏杰,张文泉,闫伟. 樟子松4种深色外生菌根研究[J]. 干旱区资源与环境,2015,29(4):178-183
[9] AGERER R. Characterization of ectomycorrhizae. In:Norris J R,Read D A,Varma A K (eds). Techniques for the Study of Mycorrhiza.Methods in microbiology[M]. Academic Press,London,1991:25-73.
[10] AGERER R. DAIELSON R M. EGLIS.et al.(eds) Discriptions of ectomycorrhizae[J]. Nova Hedwigia,1996,23-183.
[11] 樊永军,闫伟. 内蒙古地区白桦外生菌根形态类型及分子鉴定[J]. 西北植物学报,2013,33(11):2209-2215.
[12] 王福强,张世奇. 块菌的国内外研究及其有效活性成分的应用[J]. 农产品加工,2011,1(1):63-67.
[13] 刘培贵,王云,王向华,等. 中国块菌要览及其保护策略[J]. 菌物研究,2011,9(4):232-243.
[14] 徐阿生,郑维列. 中国块菌属真菌研究述评[J]. 林业科学研究,2003,16:73-85.
[15] 陈应龙,弓明钦. 块菌资源多样性及其地理分布[J]. 中国食用菌,2000,19(5):6-7.
[16] 陈娟,邓晓娟,陈吉岳,等. 中国块菌属多样性[J]. 菌物研究,2011,4:244-245.
[17] 任德军. 中国块菌属(Tuber)系统学研究[D]. 福州:福建农林大学,2003:9-11..
[18] 方明. 15个块菌菌株的形态学与分子生物学鉴定[D]. 长春:吉林大学,2006:24-26.
[19] 李淑超,乔鹏,刘思思,等. 块菌属分子系统学及菌根共生机制研究进展[J]. 菌物学报,2017,36(2):131-144
[20] 樊永军,赵艳玲,陈秀莉,等. 2种块菌的物种分子鉴定与系统地位分析[J]. 西北植物学报,2016,36(8):1560-1565.
——基于嵌入理论的分析视角

