水淹胁迫及排涝对榉树幼苗生长和生理特性的影响
樊菲菲,袁位高,李婷婷,吴初平,张 觉,焦洁洁
(1. 浙江农林大学 林业与生物技术学院,浙江 杭州 311300;2. 浙江省林业科学研究院,浙江 杭州 310023)
水分是维持植物正常生长的必要条件,但土壤中水分过多会阻碍植物的呼吸,造成植物组织缺氧,对植物的形态特性和生长发育会产生显著的负影响[1],如叶绿素降解加剧[2],保护酶系统受损[3],可溶性糖和可溶性蛋白含量发生变化[4],加剧植物叶片中细胞膜脂过氧化程度,即丙二醛含量的积累[5]。此外,土壤中的水分胁迫对一些濒危稀有物种的影响更大,如沙冬青Ammopiptanthus mongolicus[6],杜鹃红山茶Camellia azaleaWei[7]等,故而,水分胁迫可能是影响物种灭亡的主要因子之一。
榉树Zelkova serrata属榆科Ulmaceae榉树属Zelkova落叶大乔木,国家二级重点保护野生植物,主要分布在我国秦岭及淮河以南,长江中下游至华南、西南各省区[8],浙江是榉树主产区之一。榉树具有较高的经济和观赏价值[9],是浙江省优良的平原、河道绿化树种之一。目前,国内关于榉树耐水淹能力的研究较少,教忠意等[10]对榉树受涝后叶形、叶色、脱落的叶片数、皮孔和不定根产生时间等形态特征进行了观察,找出树种受涝时间长短的临界值和受淹后的形态变化,以此来判断榉树耐水淹能力的强弱。本试验通过人工模拟水淹条件,测定不同水淹梯度下榉树幼苗的叶片总叶绿素含量、超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性、丙二醛(MDA)含量、可溶性糖和可溶性蛋白含量,旨在探索水淹胁迫对榉树的伤害机制以及榉树对水淹环境的适应机制,为提高榉树栽培和造林工作中水分管理技术和浙江省河道生态建设中树种的选择提供一定的理论依据。
1 材料与方法
1.1 试验地概况
实验地点设在浙江省林业科学研究院温室大棚,地处 118°21′ ~ 120°30′ E,29°11′ ~ 30°33′ N。该区属典型的亚热带季风性湿润气候,年平均气温15.3 ~ 18.5℃,最低月均气温2.7 ~ 7.9℃,最高月平均气温27.0 ~ 29.5℃,≥10℃年积温4 800 ~ 5 800℃,无霜期225 ~ 280 d;年降水量1 000 ~ 2 000 mm,以春雨、梅雨、台风雨为主,7 ~ 8 月有伏旱。
1.2 试验设计
实验材料为2015年于浙江省建德市欣林中心播种培育的2年生营养袋容器苗(营养袋内径和高均为15 cm),选择生长状况相近的苗木作为试验对象,平均苗高和地径分别为(45.29±3.69)cm和(0.82±0.66)cm。设置4个处理,分别为正常、轻度胁迫、中度胁迫和重度胁迫,即对照(CK)、根淹(RF)、半淹(SF)和近全淹(AF)。每个处理重复5次,即5株。具体处理情况:幼苗浇透后的次日,将其(对照除外)放入81 cm×70 cm×65 cm的塑料箱中进行水淹处理。用泰州市正大科教仪器设备厂生产的ZD-1608土壤水分专用检测仪保持CK盆内土壤含水量在75% ~ 80%;RF,土壤表面渗水,水位不超过1 cm;SF,植株地上部分一半水淹;AF,植株顶端露出水面约3 cm。之后每天保持水位,每隔3 d左右进行换水,保证水体干净。将榉树的采样间隔期定为7 d,当水淹致使植株叶片萎蔫坏死约50%时,停止实验。胁迫从2016年8月1日开始,9月4日结束,水淹共35 d。实验结束时,即于9月5日将植物从塑料箱中取出进行排涝,盆内土壤含水量达到CK水平处理之后继续保持,14 d后(R14 d),即于9月18日测定植株各项生理指标。各水淹处理和排涝恢复实验的采样均在早上进行,取每株苗木上中下部位生长良好、大小均一的成熟叶片3 ~ 4片,用自来水清洗叶片表面污物,再用蒸馏水冲洗2 ~ 3次后,擦净表面水分,混合采集叶片后进行生理指标测定,重复3次。
1.3 测定内容与方法
于水淹胁迫开始前和排涝14 d后分别测定各处理下植物的苗高和地径。用卷尺测量苗高,精确到0.1 cm;用游标卡尺在高于土面1 cm处测定地径,精确到0.01 mm。定株观测,每处理5次重复。
相对增长量=排涝后测量值-胁迫前测量值
相对增长速率=(相对增长量/胁迫前测量值)×100%
测定各项生理指标时,均取0.1 g样品。总叶绿素含量的测定采用直接浸提法测定;超氧化物歧化酶(SOD)活性采用氮蓝四唑还原法测定;丙二醛(MDA)含量采用硫代巴比妥酸法测定;可溶性蛋白含量采用考马斯亮蓝法测定[11];过氧化物酶(POD)活性参考汪南阳等采用愈创木酚法测定[12]。
可溶性糖含量(μmol·g-1)=可溶性糖浓度×V/(FW×103)(V:提取液总体积,mL;FW:样品鲜质量,g)
可溶性糖浓度(μmol·g-1)=11.71A450[13],其中A450测定方法同MDA的测定。吸光值测定均采用UV-4802S双光束紫外可见分光光度计进行。
1.4 数据处理
所得实验数据用Excel 2016进行整理,用Origin Pro 8.5软件作图,用SPSS 22.0软件进行单因素方差分析以及相关性分析,并用Duncan法进行多重比较。
2 结果与分析
2.1 水淹胁迫对榉树苗高和地径的影响
由表 1可知,水淹胁迫及恢复后,随着水淹胁迫程度的增加,榉树幼苗的生长受到了显著的抑制作用。3个水淹处理下的苗高相对增长量均显著低于CK(P<0.05),RF,SF,AF分别比CK下降了63.38%,70.0%,84.93%。榉树幼苗地径相对增长量的变化趋势同苗高相对增长量的变化趋势相比,下降幅度较小。三个水淹处理下的地径相对增长量,从轻度到重度分别比CK下降了13.73%,37.25%,53.92%。可以发现AF组各指标的下降幅度最大,且处于4组处理的最低水平。
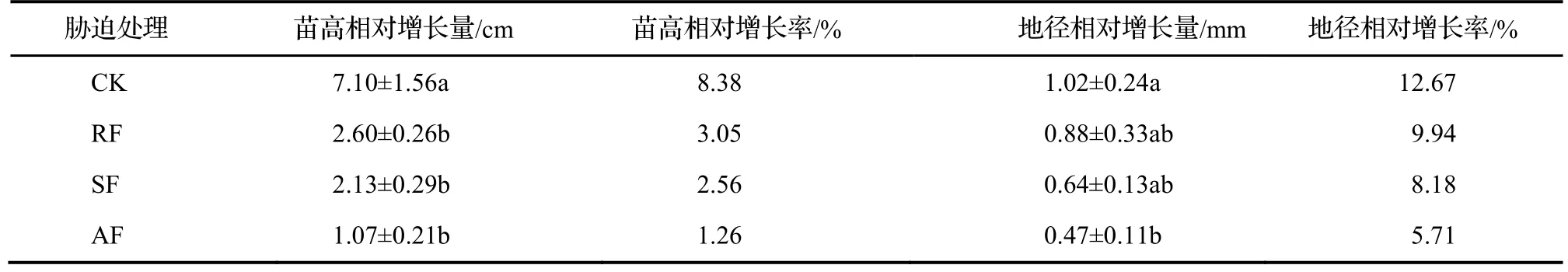
表1 不同水淹处理对榉树苗高、地径生长的影响Table 1 Effect of different treatments of water logging on height and ground diameter growth of Z. serrata seedlings
2.2 水淹胁迫对榉树叶片叶绿素含量的影响
由图 1可见,CK处理榉树幼苗叶片叶绿素含量的变化随着时间的延长呈先升后降的趋势,生长前、中期叶绿素含量较高,随后明显下降。RF组没有改变叶绿素含量的总体变化趋势,但明显降低了叶绿素的含量,在胁迫时间超过7 d之后,显著低于CK(P<0.05)。SF组叶绿素含量的变化情况同 RF组相似,但其叶绿素含量一直维持在低于CK却高于RF的水平。AF组的榉树叶片叶绿素含量明显低于 CK,其叶绿素含量的变化趋势受到的影响最显著。R14 d后,各处理下榉树叶片的叶绿素含量分别比胁迫0 d时下降了20.50%,38.54%,38.66%,59.28%。此时,3组水淹胁迫处理下的叶绿素含量显著低于CK(P<0.05),其中,AF处理的叶绿素含量处于4组胁迫处理的最低水平。
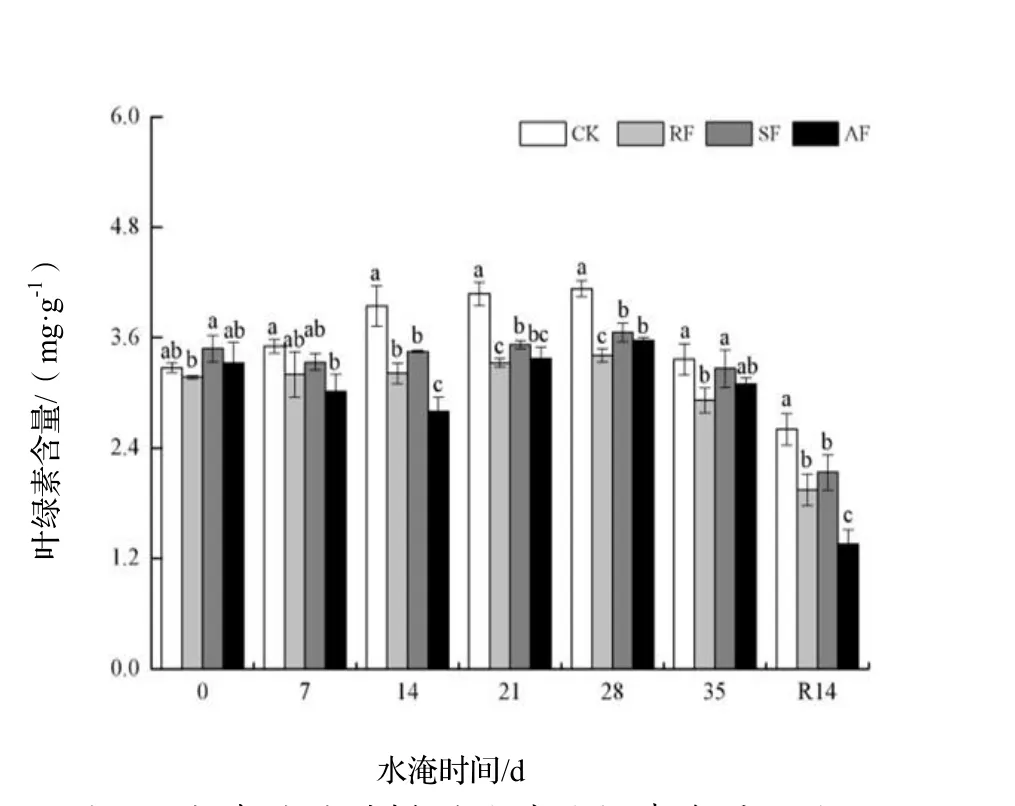
图1 水淹胁迫对榉树叶片叶绿素含量的影响Figure 1 Effect of water logging on chlorophyll content in leaves of Z. serrata seedlings
2.3 水淹胁迫对榉树叶片2种主要抗氧化酶活性的影响
随着胁迫时间的延长,不同处理下榉树幼苗叶片SOD活性的变化趋势也不同(图2A)。CK组的SOD活性在28 d前随幼苗生长而逐渐下降,在28 d时下降至最小值,比0 d降低了41.32%,而后开始回升,至35 d时酶活性接近0 d时的水平。随着胁迫程度的加深,3组水淹处理下SOD活性的升降变化幅度加大,均在生长前期不断下降,又在21 d时急速上升,与CK相比,回升速度加快;之后3组水淹处理内SOD酶活性的变化趋势各有不同,胁迫至35 d时,RF和AF组的酶活性分别比0 d升高了32.64%,39.27%,而SF组的酶活性仅升高9.76%。总体上看,3组水淹处理下榉树叶片SOD活性在胁迫中后期一直保持着显著高于CK组的水平(P<0.05),其中,AF组的酶活性处于处理间最高水平。至R14 d时,各处理下榉树叶片SOD活性与0 d时相比升降幅度不大,其中,AF组的酶活性上升,其他则下降。此时,只有AF组的酶活性显著高于其他3组处理水平(P<0.05)。

图2 水淹胁迫对榉树叶片抗氧化酶活性的影响Figure 2 Effect of water logging on antioxidant enzyme activities in leaves of Z. serrata seedlings
由图2B可见,随着胁迫时间的延长,各水淹处理下榉树幼苗叶片POD活性的变化总体上均呈先升后降的趋势,且均在胁迫至28 d时达到组内最大值,依次比0 d提高了0.59,1.17,1.14,1.34倍。但水淹胁迫后对3组水淹处理下POD酶活性的升降幅度产生了不同影响,RF和SF组的酶活性在28 d之前一直处于较低的水平,在28 d时酶活性急速上升并显著超过CK组(P<0.05);AF组的POD酶活性在胁迫时间超过7 d之后,一直维持着明显高于CK组的水平。至35 d时,4组处理下叶片POD的酶活性开始大幅度下降,但依旧高于0 d,分别升高了15.01%,39.25%,50.03%,79.67%,AF组的酶活性显著高于其他组水平(P<0.05)。至R14 d时,CK和RF组的酶活性分别比0 d下降了31.05%,24.50%,而其他处理下依旧保持较高的酶活性水平。此时,AF组的POD酶活性处于4组处理间的最高水平。
2.4 水淹胁迫对榉树叶片丙二醛含量的影响
由图3可见,随着胁迫时间的延长,各处理下榉树幼苗叶片 MDA含量均呈先升后降的变化趋势,但 CK组的MDA含量在14 d时已经上升到组内最大值,而3组水淹处理下的MDA含量均在21 d时达到最高水平,且显著高于CK(P<0.05),分别比0 d提高了1.30,1.70,1.57倍;至35 d时,4组处理下的MDA含量依次比0 d升高了26.0%,66.60%,73.02%,79.36%。RF组MDA含量的升降幅度小于CK组;SF组MDA含量的水平整体上高于RF;AF组的MDA含量在整个水淹期内一直保持着较高水平,在胁迫中后期显著高于其他处理(P<0.05)。至R14d时,各水淹处理下榉树叶片MDA含量与0 d相比分别升高了16.23%,17.20%,19.05%,17.01%。
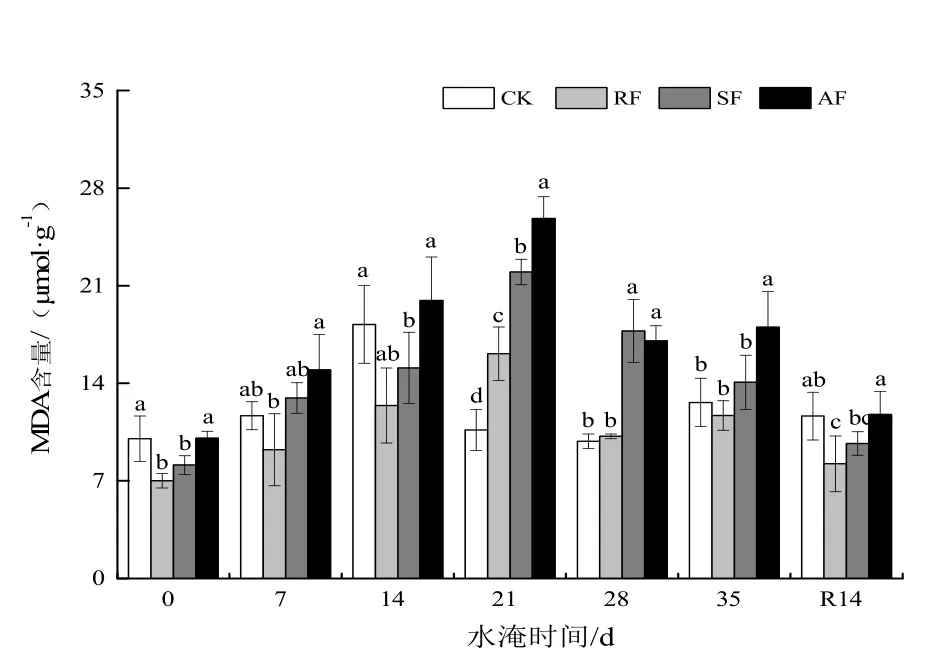
图3 水淹胁迫对榉树叶片MDA含量的影响Figure 3 Effect of water logging on MDA content in leaves of Z. serrata seedlings
2.5 水淹胁迫对榉树叶片渗透调节物质的影响
各胁迫处理下榉树叶片可溶性糖含量随着时间的延长变化波动较大(图4A)。CK组内叶片可溶性糖含量呈不断大幅度下降趋势,在35 d时比0 d时下降了55.0%。3个水淹组内可溶性糖的含量总体上呈波浪性变化,在胁迫前期含量不断下降,随后含量上升,胁迫至35 d时又下降,分别比0 d下降了41.18%,12.70%,17.32%。RF和SF组内可溶性糖含量在胁迫中后期显著超过CK(P<0.05);AF组内含量则在整个水淹过程中一直处于4组处理的最高水平。至R14 d时,只有CK组内的可溶性糖含量急速上升,比0 d时高了36.17%,而其他3组的可溶性糖含量均显著低于CK组(P<0.05),且基本恢复至0 d时的水平范围内。
由图4B可见,各处理下可溶性蛋白含量的变化幅度也很大,整体上均幼苗生长前期呈不同程度下降,随后含量上升。CK组的可溶性蛋白含量在35 d时上升到组内最大值,比0 d高了14.71%,但经过水淹后,缩短了蛋白含量达到处理内最高水平的时间。RF和SF组、AF组的蛋白含量在28 d、21 d达到峰值,分别比0 d高了36.35%,42.18%,13.29%。RF组的蛋白含量降低或升高的幅度明显大于其他处理;水淹前SF组内蛋白含量水平最低,但在胁迫中后期上升速度较快,并显著超过CK组的水平(P<0.05);AF组的蛋白含量的下降速度较快,至35 d时显著低于其他处理内水平(P<0.05),比0 d下降了40.62%。至R14 d时,3组水淹处理下的可溶性蛋白含量均显著低于CK(P<0.05),分别比0 d降低了62.22%,53.92%,67.16%。
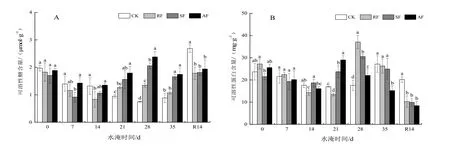
图4 水淹胁迫对榉树叶片渗透调节物质的影响Figure 4 Effects of flooding stress on osmotic adjusting substances in leaves of Z. serrata seedlings
2.6 水淹胁迫下榉树各项生理指标间的相关性
由表2可知,各项生理指标之间相关性较弱,但存在一定联系。叶绿素总含量与POD活性呈显著正相关,与可溶性糖含量呈显著负相关,与可溶性蛋白含量呈极显著正相关;SOD活性与POD活性、可溶性糖含量呈极显著正相关,与MDA含量、可溶性蛋白含量呈显著正相关。POD活性与可溶性蛋白含量呈显著正相关。再结合各指标在水淹胁处理下响应的稳定性,确定主要指标为叶绿素、酶活性和MDA。
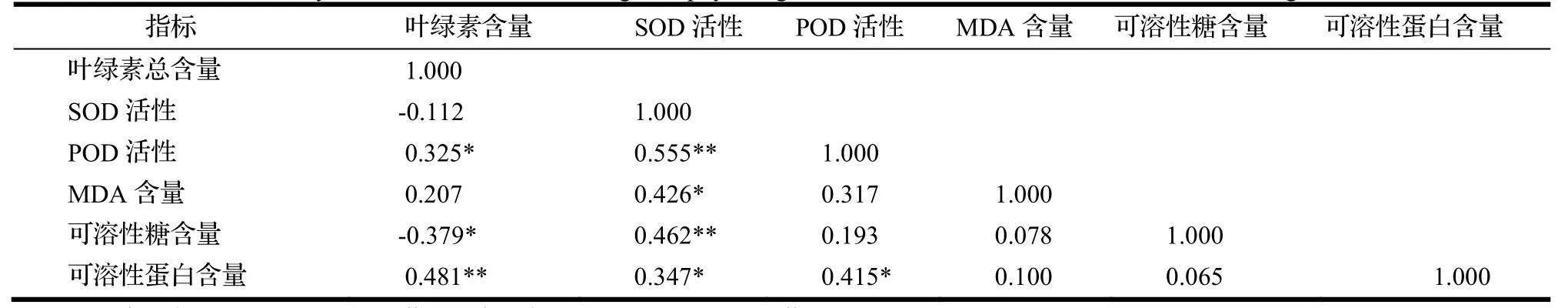
表2 不同水淹处理下榉树叶片生理指标变化的相关性分析Table 2 Analysis of correlation about changes of physiological indexes of Z. serrata under different flooding treatment
3 讨论与结论
在水淹环境下,长时间的供氧不足将导致植物由有氧呼吸逐渐向无氧呼吸转变,植物生长因此受到影响[14]。植物生长受到的抑制作用一般随胁迫程度的加深而越显著。本实验中,处理间的苗高和地径相对增长量的顺序均为 CK>RF>SF>AF。榉树在水淹环境中可采取“静默策略”[15],即抑制地上部分生长,减少养分消耗,提高自身对水淹的耐受性[16]。
水淹造成厌氧或缺氧的生长环境,阻碍植物根系内部矿物质的运输,造成地上部分营养不良,叶片发黄,叶绿素含量下降[17-18]。本实验中,3种水淹胁迫明显抑制了榉树叶片叶绿素含量的积累;排涝后,水淹组的叶绿素含量均小于胁迫前水平,CK组的叶绿素含量也有所下降,下降幅度大小顺序为:AF>SF>RF>CK。植物自身生长受到季节更替时的气温影响,导致叶片叶绿素含量有所下降。另外,随着胁迫程度的加深,水淹植物的叶绿体膜结构受到的损害越严重,加快了叶绿素的降解[19]。水淹植物的叶绿素含量受到生长条件和胁迫环境的双重影响而下降更为显著。
SOD和 POD是植物体内普遍存在且活性较高的两种活性氧清除酶,在植物受到逆境胁迫时,可抵御活性氧自由基带来的毒害作用;MDA含量的高低可以反映细胞膜脂过氧化程度和植物逆境条件反应的强弱[20-23]。本实验中,水淹胁迫显著提高了酶活性和MDA含量,且排涝后重度胁迫下酶活性仍保持较高活性,MDA含量则下降接近水淹前水平。说明该胁迫未超出植物细胞的承受能力,细胞仍可以通过调节两者之间的相互作用,清除细胞内过多氧自由基并降低膜脂过氧化程度来提高植物的逆境适应性和存活能力[24-25]。
植物在水淹环境下可以通过调节可溶性糖和可溶性蛋白的含量来保持细胞渗透势的平衡,以此抵抗水分胁迫带来的伤害[18]。本实验中,3种水淹胁迫不同程度地提升了榉树的可溶性糖和可溶性蛋白的含量,植物自身可通过积累大量可溶性糖和蛋白来降低细胞渗透势,缓解水淹下胁迫对细胞膜系统造成的伤害[20,26]。排涝后前者含量仍能维持在水淹前的生理水平范围内,但后者含量显著下降,其中重度水淹胁迫的下降幅度最大。此时胁迫已超过植物细胞的耐受极限,蛋白酶的活性迅速提高,加快了蛋白质的水解,促使蛋白质大量降解成可溶性糖等物质[27-28],以此提高榉树对水分胁迫的适应性。这与利容千等[29]对植物抗性指标研究所得结论一致。
综上所述,榉树会通过改变生长形态和生理调节作用来应对水淹胁迫带来的伤害,即使在重度胁迫下榉树仍具有较高的酶活性、膜脂过氧化程度和渗透调节能力。所有受淹植株在排涝后均能重新萌叶,表现出较强的耐水淹能力与自我恢复能力。这一结论为榉树在推进“森林浙江”、“1818平原绿化行动”、“五水共治”中晋升为优良平原、河道绿化树种中进一步提供了有效依据。
参考文献:
[1] 衣英华,樊大勇,谢宗强,等. 模拟淹水对枫杨和栓皮栎气体交换、叶绿素荧光和水势的影响[J]. 植物生态学报,2006,30(6):960-968.
[2] 赵竑绯,赵阳,张驰,等. 模拟淹水对杞柳生长和光合特性的影响[J]. 生态学报,2013,33(3):898-906.
[3] 杨鹏,胥晓. 淹水胁迫对青杨雌雄幼苗生理特性和生长的影响[J]. 植物生态学报,2012,36(1):81-87.
[4] 卓仁英,陈益泰. 木本植物抗涝性研究进展[J]. 林业科学研究,2001,14(2):215-222.
[5] 罗祺,张纪林,郝日明,等. 水淹胁迫下10个树种某些生理指标的变化及其耐水淹能力的比较[J]. 植物资源与环境学报,2007,16(1):69-73.
[6] 何炎红,田有亮,林涛等. 水分胁迫对沙冬青气体交换和叶绿素荧光的影响[J]. 广东农业科学,2014,22(10):42-47.
[7] 吴刘萍,王廷芹,杨瑞. 珍稀濒危植物杜鹃红山茶嫁接苗对水分胁迫的生理响应[J]. 福建林业科技,2012,39(3):51-56.
[8] 汪灵丹,张日清. 榉树的研究进展[J]. 广西林业科学,2005,34(4):188-191,211.
[9] 赵旺兔. 榉树生物学特性及园林应用研究[D]. 南京:南京林业大学,2003:2-6.
[10] 教忠意,罗祺,张纪林,等. 10个树种耐水淹能力的比较[J]. 江苏林业科技,2007,34(1):15-18.
[11] 高俊凤. 植物生理实验学实验指导[M]. 北京:高等教育出版社,2006:74-77,142-144,210-213.
[12] 汪南阳. 盐胁迫下杨树的生理响应及其胞外蛋白双向电泳分析[D]. 南京:南京林业大学,2013:13.
[13] 徐世伟. 榉树、弗吉尼亚栎和女贞幼苗的耐旱特性及评价[D]. 南京:南京林业大学,2014:10.
[14] MUKASSABI T A,POLWART A,COLESHAW T,et al. How long can young Scots pine seedlings survive waterlogging[J]. Trees,2012,26(5):1641-1649.
[15] NISHIUCHI S,YAMAUCHIi T,TAKAHASHI H,et al.Mechanisms for coping with submergence and waterlogging in rice[J]. Rice,2012,5(17):2314-2322.
[16] 熊怀阳,阳菁,安保光,等. 水稻适应淹水胁迫的分子机理及品种改良[J]. 武汉大学学报:理学版,2013,59(1):17-23.
[17] 王萍,胡永红,王丽勉,等. 观赏植物耐涝性鉴定指标的种类及其评价方法[J]. 北方园艺,2007,14(11):78-81.
[18] 谭淑端,朱明勇,张克荣,等. 植物对水淹胁迫的响应与适应[J]. 生态学杂志,2009,28(9):1871-1877.
[19] 陈芳清,郭成圆,王传华,等. 水淹对秋华柳幼苗生理生态特征的影响[J]. 应用生态学报,2008,19(6):1229-1233.
[20] 潘澜,薛立. 植物淹水胁迫的生理学机制研究进展[J]. 生态学杂志,2012,31(10):2662-2672.
[21] 安玉艳,梁宗锁,郝文芳. 杠柳幼苗对不同强度干旱胁迫的生长与生理响应[J]. 生态学报,2011,31(3):716-725.
[22] SUN O J,SWEET G B,WHITHEAD D,et al.Physiological responses to water stress and waterlogging in Nothofagus species[J]. Tree Phsiol,1995,15(10):220-225.
[23] 张秋芳,吕春平,贝昭贤,等. 野外模拟增温对亚热带杉木叶片膜脂过氧化及保护酶活性的影响[J]. 植物生态学报,2016,40(12):1230-1237.
[24] 梁建萍,贾小云,刘亚令,等. 干旱胁迫对蒙古黄芪生长及根部次生代谢物含量的影响[J]. 生态学报,2016,36(14):4415-4422.
[25] 孙一荣,朱教君. 水分处理对沙地樟子松幼苗膜脂过氧化作用及保护酶活性影响[J]. 生态学杂志,2008,27(5):729-734.
[26] 李昳乐. 青竹复叶槭耐水淹与耐低温生理研究[D]. 河南:河南农业大学,2008:2-4.
[27] 陈蕾太,孙爱清,杨敏,等. 逆境条件下小麦种子活力与种子萌发相关酶活性及其基因表达的关系[J]. 应用生态学报,2017,28(2):609-619.
[28] HONG Z,LIU Q Y,ZHANG X Q. Physiological responses on Sedum yvesii under Water Stress[J]. Adv Mater Res,2015,3(1073):52-60.
[29] 利容千,王建波. 植物逆境细胞及生理学[M]. 武汉:武汉大学出版社,2002:34-37.

