神经肌肉电刺激对慢性阻塞性肺疾病患者骨骼肌的康复研究进展
刘景新,吴卫兵,刘晓丹,胡 军,严隽陶
1.上海体育学院运动科学学院,上海市200438;2.上海中医药大学康复医学院,上海市201203
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种具有较高发病率和死亡率的慢性呼吸系统疾病,据统计全球至少2.1亿COPD患者[1],给社会和家庭带来沉重的负担。预计COPD的全球死亡率在2020年上升至第3位[2];在2000~2013年间,我国COPD死亡率已上升至我国全因死亡的第3位[3]。骨骼肌萎缩及功能障碍作为COPD的肺外损伤效应之一,近年来发现与患者的生活质量和死亡率息息相关。研究发现[4-5],运动康复锻炼能够有效提高骨骼肌功能,防治骨骼肌萎缩,对于改善患者预后,提高生活质量,预防疾病进一步发展具有重要意义。然而对于重度或极重度,特别是处于急性加重期的COPD患者,由于运动耐力下降、呼吸困难等临床症状的影响,极大限制了运动康复锻炼的实施。有研究证实急性加重期COPD患者骨骼肌消耗及功能下降更明显[6-7]。探究适合运动受限,特别是急性加重期COPD患者改善骨骼肌功能的治疗方式具有重要意义。
神经肌肉电刺激(neuromuscular electrical stimulation,NMES)通过低频脉冲电流刺激相应的神经或肌肉,从而被动引起肌肉收缩,达到提高肌肉功能以及治疗神经肌肉系统疾病的目的。长期以来NMES主要应用于前交叉韧带损伤[8-9]、脑卒中[10-11]、吞咽功能障碍[12-13]等中枢及周围神经系统损伤疾病的康复,近年来国内学者开始将NMES应用于COPD康复治疗的临床和基础研究,认为NMES在提高患者骨骼肌肌力、耐力,改善运动能力等方面能够取得与运动锻炼相类似的效果,对于运动受限的COPD患者具有重要的意义[14-16]。
本文拟通过对国内外NMES对COPD康复治疗的现状进行综述,旨在为NMES在COPD康复治疗中的应用提供参考。
1 NMES及其在COPD中的临床应用
1.1 NMES概述
NMES作为一种比较成熟的物理治疗技术,在临床中得到广泛应用,目前主要包括经皮神经电刺激(transcutaneous electrical nerve stimulation,TENS)和功能性电刺激(functional electrical stimulation,FES)两种主要的形式[17-18]。TENS将电极片作用于目标肌肉的皮肤表面,通过低频电刺激使得目标肌群运动神经元去极化,从而诱导肌肉产生无意识收缩。TENS在20世纪70年代主要应用于各类疼痛的治疗,在缓解疼痛方面具有良好的效果;在20世纪90年代主要应用于脑卒中患者的临床康复治疗。FES通过预先设定的刺激程序,利用一定强度的低频脉冲电流刺激肌肉,诱发肌肉收缩或模拟肌肉正常自主运动。NMES的刺激参数主要包括刺激频率、脉宽、脉冲幅度、通电断电比等,患者事先设定参数,将电极片放置于相应的肌肉表面即可;治疗过程中生理代谢负荷较低,具有良好的接受性,十分适合家庭、社区及康复治疗中心使用[19-20]。NMES治疗神经肌肉系统疾病的优点在于受患者主观意志影响较小,且不易引起呼吸困难等症状;缺点是对患者久坐的日常行为模式改变没有帮助。
1.2 NMES在COPD中的临床应用
目前,国内COPD患者的NMES治疗尚未引起足够的重视,国外则进行了比较广泛的临床研究。NMES治疗参数是影响患者康复效果的主要因素。国外COPD患者的电刺激频率通常为15~75 Hz,脉宽300~400 μs,脉冲幅度10~100 mA,各个研究间通电断电比的差异比较大,不同的刺激变量(频率、脉宽、振幅等)均可影响NMES过程中肌纤维的募集数量、类型以及运动单位募集的顺序,进而影响患者的康复效果(表1)。COPD患者NMES的最佳治疗参数仍有一定的争议。
现阶段的研究表明,NMES的电刺激频率是影响患者骨骼肌功能改善的最重要因素,高频NMES在提高患者骨骼肌肌力、肌耐力,改善运动能力方面比低频NMES效果更佳[21]。然而不同患病等级、身体状况的患者对NMES的电刺激频率耐受性存在一定的差异,因此研究普遍采用患者最大耐受水平的刺激频率;随着治疗的进行患者对NMES刺激频率的耐受性也会提高,形成良性循环[14,22-23]。未来研究仍需进一步优化COPD患者NMES治疗方案,以及针对不同病程患者结合运动疗法的康复,定制个性化的治疗方案。
国外一些研究[6,14,16,21-29]中COPD患者的NMES治疗方案见表1。
2 NMES对COPD患者骨骼肌的康复效果
2.1 骨骼肌肌力
骨骼肌肌力下降是COPD骨骼肌功能障碍的突出表现之一,同样是影响患者死亡率的重要因素[30-31]。现阶段研究表明,NMES能够有效提高患者骨骼肌肌力。Abdellaoui等[32]对急性加重期COPD患者股四头肌和股后肌群进行35 Hz的NMES后,患者股四头肌最大自主收缩肌力(maximal voluntary contraction,MVC)平均增加10 kg。与Abdellaoui等的研究结果类似,Vivodtzev等[33]发现NMES干预6周后,患者股四头肌肌力增加(11%±5)%。患者骨骼肌肌力的增加与NMES的刺激频率密切相关,刺激频率越大患者肌力提高越明显。另外,有研究表明对于急性加重期COPD患者进行NMES能够有效减缓肌力下降。Giavedoni等[6]通过对急性加重期COPD患者NMES 2周后发现,NMES组下肢MVC增加(19.2±6.1)N[(8.4±2.4)%],非NEMS组下肢肌力下降(2.9±5.3)N[(2.2±2.6)%]。刺激频率是影响NMES提高患者骨骼肌肌力的重要因素,低频NMES对于肌力的提高不明显,高频NMES效果更佳[21]。
此外,Kaymaz等[15]、Tasdemir等[16]和 Sillen 等[21]的研究还发现,NMES在提高COPD患者上、下肢骨骼肌肌力方面效果与常规运动康复锻炼效果类似。同样有学者发现,在运动锻炼的基础上增加NMES对于提高患者肌力效果更明显,如Akar等[34]发现,运动锻炼结合NMES对于提高患者上、下肢肌力均具有较好效果,而单纯运动锻炼患者上肢肌力提高并不明显。Vivodtzev等[35]的研究结果与Akar相类似,发现NMES结合运动锻炼组患者股四头肌MVC增加(97±71)N,而运动锻炼组患者股四头肌MVC仅增加(36±34)N。
综上所述,NMES能够有效提高COPD患者骨骼肌肌力,而提高COPD患者骨骼肌肌力的康复效果依赖于一定的刺激频率;NMES提高骨骼肌肌力的康复效果与常规运动锻炼类似,NMES结合运动锻炼对于提高患者骨骼肌肌力效果更佳。
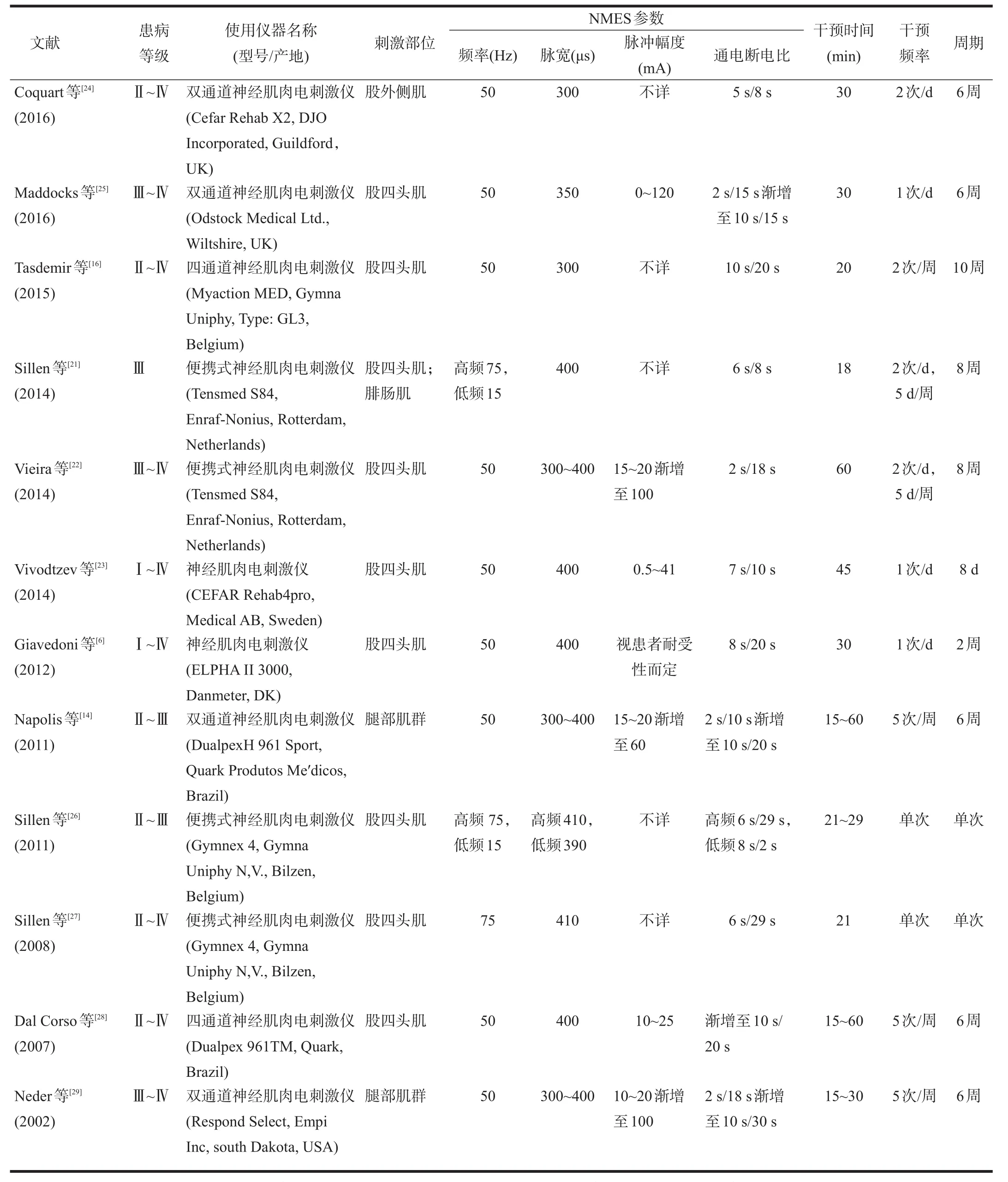
表1 COPD患者NMES治疗方案
2.2 骨骼肌耐力
骨骼肌耐力下降是COPD骨骼肌功能障碍的又一突出表现,与肌纤维类型的转变、肌纤维横截面积减小有关。现阶段的研究表明,NMES通过电刺激引起COPD患者骨骼肌被动收缩来提高患者骨骼肌肌力的同时,还能够提高患者的骨骼肌耐力。其中Vivodtzev等[33]通过对COPD患者股四头肌NMES干预4周后,发现患者股四头肌耐力平均增加37%。Tasdemir等[16]研究发现,NMES治疗10周后患者30 s坐蹲起次数显著增加,腿部疲劳感显著降低。Sillen等[21]研究进一步发现,NMES刺激频率是影响患者骨骼肌耐力提高的重要因素,高频NMES(75 Hz)8周后患者等速肌力总功增加(285±51)J,低频NMES(15 Hz)8周后增加(101±45)J。以上研究结果表明,NMES对于提高骨骼肌耐力具有积极的作用,高频NMES效果更佳。
2.3 运动能力
COPD是一种累及全身多个器官的系统性疾病,运动能力下降是其主要特征之一。导致COPD患者运动能力下降的原因十分复杂,与肺功能下降、骨骼肌萎缩及功能障碍、炎症反应、营养不良以及运动后症状反应加剧等因素有关。NMES通过改善患者骨骼肌功能能够在一定程度上提高患者的运动能力,具体表现为患者步行距离的增加和运动时间的延长[15,19,23]。如NMES干预8周能够有效增加患者的6 min步行距离,提高运动过程中的血氧饱和度,降低运动后的呼吸困难[21-22]。Vivodtzev等[33]发现,NMES干预6周后患者往返步行距离增加(174±72)m。Napolis等[14]和Vieira等[22]的研究均发现,NMES治疗后COPD患者完成恒定负荷的持续时间增加,与外周骨骼肌肌纤维活化的数量显著降低,以及外周骨骼肌工作的经济性提高有关。
综上所述,NMES能够有效提高患者的运动能力,主要表现为运动距离的增加和运动持续时间的延长,患者骨骼肌功能的改善与运动能力的提高密切相关。
2.4 生活质量
COPD患者普遍病程较长且病情反复发作,而持续存在的运动能力降低、呼吸困难等情况严重影响患者的工作和日常生活,常常导致患者产生消极悲观、抑郁等不良情绪。NMES通过改善患者外周骨骼肌功能,提高运动能力,进一步提高患者的生活质量,对于运动耐受性差的COPD患者,NMES比常规运动康复更实用。Kaymaz等[15]根据圣▪乔治呼吸问卷评分结果得出,NMES治疗显著提高重度COPD患者的活动能力,改善患者的低落情绪。Vieira等[22]报道,NMES对COPD患者的运动能力和生活质量有显著改善。Coquart等[24]研究表明,NMES显著提高患者的整体生活质量,减轻患者的抑郁程度,其效果与运动康复锻炼类似。由此可见,NMES是一种能有效提高患者的生活质量和改善患者不良情绪的临床康复手段,能够取得类似于常规运动康复锻炼的效果,对重度COPD或运动受限患者生活质量的提高具有极其重要的意义。
3 NMES对COPD患者骨骼肌康复效果的作用机制
3.1 改变COPD患者骨骼肌形态结构
COPD患者骨骼肌萎缩及肌纤维类型的转变是导致功能降低的主要原因,NMES治疗后患者骨骼肌功能的提高与缓解骨骼肌萎缩及肌纤维类型的转变密切相关。研究表明,NMES治疗后患者骨骼肌萎缩得到逆转。Vivodtzev等[35]发现,NMES结合常规运动康复锻炼后,患者大腿围增加(1.1±0.9)cm,大腿骨骼肌质量增加(0.95±0.58)kg。患者骨骼肌质量的增加与骨骼肌形态结构的改变有关。Dal Corso等[28]研究发现,NMES后患者Ⅱ型肌纤维的横截面积由(3786±1294)μm2增加至(4119±936)μm2,较干预前增加12.5%,患者肌纤维横截面积的增加与肌力的增加呈正相关。与Dal Corso等研究结果类似,Vivodtzev等[33]研究发现,NMES干预6周后患者股四头肌肌纤维横断面积增加(6±2)%,腓肠肌肌纤维横截面积同样增加(6±2)%,这说明肌力的增加与肌纤维横断面积密切相关。另外,COPD患者肌纤维横断面积增加的同时还伴有肌纤维类型的转变。Abdellaoui等[32]发现,对急性加重期COPD患者NMES治疗6周后,Ⅰ型肌纤维的比例由(13±4)%增加至(25±3)%,Ⅱα/Ⅱx肌纤维的比例由(9±2)%增加至(23±4)%,Ⅱα型肌纤维比例变化不明显,而Ⅱx型肌纤维比例降低。
综上所述,NMES能够改变COPD患者骨骼肌形态结构,主要表现为肌纤维横截面积以及瘦体质量的增加,以及肌纤维类型的改变。然而现阶段对于NMES促进COPD肌纤维类型转变的信号通路仍不清楚。有研究显示过氧化物酶体增殖物激活受体γ辅激活子1α(peroxisome proliferator-activated receptor-γ coactivator-1α,PGC-1α)在COPD患者骨骼肌纤维类型的转变中发挥重要作用,PGC-1α mRNA的水平与COPD骨骼肌氧化性肌纤维的比例密切相关,NMES是否通过增加PGC-1α的表达来促进肌纤维类型的转变仍需进一步研究。
3.2 调节COPD骨骼肌蛋白质代谢平衡
COPD骨骼肌蛋白合成与分解失衡是导致骨骼肌萎缩的重要分子机制,泛素蛋白酶体通路中的骨骼肌特异性E3连接酶Atrogin-1和MuRF-1的过度激活导致COPD骨骼肌蛋白质降解增加[36-38],其降解速率大于IGF-1/PI3K/AKT/mTOR信号通路诱导骨骼肌蛋白合成的速率[39]。Pan等[40]研究发现香烟诱导的COPD模型大鼠miR-1表达升高,通过负反馈调节通路导致IGF-1表达降低,AKT磷酸化表达降低,蛋白合成减少;而通过NMES能够逆转这种改变,表现为miR-1表达降低,AKT磷酸化表达升高,蛋白合成增加。Vivodtizev等[33]通过对COPD患者肌肉活检发现,NMES治疗后患者骨骼肌包括哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)、糖原合成酶激酶(glycogen synthase kinase,GSK)-3b、p70S6K以及4EBP-1等在内的下游目标因子表达的增加,且p70S6K蛋白磷酸化水平与腓肠肌横截面积的变化呈正相关;该研究同时发现,NMES能够降低患者骨骼肌Atrogin-1表达,减少骨骼肌蛋白的降解。综上所述,NMES能够提高COPD患者骨骼肌蛋白合成信号通路的活性,增加骨骼肌蛋白合成,降低蛋白降解。
3.3 改善COPD骨骼肌氧化应激水平
安静状态以及运动状态的氧化应激水平被认为是导致COPD外周骨骼肌功能障碍的重要因素[41],活性氧可通过影响肌原纤维蛋白,尤其是肌球蛋白重链(myosin heavy chain,MHC),扰乱肌球蛋白结构并损害肌球蛋白功能。Pomies等[42]发现,氧化应激能够通过使骨骼肌蛋白羰基化导致骨骼肌萎缩,通过激活FoxO1/MuRF1/Atrogin-1信号通路实现;给予抗氧化治疗能够降低骨骼肌蛋白的羰基化,骨骼肌蛋白羰基化的降低可进一步通过降低FoxO1/MuRF1/Atrogin-1信号通路的活性,减轻骨骼肌的萎缩。Abdellaoui等[32]研究发现,NMES能够降低COPD患者氧化应激,表现为骨骼肌MHC羟基化水平降低,羰基化MHC蛋白与总MHC蛋白的比值下降,且总MHC蛋白的增加量与骨骼肌力的增加程度呈高度相关。研究结果提示,NMES改善COPD患者骨骼肌功能可能与改善氧化应激水平有关,其具体分子机制仍需进一步研究。
4 总结与展望
NMES能够有效增加COPD患者骨骼肌肌力、肌耐力,提高运动能力,改善患者生活质量,对于运动不耐受COPD患者具有十分重要的意义。NMES对COPD患者骨骼肌的康复效果与骨骼肌形态结构改变有关,其作用机制主要是调整骨骼肌蛋白质代谢平衡,改善骨骼肌氧化应激水平。然而,目前仍缺乏NMES对于COPD患者呼吸肌肌力、健康状态以及日常体力活动水平恢复等方面的康复效果相关研究,并且现阶段的临床研究纳入样本量相对较小,对于NMES的生理机制研究仍相对有限,尤其是对骨骼肌纤维类型转变的分子机制仍需进一步探讨。虽然NMES对于COPD患者骨骼肌功能障碍的康复治疗具有积极的作用,但并不能完全替代运动康复锻炼,可作为急性加重期COPD以及运动不耐受患者的辅助治疗手段。
]
[1]Murray CJ,Atkinson C,Bhalla K,et al.The state of US health,1990-2010:burden of diseases,injuries,and risk factors[J].JAMA,2013,310(6):591-608.
[2]Lozano R,Naghavi M,Foreman K,et al.Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010:a systematic analysis for the Global Burden of Disease Study 2010[J].Lancet,2012,380(9859):2095-2128.
[3]Zhou M,Wang H,Zhu J,et al.Cause-specific mortality for 240 causes in China during 1990–2013:a systematic subnational analysis for the Global Burden of Disease Study 2013[J].Lancet,2015,387(10015):251-272.
[4]De Brandt J,Spruit MA,Derave W,et al.Changes in structural and metabolic muscle characteristics following exercise-based interventions in patients with COPD:a systematic review[J].Expert Rev Respir Med,2016,10(5):521-545.
[5]Nyberg A,Carvalho J,Bui KL,et al.Adaptations in limb muscle function following pulmonary rehabilitation in patients with COPD–a review[J].Rev Port Pneumol,2016,22(6):342-350.
[6]Giavedoni S,Deans A,Mccaughey P,et al.Neuromuscular electrical stimulation prevents muscle function deterioration in exacerbated COPD:a pilot study[J].Respir Med,2012,106(10):1429-1434.
[7]Vilaro J,Ramirez-sarmiento A,Martinez-Llorens JM,et al.Global muscle dysfunction as a risk factor of readmission to hospital due to COPD exacerbations[J].Respir Med,2010,104(12):1896-1902.
[8]Lepley LK,Wojtys EM,Palmieri-smith RM.Combination of eccentric exercise and neuromuscular electrical stimulation to improve biomechanical limb symmetry after anterior cruciate ligamentreconstruction [J].Clin Biomech,2015,30(7):738-747.
[9]Durigan JL,Peviani SM,Delfino GB,et al.Neuromuscular electrical stimulation induces beneficial adaptations in the extracellular matrix of quadriceps muscle after anterior cruciate ligament transection of rats[J].Am J Phys Med Rehabil,2014,93(11):948-961.
[10]杨永翠.神经肌肉电刺激对脑卒中患者生活能力及肢体运动功能的影响[J].中国实用神经疾病杂志,2015,18(19):112-113.
[11]张月兰,李明,罗莎.神经肌肉电刺激治疗脑卒中后吞咽功能障碍的疗效观察[J].中国实用神经疾病杂志,2015,18(8):65-66.
[12]徐晓明,段隽丹,杨麟.神经肌肉电刺激与酸性刺激治疗急性脑卒中吞咽障碍口腔期的效果[J].中国康复理论与实践,2017,23(2):194-198.
[13]朱士文,江平胤,党红梅,等.神经肌肉电刺激和吞咽训练对脑卒中后吞咽障碍的影响[J].中国康复理论与实践,2011,17(8):730-732.
[14]Napolis LM,Dal Corso S,Neder JA,et al.Neuromuscular electrical stimulation improves exercise tolerance in chronic obstructive pulmonary disease patients with better preserved fat-free mass[J].Clinics,2011,66(3):401-406.
[15]Kaymaz D,Ergun P,Demirci E,et al.Comparison of the effects of neuromuscular electrical stimulation and endurance training in patients with severe chronic obstructive pulmonary disease[J].Tuberk Toraks,2015,63(1):1-7.
[16]Tasdemir F,Inal-Ince D,Ergun P,et al.Neuromuscular electrical stimulation as an adjunct to endurance and resistance training during pulmonary rehabilitation in stable chronic obstructive pulmonary disease[J].Expert Rev Respir Med,2015,9(4):493-502.
[17]丁晓伟,王淑萍,黄英,等.神经肌肉电刺激疗法的临床应用[J].沈阳医学院学报,2014,16(4):234-236.
[18]赵少珩,赵睿,张航,等.神经肌肉电刺激在周围神经损伤修复中的研究进展[J].医学综述,2014,20(14):2586-2588.
[19]Sillen MJ,Franssen FM,Vaes AW,et al.Metabolic load during strength training or NMES in individuals with COPD:results from the DICES trial[J].BMC Pulm Med,2014,14(1):1-9.
[20]Azevedo Dde P,Medeiros WM,de Freitas FF,et al.High oxygen extraction and slow recovery of muscle deoxygenation kinetics after neuromuscular electrical stimulation in COPD patients[J].Eur JAppl Physiol,2016,116(10):1899-1910.
[21]Sillen MJ,Franssen FM,Delbressine JM,et al.Efficacy of lower-limb muscle training modalities in severely dyspnoeic individuals with COPD and quadriceps muscle weakness:results from the Dices trial[J].Thorax,2014,69(6):525-531.
[22]Vieira PJ,Chiappa AM,Cipriano G Jr,et al.Neuromuscular electrical stimulation improves clinical and physiological function in COPD patients[J].Respir Med,2014,108(4):609-620.
[23]Vivodtzev I,Rivard B,Gagnon P,et al.Tolerance and physiological correlates of neuromuscular electrical stimulation in COPD:a pilot study[J].PLoS One,2014,9(5):e94850.
[24]Coquart JB,Grosbois JM,Olivier C,et al.Home-based neuromuscular electrical stimulation improves exercise tolerance and health-related quality of life in patients with COPD[J].Int J Chron Obstruct Pulmon Dis,2016,11(1):1189-1197.
[25]Maddocks M,Nolan CM,Man WD,et al.Neuromuscular electrical stimulation to improve exercise capacity in patients with severe COPD:a randomised double-blind,placebo-controlled trial[J].Lancet Respir Med,2016,4(1):27-36.
[26]Sillen MJ,Wouters EF,Franssen FM,et al.Oxygen uptake,ventilation,and symptomsduring low-frequency versus high-frequency NMES in COPD:a pilot study[J].Lung,2011,189(1):21-26.
[27]Sillen MJ,Janssen PP,Akkermans MA,et al.The metabolic response during resistance training and neuromuscular electrical stimulation(NMES)in patients with COPD,a pilot study[J].Respir Med,2008,102(5):786-789.
[28]Dal Corso S,Napolis L,Malaguti C,et al.Skeletal muscle structure and function in response to electrical stimulation in moderately impaired COPD patients[J].Respir Med,2007,101(6):1236-1243.
[29]Neder JA,Sword D,Ward SA,et al.Home based neuromuscular electrical stimulation as a new rehabilitative strategy for severely disabled patients with chronic obstructive pulmonary disease(COPD)[J].Thorax,2002,57(4):333-337.
[30]Marquis K,Debigare R,Lacasse Y,et al.Midthigh muscle cross-sectional area is a better predictor of mortality than body mass index in patients with chronic obstructive pulmonary disease[J].Am J Respir Crit Care Med,2002,166(6):809-813.
[31]Kharbanda S,Ramakrishna A,Krishnan S.Prevalence of quadriceps muscle weakness in patients with COPD and its association with disease severity[J].Int J Chron Obstruct Pulmon Dis,2015,10(1):1727-1735.
[32]Abdellaoui A,Prefaut C,Gouzi F,et al.Skeletal muscle effects of electrostimulation after COPD exacerbation:a pilot study[J].Eur Respir J,2011,38(4):781-788.
[33]Vivodtzev I,Debigare R,Gagnon P,et al.Functional and muscular effects of neuromuscular electrical stimulation in patients with severe COPD:a randomized clinical trial[J].Chest,2012,141(3):716-725.
[34]Akar O,Gunay E,Ulasli SS,et al.Efficacy of neuromuscular electrical stimulation in patients with COPD followed in intensive care unit[J].Clin Respir J,2017,11(46):743-750.
[35]Vivodtzev I,Pepin JL,Vottero G,et al.Improvement in quadriceps strength and dyspnea in daily tasks after 1 month of electrical stimulation in severely deconditioned and malnourished COPD[J].Chest,2006,129(6):1540-1548.
[36]Rom O,Reznick AZ.The role of E3 ubiquitin-ligases MuRF-1 and MAFbx in loss of skeletal muscle mass[J].Free Radic Biol Med,2016,98:218-230.
[37]HaegensA,ScholsAM,Gorissen SH,et al.NF-kappaB activation and polyubiquitin conjugation are required for pulmonary inflammation-induced diaphragm atrophy[J].Am J Physiol Lung Cell Mol Physiol,2012,302(1):L103-L110.
[38]Langen RC,Gosker HR,RemelsAH,et al.Triggers and mechanisms of skeletal muscle wasting in chronic obstructive pulmonary disease[J].Int J Biochem Cell Biol,2013,45(10):2245-2256.
[39]Doucet M,Russell AP,Leger B,et al.Muscle atrophy and hypertrophy signaling in patients with chronic obstructive pulmonary disease[J].Am J Respir Crit Care Med,2007,176(3):261-269.
[40]Pan LL,Ke JQ,Zhao CC,et al.Electrical stimulation improves rat muscle dysfunction caused by chronic intermittent hypoxia-hypercapnia via regulation of miRNA-related signaling pathways[J].PLoS One,2016,11(3):e0152525.
[41]Gyanqpuig-Vilanova E,Rodriguez DA,Lloreta J,et al.Oxidative stress,redox signaling pathways,and autophagy in cachectic muscles of male patients with advanced COPD and lung cancer[J].Free Radic Biol Med,2015,79:91-108.
[42]Pomies P,Blaquiere M,Maury J,et al.Involvement of the FoxO1/MuRF1/Atrogin-1 signaling pathway in the oxidative stress-induced atrophy of cultured chronic obstructive pulmonary disease myotubes[J].PLoS One,2016,11(8):e0160092.

