儿童中枢神经细胞瘤伴血液生长激素异常改变1例☆
侯萌 付尧 王占峰 刘彩芬赵兴利
中枢神经细胞瘤(central neurocytoma,CNC)是中枢神经系统少见的肿瘤,属于神经元和混合性神经元-胶质瘤,WHOⅡ级,约占颅内肿瘤的0.1%~0.5%,好发年龄为20~40岁[1-3],儿童CNC非常罕见。CNC临床症状无特异性,主要症状包括幕上梗阻性脑积水,颅内压增高,头痛、头晕、恶心、视神经乳头水肿。激素异常十分罕见,现分析我科收治的1例中枢神经细胞瘤伴血液生长激素异常病例,报告如下。
1 临床资料
患者,男,13岁,因生长发育迟缓就诊,查体见发育迟滞,矮小,身高 144 cm(同龄男童平均身高为 159.5 cm,97%同龄儿童身高大于145 cm),未见第二性征发育,神经系统查体未见明显异常。实验室检查:生长激素激发试验(血液)0 min 为 1.1 ng/mL、30 min 为 0.216 ng/mL、60 min为0.21 ng/mL(长春市儿童医院,参考值5.000 ng/mL~10.000 ng/mL),余各项实验室检查未见异常。骨龄评价(RUS-CHN法):骨龄11.9岁;骨龄百分位数 10.0岁;RUS骨龄减年龄:-1.4岁。头部MRI(吉林大学中日联谊医院):右侧侧脑室体部近室间孔可见类椭圆形长T1长T2信号影,病变内信号欠均匀,Flair像呈不均匀稍低信号,大小约为2.2 cm×1.9 cm×1.7 cm,右侧侧脑室扩张,局部中线结构略向左移位。增强可见轻度强化(图1)。完善术前检查后经右侧皮质造瘘-侧脑室入路行肿瘤切除术。术中见肿瘤位于右侧侧脑室内,起源于侧脑室壁,色灰白,质软,无包膜,与周围脑组织界限清,血运一般,镜下全切除肿瘤。术后病理报告:中枢神经细胞瘤 WHOⅡ级(图2)。免疫组化:Syn (+)、NeuN (个别+)、CgA (+)、p53 (-)、CK (-)、Vimentin(+)、Ki67(1%+)、MGMT(20%+)、GFAP(+)、EMA(-)。患儿术前、术后均未补充生长激素,术后3 d及1周后复查血液生长激素正常,结果为0.74 ng/mL、1.61 ng/mL(吉林大学中日联谊医院,参考值0.1~10 ng/mL)。痊愈出院,术后3个月、半年定期复查头部MRI平扫+增强。术后18个月,患儿身高增高18.5 cm(162.5 cm),各项复查检查化验无异常。
2 讨论
CNC首先由HASSOUN等[4]于1982年提出,好发于脑室系统,也有报道发生于脑室外系统,包括大脑半球、岛叶、松果体、杏仁体、鞍区、桥脑、脑干、脊髓等[1-2]。CNC好发于青中年,无明显性别差异,在儿童CNC多为个案报道,国外关于儿童CNC的大宗病例报道仅为RADES D[5-6]59例儿童中枢神经细胞瘤回顾性分析及后续73例儿童患者的相关研究。CNC好发于脑室内,临床表现主要为梗阻性脑积水导致颅内压升高,同时还可能出现癫痫、意识下降、出血等,症状主要与肿瘤位置相关,与其侵袭性相关度不大[2]。本例患者肿瘤体积较小,位于侧脑室内,未见明显上述临床症状,主要表现为生长发育迟缓。CNC伴发激素异常更为罕见,ARAKI Y等[7]于 1992年报道 1例 CNC患者伴有血液生长激素异常,21岁男性巨人症患者,肿瘤位于侧脑室,予以手术切除肿瘤。术前血液生长激素异常升高(20.7 ng/mL),术后降至正常(0.9 ng/mL),手术前后均未发现患者有垂体功能异常,但肿瘤细胞培养发现有低水平促生长激素释放因子生成,考虑患者血液生长激素异常增高与CNC相关。血液生长激素异常常见于鞍区肿瘤,PENG P等[8]回顾分析了鞍区CNC 4例均未见激素异常,此外,国内外均未见CNC伴发激素异常病例报告及相关研究。
生长激素(growth hormone,GH)是一种由腺垂体细胞分泌的蛋白质。腺垂体分泌GH主要受下丘脑分泌的生长激素释放素 (growth hormone-releasing hormone,GHRH)和生长激素释放抑制激素(growth hormone-releasing inhibitory hormone,GHIH)的调节。研究表明,切断大鼠垂体柄,消除下丘脑分泌的GHRH和GHIH对腺垂体分泌GH的作用,可见垂体分泌GH明显减少。该患者影像学检查,未见垂体异常信号影。ARAKI Y等[7]报道CNC自身具有分泌GHRH的能力,我们推测本例患儿血中GH水平降低可能有以下两方面因素:一方面CNC肿瘤细胞具有分泌激素的功能,CNC肿瘤细胞异常分泌GHRH,可能通过脑脊液循环系统,抑制下丘脑分泌GHRH,导致通过垂体门脉系统作用于腺垂体的GHRH减少和GHIH相对增多;CNC肿瘤细胞异常分泌GHIH,通过下丘脑-垂体轴,致使腺垂体分泌GH减少;CNC肿瘤细胞异常分泌类生长激素,通过负反馈调节,导致垂体分泌GH减少。另一方面由于肿瘤对周围组织压迫可能导致下丘脑分泌GHRH和GHIH减少,而出现类似于垂体柄切断的效果,导致GH分泌减少。
CNC好发于侧脑室前部[9],需与室管膜下巨细胞星形细胞瘤鉴别。CNC影像学上无明显特异性,典型CNC可见大小不同的囊肿簇,T2可见囊肿样或肥皂泡外观样物质,DWI可见高信号,MRI增强可见T1像轻度至中度强化[10]。MRS可见CHo波升高和NAA波降低[11,12]。室管膜下巨细胞星形细胞瘤MRI增强检查可见明显或不均一强化,同时伴有神经系统以外的病变[13]。本例患儿MRI右侧侧脑室内可见囊肿样圆形长T1长T2信号,轻度强化,符合CNC影像学表现,同时可与室管膜下巨细胞星形细胞瘤鉴别。
光镜下CNC肿瘤细胞呈“蜂窝图案”,出现小而圆的细胞质和斑点染色质与少枝突细胞难以鉴别[2]。CNC诊断依赖于免疫组化,突触素(Syn)阳性为其特有,神经元特异性烯醇化酶(NSE)、神经元特异性核蛋白(NeuN)、神经元特异性III类β微管蛋白(Tuj-1)阳性有助于诊断[2,14]。本例患儿病理学检查中可见Syn(+)、NeuN (个别+),符合CNC诊断。
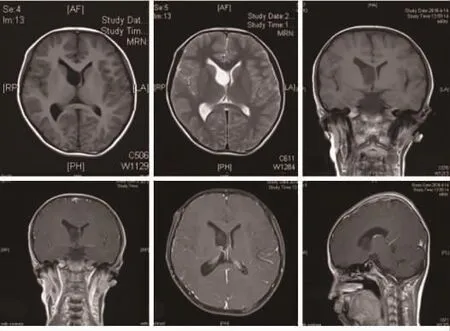
图 1 头部 MRI检查。 A,C:T1WI平扫;B:T2WI平扫;D,E,F:T1WI增强检查。脑室体部类椭圆形长T1长T2信号影,右侧侧脑室扩张,增强检查可见轻度强化
CNC为WHOⅡ级肿瘤,总体偏良性,愈后较好。根据Ki67分为典型 CNC(<2%)和非典型 CNC(≥2%),典型CNC 10年生存率为90%,非典型CNC 10年生存率为63%[15-17]。首选手术治疗,手术是影响预后的独立因素[18],全切患者术后5年生存率达到99%,行放射治疗对全切除患者生存率影响不大[19]。对于不能行手术治疗的患者,立体定向放疗是其治疗的另一选择[2,14]。RADES D等[5,6]研究表明儿童CNC预后良好,全切除的生存率优于部分切除,若不能全切除建议术后放疗,可明显提高生存率[20]。本例患儿为CNC伴GH降低,治疗首先考虑行手术治疗而非补充GH,术中实现肿瘤全切除,病理组织免疫组化示Ki67(1%+),术后 GH正常,多次复查 GH及头部MRI未见复发,预后良好。
CNC发病率低,儿童患者更为罕见,主要依据病理结果,治疗上应尽可能实现肿瘤全切除,愈后较好,对于不能实现全切除的患者术后应辅以放疗。CNC伴发GH等激素异常非常罕见,本例患者术前血液GH水平显著降低,且存在明显生长发育迟缓,行CNC全切除后血液生长激素水平恢复正常,考虑其血中GH异常与CNC相关。目前,GH检查并非CNC术前常规检查项目,本文报道儿童CNC伴发血液GH异常旨在引起广大医务工作者对CNC伴GH异常的关注,对于CNC是否对GH或其他激素影响,尚需进一步探究。
[1]PATEL DM,SCHMIDT RF,LIU JK.Update on the diagnosis,pathogenesis,and treatment strategies for central neurocytoma[J].J Clin Neurosci,2013,20(9):1193-1199.
[2]LEE SJ,BUI TT,CHEN CH,et al.Central Neurocytoma:A Review of Clinical Management and Histopathologic Features[J].Brain Tumor Res Treat,2016,4(2):49-57.
[3]KIM CY,DONG GK,JOO JD,et al.Clinical Outcome and Quality of Life AfterTreatmentofPatientswith Central Neurocytoma[J].Neurosurg Clin N Am,2015,26(1):83-90.
[4]HASSOUN J,GAMBARELLI D,GRISOLI F,et al.Central neurocytoma.An electron-microscopic study of two cases[J].Acta Neuropathologica,1982,56(2):151-156.
[5]RADES D,SCHILD SE,FEHLAUER F.Defining the best available treatment for neurocytomas in children[J].Cancer,2004,101(11):2629-2632.
[6]RADES D,SCHILD SE.Treatment recommendations for the various subgroups of neurocytomas[J].J Neurooncol,2006,77(3):305-309.
[7]ARAKI Y,SAKAI N,ANDOH T,et al.Central neurocytoma presenting with gigantism:case report[J].Surg Neurol,1992,38(2):141-145.
[8]PENG P,CHEN F,ZHOU D,et al.Neurocytoma of the pituitary gland:A case report and literature review [J].BiomedRep,2015,3(3):301-303.
[9]王辉,李文胜,石德金,等.中枢神经细胞瘤的临床、病理及影像学表现[J].中国神经精神疾病杂志,2008,34(11):687-688.
[10]MA Z,YAN H,SHI H,et al.The typical and atypical MR imaging findings of central neurocytomas:Report on eighteen cases and review of the literature[J].Clin Neurol Neurosurg,2016,146:18-23.
[11]UEDA F,ABURANO H,RYU Y,et al.MR Spectroscopy to Distinguish between Supratentorial Intraventricular Subependymoma and Central Neurocytoma[J].Magn Reson Med Sci,2017,16(3):223-230.
[12]TLILIGRAIESS K,MAMA N,ARIFA N,et al.Diffusion weighted MR imaging and proton MR spectroscopy findings of central neurocytoma with pathological correlation[J].J Neuroradiol,2014,41(4):243-250.
[13]罗青扬,邱天明,陈宏,等.室管膜下巨细胞星形细胞瘤的诊断和治疗 (附20例报告)[J].中国神经精神疾病杂志,2010,36(9):559-561.
[14]KANE AJ,SUGHRUE ME,RUTKOWSKI MJ,et al.The molecular pathology of central neurocytomas[J].J Clin Neurosci,2011,18(1):1-6.
[15]BUI TT,LAGMAN C,CHUNG LK,et al.Systematic Analysis of Clinical Outcomes Following Stereotactic Radiosurgery for Central Neurocytoma[J].Brain Tumor Res Treat,2017,5(1):10-15.
[16]IMBER BS,BRAUNSTEIN SE,WU FY,et al.Clinical outcome and prognostic factors for central neurocytoma:,twenty year institutional experience[J].J Neurooncol,2016,126(1):193-200.
[17]VAJRALA G,JAIN PK,SURANA S,et al.Atypical Neurocytoma:Dilemma in diagnosis and management[J].Surg Neurol Int,2014,5:183.
[18]SONG Y,KANG X,CAO G,et al.Clinical characteristics and prognostic factors of brain central neurocytoma[J].Oncotarget,2016,7(46):76291-76297.
[19]RADES D,FEHLAUER F,SCHILD SE.Treatment of atypical neurocytomas[J].Cancer,2004,100(4):814-817.
[20]CHEN YD,LI WB,FENG J,et al.Long-term outcomes of adjuvant radiotherapy after surgical resection of central neurocytoma[J].Radiat Oncol,2014,9(1):242.

