闽南地区RGS4基因多态性与精神分裂症及利培酮血药浓度关联研究☆
徐志忠 陈彬彬 徐象珍 吕海燕 郑慧斐 何珏
遗传因素在精神分裂症发病过程中具有重要作用[1-2]。G-蛋白信号转导调节子4(regulator of G protein signaling 4,RGS4)基因是精神分裂症易感基因之一[3],可能抑制多巴胺D2和D3受体的信号传递以及调控谷氨酸的信号转导,RGS4基因多态性与精神分裂症有一定的关联[4],但相同位点在不同人群中的研究结果并不完全一致[5-6]。利培酮(risperidone)是一种非典型抗精神病药,对多巴胺D2受体和5-羟色胺能受体具有抑制作用,单核苷酸多态性 (single-nucleotide polymorphisms,SNPs)有可能是引起利培酮血药浓度个体化差异的原因之一[7-8]。本研究选取位于RGS4基因调控区域 3个多态性位点 rs2842029、rs6678136和rs10799897,检测其在闽南地区精神分裂症患者和正常对照中的分布差异,同时检测患者服用利培酮后的血药浓度,分析多态性位点与利培酮血药浓度的关联。
1 对象与方法
1.1 研究对象 2016年1月至2017年8月就诊于厦门市仙岳医院门诊及住院治疗的患者。入组标准:①符合《国际疾病与相关健康问题统计分类》(International Statistical Classification of Diseases and Related Health Problems,ICD-10)精神分裂症的诊断标准;②来自中国闽南地区(厦门、漳州、泉州)[9];③单独服用利培酮2周以上;④详细了解本研究的目的和流程,并签署临床科研知情同意书。排除标准:①同时服用其他精神科药物;②患有严重躯体疾病。纳入精神分裂症患者共132例,男82 例,女 50 例,年龄(42.87±15.06)岁。 选取同期在厦门市仙岳医院体检的志愿者作为对照。入组标准:①无精神疾病史及家族史;②来自中国闽南地区(厦门、漳州、泉州);③签署临床科研知情同意书。排除标准:①与患者有血缘关系;②有重大躯体疾病。纳入正常对照140名,男81名,女59名,年龄(34.54±11.34)岁。
1.2 研究方法
1.2.1 外周静脉血采集 患者服用利培酮2周后,抽取外周静脉血,离心分离血浆和血细胞,分别用于血药浓度测定和基因组DNA提取。同时抽取对照者的外周静脉血用于提取基因组DNA。
1.2.2 利培酮血药浓度测定 采用高效液相色谱—质谱联用 (high performance liquid chromatography and mass spectrometry,HPLC/MS)技术检测利培酮血药浓度。色谱和质谱条件参考既往研究报道[10]。为了消除用药剂量、体重对血药浓度的影响,采用剂量校正浓度和标准浓度进行统计学分析[11]:剂量校正浓度=血药浓度(ng/mL)/剂量(mg/d);标准浓度=剂量校正浓度/体重(kg)。
1.2.3 受试者基因组DNA提取 使用Ezup柱式血液基因组DNA抽提试剂盒(B518253-0100,上海生工生物)从血细胞中提取基因组DNA,溶于TE缓冲液。
1.2.4 RGS4基因多态性位点扩增 采用聚合酶链式反应 (polymerase chain reaction,PCR) 扩增RGS4基因各多态性位点片段。根据RGS4基因序列 (NCBI:NG_023312.1)设计 PCR引物,rs2842029正向引物为 5’-GGTCTGAGGGCCTTC CTAGTT-3’, 反向引物为 5’-AAGTCTAAACCG GCAGCTCG-3’;rs6678136 正 向 引 物 为 5’-TTGGGCAAGTGAACACTCCT-3’,反向引物为 5’-TCTTTGTTTACCTGGGCACCT-3’;rs10799897 正向引物为 5’-CAGCAACCTGGGATGAGGTA-3’,反向引物为 5’-TGGTTGCCTGGACTGAGATG-3’。反应条件如下:95℃预变性5 min,然后每一循环95℃变性 30 s,55℃退火 30 s,72℃延伸 30 s,共35个循环,最后72℃延伸10 min。
1.2.5 DNA测序 PCR扩增完成后,经琼脂糖凝胶电泳检测,片段大小符合后送至上海生工测序公司,采用毛细管电泳法测序。
1.3 统计学方法 所有统计学分析由SPSS 20.0(IBM,USA)完成。Hardy-Weinberg平衡检验采用χ2检验,基因型和等位基因频率在患者组和对照组中分布比较使用χ2检验,不同基因型患者、不同性别患者对应的利培酮血药浓度比较分别使用方差分析和独立样本t检验,两两比较采用SNK-q检验。检验水准α=0.05,双侧检验。
2 结果
2.1 基因分型结果 RGS4基因各多态性位点的扩增片段长度分别为 899 bp、530 bp、741 bp,PCR产物经琼脂糖凝胶电泳检测,片段大小符合,见图1。在患者组和对照组中,rs2842029位点只有1种基因型AA,rs6678136位点和rs10799897位点均具有AA、AG、GG 3种基因型。

图1 RGS4基因各多态性位点电泳结果
2.2 Hardy-Weinberg平衡检验 rs2842029位点的基因型均为纯合子,rs6678136、rs10799897位点各基因型在各组中的观察值和理论值之间差异均无统计学意义(P>0.05),符合Hardy-Weinberg平衡定律。
2.3 基因型和等位基因频率 患者组和对照组rs6678136 位点的基因型(χ2=6.753,P=0.034)和等位基因(χ2=4.592,P=0.032)频率差异具有统计学意义,rs10799897 位点的基因型 (χ2=0.250,P=0.883)和等位基因频率(χ2=0.035,P=0.852)差异不具有统计学意义,见表1。
2.4 利培酮血药浓度 精神分裂症患者中,rs6678136位点各基因型所对应的血药浓度 (F=0.690,P=0.504)、 剂量校正浓度 (F=0.432,P=0.650)和标准浓度(F=0.244,P=0.784)差异均没有统计学意义。而rs10799897位点各基因型所对应的血药浓度 (F=3.601,P=0.030)、剂量校正浓度(F=3.656,P=0.029) 和 标 准 浓 度 (F=3.466,P=0.034)差异均具有统计学意义,两两比较发现AA型血药浓度(q=3.574,P<0.05)、剂量校正浓度(q=3.807,P<0.05)以及标准浓度(q=3.735,P<0.05)均低于GG型,而AA型与AG型、AG型与GG型的血药浓度、剂量校正浓度、标准浓度差异均无统计学意义(P>0.05)。 见表 2。

表1 RGS4基因各多态性位点基因型和等位基因频率[n(%)]
表2 RGS4基因rs6678136位点和rs10799897位点各基因型精神分裂症患者利培酮血药浓度(±s)

表2 RGS4基因rs6678136位点和rs10799897位点各基因型精神分裂症患者利培酮血药浓度(±s)
1)方差分析后,与GG型比较,经SNK-q检验,P<0.05
多态性位点rs6678136 rs10799897基因型AA AG GG AA AG GG n 32 57 43 46 70 16血药浓度(ng/mL)28.62±12.48 32.16±16.42 29.22±15.67 26.65±11.921)32.52±18.64 39.67±20.32剂量校正浓度7.54±3.29 7.70±3.57 7.01±3.93 6.74±3.581)7.78±4.09 10.09±5.26标准浓度0.13±0.06 0.13±0.07 0.12±0.06 0.12±0.061)0.13±0.07 0.17±0.10
男女患者的血药浓度(t=-1.232,P=0.220)和剂量校正浓度(t=-0.567,P=0.572)差异不具有统计学意义,而标准浓度差异则具有统计学意义 (t=-3.153,P=0.002),见表 3。
表3 不同性别精神分裂症患者利培酮血药浓度(±s)
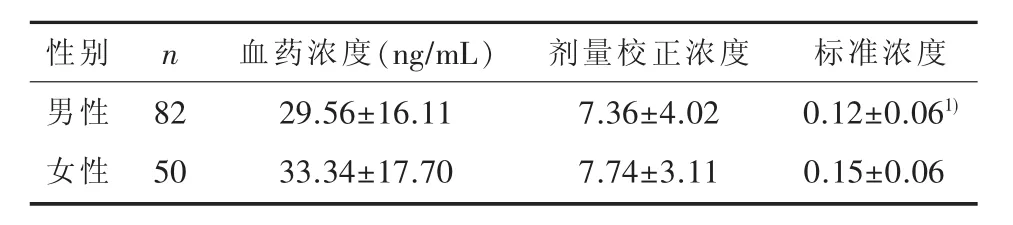
表3 不同性别精神分裂症患者利培酮血药浓度(±s)
1)与女性患者比较,经独立样本t检验,P<0.05
性别男性女性n 82 50血药浓度(ng/mL)29.56±16.11 33.34±17.70剂量校正浓度7.36±4.02 7.74±3.11标准浓度0.12±0.061)0.15±0.06
3 讨论
本研究探讨闽南人群中RGS4基因多态性位点与精神分裂症的相关性。rs2842029位点位于RGS4基因的上游启动子区,本研究发现闽南人群中该位点只有1种基因型,说明该位点可能不存在变异。rs6678136位点也位于RGS4基因的上游启动子区,NEED等[12]在欧洲人群中研究发现,rs6678136位点在精神分裂症患者和正常人群中没有差异,该位点变异和精神分裂症没有相关性,而本研究则发现该位点与精神分裂症具有相关性,可能是精神分裂症的风险因子,出现不同结果可能与研究方法、对象差异等有关,此外,该位点位于RGS4基因的调控区域,与基因表达的关联也值得进一步研究。rs10799897位于RGS4基因的内含子区域,DING等[4]研究RGS4基因多态性位点与其mRNA表达水平的关联,结果发现rs10799897位点与mRNA的表达水平无关,PRASAD等[13]也发现该位点与精神分裂症患者的认知能力没有相关性,本研究也没有发现该位点的基因型和等位基因频率在精神分裂症患者和正常对照中存在差异,这说明该位点可能不是精神分裂症的风险因子。
利培酮在体内经CYP2D6和CYP3A4代谢为9-羟利培酮,利培酮和9-羟利培酮在血浆中的半衰期分别为2.8 h和20.5 h,患者连续口服5 d左右,血药浓度达到稳态,临床上把利培酮与9-羟利培酮的血药浓度之和作为评估利培酮疗效的依据[14-15]。利培酮具有一定的副反应,可能会引起肾功能损伤、代谢紊乱等,因此,检测利培酮的血药浓度及其影响因素具有重要临床意义[16-17]。RGS4基因多态性可能与利培酮的临床疗效相关,LANE等[18]研究发现,经过利培酮治疗后,SNP1、SNP18位点基因型为A/A的患者社会功能改善更加明显。本研究利用HPLC/MS技术检测利培酮血药浓度,准确度、灵敏度较高,结果表明rs10799897位点不同基因型所对应的血药浓度差异具有统计学意义,说明该位点可能会影响利培酮的血药浓度,虽然该位点可能不是精神分裂症的风险因子,但可能会对利培酮的临床用药有指导意义。此外,利培酮标准浓度在男女患者中具有差异,说明性别也可能是影响血药浓度的一个因素。
综上所述,本研究发现RGS4基因新的与精神分裂症及利培酮血药浓度相关的多态性位点,具有一定的创新性。但由于样本量偏少,需要进一步扩大样本量,同时需要探讨患者多态性位点与利培酮治疗效果及副反应的关系,以提高研究结果的可信性,这对个体化用药、减少药物的副反应都有重要的临床意义。
[1]洪汉林,段秀荣,刘婵媛.L型钙离子通道α1C亚基基因多态性与精神分裂症的相关性 [J].中国神经精神疾病杂志,2016,42(4):199-205.
[2]许扬扬,张天宏,王继军,等.精神分裂症患者海马受损导致记忆缺陷的发生机制研究进展 [J].中国神经精神疾病杂志,2016,42(10):633-636.
[3]SCHWARZ E.A gene-based review of RGS4 as a putative risk gene for psychiatric illness[J].Am J Med Genet B Neuropsychiatr Genet,2018,177(2):267-273.
[4]DING L,STYBLO M,DROBNA Z,et al.Expression of the longest RGS4 splice variant in the prefrontal cortex is associated with single nucleotide polymorphisms in schizophrenia patients[J].Front Psychiatry,2016,7:26.
[5]MORRIS DW,RODHERS A,MCGHEE KA,et al.Confirming RGS4 as a susceptibility gene for schizophrenia[J].Am J Med Genet B Neuropsychiatr Genet,2004,125B(1):50-53.
[6]ISHIGURO H,HORIUCHI Y,KOGA M,et al.RGS4 is not a susceptibility gene for schizophrenia in Japanese:association study in a large case-control population[J].Schizophr Res,2007,89(1-3):161-164.
[7]CABALEIRO T,OCHOA D,LOPEZ-RODRIGUEZ R,et al.Effect of polymorphisms on the pharmacokinetics,pharmacodynamics,and safety of risperidone in healthy volunteers[J].Hum Psychopharmacol,2014,29(5):459-469.
[8]SUZUKI Y,FUKUI N,TSUNEYAMA N,et al.Effect of the cytochrome P450 2D6*10 allele on risperidone metabolism in Japanese psychiatric patients[J].Hum Psychopharmacol,2012,27(1):43-46.
[9]梁栋,李时鸿.闽南地区居民养老健康服务需求行为调查及分析[J].福建医科大学学报(社会科学版),2016,17(1):21-26.
[10]徐志忠,陈彬彬,徐象珍,等.闽南地区精神分裂症患者DISC1基因表达与利培酮血药浓度的关联研究 [J].中国现代医药杂志,2017,19(7):5-8.
[11]PARK PW,SEO YH,AHN JY,et al.Effect of CYP3A5*3 genotype on serum carbamazepine concentrations at steady-state in Korean epileptic patients[J].J Clin Pharm Ther,2009,34:569-574.
[12]NEED AC,GE D,WEALE ME,et al.A Genome-Wide Investigation of SNPs and CNVs in Schizophrenia[J].PLoS Genet,2009,5(2):e1000373.
[13]PRASAD KM,ALMASY L,GUR RC,et al.RGS4 polymorphisms associated with variability of cognitive performance in a family-based schizophrenia sample[J].Schizophr Bull,2010,36(5):983-990.
[14]MANNENS G,HUANG ML,MEULDERMANS W,et al.Absorption,metabolism and excretion of risperidone in humans[J].Drug Metab Dispos,1993,21(6):1134-1141.
[15]VERMEIR M,NAESSENS I,REMMERIE B,et al.Absorption,metabolism,and excretion of paliperidone,a new monoaminergic antagonist,in humans[J].Drug Metab Dispos,2008,36(4):769-779.
[16]ITO A,ENOKIYA T,KAWAMOTO E,et al.Two cases of lifethreatening arrhythmia induced by risperidone:evaluation of risperidone and 9-hydroxy-risperidone concentrations[J].Acute Med Surg,2017,4(3):341-343.
[17]BILGIÇ S,KORKMAZ DT,AZIRAK S,et al.Risperidone-induced renal damage and metabolic side effects:the protective effect of resveratrol[J].Oxid Med Cell Longev,2017,2017:8709521.
[18]LANE HY,LIU YC,HUANG CL,et al.RGS4 polymorphisms predict clinical manifestations and responses to risperidone treatment in patients with schizophrenia[J].J Clin Psychopharmacol,2008,28(1):64-68.

