ZD制剂对马急性软组织损伤模型的作用
杨珊珊,李云章,王 煜,罗园渠,蒋瑞东,刘 伟,程 波,任书男
(内蒙古农业大学兽医学院,内蒙古呼和浩特 010018)
赛马比赛中的损伤主要是肢蹄的软组织损伤,有效的治疗马匹肢蹄病能够为赛事保驾护航,提高马匹福利和畜主利益。急性软组织损伤包括皮肤、皮下组织、肌肉、肌腱、韧带、关节、腱鞘、黏液囊等组织的损伤[1-2]。马匹的常见软组织损伤疾病有肌腱炎、骨膜炎、肌肉挫伤、韧带炎、关节炎、腱鞘、黏液囊炎等[3]。肌肉状态影响马匹、运动员在赛场上的表现、高水平运动员马匹的竞技水平和骨骼肌的状态有着密不可分的关系[4]。传统兽医学在临床治疗马软组织损伤方面有着悠久的历史,且流传很多治疗效果良好的中兽药验方。ZD制剂是治疗马属动物肢蹄软组织损伤的经验方剂,在临床应用中取得较好的疗效,前期在小鼠模型上发现ZD制剂有抗炎镇痛、降低毛细血管通透性、改善微循环、缩短组织修复时间的作用[5-6]。前期在马的骨骼肌、肌腱损伤模型上验证了ZD制剂的疗效[7]。本试验建立马急性软组织损伤模型,采用非介入性的超声诊断、红外热像技术观察、评估ZD制剂对马骨骼肌挫伤的作用,为进一步探明ZD制剂的作用机制提供理论基础。
1 材料与方法
1.1 材料
1.1.1 药物和试剂 ZD制剂,内蒙古农业大学临床兽医系自制;ZD制剂由乳香、没药、红花等12味中药组成,软膏基质有甘油、三乙醇胺、山梨酸钾、医用凡士林、单硬脂酸甘油酯、硬脂酸、液体石蜡、冰片、医用氮酮。经过煎药、低压浓缩制成中药原液,后使用保湿剂、乳化剂、防腐剂等将水相和油相进行乳化,制成水包油的膏剂;按摩软膏,神威药业集团有限公司产品,国药准字Z27020377;静松灵,兰州正丰制药有限责任公司产品,批号2012-280031579;空白膏药为ZD制剂不加中药原液,软膏基质相同,由生理盐水制成空白膏药。
1.1.2 仪器设备 传感器,启励传感系统工程有限公司产品;红外热成像仪,Fluke公司产品;绳索、兽用B超机、超声线阵探头,Esaote Mylab30产品;耦合剂,天津市西苑寺生产;皮肤取样器(P1050),Acuderm Inc公司产品。
1.1.3 试验用动物 20匹蒙古马由内蒙古农业大学动物园提供,体重250 kg±50 kg。
1.2 方法
1.2.1 动物分组及模型的构建 将试验用马随机分为4组,分别为模型组和正常组,模型组进行造模,正常组不进行造模。模型组分为试验药物组,阳性药物组,阴性对照组。阴性对照组给予不含ZD制剂中药原液的空白膏药,试验药物组给予自制ZD制剂膏药,阳性药物组给予按摩乳,造模部位12 h内出现明显肿胀,有淤血点出现,局部发热。造模后2 h于损伤处涂抹药物,每天1次,连续用药30 d,药物厚度约5 mm。
将马随机分为2组,模型组和正常组。正常对照组不进行造模。模型组马匹左侧肩部臂部剃毛,静松灵镇静后,对马进行保定,用重物从高处自由落下,锤击肩部肌肉,排列锤击,重复操作,每点4次,制作急性软组织损伤模型。造模部位12 h内出现明显肿胀,淤血,局部发热。通过传感器测量其平均撞击受力,得出瞬时应力为78.84 N/cm2±15.22 N/cm2。
1.2.2 血清检测 造模前、后对马进行颈静脉采血,静置,离心分离血清,置-20℃保存,检测乳酸脱氢酶(lactate dehydrogenase,LDH),谷草转氨酶 (aspartate transaminase,AST),肌酸激酶(creatine kinase,CK)的含量。
1.2.3 损伤部位形态学观察 对马匹静脉注射静松灵镇静,倒卧保定,肩部臂部剃毛,无菌操作,用皮肤取样器依次在造模前、后12 h进行肌肉取样。组织用中性福尔马林固定,制作石蜡切片,染色镜检,观察并记录。
1.2.4 马模型超声观察 将动物拉入六柱栏,用推子剔除体表毛,用肥皂水清洗检查部位,并用清水冲洗掉肥皂,涂抹耦合剂。实施超声机检查。扫描受损部位和对侧健康部位的肌肉,对比两侧肌肉灰度,皮下组织厚度。
1.2.5 损伤部位红外热成像拍摄 红外热成像评估,提前30 min将动物拉入室内,关闭门窗,使室内无空气对流,拍摄部位据镜头2 m。待动物安静后,进行拍摄,每个部位拍摄3次,记录损伤部位与健康部位温度差值。
2 结果
2.1 造模后血液检测
由表1可知,造模前两组比较,差异不显著(P>0.05);造模后1 d,模型组血清中LDH含量显著增加,模型组和正常组比较,差异极显著(P<0.01)。
由表2可知,造模前模型组和正常组的AST含量差异不显著(P>0.05);造模后模型组血清中的AST含量升高,正常组血清中的AST含量始终处于正常范围内。造模后1 d,模型组血清中AST含量和正常组比较差异显著(P<0.05)。
由表3可知,造模前模型组和正常组的CK含量差异不显著(P>0.05);造模后模型组的CK数值明显升高,差异极显著(P<0.01),造模后1 d模型组和正常组比较差异极显著(P<0.01)。

表1 各组马血清中LDH的变化
注:与正常组相比,*表示P<0.05,**表示P<0.01。
Note:* means the difference is significant at the 0.05 level compared to normal group; ** means the difference is significant at the 0.01 level.

表2 各组马血清中AST的变化
注:与正常组相比,*表示P<0.05,**表示P<0.01。
Note:* means the difference is significant at the 0.05 level compared to normal group; ** means the difference is significant at the 0.01 level.

表3 血清中肌酸激酶含量
注:与正常组相比,*表示P<0.05,**表示P<0.01。
Note:* means the difference is significant at the 0.05 level compared to normal group; ** means the difference is significant at the 0.01 level.
2.2 损伤部位肌肉切片的光镜观察
正常肌肉表现为肌细胞排列整齐,细胞膜完整无破裂,包浆染色均匀一致,细胞形体结构完整,无变性、无炎性渗出及炎细胞浸润现象。肌纤维排列整齐,大小基本一致。未见充血、水肿(图1A)。损伤后12 h可见肌细胞变性坏死,肌纤维溶解甚至断裂,肌纤维间隙明显增宽,大量炎性渗出,大量血细胞离开血管在肌纤维中(图1B)。
2.3 超声评价软组织损伤
由图2和图3可知,造模后12 h,皮下组织回声降低,厚度明显增大,肌肉回声降低;造模后1 d,皮下组织、肌肉肿胀减轻,但肿胀依然明显,肌肉组织纹理不清晰;造模后3 d,皮下组织、肌肉肿胀减轻,肌肉回声升高;造模后5 d和7 d,肌肉、皮下组织回声有所升高;造模后15 d,皮下组织、肌肉略有肿胀,厚度无明显变化。
2.4 皮下组织肿胀变化
皮下组织肿胀变化见表4,造模前、后12 h,组间差异不显著(P>0.05);损伤前期(1、3、5、7、15 d),阴性对照组的皮下组织肿胀大于试验药物组、阳性药物组;损伤后期(21 d),阴性对照组的肿胀不如试验药物组和阳性药物组。
2.5 肌肉回声变化
肌肉超声图像见图3,记肌肉灰度变化为x,即造模前肌肉灰度值减去造模后肌肉灰度值:x=对侧肌肉灰度值-造模前肌肉灰度值。
灰度变化趋势见表5。造模后2 h试验药物组、阴性对照组及阳性药物组差异不显著(P>0.05)。造模后三组的肌肉灰度值均显著下降,在3 d灰度值达到最低,直到21 d灰度值逐渐上升。造模后1、3、5、7 d试验药物组、阳性药物组和阴性对照组差异极显著(P<0.01),试验药物组和阳性药物差异不显著(P>0.05);造模后15 d,试验药物组、阳性药物组和阴性对照组差异极显著(P<0.01),试验药物组和阳性药物组比差异极显著(P<0.01);造模后21 d,三组组间差异不显著(P>0.05),且试验药物组、阳性药物组的灰度均大于造模前各自的灰度值,阴性药物组的灰度值仍低于造模前的灰度值。

A.造模前肌肉;B.造模后12 h肌肉 A.Normal muscle before modeling;B. Muscle injury 12 h after modeling图1 造模前后图片Fig.1 Histological sections before and after modeling

A.造模后12 h; B.造模后1 d; C.造模后3 d; D.造模后15 d
A.12 h after modeling; B.1 d after modeling; C. 3 d after modeling;D.15 d after modeling
图2不同时间段损伤部位超声图像
Fig.2 Ultrasound images of muscles at different periods of time
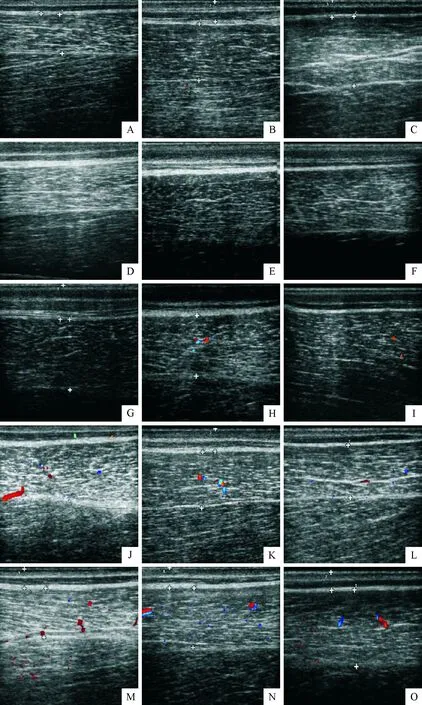
A.试验药物组造模前; B.阳性药物组造模前; C.阴性对照组造模前; D.试验药物组造模后2 h; E.阳性药物组造模后2 h; F.阴性对照组造模后2 h; G.试验药物组造模后1 d; H.阳性药物组造模后1 d; I.阴性对照组造模后1 d; J.试验药物组造模后3 d; K.阳性药物组造模后3 d; L.阴性对照组造模后3 d; M.试验药物组造模后7 d; N.阳性药物组造模后7 d; O.阴性对照组造模后7 d
A.Normal of test group before modeling; B.Normal of positive group before modeling; C.Normal of negative group before modeling; D.2 h of test group after modeling; E.2 h of positive group after modeling; F.2 h of negative group after modeling; G.1 d of test group after modeling; H.1 d of positive group after modeling; I.1 d of negative group after modeling; J.3 d of test group after modeling; K.3 d of positive group after modeling; L.3 d of negative group after modeling; M.7 d of test group after modeling; N.7 d of positive group after modeling; O.7 d of negative group after modeling
图3试验各阶段超声图像纵切面
Fig.3 Longitudinal sections of ultrasound images at different stages
续图3

P.试验药物组造模后15 d; Q.阳性药物组造模后15 d; R.阴性对照组造模后15 d; S.试验药物组造模后21 d; T.阳性药物组造模后21 d; U.阴性对照组造模后21 d
P.15 d of test group after modeling; Q.15 d of positive group after modeling; R.15 d of negative group after modeling; S.21 d of test group after modeling; T.21 d of positive group after modeling; U.21 d of negative group after modeling

图3 试验各阶段超声图像纵切面
注:与阴性对照组相比,*表示P<0.05,**表示P<0.01;与阳性药物组相比,#表示P<0.05,##表示P<0.01。
Note:* means the difference is significant at the 0.05 level; ** means the difference is significant at the 0.01 level compared to negative group; #means the difference is significant at the 0.05 level compared to positive group; ## means the difference is significant at the 0.01leval compared to positive group.

表5 肌肉灰度变化趋势
注:与阴性对照组相比,*表示P<0.05,**表示P<0.01;与阳性药物组相比,#表示P<0.05,##表示P<0.01;@表示该灰度值高于造模前灰度值,未标明的表示该灰度值小于造模前的灰度值。
Note:* means the difference is significant at the 0.05 level; ** means the difference is significant at the 0.01 level compared to negative group; # means the difference is significant at the 0.05 level compared to positive group; ## means the difference is significant at the 0.01 level compared to positive group; @means the muscle grey scale is higher than that before modeling.
2.6 红外热成像温度的变化
结果见图4和表6,试验初期,试验药物组、阳性药物组、阴性对照组的皮肤局部温度均升高,阴性对照组的温度变化显著高于试验药物组、阳性药物组;损伤后期,阴性对照组、试验药物组、阳性药物组温度均降低,阴性对照组局部温度降低程度显著高于试验药物组和阳性药物组。造模后1 d,试验药物组、阳性药物组与阴性对照组相比差异不显著(P>0.05);造模后3 d,试验药物组、阳性药物组和阴性对照组比较差异极显著(P<0.01),试验药物组和阳性药物组比较差异不显著(P>0.05);造模后5 d,试验药物组、阳性药物组和阴性对照组相比差异极显著(P<0.01),试验药物组和阳性药物组相比差异极显著(P<0.01);造模后7 d,试验药物组、阳性药物组相比阴性对照组差异极显著(P<0.01),试验药物组和和阳性药物组无显著差异(P>0.05);造模后16 d试验药物组和阴性对照组差异显著(P<0.05),阳性药物组相比阴性对照组差异极显著(P<0.01),试验药物组和阳性药物组无显著差异(P>0.05)。
2.7 局部肿胀观察
正常组不造模,肉眼观察试验药物组、阳性药物组、阴性对照组造模损伤部位肿胀情况(图5和表7),1 d时3个组局部均明显肿胀,差异不显著。造模后3 d,试验药物组、阳性药物组、阴性对照组消肿明显,但是阴性对照组肿胀仍明显;造模后5 d,试验药物组、阳性药物组为轻微肿胀,阴性对照组肿胀仍比各药物组明显。造模后7 d,试验药物组、阳性药物组、阴性对照组可见肿胀消失;造模后16 d,4组损伤部位恢复正常。
2.8 临床观察
造模后1 d马匹受损部位肌肉出现明显肿胀,局部温度显著高于其他部位,触诊躲闪,马匹精神稍沉郁,运动出现跛行。造模后3 d马匹精神状况逐渐改善,局部位温度还高于正常部位,局部肿胀稍缓解,跛行。造模后7 d马匹精神状况良好,局部温度比正常部位偏高,跛行减轻;在造模后16 d,马匹精神状况良好,造模部位肿胀消失,局温正常,跛行消失。
3 讨论
3.1 模型的建立
构建客观合理的软组织损伤模型是研究马肢蹄软组织损伤的重要基础。损伤程度和该部位受到的应力有关,通过传感器反复测试,得出重物的最大应力是78.84 N/cm2±15.22 N/cm2。制作急性软组织损伤模型。急性软组织损伤包括皮肤、肌肉挫伤。其病理形态与运动赛马发生急性软组织损伤病理学形态非常相似。急性软组织损伤模型伴随着红、肿、热、痛的特征,在超声图像上显示皮下组织厚度增加。在红外热温度上显示局部温度显著升高。在肌细胞受损后引起CK、LDH、AST的释放。CK主要存在于心肌、骨骼肌及脑组织,肌肉损伤数小时就能明显升高,AST存在于组织细胞中,LDH以LDH-5的形式存在骨骼肌细胞的胞质中,造模后模型组血清的CK值变化极显著,LDH值变化显著,AST值变化不如CK、LDH显著,这和它在组织中的分布有关相符。CK、AST、LDH是肌肉损伤后血清中出现可参考指标,表明马软组织损伤模型造模成功。
3.2 肌肉超声回声的变化
超声图像的变化可以反应损伤的严重性和持续性。软组织损伤因为血肿等原因表现低回声液体聚集。低回声液体在分析软件中表现为灰度值降低。再生组织出现在损伤部位回声强度增加,在图像分析软件表现为灰度值升高。超声图像可以显示出相对应的炎症程度、液体含量、纤维化等病理变化过程。
组织的厚度变化和灰度值的变化可作为监测肌肉损伤后恢复指标。在急性损伤中,伴随着皮下组织出血,超声图像上显示皮下组织厚度增加。急性软组织损伤有大量炎性渗出物,肌肉的超声图像呈现灰度值显著下降。本试验的超声灰度评测结果显示,试验药物组的肌肉灰度下降程度低于阴性对照组,这可能和试验药物组在抑制炎性产物渗出,降低炎症反应,促进组织的再生有关。试验药物组的皮下组织消肿情况优于阴性对照组,这可能和试验药物组早期抑制炎症反应,减轻局部肿胀有关。
超声诊断可以配合活检技术,可确定损伤位置。超声诊断对马急性软组织损伤可提供一种非介入性的、可靠的诊断方法,可为进一步研究ZD制剂对皮下、肌肉组织的修复提供一定的理论依据。
3.3 红外热成像
红外热成像技术可以通过体表温度的变化阐明局部血液循环的变化,局部受损充血,血流量增加伴随温度的增加,红外热成像仪采集体表温度的变化,并以图像形式直观显示。
由表6可以看出,试验药物组和阳性药物组在损伤后的7 d内,与阴性对照组比较温度明显降低,这可能和试验药物的抗炎作用有关。在损伤后16 d,试验药物组和阳性药物组的局部温度高于阴性对照组,这可能和试验药物在后期通过重建局部微循环,加速血流,提高局部温度有关。分析红外热成像温度,通过对损伤与健康两侧部位热成像图进行比较。数据显示,ZD制剂能够在损伤早期降低局部温度,后期提高损伤部位的温度,这可能和炎症急性期降低毛细血管通透性,抑制炎症因子的释放有关,在炎症后期改善局部微循环,增加血流量和血流速度,进行局部修复,最终达到治疗效果。

A.试验药物组造模8 h; B.阳性药物组造模8 h; C.阴性对照组造模8 h; D.试验药物组造模1 d; E.阳性药物组造模1 d; F.阴性对照组造模1 d;G.试验药物组造模3 d; H.阳性药物组造模3 d; I.阴性对照组造模3 d; J.试验药物组造模5 d; K.阳性药物组造模5 d; L.阴性对照组造模5 d; M.试验药物组造模7 d; N.阳性药物组造模7 d; O.阴性对照组造模7 d; P.试验药物组造模16 d; Q.阳性药物组造模16 d; R.阴性对照组造模16 d
A.8 h after modeling of test group; B.8 h after modeling of positive group; C.8 h after modeling of negative group; D.1 d after modeling of test group; E.1 d after modeling of positive group; F.1 d after modeling of negative group;G.5 d after modeling of test group; H.3 d after modeling of positive group; I.3 d after modeling of negative group; J.5 d after modeling of test group; K.5 d after modeling of positive group; L.5 d after modeling of negative group; M.7 d after modeling of test group; N.7 d after modeling of positive group; O.7 d after modeling of negative group; P.16 d after modeling of test group; Q.16 d after modeling of positive group; R.16 d after modeling of negative group

图4 损伤部位红外热成像图像
注:与阴性对照组相比,*表示P<0.05,**表示P<0.01;与阳性药物组相比#表示P<0.05,##表示P<0.01。
Note:* means the difference is significant at the 0.05 level;** means the difference is significant at the 0.01 level compared to negative group;# means the difference is significant at the 0.05 level,## means the difference is significant at the 0.01 level compared to positive group.

A.造模前试验药物组; B.造模前阳性药物组; C.造模前阴性对照组; D.试验药物组造模2 h; E.阳性药物组造模2 h; F.阴性对照组造模2 h
A.Test group before modeling; B.Positive group before modeling; C.Negative group before modeling; D. 2 h of test group after modeling; E. 2 h of positive group after modeling; F.2 h of negative group after modeling

图5 损伤肌肉局部观察
注:+表示肿胀程度,其中+越多,肿胀则越严重;-表示无明显肿胀。
Note :+ means the degree of swelling, the more + added ,the more swelling degree;- means no obvious swelling.
临床观察表明ZD制剂对急性软组织损伤有明显治疗效果。超声结果显示ZD制剂在急性软组织损伤中对皮下组织肿胀的消除、肌肉灰度的恢复有良好的作用。红外热成像技术显示ZD制剂可以在炎症早期显著降低损伤部位的温度,在炎症后期提高损伤部位的温度,真正起到消肿止痛、去腐生肌、活血化瘀的作用,对软组织损伤的修复效果良好。
参考文献:
[1] Thorpe C T,Clegg P D,Birch H L.A review of tendon injury:why is the equine superficial digital flexor tendon most at risk? [J].Equine Vet J,2010,42(2):174.
[2] Ross M W.Chapter 2-lameness in horses:basic facts before starting [M].Diagnosis and Management of Lameness in the Horse.Saint Louis; W.B.Saunders.2003:3-8.
[3] Bellas E,Rollins A,Moreau J E,et al.Equine model for soft-tissue regeneration[J].J Biomed Materials Res Part B:Appl Biomaterials,2015,103(6):1217-27.
[4] Hinchcliff K W,Kaneps A J,Geor R J.Equine sports medicine and surgery E-book [M].Elsevier Health Sciences,2013.
[5] 柏 合,王 未,李云章,等.ZD制剂对小鼠急性软组织损伤的毛细血管通透性及血液流变影响的研究 [J].中国兽医杂志,2016,52(7):25-7.
[6] 高 鑫,李云章.ZD制剂对非开放性软组织损伤模型小鼠肌肉中IL-1β表达的影响 [J].畜牧与饲料科学,2016,37(4):1-4.
[7] 王 煜.ZD制剂对马指浅屈肌腱炎和肌肉挫伤模型疗效的超声评估 [D].内蒙古呼和浩特:内蒙古农业大学,2016.

