单核细胞增生李斯特菌溶血素hly基因缺失株和回补株的构建
陈凤霞,叶精精,姜 莉,王 航,吕洁婷,罗微微,冯振灿,程昌勇,宋厚辉
(浙江农林大学动物科技学院,浙江临安 311300)
单核细胞增生李斯特菌(Listeriamoncoytogenes,Lm)简称单增李斯特菌,因其对盐浓度、pH等理化因素不敏感而在自然界中广泛存在,对人和动物的健康构成很大的威胁[1-5]。2015年蓝铃公司生产的冰淇淋曾因其中存在李斯特菌而被紧急召回,2017年4月加拿大某公司生产的酸奶也因疑似污染李斯特菌被要求全部下架。该菌在4℃仍然可以增殖,因此冷藏食品成为该菌感染人类的重要传播媒介。
单增李斯特菌作为胞内寄生菌,其感染宿主细胞主要包括黏附与侵袭、逃逸吞噬体、胞内增殖及细胞间迁移等诸多过程,且每一步均有相关的毒力因子参与[6]。
李斯特菌溶血素O(listeriolysin O,LLO)作为李斯特菌重要毒力因子主要介导细菌裂解并逃逸吞噬体,该蛋白由hly基因编码,属于依赖胆固醇的膜穿孔蛋白家族(CDCs)[7],在酸性条件下可形成直径为35 nm的孔状结构进而插入到宿主细胞膜内[8]。因此,当李斯特菌包裹在吞噬体内侵入细胞时,可借助LLO和磷脂酶A、B(PlcA和PlcB)的作用[9],将吞噬体的膜破坏使其得以逃脱并进入细胞质,导致其在胞内能够进行增殖。由此可见,在细菌逃逸初级和次级吞噬体过程中LLO发挥着重要作用[7]。除此之外,LLO还能激活如钙离子、核转录因子κB(NF-κB)[10-11]等信号通路。
尽管关于LLO功能的研究已较多,但该分子在发挥生物学功能过程中涉及的潜在分子机制尚待深入解析。本研究采用同源重组策略及质粒回补手段构建出hly基因缺失株和回补株,并利用这些重组菌株进一步探索和挖掘LLO参与李斯特菌感染、胞内生存等生物学途径的分子机理,为进一步探索LLO在李斯特菌感染过程中的生物学功能奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株及培养条件 试验需用到的菌株有单增李斯特菌野生型EGD-e和大肠埃希菌DH5α,来自于Song’s Lab冻存库。EGD-e菌株需要接种于牛脑心浸出液肉汤(brain heart infusion,BHI),DH5α菌株需要接种于肉汤(luria-bertani,LB),37℃振荡过夜培养。
1.1.2 试剂和仪器 T4核酸连接酶、DNA标准品、经典蛋白,宝日医生物技术有限公司产品;限制性核酸内切酶BamHⅠ和SalⅠ,美国NEB公司产品;PCR产物纯化/回收试剂盒,上海莱枫生物科技有限公司产品;质粒提取试剂盒,天根生化科技有限公司产品;蛋白免疫印迹显色液,伯尚生物技术有限公司产品;硝酸纤维膜,上海安谱实验科技股份有限公司产品;山羊抗小鼠IgG(H+L)HRP-tag,上海生工生物工程技术服务有限公司产品;聚丙烯酰胺凝胶电泳试剂,美国BBI生命科学有限公司;质粒pKSV7 Plasmid pKSV7,本实验室自存;李斯特菌裂解液,本实验室自配。
1.1.3 引物设计与合成 对于缺失株的构建,所用模板为EGD-e菌株全基因组(GenBank № NC-003210.1),设计2对分别用于扩增hly基因(lmo0202)上、下游同源臂序列的特异性引物(hly EGD-e up-fwd/rev和hly EGD-e down-fwd/rev),同时为了后续缺失株的筛选,在距离上游同源臂100 bp左右设计1条引物(hly EGD-e up front),并搭配引物hly EGD-e down-rev用于同源重组后基因交换验证。对于回补株的引物设计与缺失株的不同在于用到的是在EGD-e菌株全基因组、表达载体pIMK2和重组载体pSL251上都具有其识别位点的1对序列(hly EGD-e completion-fwd/rev),本研究中用到的引物见表1。

表1 本研究中所用到的引物
1.2 方法
1.2.1 单增李斯特菌感受态细胞的制备 挑取单克隆摇菌,培养过夜后吸取新鲜菌液1 mL放入100 mL 终浓度为0.5 g/mol的蔗糖与BHI混合培养基中培养4 h,加入已过滤除菌的青霉素G进行筛选,约2 h后李斯特菌生长至对数期,适合做感受态细胞。用已过滤除菌的1 mg/mol HEPES+0.5 g/mol蔗糖混合液进行洗涤,一般洗2次,第1次用25 mL,第2次用量减半,最后再用400 μL重悬。感受态细胞制备完毕,若需要备用则可分两管冻存在-80℃。
1.2.2 EGD-e基因组的抽提 试验采用裂解、冰冻、煮沸再冰浴冷却的方法,促使它破裂,释放出基因组。先从试管里吸取过夜培养的菌液1 mL~2 mL到适合的离心管,以12 000 r/min 离心1 min。轻轻取出并用200 μL移液器吸取上清弃掉。然后用等体积的TZ和蒸馏水将沉淀菌体重悬,将混合物于-20℃静置30 min后,立即放进泡沫浮漂置于沸水中10 min,随即冰浴进行10 min的冷却,再次离心后取其上清置-20℃冰箱保存备用。
1.2.3 hly基因缺失株Δhly的构建
1.2.3.1 hly上、下游同源臂的扩增 以EGD-e基因组为模板,采用1对上游引物hly EGD-e up-fwd/rev从李斯特菌EGD-e基因组中扩增hly上游同源臂hly EGD-e up homoarm(539 bp),1对下游引物hly EGD-e down-fwd/rev扩增hly下游同源臂hly EGD-e down homoarm(541 bp)。利用引物hly EGD-e up fwdSalⅠ和引物hly EGD-e down revBamHⅠ通过SOE PCR将上、下游同源臂连接起来,得到hly EGD-e homoarms。
宫颈癌为临床最常见的妇科恶性肿瘤,近些年来,随着宫颈病变筛查的广泛开展,近年来宫颈癌的发病率下对降低,但其发病却有明显年轻化趋势,10%~15%的宫颈癌患者在生育期被诊断,其中包括许多未生育者[1]。对这些患者来讲,保留生育功能是十分重要的,部分早期子宫颈癌的年龄患者有渴望保留生育功能的需要。选取2014年1月~2017年12月宫颈癌患者40例行根治性宫颈切除术治疗治疗的临床疗效分析进行分析如下。
1.2.3.2 hly同源臂与pKSV7连接 将hly同源臂与pKSV7用BamHⅠ、SalⅠ进行双酶切,经纯化回收之后,用T4连接酶连接再转入大肠埃希菌DH5α细胞中培养,通过验证,对得到的阳性克隆提质粒,即可得到重组质粒pSL081(图1)。
1.2.3.3 hly基因缺失株的筛选 将质粒pSL081电转入EGD-e感受态细胞中,42℃、BHI/Chl抗性下,培养2代~3代,采用平板划线和PCR验证,选出发生同源重组的阳性克隆。将阳性克隆在30℃、Chl抗性下,进行传代培养,约10代后,在无抗的BHI平板上划线。大约24 h,待平板上长出菌落后,用无菌牙签挑取数个规则的单菌落同步接种于有氯霉素抗性和无抗性的BHI液体培养基或固体平板中培养。在没有抗性的培养基中长势良好,而对应的在有氯霉素抗性的培养基中无法繁殖的即是试验缺失成功的菌株。
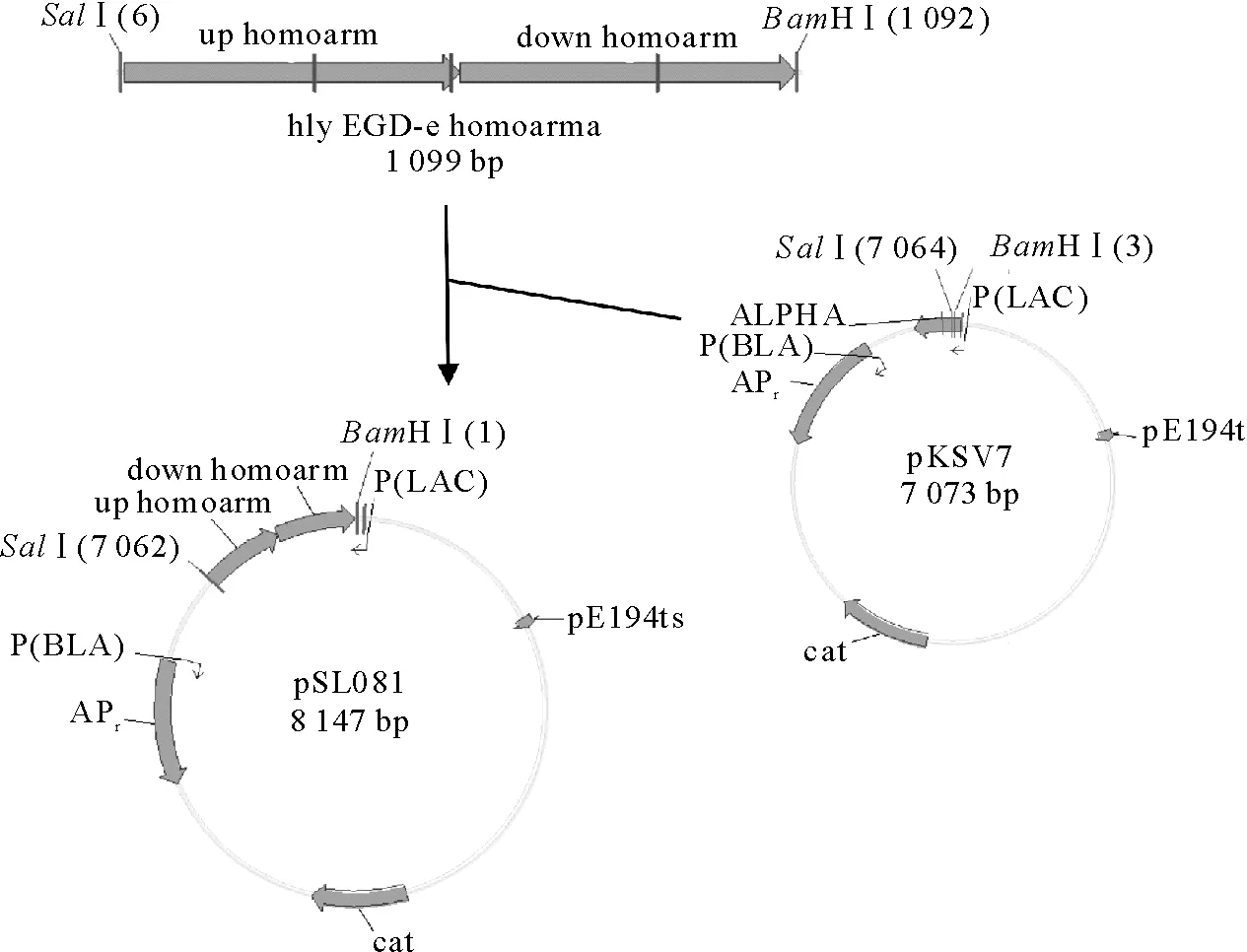
图1 基因敲除载体pSL081的构建Fig.1 Construction strategy of the recombinant plasmid pSL081 for hly gene deletion
1.2.4 hly的回补株CΔhly的构建 为了证实缺失株Δhly的表型缺失是由于基因敲除造成的,利用表达载体pIMK2构建了一个重组载体pSL251(构建示意图见图2),将其在25 μF、200 Ω、2 500 V条件下,用0.2 cm的电击转化杯电转至李斯特菌缺失株Δhly的感受态细胞中。将菌液涂布于有氯霉素抗性的BHI固体平板,放在37℃恒温培养箱中培养约12 h后,挑取单克隆,用引物进行PCR,经鉴定呈阳性的克隆送测序公司,测序成功后的菌株即为回补株,并将其命名为CΔhly。

图2 李斯特菌hly基因回补株重组载体pSL251的构建Fig.2 Construction strategy of the recombinant plasmid pSL251 for hly gene complementation
1.2.5 Δhly和CΔhly的鉴定及遗传稳定性测定 用引物hly EGD-e up front和hly EGD-e down revBamHⅠ进行菌液PCR验证缺失株Δhly和回补株CΔhly,以检测突变株是否发生缺失或回补不完全,并确定重组菌的遗传稳定性。预计野生型菌株和回补株CΔhly可以得到2 779 bp的片段,而缺失株Δhly预期得到1 189 bp的片段。
1.2.6 Western blot检测 为了检测缺失株Δhly和回补株CΔhly是否构建成功,以及融合蛋白在重组菌株内是否成功表达,利用抗原抗体特异性反应原理,以LLO多克隆抗体为一抗,羊抗鼠IgG-HRP为二抗来检测。具体操作时先挑取制备的缺失株Δhly和回补株CΔhly单克隆摇菌,收集菌体后进行离心,分别获得上清和沉淀,为了得到上清中的蛋白,用100 mL/L的TCA对上清进行沉淀,为了得到菌体蛋白,超声破碎将沉淀中的菌体裂解。得到蛋白后测定浓度,计算蛋白量与着色液的合适配比并以两倍该体系分别加入蛋白与试剂,混合均匀,高温煮沸5 min,将样品瞬离使得一些碎片沉到试管底部,降低对下一步SDS-PAGE的影响,电泳后采用半干法转膜,脱脂奶粉封闭,一抗二抗孵育,最后利用紫外线对蛋白进行检测。
2 结果
2.1 缺失株Δhly和回补株CΔhly的验证
采用菌液PCR技术,挑取在氯霉素抗性培养基中不生长而在无抗培养基中生长的单菌落进行验证,用引物hly EGD-e up front和hly EGD-e down revBamHⅠ验证缺失株Δhly和回补株CΔhly。将所得产物进行琼脂糖凝胶电泳,由图3可知,与DNA标准DL 2 000相比,野生株EGD-e得到2 779 bp的片段,而缺失株Δhly是1 189 bp的片段。
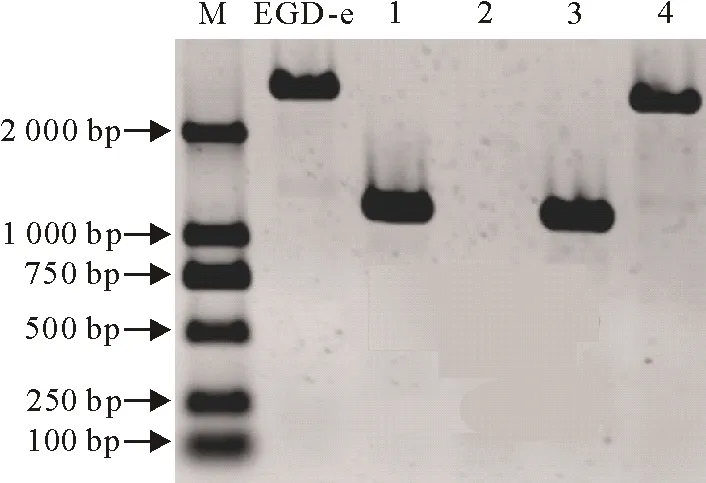
M.DNA标准DL 2 000; EGD-e.野生株;1,3.缺失株Δhly阳性克隆;2.阴性对照;4.回补株CΔhly阳性克隆
M.DNA Marker DL 2 000; EGD-e.Wild strain;1,3. Δhly KO candicates;2. Negative control; 4. CΔhly KO candicate
图3单增李斯特菌EGD-e、缺失株Δhly和回补株CΔhly的PCR验证
Fig.3 Identification of EGD-e,Δhly and CΔhly mutants by PCR
2.2 缺失株Δhly序列测定与分析
本研究设计缺失的序列为GenBank中公布的hly基因整个ORF区(1 590 bp,NC-003210)。为了进一步验证缺失株Δhly的构建情况,采用核苷酸测序分析发现,与野生型EGD-e的hly基因两侧序列比较,本研究构建的缺失株Δhly正好缺失了该基因的整个ORF区(1 590 bp),与预期完全一致(图4),该结果进一步确证缺失株Δhly构建成功,可以用于下一步试验研究。
2.3 重组菌株Western blot检测
3 讨论
单增李斯特菌LLO是该菌感染宿主过程中至关重要的毒力因子,且对宿主细胞具有毒性[12]。已有研究证实LLO能够在各种人类组织细胞(如鼠BMDM与J774和人Caco-2细胞)中协助细菌逃逸吞噬体[13]。目前有研究表明,虽然LLO与细菌磷脂酶PC-PLC为裂解宿主细胞吞噬体膜所必需的蛋白,但单增李斯特菌可以通过肠道派伊尔结上的M细胞进入感染宿主细胞内[14]而不依赖于LLO的作用。基于这一研究结果,笔者认为更有构建Δhly和CΔhly的必要性。在此基础上,下一步将开展LLO生物学特性分析、Δhly毒力分析及致病机理的深入研究,以期解析LLO在单增李斯特菌增殖过程中所发挥功能的潜在分子机制及在没有LLO表达的情况下,单增李斯特菌如何进入被感染的宿主细胞内增殖,比较两者的区别及增殖途径的异同。本研究查阅大量文献做试验,详细记录了构建单增李斯特菌hly基因缺失株和回补株的方法,成功构建出缺失株Δhly和回补株CΔhly,可为初步接触分子生物学领域的学子提供参考,也为进一步探究LLO蛋白的生物学功能奠定重要基础,为探索和挖掘LLO参与李斯特菌感染、胞内生存等生物学途径的分子机理提供试验材料。此外,有学者将李斯特菌用于疫苗开发和研究[15],作为载体通过表达各种免疫蛋白来启动细胞免疫,故本研究成功构建的缺失株Δhly也可为单增李斯特菌用于疫苗载体研究提供可行性方案。
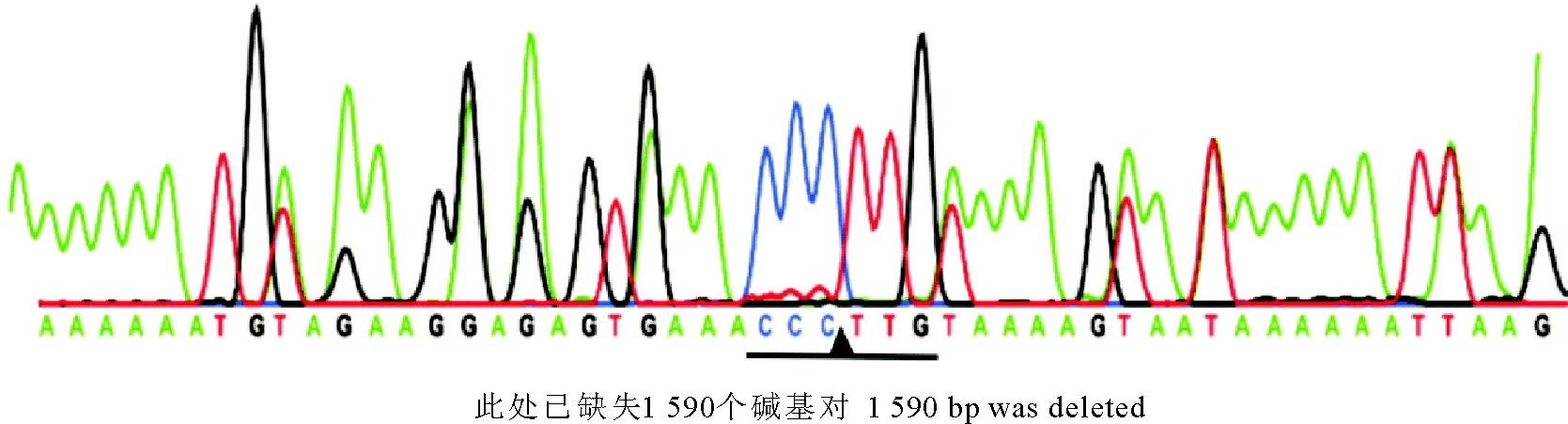
图4 缺失株Δhly测序鉴定结果Fig.4 Verification of Δhly mutant by sequencing

图5 单增李斯特菌EGD-e、缺失株Δhly和回补株CΔhly中LLO的表达分析Fig.5 Western blot analysis of LLO expression in the wild-type strain EGD-e and the mutant strains Δhly and CΔhly
参考文献:
[1] Cheng C,Wang X,Dong Z,et al.Aminopeptidase T of M29 family acts as a novel intracellular virulence factor forListeriamonocytogenesinfection [J].Sci Rep,2015,5:17370.
[2] Valckx W,Lutgens S P M,Haerkens-arends H E,et al.Listeriaendocarditis:a diagnostic challenge [J].J Invest Med High Impact Case Rep,2017,5(2):1-3
[3] 程昌勇,陈健舜,赵寒昕,等.单核细胞增生李斯特菌精氨酸脱亚胺酶基因的克隆及原核表达 [J].动物医学进展,2010,31(s1):70-73.
[4] Morlay A,Roux A,Templier V,et al.Label-free immuno-sensors for the fast detection of listeria in food [J].Methods Mol Biol,2017,1600:49-59.
[5] Althaus D,Jermina M,Giannini P,et al.Local outbreak ofListeriamonocytogenesserotype 4b sequence type 6 due to contaminated meat pate [J].Foodb Pathog Dis,2017,14(4):219-222.
[6] Yin Y,Zhang C,Dong H,et al.Protective immunity induced by a LLO-deficientListeriamonocytogenes[J].Microbiol Immunol,2010,54(4):175-183.
[7] 程昌勇.单核细胞增多性李斯特菌精氨酸和鲱精胺脱亚胺酶的抗酸应激机制及其调控 [D].浙江杭州:浙江大学,2014.
[8] Bavdek A,Kostanjsek R,Antonini V,et al.pH dependence of listeriolysin O aggregation and pore-forming ability [J].FEBS J,2012,279(1):126-141.
[9] 武晓林.单核细胞增多性李斯特菌溶血素LLO的功能关键位点鉴定及表面展示系统的构建[D].浙江临安:浙江农林大学,2015.
[10] Tsuchiya K,Kawamura I,Takahashi A,et al.Listeriolysin O-induced membrane permeation mediates persistent interleukin-6 production in Caco-2 cells duringListeriamonocytogenesinfectioninvitro[J].Infect Immun,2005,73(7):3869-3877.
[11] Dramsi S,Cossart P.Listeriolysin O-mediated calcium influx potentiates entry ofListeriamonocytogenesinto the human Hep-2 epithelial cell line [J].Infect Immun,2003,71(6):3614-3618.
[12] Koster S,Van Pee K,Hudel M,et al.Crystal structure of listeriolysin O reveals molecular details of oligomerization and pore formation [J].Nat Commun,2014,5:3690.
[13] Carrero J A,Vivanco-Cid H,Unanue E R.Listeriolysin o is strongly immunogenic independently of its cytotoxic activity [J].PLoS One,2012,7(3):e32310.
[14] Hastings K T,Cresswell P.Disulfide reduction in the endocytic pathway:immunological functions of gamma-interferon-inducible lysosomal thiol reductase [J].Antioxid Redox Signal,2011,15(3):657-668.
[15] Yang Y,Hou J,Lin Z,et al.AttenuatedListeriamonocytogenesas a cancer vaccine vector for the delivery of CD24,a biomarker for hepatic cancer stem cells [J].Cell Mol Immunol,2014,11(2):184-196.

