高盐饮食对健康人和高血压患者血浆血管内皮生长因子C水平的影响及其与血压的相关性研究
鞠文浩,刘金波,赵红薇,周迎燕,王宏宇
人体的钠盐总量和细胞外液容量关系密切,钠盐储存在体液里,钠盐的量主要受饮食摄入和肾脏排泄的影响。肾排钠的特点:多摄多排,少摄少排。因此细胞外液的渗透压是稳定的,过多的组织间液的钠盐流入血液,通过肾脏清除[1]。但是最近的动物实验发现,存在无水储存的钠盐。在组织间液内,钠盐通过结合阴离子的蛋白聚糖和糖胺聚糖,储存在皮下的组织间质腔室内,这部分钠盐不需要等体积的水[2,3]。进一步研究发现,这部分钠盐造成的渗透压力,使巨噬细胞聚集,促进其分泌血管内皮生长因子-C(VEGF-C),VEGF-C 进一步促进血管新生和内皮型一氧化氮(eNOS)的表达增加,部分缓解血压升高。如果抑制巨噬细胞-VEGF-C-血管新生这条信号通路,高盐饮食就会导致血压升高[4-7]。另有研究发现,顽固性高血压患者血浆中VEGF-C水平也升高[8]。这些发现都提示,在人的钠盐代谢中也存在一种肾外调节机制,即巨噬细胞-VEGF-C-血管新生信号通路,它可能通过调控钠盐,进一步调控血压[9-11]。因此,血浆中VEGF-C水平和高盐饮食可能存在相关性,高盐饮食会使血浆中VEGF-C水平升高。本研究在原发性高血压患者中进一步探讨血浆VEGF-C水平与血压的相关性。
1 资料与方法
1.1 研究对象
北京大学首钢医院血管医学中2013-2014年度住院的原发性高血压患者 75例(高血压组)和同期体检健康者98例(对照组)。按照《中国高血压防治指南2010》定义,收缩压≥140 mmHg(1 mmHg=0.133 kPa)和(或)舒张压≥90 mmHg;既往有高血压病史,2周内服用降压药物,体检时血压<140/90 mmHg,也诊断为高血压。排除冠心病、糖尿病、脑梗死、心力衰竭、肝肾功能异常、全身炎症反应、感染性疾病、癌症患者。
1.2 研究方法
血压的测定和平均动脉压的计算方法:按照国际通用的测量方法和质量控制规范进行,使用经过校准的水银血压计,在安静状态下测量。连续测量两次,每次间隔2 min,取两次结果的平均值。平均动脉压=舒张压+1/3脉压。
食盐摄入量评估方法:通过量化食物频率法(SALTFFQ)获得。调查对象计算得出的食盐摄入量包括在家烹饪食物和在外就餐的食用盐两部分的总和[12]。
颈-股脉搏波传导速度(CF-PWV)的测定:应用动脉硬化检测仪器Compliar SP(r),受检者采取平卧位,压力探头分别置于颈动脉及股动脉搏动点,取得最佳波形,并检测两点间的距离,仪器自动计算CF-PWV。
实验室检查:取空腹静脉血,用EDTA抗凝,应用自动分析仪(HITACHI-7170)检测空腹血糖(FBG)、血肌酐(CCr)、血尿酸(UA)、血总胆固醇 (TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)。
血浆VEGF-C的测定:(1)试剂盒和仪器:VEGF-C(ELISA)试剂盒(购自美国R&D公司),测量吸光度的酶标仪为550型(美国BIO-RAD公司)。(2)检测方法:-80℃冻存样品复温。以试剂盒提供的标准品绘制标准曲线,每批检测设空白、阴性对照各 2 孔。严格按照说明书进行操作。在酶标分析仪上 450 nm 处读取吸光度值,每孔测定3次,取均值。结果计算:参照试剂盒操作步骤与方法绘制标准曲线,并求浓度与吸光度的回归方程,依标准曲线和回归方程确定各样品 VEGF-C 含量。(3)血浆VEGF-C水平的正常参考值范围:109.0~7 000.0 pg/ml。
一般病史的采集:收集受试者的一般资料如年龄、性别、体重指数(BMI)、收缩压、舒张压、脉压、平均动脉压、心率、血管相关的病史(冠心病、脑梗死、糖尿病、高脂血症、下肢动脉疾病) 等。
1.3 统计学方法
采用SPSS 22.0统计软件进行统计检验。两组间性别构成比较采用χ2检验。计量资料以(±s)表示,两组间比较采用独立样本t检验。相关性分析采用Spearman相关性检验,P<0.05(双侧)认为具有统计学意义。
2 结果
两组受试者的基本临床资料比较(表1):高血压组与对照组相比,血浆VEGF-C水平升高,差异有统计学意义[(3 940.8±1 141.1)pg/ml vs (2 938.0±987.0)pg/ml,P<0.001],同时两组在年龄、BMI、收缩压、舒张压、脉压、平均动脉压、CFPWV上的差异也均有统计学意义(P均<0.05)。
表1 两组受试者的基本临床资料比较(±s)

表1 两组受试者的基本临床资料比较(±s)
注:TC:总胆固醇; HDL-C:高密度脂蛋白胆固醇;LDL-C:低密度脂蛋白胆固醇;TG:甘油三酯;CF-PWV:颈-股动脉脉搏传导速度;VEGF-C:血管内皮生长因子。1 mmHg=0.133 kPa
年龄 (岁) 57.0±8.0 60.4±9.4 0.013 CF-PWV (m/s) 9.6±1.5 10.7±1.9 <0.001
高血压组中高盐饮食亚组与低盐饮食亚组的基本临床资料比较(表2):高血压组中高盐饮食亚组与低盐饮食亚组相比,血浆VEGF-C水平升高,差异有统计学意义[(4 208.8±113.1)pg/ml vs (3 515.8±1 070.1)pg/ml,P=0.009],同时两亚组在年龄、收缩压、舒张压、脉压上的差异也均有统计学意义(P均<0.05)。
表2 高血压组患者中高盐饮食亚组与低盐饮食亚组的基本临床资料比较(±s)
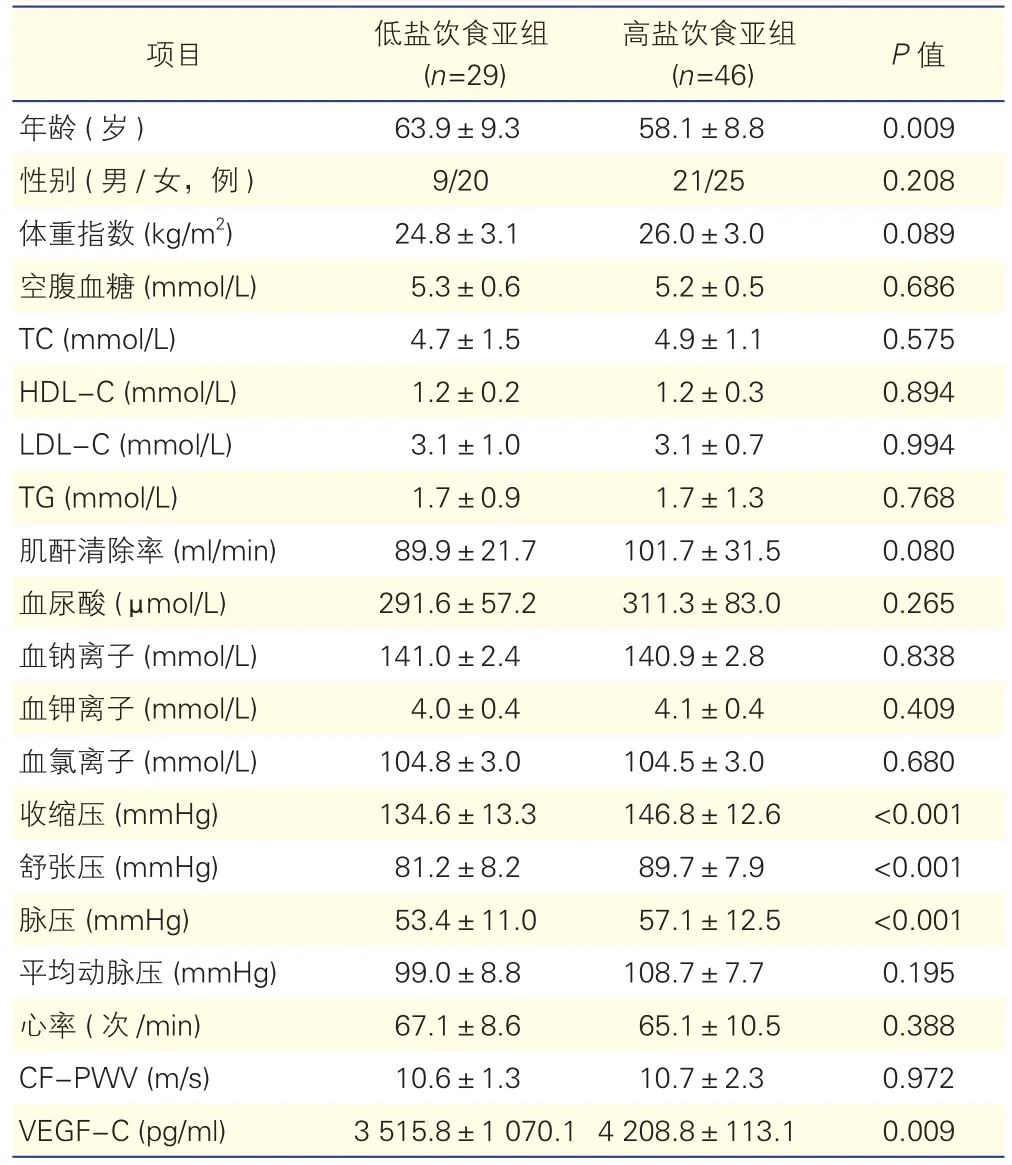
表2 高血压组患者中高盐饮食亚组与低盐饮食亚组的基本临床资料比较(±s)
注:TC:总胆固醇; HDL-C:高密度脂蛋白胆固醇;LDL-C:低密度脂蛋白胆固醇;TG:甘油三酯;CF-PWV:颈-股动脉脉搏传导速度;VEGF-C:血管内皮生长因子。1 mmHg=0.133 kPa
项目 低盐饮食亚组(n=29)高盐饮食亚组(n=46) P值年龄 (岁) 63.9±9.3 58.1±8.8 0.009性别 (男/女,例) 9/20 21/25 0.208体重指数 (kg/m2) 24.8±3.1 26.0±3.0 0.089空腹血糖 (mmol/L) 5.3±0.6 5.2±0.5 0.686 TC (mmol/L) 4.7±1.5 4.9±1.1 0.575 HDL-C (mmol/L) 1.2±0.2 1.2±0.3 0.894 LDL-C (mmol/L) 3.1±1.0 3.1±0.7 0.994 TG (mmol/L) 1.7±0.9 1.7±1.3 0.768肌酐清除率 (ml/min) 89.9±21.7 101.7±31.5 0.080血尿酸 (μmol/L) 291.6±57.2 311.3±83.0 0.265血钠离子 (mmol/L) 141.0±2.4 140.9±2.8 0.838血钾离子 (mmol/L) 4.0±0.4 4.1±0.4 0.409血氯离子 (mmol/L) 104.8±3.0 104.5±3.0 0.680收缩压 (mmHg) 134.6±13.3 146.8±12.6 <0.001舒张压 (mmHg) 81.2±8.2 89.7±7.9 <0.001脉压 (mmHg) 53.4±11.0 57.1±12.5 <0.001平均动脉压 (mmHg) 99.0±8.8 108.7±7.7 0.195心率 (次/min) 67.1±8.6 65.1±10.5 0.388 CF-PWV (m/s) 10.6±1.3 10.7±2.3 0.972 VEGF-C (pg/ml) 3 515.8±1 070.1 4 208.8±113.1 0.009
对照组中高盐饮食亚组与低盐饮食亚组的基本临床资料比较(表3):对照组中高盐饮食亚组血浆VEGF-C水平高于低盐饮食亚组,差异有统计学意义[(3 158.7±917.2)pg/ml vs (2 655.7±1 011.3)pg/ml,P=0.012],两亚组在年龄、BMI、CCr的差异也均有统计学意义(P均<0.05)。
平均动脉压与血浆VEGF-C水平的相关性分析(表4):Spearman相关分析显示,在所有入组受试者中,平均动脉压与 BMI(r=0.290,P<0.001)、LDL-C(r=0.122,P=0.018)、TG(r=0.230,P=0.002)、VEGF-C(r=0.209,P<0.001)、CFPWV(r=0.106,P<0.001)、钠盐摄入量(r=0.274,P<0.001)呈正相关,与HDL-C呈负相关(r=-1.777,P=0.020)。 进 一 步 校 正 BMI、LDL-C、TG、CF-PWV、 钠 盐摄入量后,平均动脉压仍与VEGF-C呈 正 相 关 (r=0.536,P<0.001)。在高血压组中,平均动脉压与CCr (r=0.236,P=0.041)、钠盐摄入量(r=0.534,P<0.001)、VEGF-C(r=0.617,P<0.001)呈正相关;进一步校正CCr、钠盐摄入量后,平均动脉压仍与VEGF-C呈正相关(r=0.546,P=0.002)。在对照组中,平均动脉压与BMI(r=0.227,P=0.025)、FBG(r=0.212,P<0.037)、TG(r=0.221,P=0.030)、UA(r=0.201,P=0.048)、VEGF-C(r=0.379,P<0.001)、CF-PWV(r=0.517,P<0.001)呈正相关;进一步校正BMI、FBG、TG、UA、CF-PWV后,平均动脉压仍与VEGF-C呈正相关(r=0.291,P=0.006)。
表3 对照组受试者中高盐饮食亚组与低盐饮食亚组的基本临床资料比较(±s)

表3 对照组受试者中高盐饮食亚组与低盐饮食亚组的基本临床资料比较(±s)
注:TC:总胆固醇; HDL-C:高密度脂蛋白胆固醇;LDL-C:低密度脂蛋白胆固醇;TG:甘油三酯;CF-PWV:颈-股动脉脉搏传导速度;VEGF-C:血管内皮生长因子。1 mmHg=0.133 kPa
项目 低盐饮食亚组(n=43)高盐饮食亚组(n=55) P值年龄 (岁) 59.3±8.6 55.3±7.1 0.012性别 (男/女,例) 14/29 21/34 0.564体重指数 (kg/m2) 23.0±3.6 24.8±3.0 0.009空腹血糖 (mmol/L) 5.1±0.4 5.1±0.6 0.699 TC (mmol/L) 4.7±0.9 5.1±1.1 0.073 HDL-C (mmol/L) 1.4±0.4 1.3±0.3 0.613 LDL-C (mmol/L) 2.9±0.7 3.2±0.8 0.107 TG (mmol/L) 1.3±0.8 1.9±2.1 0.061肌酐清除率 (ml/min) 83.4±22.5 109.1±26.1 <0.001血尿酸 (μmol/L) 301.3±83.9 298.3±89.5 0.871血钠离子 (mmol/L) 140.1±2.2 140.5±2.4 0.367血钾离子 (mmol/L) 4.0±0.3 4.0±0.3 0.634血氯离子 (mmol/L) 105.0±2.7 105.0±2.6 0.904收缩压 (mmHg) 123.0±13.9 125.1±11.7 0.420舒张压 (mmHg) 77.6±6.4 79.7±8.1 0.152脉压 (mmHg) 45.4±11.3 44.5±10.0 0.677平均动脉压 (mmHg) 92.7±8.0 93.1±15.4 0.867心率 (次/min) 65.5±9.9 67.8±12.6 0.333 CF-PWV (m/s) 9.5±1.6 9.8±1.5 0.377 VEGF-C (pg/ml) 2 655.7±1 011.3 3 158.7±917.2 0.012

表4 平均动脉压与血浆VEGF-C水平的Spearman相关分析
3 讨论
我们发现,高血压组血浆VEGF-C水平比对照组高,且血浆VEGF-C水平受高盐饮食的影响。在健康人群和高血压人群中,高盐饮食亚组的血浆VEGF-C水平均更高。在高血压组中,与低盐饮食亚组相比,高盐饮食亚组的收缩压[(146.8±12.6)mmHg vs (134.6±13.3)mmHg,P<0.001]和舒张压 [(89.7±7.9)mmHg vs(81.2±8.2)mmHg,P<0.001]明显升高;而在健康人群中,高盐饮食对血压的影响不大;这提示可能与高血压患者肾外血压调节轴(巨噬细胞-VEGF-C-血管新生)受损、血压调节失代偿有关。在健康人群中,该调节轴功能正常。
在动物试验中,高盐饮食干预后动物皮下的组织间质钠盐蓄积,渗透压增大,糖胺聚糖含量和糖胺聚糖所带的负电荷增加[13]。为了响应间质的高渗透压力,巨噬细胞聚集,分泌VEGF-C,诱导eNOS表达,其结合VEGFR-2或VEGFR-3受体,促进血管新生[14-16]。随后血管舒张,钠盐从组织间质中清除掉,从而调控血压[15-17]。
健康人群经高盐饮食干预一周后,血浆中VEGF-C水平升高,同时细胞外体积和CCr也增加,提示肾脏也参与了高盐饮食的调节[18,19]。我们的数据显示,在健康人群中,与低盐饮食亚组相比,高盐饮食亚组的CCr明显上升,而高血压人群经高盐饮食干预后CCr变化不明显;这提示可能是肾外血压调节轴(巨噬细胞-VEGF-C-血管新生)通路和传统的肾内盐平衡肾渗透压通路一起调控血压,肾内也可能存在巨噬细胞-VEGF-C-血管新生的调节通路。
我们的研究证明,在原发性高血压患者中,高盐饮食对血浆中VEGF-C水平有影响,血浆VEGF-C水平和血压存在相关性;这提示了人体肾外巨噬细胞-VEGF-C-血管新生信号通路在血压调节中的重要作用,该通路在正常人群和高血压患者中均发挥作用。
我们的研究存在缺陷:第一,钠盐摄入评估方法采取的是膳食史法,主观性强,容易出现一些偏差和错误;第二,由于技术限制,我们没有准确测定皮肤中钠盐的总含量和VEGF-C的表达情况。随着技术的改善,现在用新的核磁共振技术测量皮肤中钠盐的含量[19],为下一步研究奠定了基础。
综上所述,与健康人群相比,高血压患者血浆VEGF-C水平升高。血浆VEGF-C水平受高盐饮食的影响,且血浆VEGF-C水平和血压呈正相关。VEGF-C介导的巨噬细胞-VEGF-C-血管新生这条信号通路在人体盐平衡调节中有重要作用,未来应进一步探讨VEGF-C介导的间质的电解平衡和体内稳态的相关性。
高盐饮食在我国北方比较普遍,考虑到个体易感性,检测某一高血压患者是否为盐敏感性高血压患者是有难度的。而我们可以通过检测血浆中VEGF-C水平,以其作为靶标,干预盐敏感高血压患者因高盐饮食引起的血压升高。
[1] Nierenberg JL, Li C, He J, et al. Blood pressure genetic risk score predicts blood pressure responses to dietary sodium and potassium:the GenSalt Study (Genetic Epidemiology Network of Salt Sensitivity)[J]. Hypertension, 2017, 70(6): 1106-1112. DOI: 10.1161/HYPERTENSIONAHA.117.10108.
[2] Schneider MP, Raff U, Kopp C, et al. Skin sodium concentration correlates with left ventricular hypertrophy in CKD[J]. J Am Soc Nephrol, 2017, 28(6): 1867-1876. DOI: 10.1681/ASN.2016060662.
[3] Zeidel ML. Salt and water: not so simple[J]. J Clin Invest, 2017, 127(5):1625-1626. DOI: 10.1172/JCI94004.
[4] Machnik A, Neuhofer W, Jantsch J, et al. Macrophages regulate saltdependent volume and blood pressure by a vascular endothelial growth factor-C-dependent buffering mechanism[J]. Nat Med, 2009, 15(5):545-552. DOI: 10.1038/nm.1960.
[5] Machnik A, Dahlmann A, Kopp C, et al. Mononuclear phagocyte system depletion blocks interstitial tonicity-responsive enhancer binding protein/vascular endothelial growth factor C expression and induces salt-sensitive hypertension in rats[J]. Hypertension, 2010,55(3): 755-761. DOI: 10.1161/HYPERTENSIONAHA.109.143339.
[6] Zhang MZ, Yao B, Wang Y, et al. Inhibition of cyclooxygenase-2 in hematopoietic cells results in salt-sensitive hypertension[J]. J Clin Invest, 2015, 125(11): 4281-4294. DOI: 10.1172/JCI81550.
[7] Al-Attar R, Zhang Y, Storey KB. Osmolyte regulation by TonEBP/NFAT5 during anoxia-recovery and dehydration-rehydration stresses in the freeze-tolerant wood frog (Rana sylvatica) [J]. Peer J, 2017, 5:e2797. DOI: 10.7717/peerj.2797.
[8] De Beus E, de Jager RL, Beeftink MM, et al. Salt intake and blood pressure response to percutaneous renal denervation in resistant hypertension[J]. J Clin Hypertens (Greenwich), 2017, 19(11): 1125-1133. DOI: 10.1111/jch.13085.
[9] Go WY, Liu X, Roti MA, et al. NFAT5/TonEBP mutant mice define osmotic stress as a critical feature of the lymphoid microenvironment[J].Proc Natl Acad Sci USA, 2004, 101(29): 10673-10678. DOI: 10.1073/pnas.0403139101.
[10] Jantsch J, Schatz V, Friedrich D, et al. Cutaneous Na+storage strengthens the antimicrobial barrier function of the skin and boosts macrophage-driven host defense[J]. Cell Metab, 2015, 21(3): 493-501.DOI: 10.1016/j.cmet.2015.02.003.
[11] Kerjaschki D. The lymphatic vasculature revisited[J]. J Clin Invest,2014, 124(3): 874-877. DOI: 10.1172/JCI74854.
[12] Newson RS, Elmadfa I, Biro G, et al. Barriers for progress in salt reduction in the general population: an international study[J]. Appetite,2013, 71: 22-31. DOI: 10.1016/j.appet.2013.07.003.
[13] Wiig H, Schroder A, Neuhofer W, et al. Immune cells control skin lymphatic electrolyte homeostasis and blood pressure[J]. J Clin Invest,2013, 123(7): 2803-2815. DOI: 10.1172/JCI60113.
[14] Taher M, Nakao S, Zandi S, et al. Phenotypic transformation of intimal and adventitial lymphatics in atherosclerosis: a regulatory role for soluble VEGF receptor 2[J]. FASEB J, 2016, 30(7): 2490-2499. DOI:10.1096/fj.201500112.
[15] Yao LC, Testini C, Tvorogov D, et al. Pulmonary lymphangiectasia resulting from vascular endothelial growth factor-C overexpression during a critical period[J]. Circ Res, 2014, 114(5): 806-822. DOI:10.1161/CIRCRESAHA.114.303119.
[16] Tammela T, Alitalo K. Lymphangiogenesis: molecular mechanisms and future promise[J]. Cell, 2010, 140(4): 460-476. DOI: 10.1016/j.cell.2010.01.045.
[17] Lucarelli RT, Ogawa M, Kosaka N, et al. New approaches to lymphatic imaging[J]. Lymphat Res Biol, 2009, 7(4): 205-214. DOI: 10.1089/lrb.2009.0021.
[18] Lankhorst S, Severs D, Marko L, et al. Salt sensitivity of angiogenesis inhibition-induced blood pressure rise: role of interstitial sodium accumulation[J]. Hypertension, 2017, 69(5): 919-926. DOI: 10.1161/HYPERTENSIONAHA.116.08565.
[19] Wang P, Deger MS, Kang H, et al. Sex differences in sodium deposition in human muscle and skin[J]. Magn Reson Imaging, 2017, 36: 93-97.DOI: 10.1016/j.mri.2016.10.023.

