定量计算机断层摄影术测定中国人群多中心体脂指标与高血压水平的相关性研究
陈洪群,陈游洲,郑梅,王继红,端木洋洋,王玲,程晓光,赵兴山
根据《中国心血管病报告》示:2010年中国成人超重率、肥胖率和中心性肥胖率分别达到30.6%、12.0%和40.7%[1]。肥胖与高血压关系密切[2,3]。内脏脂肪堆积所致的腹型肥胖可促使脂代谢紊乱、高血压或空腹血糖水平升高,加速动脉粥样硬化,导致心血管疾病的发生与进展。腹部脂肪包括腹内脂肪和皮下脂肪。针对欧美人群的研究证实腹内脂肪和皮下脂肪与心血管损害的程度关系密切,是心血管疾病的独立危险因素[4]。而有的研究却认为腹内脂肪含量与高血压、冠心病等关系密切,而皮下脂肪与高血压等相关性并不明显[5]。在中国人群中,有关腹内脂肪与高血压的研究目前相对较少[6,7],且研究是小样本或者单中心,尚缺少针对中国人群的多中心大规模研究。以往的研究提示腰围、腰臀比等体脂指标与内脏脂肪存在较好的相关性,可以预测高血压、糖尿病发病风险[8,9]。目前认为,与其他常规方法相比,定量计算机断层摄影术(quantitative CT,QCT)可以精确测量腹部脂肪含量和分布[5],但该方法目前尚缺乏在大规模多中心中国人群中探讨常规的体脂参数及腹内脂肪与高血压相关性的研究资料。因而本研究采用QCT测量腹内脂肪面积和腹部皮下脂肪面积,并探讨体表测量指标及腹内脂肪面积、皮下脂肪面积与血压水平的相关性。
1 资料与方法
1.1 一般资料
选取从2005~2007年在中国参与前瞻性城市流行病学(The prospective urban-rural epidemiology study,PURE)研究中的纳入退行性骨科疾病研究人群共3 091例[10],其中参与的人群包括来自北京市、常州市、成都市、大邑县、南京市、南昌市、沈阳市、太原市、西安市。除去血压数据不完整者,最后共1 488例入选。该项目经本院伦理委员会批准通过。受试者均签署知情同意书,并行计算机断层摄影术(CT)平扫检查。
排除标准:患有脂肪萎缩症、甲状腺功能亢进、甲状腺功能减退等全身和代谢性疾病患者;服用糖皮质激素、降胆固醇等药物患者。
1.2 研究方法
血压数据:经过培训的研究人员对研究对象的身高和体重进行测量,并计算体重指数(BMI)。BMI=体重/身高2(kg/m2)。测量腰围时,研究对象直立,用软皮尺直接贴在皮肤上,在肚脐以上1 cm的水平面上进行测量。用水银柱血压计按照标准方法对血压进行测量,收缩压(SBP)、舒张压(DBP)分别测量3次,取其平均值。依据《中国高血压防治指南2010》,定义为平均SBP≥140 mmHg(1 mmHg =0.133 kPa)和(或)DBP≥90 mmHg和(或)最近两周内正在服用抗高血压药物。
体脂指标数据测量:腰围测定:受试者站立位,应用非弹性的软尺,自右侧腋中线上第12肋下缘与髂前上棘连接线的中点,沿水平方向绕腹部一周,在正常呼气末屏息测定读数。臀围是在应用软尺测量臀部的最大周径,测定腰围与身高比值(waist to height ratio,WHtR)。
分组:根据受试者的血压情况将1 488例分为非高血压组783例和高血压组705例。
QCT脂肪测量:所有患者于空腹状态下采用螺旋CT行腹部扫描。患者仰卧并于扫描过程中屏气,脐上平面(L2~L3)为扫描水平,选择被检查者腹部CT脐上平面图像。平扫数据传至QCT骨密度测量分析软件工作站进行测量,运用QCT骨密度测量分析软件中的“tissue composition”功能进行测量。软件对断面图像自动着色,区分脂肪成分和内脏肌肉成分,自动圈定腹壁肌肉外围,以腹壁肌肉为界,区分内脏脂肪组织和皮下脂肪组织,继而通过软件自动计算腹部脂肪面积及内脏脂肪面积,然后二者相减得出皮下脂肪面积。
1.3 统计学方法
采用SPSS 22.0统计软件进行分析。对各定量变量进行正态性检验,符合正态分布以均数±标准差表示,采用多因素方差分析或t检验进行分析。计数资料以率表示,采用χ2检验。两组之间定量资料相关性分析,符合正态分布者,采用Pearson相关性分析,不符合正态分布者,选用Spearman等级相关分析。分别采用线性Logistic回归和二分类Logistic分析体表测量指标及腹内脂肪面积、皮下脂肪面积与高血压的相关性。检验水准α=0.05,以P<0.05为差异有统计学意义。
2 结果
2.1 两组受试者的基线特征(表1)
1 488例入选者中,年龄为42~82岁,平均年龄63岁;男性514例,占34.5%。其中高血压组患者705例,占47.4%。与非高血压组相比,高血压组的血压、体脂指标如BMI、腰围、臀围、WHtR、腹内脂肪面积、皮下脂肪面积均显著增高(P<0.05)。
表1 高血压组与非高血压组受试者的基线特征(±s)
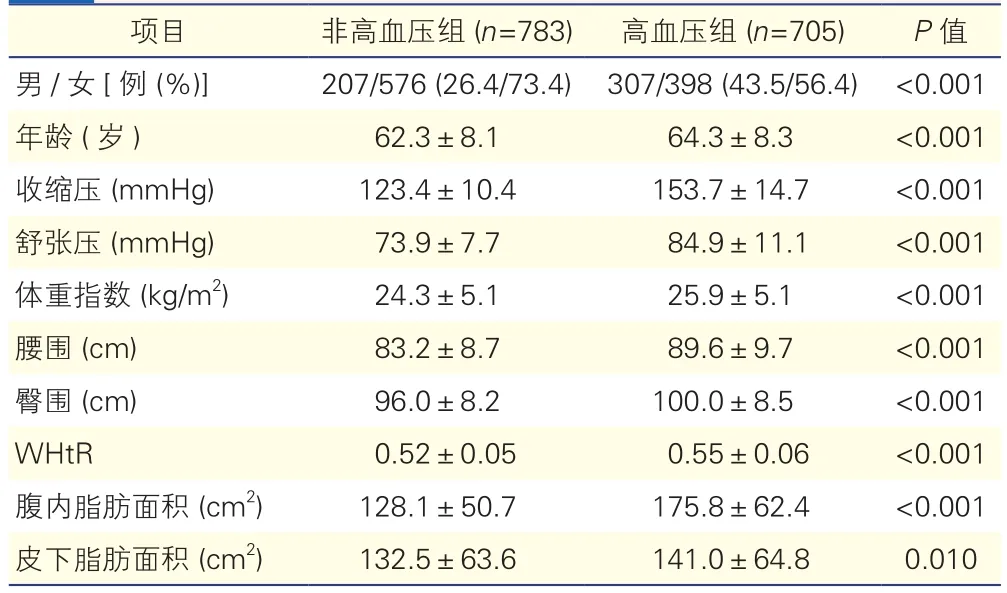
表1 高血压组与非高血压组受试者的基线特征(±s)
注:WHtR:腰围与身高比值。1 mmHg =0.133 kPa
项目 非高血压组 (n=783) 高血压组 (n=705) P值男/女[例 (%)] 207/576 (26.4/73.4) 307/398 (43.5/56.4) <0.001年龄 (岁) 62.3±8.1 64.3±8.3 <0.001收缩压 (mmHg) 123.4±10.4 153.7±14.7 <0.001舒张压 (mmHg) 73.9±7.7 84.9±11.1 <0.001体重指数 (kg/m2) 24.3±5.1 25.9±5.1 <0.001腰围 (cm) 83.2±8.7 89.6±9.7 <0.001臀围 (cm) 96.0±8.2 100.0±8.5 <0.001 WHtR 0.52±0.05 0.55±0.06 <0.001腹内脂肪面积 (cm2) 128.1±50.7 175.8±62.4 <0.001皮下脂肪面积 (cm2) 132.5±63.6 141.0±64.8 0.010
2.2 体重指数、腰围/身高与腹内脂肪面积和皮下脂肪面积的相关性
BMI与腹内脂肪面积(r=0.605,P<0.001)、皮下脂肪面积(r=0.516,P<0.001)均呈显著正相关性。WHtR与腹内脂肪面积(r=0.503,P<0.001)、皮下脂肪面积(r=0.442,P<0.001)也呈显著相关性。
2.3 体脂测量指标及腹内脂肪面积、皮下脂肪面积与血压相关性分析(表2)
采用Pearson相关性分析比较体脂指标如BMI、腰围、臀围、WHtR与SBP、DBP相关性,采用Spearman相关性分析腹内脂肪面积、标准化腹内脂肪面积、皮下脂肪面积、标准化皮下脂肪面积与SBP、DBP相关性。表2结果显示:BMI、腰围、臀围、WHtR、腹内脂肪面积、皮下脂肪面积与SBP均呈显著正相关(P<0.05),其中,腹内脂肪面积与SBP的相关性最强(r=0.463,P<0.001);同样上述各变量与DBP的相关性也有相同趋势,即BMI、腰围、臀围、WHtR、腹内脂肪面积、皮下脂肪面积与DBP均呈显著正相关,且DBP与腹内脂肪面积的相关性也最强(r=0.246,P<0.01)。

表2 体脂测量指标及腹内脂肪面积、皮下脂肪面积与血压相关性分析
2.4 体脂测量指标及腹内脂肪面积、皮下脂肪面积与血压多因素线性回归分析(表3)
分别以SBP和DBP为因变量,采用多因素线性回归,探讨常规体脂指标及腹内脂肪面积、皮下脂肪面积与血压水平相关性。当校正性别、年龄、BMI因素后,WHtR及腹内脂肪面积、皮下脂肪面积均为SBP的独立影响因素;而腰围、腹内脂肪面积为DBP的独立影响因素。

表3 体脂测量指标及腹内脂肪面积、皮下脂肪面积与血压多因素线性回归分析
2.5 体脂测量指标及腹内脂肪面积、皮下脂肪面积与高血压多因素回归分析(表4)
本研究以是否存在高血压为因变量,在调整了年龄、性别、BMI、腰围、臀围因素后,Logistics回归分析结果显示腹内脂肪面积 (OR=1.012,95% CI:1.010~1.015)、腰围(OR=1.042,95%CI :1.020~1.065)是高血压发生的独立影响因素。

表4 体脂测量指标及腹内脂肪面积、皮下脂肪面积与高血压多因素回归分析
3 讨论
流行病学调查表明,在中国人群中,肥胖的发生率增加,其心脑血管发病率显著增高[4,11,12]。肥胖者腹部脂肪的增加与高血压关系密切。腹部脂肪分为腹内脂肪和皮下脂肪两部分,两者对血压水平的影响尚有争论。本研究基于大规模多中心临床研究人群,通过QCT的手段,分析腹内脂肪面积与血压水平的相关性,证实腹内脂肪面积与血压水平呈显著相关性,且腹内脂肪面积而非皮下脂肪面积为高血压的独立影响因素。
传统的反映肥胖或体脂指标如BMI、腰围和WHtR与高血压发生风险呈相关性[5,13,14],Chandra等[5]研究发现随着BMI增高,高血压发病风险显著增加。de Oliveira等[14]研究发现,腰围和BMI较通过腰围、BMI、血脂数据计算出的内脏指数与血压相关性更强。与其研究相似,本研究中我们也发现,BMI和腰围与血压水平均呈相关性。然而BMI并不能反映体内脂肪真正的分布情况,限制了其临床应用[7]。最新的研究证实肥胖患者中内脏脂肪的增加较BMI能更好的预测高血压发生风险[5]。与其研究一致,我们的研究也发现,当BMI和腹内脂肪面积同时纳入回归方程后,腹内脂肪面积而非体重指数是高血压的独立影响因素。
近年来WHtR与心血管疾病、死亡率密切相关[15]。Cai等[13]研究认为与BMI和腰围相比,WHtR可以更好的预测高血压和糖尿病风险,其切入点为(0.661~0.773)。同样 Ashwell等[9]研究显示:WHtR在预测高血压、2型糖尿病、高脂血症等方面优于腰围和BMI。然而,在针对日本人群的研究中认为,WHtR并不能真正反映内脏脂肪。在本研究中,WHtR与血压水平同样呈正相关,多元回归分析时当校正性别、年龄、体重后,WHtR仍是血压水平的独立影响因素。但当是否为高血压作为因变量行多元回归分析显示,腹内脂肪含量而非WHtR是血压增高的独立影响因素,提示与单纯的体表测量指标相比,腹内脂肪可能是更好的预测因子[16]。
内脏脂肪堆积导致高血压产生的机制目前尚不清楚。目前有证据表明内脏脂肪代表病理性脂肪组织堆积,当皮下脂肪过量或者无法贮存时便会转移到肝脏、骨骼肌及其他脏器形成内脏脂肪。与皮下脂肪相比,内脏脂肪对脂溶酶更敏感,可以分泌大量的炎症因子[5]。另外位于肾脏内及包绕在肾脏外面的大量脂肪本身对肾脏的机械压迫、激活肾素-血管紧张素-醛固酮系统及醛固酮受体的激活、分布在肌肉及肾脏交感神经系统兴奋性增加等因素共同作用导致血压水平增高[17]。有研究认为血压水平的增加可能与瘦素水平增高相关。瘦素水平与肌肉交感神经活性呈正相关。在临床中,短时间应用瘦素可以增加交感神经活性,可间接导致血压增加[18]。从本项研究中也可以看出腹内脂肪面积为血压水平独立影响因素,间接提示肥胖尤其是腹内脂肪增加在高血压发生、发展中可能占据重要地位。
在本研究中选取L2-L3层面代表腹内脂肪来探讨其与高血压的相关性,这与Chandra 等[5]研究相一致,可能的机制:在L2-L3区域内的网膜和肠系膜中,沉积了代谢更为活跃的内脏脂肪细胞;其次在此区域中包围肾脏的脂肪可能通过旁分泌途径分泌因子影响血压。尽管可能是一小部分的效应,但是类似的旁分泌途径在心脏外脂肪及冠心病的发生和发展中得到证实[19]。
本研究尚有不足,为横断面观察性研究,尚缺乏大规模多中心针对中国人群的前瞻性研究,在未来的研究中尚需进一步探讨。
综上所述,欧美人群的研究已证实内脏脂肪是高血压发生的独立预测因素[5]。本研究中基于大规模多中心人群探讨传统的体脂指标及利用QCT测定的腹部脂肪与高血压的相关性,证实了腹内脂肪面积而非皮下脂肪面积是高血压的独立影响因素,可作为高血压的监测指标,并可能有助于高血压的危险分层。
[1] 何洪波, 雷寒, 祝之明. 兼顾血压控制、体重控制和改善代谢紊乱——肥胖相关性高血压管理的中国专家共识解读[J]. 中国循环杂志, 2016, 31(zl): 117-120. DOI: 10. 3969/j. issn. 1000-3614.2016. 增刊. 031.
[2] 谷鸿秋, 李卫, 杨进刚, 等. 中国城乡社区人群体力活动与肥胖、高血压和糖尿病的关系[J]. 中国循环杂志, 2013, 28( z1): 9.
[3] Fox CS, Massaro JM, Hoffmann U, et al. Abdominal visceral and subcutaneous adipose tissue compartments: association with metabolic risk factors in the Framingham heart study[J]. Circulation, 2007,116(1): 39-48. DOI: 10. 1161/CIRCULATIONAHA. 106. 675355.
[4] Figueroa AL, Takx RA, Macnabb MH, et al. Relationship between measures of adiposity, arterial inflammation, and subsequent cardiovascular events[J]. Circ Cardiovasc Imaging, 2016, 9(4) :e004043. DOI: 10. 1161/CIRCIMAGING. 115. 004043.
[5] Chandra A, Neeland IJ, Berry JD, et al. The relationship of body mass and fat distribution with incident hypertension: observations from the Dallas Heart Study[J]. J Am Coll Cardiol, 2014, 64(10): 997-1002.DOI: 10. 1016/j. jacc. 2014. 05. 057.
[6] Wang Z, Zeng X, Chen Z, et al. Association of visceral and total body fat with hypertension and prehypertension in a middle-aged Chinese population[J]. J Hypertens, 2015, 33(8): 1555-1562. DOI: 10. 1097/HJH. 0000000000000602.
[7] Jiang J, Deng S, Chen Y, et al. Comparison of visceral and body fat indices and anthropometric measures in relation to untreated hypertension by age and gender among Chinese[J]. Int J Cardiol, 2016,219: 204-211. DOI: 10. 1016/j. ijcard. 2016. 06. 032.
[8] 王继红, 张源, 赵兴山, 等. 双能X线吸收法对体脂测量的应用[J].中国循环杂志, 2011, 26(3): 212-215. DOI: 10. 3969/j. issn. 1000-3614. 2011. 03. 015.
[9] Ashwell M, Gunn P, Gibson S. Waist-to-height ratio is a better screening tool than waist circumference and BMI for adult cardiometabolic risk factors: systematic review and meta-analysis[J].Obes Rev, 2012, 13(3): 275-286. DOI: 10. 1111/j. 1467-789X. 2011.00952. x.
[10] Cheng X, Wang L, Wang Q, et al. Validation of quantitative computed tomography-derived areal bone mineral density with dual energy X-ray absorptiometry in an elderly Chinese population[J]. Chin Med J (Engl),2014, 127(8): 1445-1449.
[11] Neeland IJ, Ayers CR, Rohatgi K, et al. Associations of visceral and abdominal subcutaneous adipose tissue with markers of cardiac and metabolic risk in obese adults[J]. Obesity (Silver Spring), 2013, 21:E439-E447. DOI: 10. 1002/oby. 20135.
[12] Vasan SK, Osmond C, Canoy D, et al. Comparison of regional fat measurements by dual-energy X-ray absorptiometry and conventional anthropometry and their association with markers of diabetes and cardiovascular disease risk[J]. Int J Obes (Lond), 2017, DOI: 10. 1038/ijo. 2017. 289.
[13] Cai L, Liu A, Zhang Y, et al. Waist-to-height ratio and cardiovascular risk factors among Chinese adults in Beijing[J]. PLoS One, 2013, 8(7):e69298. DOI: 10. 1371/journal. pone. 0069298.
[14] de Oliveira CM, Ulbrich AZ, Neves FS, et al. Association between anthropometric indicators of adiposity and hypertension in a Brazilian population: Baependi Heart Study[J]. PLoS One, 2017, 12(10):e185225. DOI: 10. 1371/journal. pone. 0185225.
[15] He YH, Chen YC, Jiang GX, et al. Evaluation of anthropometric indices for metabolic syndrome in Chinese adults aged 40 years and over[J]. Eur J Nutr, 2012, 51(1): 81-87. DOI: 10. 1007/s00394-011-0195-2.
[16] Han SJ, Fujimoto WY, Kahn SE, et al. Change in visceral adiposity is an independent predictor of future arterial pulse pressure[J]. J Hypertens, 2017, DOI: 10. 1097/HJH. 0000000000001532.
[17] Hall JE, Do CJ, Da SA, et al. Obesity-induced hypertension:interaction of neurohumoral and renal mechanisms[J]. Circ Res, 2015,116(16): 991-1006. DOI: 10. 1161/CIRCRESAHA. 116. 305697.
[18] Machleidt F, Simon P, Krapalis AF, et al. Experimental hyperleptinemia acutely increases vasoconstrictory sympathetic nerve activity in healthy humans[J]. J Clin Endocrinol Metab, 2013, 98(3):E491-E496. DOI: 10. 1210/jc. 2012-3009.
[19] Nakanishi R, Rajani R, Cheng VY, et al. Increase in epicardial fat volume is associated with greater coronary artery calcification progression in subjects at intermediate risk by coronary calcium score:a serial study using non-contrast cardiac CT[J]. Atherosclerosis, 2011,218(2): 363-368. DOI: 10. 1016/j. atherosclerosis. 2011. 07. 093.

