高密度CO2处理过程中虾肌球蛋白分子间作用力的变化
刘书成,郭明慧,刘 媛,吉宏武,高 静,毛伟杰,邓楚津,郝记明,罗 帅,董安迪
凝胶特性是蛋白质重要的功能特性之一。蛋白质形成凝胶可分为两步:变性和聚集[1]。在外界因素(热、酸、盐、高压等)作用下,蛋白质首先发生变性,使维持蛋白质高级结构的分子间作用力(氢键、离子键、疏水相互作用、二硫键、非二硫共价键等)被破坏,基团被暴露;接着,蛋白质发生聚集,由于蛋白质分子内部和分子间的相互作用,形成了新的分子间作用力,可稳定凝胶的三维网状结构[2]。因此,分子间作用力在蛋白质形成凝胶的不同阶段,其作用是不同的。研究蛋白质形成凝胶过程中分子间作用力的变化,可为探讨蛋白质形成凝胶的机理奠定基础。
高密度CO2(dense phase carbon dioxide,DPCD)是一种非热食品加工技术,它是将压力和二氧化碳结合,形成高压高酸性环境,实现对食品的杀菌和钝酶;它能在保证食品安全的同时,最小程度影响食品的原有风味、色泽、滋味、质构等[3-6]。DPCD最初主要用于液体食品(果汁、牛乳和啤酒等)的杀菌和钝酶[3-6]。近年来国内外的研究表明:DPCD对固体食品(肉及肉制品、海洋食品、鲜切果蔬等)同样具有较好的杀菌和钝酶效果[7-10],而且可以改善蛋白质的功能特性[11-13]、诱导蛋白质变性以制备凝胶制品[14-18]。
本课题组前期研究表明,DPCD能够诱导凡纳滨对虾肉糜形成凝胶,而且制备凝胶的微观结构和质构特性显著优于热诱导的[18]。关于蛋白质形成凝胶过程中分子间作用力的变化,目前国内外研究主要集中在热、盐、超高压等处理方面[19],而DPCD诱导蛋白质形成凝胶过程分子间作用力的变化鲜见相关报道。虽然不同的外界因素均可以使蛋白质形成凝胶,但是其形成的机制是不同的[19]。本实验以凡纳滨对虾(Litopenaeus vannamei)肌球蛋白为对象,研究DPCD诱导肌球蛋白形成凝胶过程中分子间作用力的变化,为阐明DPCD诱导虾肉糜形成凝胶的机制提供基础数据,为利用DPCD技术开发肉糜类凝胶制品提供理论依据。
1 材料与方法
1.1 材料与试剂
凡纳滨对虾(Litopenaeus vannamei),50~60 尾/kg,购于湛江市霞山区东风水产批发市场,用保温箱带水保活运至实验室(运输时间1 h左右),用自来水清洗干净后,用冰猝死,去头去壳去肠腺,取虾肉待用。药用小量杯(口服杯),购于汕头市金平区迅能得化工店。
Lowry法蛋白质含量测定试剂盒 上海荔达生物技术有限公司;牛血清白蛋白标准品 广州齐云生物技术有限公司;CO2(纯度99.9%) 湛江氧气厂;其他化学试剂均为分析纯。
1.2 仪器与设备
HA221-50-10-C型超临界装置 南通市华安超临界萃取有限公司;UX2200H电子天平、AUY220型分析天平、UV-2550型紫外-可见分光光度计 日本岛津公司;PHS-25数显pH计 上海精密科学仪器有限公司;CR22GⅡ型高速冷冻离心机 日本日立公司。
1.3 方法
1.3.1 肌球蛋白的提取
肌球蛋白的提取参考文献[20]的方法,新鲜虾肉搅碎后,按料液比1∶5(m/V)加入20 mmol/L磷酸盐缓冲液(pH 7.0),均质后5 500×g离心10 min,取沉淀再重复上述过程2 次。按1∶3(m/V)的比例向所得沉淀中加入提取液(0.45 mol/L KCl、5 mmol/L ATP、7.5 mmol/L MgCl2、0.15 mmol/L二硫苏糖醇,pH 6.4)搅拌15 min后10 000×g离心10 min。4 层纱布过滤后,取滤液与9 倍体积的预冷蒸馏水混合静置10 min,6 000×g离心10 min得沉淀。按5∶1(m/V)的比例向沉淀中加入3 mol/L KCl-0.6 mmol/L二硫苏糖醇-0.12 mol/L Tris-Maleate缓冲液(pH 7.5),于4 ℃静置过夜,按5∶1(m/V)的比例加入0.11 mol/L ATP-55 mmol/L MgCl2-5.5 mmol/L EGTA溶液(pH 7.5)后,于4 ℃静置2 h。加入饱和硫酸铵溶液,采用饱和度为40%~45%的硫酸铵来分离纯化肌球蛋白。离心后将沉淀置于0.6 mol/L KCl-20 mmol/L磷酸盐缓冲液(pH 7.0)中透析至无SO42-检出,期间更换透析液。整个过程中,溶液保持在4 ℃条件下。将透析后的溶液离心,上清液即为凡纳滨对虾肌球蛋白溶液。采用改良Lowery法[14]测定蛋白质含量为12~16 mg/mL。
1.3.2 高密度CO2处理和实验设计
间歇式DPCD处理流程参考文献[21]的方法。实验参数的设置依据前期实验而定。将肌球蛋白溶液稀释或浓缩至14 mg/mL,取5 mL肌球蛋白溶液于10 mL药用小量杯中,进行间歇式DPCD处理20 min,然后测定其分子间作用力。采用双因素等重复试验设计,处理温度水平为40、50、60 ℃,处理压强水平为5、10、15、25 MPa。设置3 个对照组:未处理虾肉糜(C1):称取2 g虾肉糜,用于化学作用力测定;水浴热处理组(C2):将肌球蛋白溶液稀释至14 mg/mL,取5 mL肌球蛋白溶液溶于10 mL药用小量杯中,放置于水浴中处理20 min,然后测定其化学作用力,水浴温度水平为40、50、60 ℃;常压CO2组(C3):将肌球蛋白溶液稀释至14 mg/mL,取5 mL肌球蛋白溶液溶于10 mL药用小量杯中,放置于间歇式DPCD设备中,充入CO2,但压强为0.1 MPa,处理20 min,然后测定其分子间作用力。
1.3.3 分子间作用力的测定
参照Tan等[22]方法。将2 g样品加10 mL S1提取液(0.6 mol/L NaCl),5 000 r/min匀浆5 min,4 ℃放置1 h,4 ℃、18 600×g离心25 min,上清液于4 ℃保存。向上述离心的沉淀加10 mL S2提取液(1.5 mol/L尿素、0.6 mol/L NaCl),3 700 r/min匀浆2 min,于4 ℃放置1 h,4 ℃、18 600×g离心25 min,上清液4 ℃保存。向上述离心沉淀加10 mL S3(8 mol/L尿素和0.6 mol/L NaCl的混合液)提取液,5 000 r/min匀浆5 min,于4 ℃放置1 h,4 ℃、18 600×g离心25 min,上清液4 ℃保存(重复2 次)。向上述离心沉淀加10 mL S4提取液(0.5 mol/L β-巯基乙醇、0.6 mol/L NaCl、8 mol/L尿素,pH 7),5 000 r/min匀浆5 min,4 ℃放置1 h,4 ℃、18 600×g离心25 min,上清液4 ℃保存。经S4液提取后离心得沉淀,加1 mL 1 mol/L NaOH溶液,4 ℃保存。上述各步离心后所得上清液分别加入等体积(5 mL)20%三氯乙酸,3 950×g离心15 min,弃上清液,向沉淀中加入1 mL 1 mol/L NaOH溶液于4 ℃放置,采用改良Lowry法[14]测定其蛋白质含量。离子键的贡献以溶解于S1的蛋白质相对质量分数来表示,氢键的贡献以溶解于S2的蛋白质相对质量分数来表示,疏水相互作用的贡献以溶解于S3的蛋白质相对质量分数来表示,二硫键的贡献以溶解于S4的蛋白质相对质量分数来表示,非二硫共价键的贡献以经S4液提取后最终沉淀的蛋白相对质量分数来表示。
1.4 数据处理
所有实验重复3 次,数据用 ±s表示;用JMP 10.0软件进行方差分析和Tukey’s HSD多重比较及作图。
2 结果与分析
2.1 氢键的变化
从图1可以看出,未处理虾肉糜的氢键的贡献(以蛋白相对质量分数计)为(20.73±0.80)%。与未处理组相比,水浴热处理、常压CO2处理和DPCD处理都显著降低了肌球蛋白的氢键贡献(P<0.05),说明3 种处理方式均能使肌球蛋白的氢键断裂。在40 ℃处理,水浴热处理的肌球蛋白氢键贡献显著低于常压CO2处理的(P<0.05),这是由于CO2溶于水形成弱酸碳酸,对氢键具有一定的稳定作用[23];DPCD处理的肌球蛋白氢键贡献显著低于水浴热处理和常压CO2处理的(P<0.05),这是因为高压CO2的pH值降低效应和分子效应使肌球蛋白发生变性[3],从而造成一些氢键断裂。在50、60 ℃下处理,水浴热处理、常压CO2处理与DPCD处理的肌球蛋白氢键贡献之间无显著差异(P>0.05),说明50 ℃以上的热效应已经能对氢键产生强烈的破坏,因为氢键对温度是比较敏感的,温度越高,氢键越弱[23]。
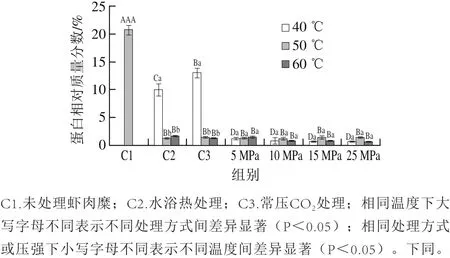
图1 DPCD处理过程中虾肌球蛋白氢键的变化Fig. 1 Change in hydrogen bond of myosin from Litopenaeus vannamei treated by DPCD
从图1还可以看出,对于水浴热处理和常压CO2处理组,温度从40 ℃升高50 ℃,肌球蛋白氢键贡献显著下降(P<0.05),而温度从50 ℃升高到60 ℃,肌球蛋白氢键贡献无显著变化(P>0.05)。这主要是因为凡纳滨对虾肌球蛋白的变性温度为42.8 ℃[24],超过变性温度,肌球蛋白因发生变性而使氢键贡献变化不大。对于DPCD处理组,压强和温度的升高对肌球蛋白的氢键贡献均无显著影响(P>0.05),这可能是因为低强度的DPCD处理(5 MPa、40 ℃)即可使肌球蛋白发生变性[25],已经破坏了大量氢键,而使其含量维持在一定水平。
在热诱导肌球蛋白形成凝胶过程中,当肌球蛋白高温受热变性时,大量氢键发生断裂且α-螺旋解旋,冷却后又会形成新的氢键起到稳定凝胶的作用[2]。邓丽等[26]研究热诱导鲍鱼腹足蛋白分子间作用力的变化,发现在60 ℃左右氢键贡献下降,再升高温度其氢键贡献变化不显著。刘海梅等[27]研究从40 ℃到90 ℃鲢鱼糜的凝胶化,发现氢键贡献也是降低的,并且认为氢键不是维持其凝胶结构的主要作用力。李杰等[28]研究草鱼鱼糜的凝胶化,发现氢键贡献也是下降的。Tan等[22]在50 ℃和60 ℃处理罗非鱼鱼糜凝胶,发现氢键贡献显著低于40 ℃处理的。许艳顺[29]研究发酵鲢鱼糜的凝胶化过程,发现随着pH值降低(由6.3降至4.3)氢键贡献下降,并认为氢键不是维持发酵鱼糜凝胶网络结构的主导作用力。这些均与本研究的结果一致。从本研究来看,低强度的DPCD处理就能破坏肌球蛋白的大量氢键,但随压力和温度升高,氢键贡献一直维持在较低水平,因此氢键不是DPCD诱导虾肌球蛋白形成凝胶过程中的主要分子间作用力。
2.2 离子键的变化
在鱼糜(接近中性)正常pH值下,离子键是维持肌原纤维蛋白天然结构的主要作用力,但是在外界因素(热、盐、高压等)作用下可以破坏蛋白质分子间的离子键,而使蛋白质发生聚集和凝胶化[2]。

图2 DPCD处理过程中虾肌球蛋白离子键的变化Fig. 2 Change in ionic bond of myosin from Litopenaeus vannamei treated by DPCD
从图2可以看出,未处理虾肉糜的离子键的贡献(以蛋白相对质量分数计)为(10.87±1.24)%。与未处理组相比,40 ℃和50 ℃的水浴热处理对肌球蛋白的离子键贡献无显著影响(P>0.05),可能是因为40 ℃和50 ℃的热能还不足以破坏蛋白质分子之间的离子键;而60 ℃的水浴热处理使肌球蛋白离子键贡献显著增加(P<0.05)。正常情况下加热会破坏蛋白质分子间的离子键,但是由于提取肌球蛋白时使用了KCl和NaCl等盐类,60 ℃的热能可能破坏蛋白质分子之间的离子键,但同时可能形成了新的离子键[2]。与未处理组相比,常压CO2处理对肌球蛋白的离子键贡献无显著影响(P>0.05),这可能是常压CO2溶解于水中形成少量碳酸的缓冲作用。与3 个对照组相比,DPCD处理能显著降低肌球蛋白的离子键贡献(P<0.05),这可是因为压强下CO2的pH值降低效应和分子效应[3]破坏了蛋白质分子之间和蛋白质与盐离子之间的离子键。
从图2还可以看出,在相同DPCD处理温度下,压强对肌球蛋白的离子键贡献无显著影响(P>0.05),这可能因为5 MPa下DPCD处理已使肌球蛋白发生变性[25],已经破坏了部分离子键,而使其贡献维持在一定水平;在相同DPCD处理压强下,温度从40 ℃升到50 ℃,肌球蛋白离子键贡献显著降低(P<0.05),而温度从50 ℃升到60 ℃,肌球蛋白离子键贡献又显著升高(P<0.05)。因为DPCD诱导蛋白质形成凝胶是pH值效应和热效应共同作用的[14-18]。DPCD溶于水降低体系pH值,通过调节pH值影响蛋白质的离子化作用和净电荷值,另一方面热效应可以破坏离子键[30-31]。因此,在固定压强下,与未处理的相比,由于40 ℃的DPCD使肌球蛋白溶液pH值降低接近于等电点,而使离子键贡献降低;温度从40 ℃升高到50 ℃(凡纳滨对虾肌球蛋白的变性温度为42.8 ℃[24]),体系的pH值变化较小,而此时热效应加剧,使离子键贡献继续下降;当温度升高到60 ℃时,体系pH值升高,此时热效应对离子键的影响较小,而使离子键的贡献又升高。
邓丽等[26]研究热诱导鲍鱼腹足蛋白分子间作用力的变化,发现在60 ℃左右离子键贡献下降,再升高温度其离子键贡献变化不显著。刘海梅等[27]研究40~90 ℃鲢鱼糜的凝胶化,发现离子键贡献是降低的,并且认为离子键不是维持鱼糜凝胶网络结构的主要分子间作用力。许艳顺[29]研究发酵鲢鱼糜的凝胶化过程,发现随着pH值从6.3降到4.3,离子键贡献是下降的,认为离子键不是维持发酵鱼糜凝胶网络结构的主导作用力。这些与本研究的结果一致。从本研究来看,DPCD处理总体上是破坏了肌球蛋白的离子键,因此离子键也不是DPCD诱导虾肌球蛋白形成凝胶过程中的主要分子间作用力。
2.3 疏水相互作用的变化
天然蛋白质在外界因素(加热、高压、离子等)作用下,疏水基团会暴露于分子表面,相邻蛋白质的疏水部分发生紧密结合,就产生了疏水相互作用,引起蛋白质凝集,在合适条件下便可以形成凝胶[2]。通过加热可以增加蛋白质分子间的疏水相互作用[2]。蛋白质分子间疏水相互作用的形成被认为是加热或高压(>300 MPa)诱导鱼糜形成凝胶的主要机制之一[32]。

图3 DPCD处理过程中虾肌球蛋白疏水相互作用的变化Fig. 3 Change in hydrophobic interaction of myosin from Litopenaeus vannamei treated by DPCD
从图3可以看出,未处理虾肉糜的疏水相互作用的贡献(以蛋白相对质量分数计)为(43.96±0.38)%。与未处理组相比,水浴热处理、常压CO2处理和DPCD处理均能显著增加肌球蛋白的疏水相互作用(P<0.05)。在40 ℃下处理,常压CO2处理的肌球蛋白的疏水相互作用显著高于水浴热处理的(P<0.05),而DPCD处理的又显著高于水浴热处理的和常压CO2处理的(P<0.05)。这可能是因为40 ℃的热效应能缓慢使肌球蛋白结构发生轻微变化,疏水基团逐渐暴露出来,有利于疏水相互作用的增加[2];由于CO2是非极性的,能促进蛋白质分子之间疏水相互作用的形成,压强下的CO2在水中的溶解度更大一些,其作用也更强烈一些。在50 ℃下处理,水浴热处理和常压CO2处理的肌球蛋白的疏水相互作用无显著差异(P>0.05),这可能是常压CO2在50 ℃下的非极性作用低于其热效应;DPCD处理的则显著高于水浴热处理和常压CO2处理的(P<0.05),主要是因为DPCD处理能够使肌球蛋白发生变性,使其疏水基团充分暴露出来,从而增强了疏水相互作用[33]。在60 ℃下处理,水浴热处理、常压CO2处理和DPCD处理的肌球蛋白的疏水相互作用无显著差异(P>0.05),可能是60 ℃的热效应已能使肌球蛋白充分变性伸展,使疏水基团暴露,增强了疏水相互作用[26-28]。在相同的DPCD处理温度下,压强对肌球蛋白的疏水相互作用无显著影响(P>0.05),说明低压强(5 MPa)即可使肌球蛋白发生较大程度的变性,使疏水基团暴露,增强了疏水相互作用[33]。
从图3还可以看出,随着处理温度升高,水浴热处理的肌球蛋白的疏水相互作用有增加趋势(P<0.05),因为温度升高,蛋白变性程度增加,更多疏水基团暴露出来,有利于疏水相互作用的形成。温度对常压CO2处理的肌球蛋白的疏水相互作用无显著影响(P>0.05),虽然温度升高有利于疏水相互作用的形成,CO2也能够促进疏水相互作用的形成,但常压下升高温度,CO2在水中的溶解度降低,使在高温下体现不出CO2的作用。在相同压强下,40 ℃和50 ℃的DPCD处理,肌球蛋白的疏水相互作用无显著差异(P>0.05),而当温度升高到60 ℃时,疏水相互作用显著下降(P<0.05)。因为在DPCD处理条件下体系处于酸性环境,在酸性环境下随着处理温度升高,蛋白质的疏水相互作用会减弱[30]。
邓丽等[26]研究热诱导鲍鱼腹足蛋白分子间作用力的变化,发现疏水相互作用呈先升高后下降的趋势。刘海梅等[27]研究40 ℃到90 ℃鲢鱼糜的凝胶化,发现疏水相互作用是增加的,并且认为疏水相互作用是维持鱼糜凝胶网络结构的主要化学作用力之一。李杰等[28]研究热诱导草鱼鱼糜的凝胶化过程,发现疏水相互作用也是增加的。Tan等[22]热处理罗非鱼鱼糜,发现疏水相互作用在40~60 ℃范围内呈增加趋势。这都与本研究的结果一致。从本研究来看,DPCD处理能够显著增加肌球蛋白分子间的疏水相互作用,而且其含量较高,因此疏水相互作用是DPCD诱导虾肌球蛋白形成凝胶过程中的主要分子间作用力。
2.4 二硫键的变化
分子间二硫键是通过相邻蛋白质肽链上具有反应活性巯基(—SH)基团的两个半胱氨酸分子的氧化形成的,它是热诱导蛋白质形成凝胶的主要共价键[2]。

图4 DPCD处理过程中虾肌球蛋白二硫键的变化Fig. 4 Change in disulfide bond of myosin from Litopenaeus vannamei treated by DPCD
从图4可以看出,未处理虾肉糜的二硫键的贡献(以蛋白相对质量分数计)为(11.84±1.01)%。与未处理组相比,水浴热处理和DPCD处理均能显著增加肌球蛋白的二硫键贡献(P<0.05),而40 ℃和50 ℃下DPCD处理又显著高于水浴热处理的(P<0.05)。水浴热处理主要是热效应促进了位于蛋白质表面的活性巯基氧化形成二硫键[2],而DPCD处理同时具有热效应和CO2的分子效应[3],能使蛋白质充分变性伸展,暴露出更多活性巯基,从而形成了较多的二硫键。与未处理组相比,40 ℃、常压CO2处理对肌球蛋白的二硫键贡献无显著影响(P>0.05),因为常压CO2溶于水形成碳酸,具有缓冲保护作用;50 ℃和60 ℃的常压CO2处理都显著增加了肌球蛋白的二硫键贡献(P<0.05),这可能是热效应促进了活性巯基的氧化作用[2],而且温度升高使CO2溶解度降低,失去了缓冲保护作用。在60 ℃下,水浴热处理、常压CO2处理和DPCD处理的肌球蛋白的二硫键贡献无显著差异(P>0.05),这可能是因为肌球蛋白中含有的活性巯基是一定量的,在60 ℃热效应作用下即可形成稳定数量的二硫键[2]。从图4还可以看出,对于DPCD处理,压强和温度对二硫键贡献均无显著影响(P>0.05),这可能是低强度的DPCD处理(5 MPa、40 ℃)即可使肌球蛋白发生变性[25,33],活性巯基充分暴露而氧化成二硫键,而使其含量维持在一定水平。
邓丽等[26]研究热诱导鲍鱼腹足蛋白分子间作用力的变化,发现二硫键贡献是增加的。刘海梅等[27]研究40~90 ℃鲢鱼糜的凝胶化,发现二硫键贡献也是增加的。Tan等[22]在30~70 ℃范围内处理罗非鱼鱼糜,随着温度升高,二硫键贡献先增加后降低,在50 ℃时二硫键最高。这都与本研究的结果一致。从本研究来看,DPCD处理能够显著增加肌球蛋白分子的二硫键,而且含量较高,因此二硫键是DPCD诱导虾肌球蛋白形成凝胶过程中的主要分子间作用力。
2.5 非二硫共价键的变化
非二硫共价键在蛋白质形成凝胶过程中也具有重要的作用[2]。从图5可以看出,未处理虾肉糜的非二硫共价键的贡献(以蛋白相对质量分数计)为(12.68±1.79)%。与未处理组相比,40 ℃水浴热处理和常压CO2处理对非二硫共价键贡献无显著影响(P>0.05),但DPCD处理能显著增加非二硫共价键贡献(P<0.05)。这可能是40 ℃的热效应不足以引起肌球蛋白的非二硫共价键贡献的变化,而压强下CO2的pH值降低效应和分子效应能够使肌球蛋白形成新的非二硫共价键。与未处理组相比,50 ℃和60 ℃的水浴热处理、常压CO2处理和DPCD处理均能显著增加肌球蛋白的非二硫共价键贡献(P<0.05),但水浴热处理与常压CO2处理组之间无显著差异(P>0.05),DPCD处理的显著高于水浴热处理与常压CO2处理组的(P<0.05)。这可能是50 ℃和60 ℃的热效应能使肌球蛋白形成新的非二硫共价键,而DPCD处理同时具有热效应和CO2分子效应,双重作用使肌球蛋白形成了更多的非二硫共价键。从图5还可以看出,在相同DPCD处理温度下,压强对非二硫共价键贡献无显著影响(P>0.05)。这可能是低压强(5 MPa)处理,CO2的分子效应即可使肌球蛋白形成更多的非二硫共价键;随着处理温度升高,水浴热处理、常压CO2处理和DPCD处理的肌球蛋白的非二硫共价键贡献均有增加趋势(P<0.05),这可能是随着热能增加,分子运动加剧,形成了数量比较多的新共价键。

图5 DPCD处理过程中虾肌球蛋白非二硫共价键的变化Fig. 5 Change in non-disulfide covalent bond of myosin from Litopenaeus vannamei treated by DPCD
邓丽等[26]研究热诱导鲍鱼腹足蛋白分子间作用力的变化,发现非二硫共价键贡献是增加的。刘海梅等[27]研究40~90 ℃鲢鱼糜的凝胶化,发现非二硫共价键贡献也是增加的,而且认为非二硫共价键是维持鱼糜凝胶网络结构的主要化学作用力之一。李杰等[28]研究草鱼鱼糜热诱导凝胶化,发现凝胶化鱼糜过程中形成了非二硫共价键,而且认为非二硫共价键参与了鱼糜凝胶化过程和鱼糜凝胶网络结构的形成。Tan等[22]发现罗非鱼鱼糜随着温度(30~70 ℃)的增加,非二硫共价键贡献是增加的。许艳顺等[29]研究发酵鲢鱼糜凝胶形成作用力的变化,发现随着发酵时间从0 h延长到48 h(pH值逐渐减小),非二硫共价键贡献逐渐增加。因此,非二硫共价键不仅参与蛋白质凝胶化过程,而且对稳定蛋白凝胶网络结构是具有一定贡献的。这些都与本研究的结果一致。从本研究来看,DPCD处理能够显著增加肌球蛋白分子的非二硫共价键,而且贡献较高,因此非二硫共价键是DPCD诱导虾肌球蛋白形成凝胶过程中的主要分子间作用力。
2.6 分子间作用力的贡献
分子间作用力在蛋白质凝胶形成、维持凝胶网络结构以及保持凝胶优良质构等方面具有重要的作用,然而在蛋白质形成凝胶的不同阶段、不同方式诱导的蛋白质凝胶、不同来源蛋白质形成的凝胶,各分子间作用力的贡献是有差异的。从图1~5可以看出,从分子间作用力的贡献角度分析,未处理虾肉糜的各分子间作用力贡献的大小顺序依次为疏水相互作用、氢键、二硫键、非二硫共价键和离子键,其中后三者的贡献接近;虾肌球蛋白经DPCD处理后,各分子间作用力贡献的大小顺序依次为疏水相互作用、二硫键、非二硫共价键、离子键和氢键。因此,疏水相互作用和氢键对维持虾肉糜中肌球蛋白的天然结构具有重要作用,而虾肌球蛋白经过DPCD处理后,氢键和离子键被破坏,促进了疏水相互作用、二硫键和非二硫共价键的形成。董秋颖等[34]从质构学角度研究鸡肉肌原纤维蛋白热诱导凝胶形成的作用力,发现疏水相互作用在凝胶形成中具有显著作用,氢键也具有重要作用,二硫键对凝胶形成的影响不大。张小燕等[35]研究分子间作用力对超高压诱导猪肉凝胶强度的影响,发现氢键、疏水相互作用和二硫键对凝胶强度影响显著,离子键对凝胶强度影响较小。Abdelhedi等[31]研究热诱导鲨鱼内脏蛋白形成凝胶,发现二硫键、疏水相互作用和氢键在凝胶形成过程中具有重要作用。比较这些研究结果可以发现,疏水相互作用在各种蛋白质形成凝胶过程中均具有重要作用,而其他分子间作用力的贡献则存在差异,这是因为蛋白质来源不同,其氨基酸组成和高级结构存在较大差异[36],还可能是因为不同的处理方式对蛋白质高级结构的破坏程度存在差异[19]。
2.7 压力和温度的协同效应
对图1~5中的数据进行双因素等重复方差分析表明,DPCD处理压力和温度之间的交互作用是显著的(P<0.05)。这说明DPCD处理压力和温度之间存在一定的协同效应。当DPCD处理肌球蛋白溶液时,CO2溶解于水中形成碳酸,再解离为碳酸氢根离子、碳酸根离子和氢离子,从而使体系的pH值降低[3]。一般来说,压力越高,CO2在溶液中的溶解度就越大,体系的pH值就越低。虽然温度升高,CO2在溶液中的溶解度降低,体系的pH值可能稍有增加,但是单纯的热效应也能诱导蛋白质形成凝胶。pH值是通过改变蛋白质中氨基酸残基的解离状态和电荷分布,从而对凝胶形成和维持凝胶结构的作用力产生影响[30-31,36]。加热主要提供热能破坏维持蛋白质高级结构的作用力,蛋白质在变性再聚集过程中又形成了新的分子间作用力[2]。因此,DPCD诱导蛋白质形成凝胶也是pH值效应、CO2分子效应和热效应共同作用的结果。
3 结 论
以未处理的虾肉糜、水浴热处理和常压CO2处理的肌球蛋白为对照,研究了DPCD诱导凡纳滨对虾肌球蛋白形成凝胶过程中分子间作用力的变化,结论如下:1)与未处理的虾肉糜相比,DPCD处理能使肌球蛋白的氢键和离子键贡献降低(P<0.05),而使疏水相互作用、二硫键和非二硫共价键的贡献增加(P<0.05);在相同DPCD处理温度下,压强(5~25 MPa)对肌球蛋白分子间作用力无显著影响(P>0.05);在相同DPCD处理压强下,随着温度(40~60 ℃)升高,氢键和二硫键贡献无显著变化(P>0.05),非二硫共价键贡献呈增加趋势(P<0.05),疏水相互作用呈降低趋势(P<0.05),离子键贡献则先降低后升高(P<0.05)。2)DPCD对分子间作用力的影响是压力和温度协同作用的结果。疏水相互作用、二硫键和非二硫共价键是DPCD诱导肌球蛋白形成凝胶过程中的主要分子间作用力,而氢键和离子键不是其主要分子间作用力。
参考文献:
[1] FERRY J D. Protein gels[J]. Advances in Protein Chemistry, 1948, 4:1-78. DOI:10.1016/S0065-3233(08)60004-2.
[2] LANIER T C, CARVAJAL P, YONGSAWATDIGUL J, et al. Surimi Gelation Chemistry[M]. Boca Raton: CRC Press, 2013: 435-489.
[3] HU W F, ZHOU L Y, XU Z Z, et al. Enzyme inactivation in food processing using high pressure carbon dioxide technology[J]. Critical Reviews in Food Science and Nutrition, 2013, 53(2): 145-161. DOI:10.10 80/10408398.2010.526258.
[4] ZHOU L, BI X, XU Z, et al. Effects of high-pressure CO2processing on flavor, texture, and color of foods[J]. Critical Reviews of Food Science and Nutrition, 2015, 55(6): 750-768. DOI:10.1080/10408398.2012.677871.
[5] 刘书成, 郭明慧, 刘媛, 等. 高密度CO2杀菌和钝酶及其在食品加工中应用的研究进展[J]. 广东海洋大学学报, 2016, 36(4): 101-116.DOI:10.3969/j.issn.1673-9159.2016.04.017.
[6] 侯志强, 赵凤, 饶雷, 等. 高压二氧化碳技术的杀菌研究进展[J]. 中国农业科技导报, 2015, 17(5): 40-48. DOI:10.13304/j.nykjdb.2015.534.
[7] FERRENTINO G, SPILIMBERGO S. High pressure carbon dioxide pasteurization of solid foods: current knowledge and future outlooks[J].Trends in Food Science and Technology, 2011, 22(8): 427-441.DOI:10.1016/j.tifs.2011.04.009.
[8] BALABAN M O, DUONG T. Dense phase carbon dioxide research:current focus and directions[J]. Agriculture and Agricultural Science Procedia, 2014, 2: 2-9. DOI:10.1016/j.aaspro.2014.11.002.
[9] 陈亚励, 屈小娟, 郭明慧, 等. 高密度CO2在肉制品和水产品加工中的应用[J]. 现代食品科技, 2014, 30(9): 304-311.
[10] 杨扬, 李欣, 饶伟丽, 等. 高密度二氧化碳杀菌技术及其在肉品工业中的应用[J]. 食品工业科技, 2014, 35(13): 387-391. DOI:10.13386/j.issn1002-0306.2014.13.076.
[11] MARELLA C, SALUNKE P, BISWAS A C, et al. Manufacture of modified milk protein concentrate utilizing injection of carbon dioxide[J].Journal of Dairy Science, 2015, 98(6): 3577-3589. DOI:10.3168/jds.2014-8946.
[12] YAN W J, XU B C, JIA F, et al. The effect of high-pressure carbon dioxide on the skeletal muscle myoglobin[J]. Food and Bioprocess Technology, 2016,9(10): 1716-1723. DOI:10.1007/s11947-016-1747-5.
[13] XU D X, YUAN F, JIANG J P, et al. Structural and conformational modification of whey proteins induced by supercritical carbon dioxide[J].Innovative Food Science & Emerging Technologies, 2011, 12(1): 32-37.DOI:10.1016/j.ifset.2010.10.001.
[14] RAO Weili, LI Xin, WANG Zhenyu, et al. Dense phase carbon dioxide combined with mild heating induced myosin denaturation, texture improvement and gel properties of sausage[J]. Journal of Food Process Engineering, 2017, 40(2): e12404. DOI:10.1111/jfpe.12404.
[15] FERNANDES-SILVA S, MOREIRA-SILVA J, SILVA T H, et al. Porous hydrogels from shark skin collagen crosslinked under dense carbon dioxide atmosphere[J]. Macromolecular Bioscience, 2013, 13(11): 1621-1631. DOI:10.1002/mabi.201300228.
[16] FLOREN M L, SPILIMBERGO S, MOTTA A, et al. Carbon dioxide induced silk protein gelation for biomedical applications[J].Biomacromolecules, 2012, 13: 2060-2072. DOI:10.1021/bm300450a.
[17] 曲亚琳, 张德权, 饶伟丽, 等. 高密度CO2对羊肉糜凝胶特性的影响[J]. 核农学报, 2010, 24(6): 1226-1231. DOI:10.11869/hnxb.2010.06.1226.
[18] 屈小娟, 刘书成, 吉宏武, 等. 高密度CO2诱导制备虾糜凝胶的特性[J].农业工程学报, 2012, 28(20): 282-287.
[19] TOTOSAUS A, MONTEJANO J G, SALAZAR J A, et al. A review of physical and chemical protein-gel induction[J]. International Journal of Food Science & Technology, 2002, 37(6): 589-601. DOI:10.1046/j.1365-2621.2002.00623.x.
[20] STAFFORD W F, SZENTKIRALYI E M, SZENT-GYORGYI A G.Regulatory properties of single-headed fragments of scallop myosin[J].Biochemistry, 1979, 18(24): 5273-5280. DOI:10.1021/bi00591a002.
[21] 张良, 刘书成, 章超桦, 等. 神经网络优化牡蛎的高密度CO2杀菌工艺[J]. 农业工程学报, 2011, 27(12): 369-373. DOI:10.3969/j.issn.1002-6819.2011.12.069.
[22] TAN F J, LAI K M, KUOCHIANG H. A comparative study on physical properties and chemical interactions of gels from tilapia meat pastes induced by heat and pressure[J]. Journal of Texture Studies, 2010, 41(2):153-170. DOI:10.1111/j.1745-4603.2010.00219.x.
[23] 戴明斐, 李磊, 刘涛, 等. 原位红外光谱研究升温过程中高压CO2与尼龙6氢键的相互作用[EB/OL]. [2010-02-26]. http://www.paper.edu.cn/releasepaper/content/201002-561.
[24] 蓝尉冰. 凡纳滨对虾肌肉蛋白组成及其肉糜特性研究[D]. 湛江: 广东海洋大学, 2012: 59.
[25] 刘书成, 陈亚励, 郭明慧, 等. 高密度CO2处理过程中虾肌球蛋白溶液浊度和溶解度的变化[J]. 食品科学, 2017, 38(19): 42-48.DOI:10.7506/spkx1002-6630-201719008.
[26] 邓丽, 李岩, 董秀萍, 等. 热加工过程中鲍鱼腹足蛋白间作用力及其质构特性[J]. 农业工程学报, 2014, 30(18): 307-316. DOI:10.3969/j.issn.1002-6819.2014.18.038.
[27] 刘海梅, 熊善柏, 谢笔钧, 等. 鲢鱼糜凝胶形成过程中化学作用力及蛋白质构象的变化[J]. 中国水产科学, 2008, 15(3): 469-475.DOI:10.3321/j.issn:1005-8737.2008.03.013.
[28] 李杰, 汪之和, 施文正. 鱼糜凝胶形成过程中物理化学变化[J]. 食品科学, 2010, 31(17): 103-106.
[29] 许艳顺. 发酵鲢鱼鱼糜凝胶形成及其机理研究[D]. 无锡: 江南大学,2010: 40-42.
[30] NI N, WANG Z Y, HE F, et al. Gel properties and molecular forces of lamb myofibrillar protein during heat induction at different pH values[J]. Process Biochemistry, 2014, 49(4): 631-636. DOI:10.1016/j.procbio.2014.01.017.
[31] ABDELHEDI O, JEMIL I, NASRI R, et al. Molecular forces study and microstructure and gelling properties of smooth hound protein gels prepared by heat-induced gelation process: effect of pH variation on textural and functional properties[J]. Process Biochemistry, 2016, 51(10):1511-1520. DOI:10.1016/j.procbio.2016.07.015.
[32] GILLELAND G M, LANIER T C, HAMANN D D. Covalent bonding in pressure-induced fish protein gels[J]. Journal of Food Science, 1997,62(4): 713-716. DOI:10.1111/j.1365-2621.1997.tb15442.x.
[33] 郭明慧, 邓倩琳, 刘书成, 等. 高密度CO2对凡纳滨对虾肌球蛋白疏水性的影响[J]. 广东海洋大学学报, 2016, 36(1): 73-78. DOI:10.3969/j.issn.1673-9159.2016.01.013.
[34] 董秋颖, 杨玉玲, 许婷. 从质构学角度研究肌原纤维蛋白凝胶形成的作用力[J]. 食品与发酵工业, 2009, 35(5): 45-49.
[35] 张小燕, 刘德明. 化学作用力对超高压诱导猪肉凝胶强度的影响研究[J]. 肉类工业, 2015(7): 22-24. DOI:10.3969/j.issn.1008-5467.2015.07.009.
[36] 励建荣, 余永名, 仪淑敏, 等. 鱼糜制品热凝胶形成机理研究进展[J].食品工业科技, 2015, 36(23): 380-385.

