海参硫酸软骨素的荧光标记方法
王 俊,吴反修,常耀光,*,陈 丰,续晓琪
海参硫酸软骨素(sea cucumber chondroitin sulfates,CHS)是海参体壁的主要组成物质之一,属于类硫酸软骨素,具有硫酸软骨素骨架,但与其他动物组织来源的硫酸软骨素不同,CHS的结构中还含有硫酸酯化的L-岩藻糖支链,是一种新颖的多糖结构[1]。CHS已被证实具有多种生理调节功能,包括抗凝血[2-3]、抗血栓[4]、降血糖[5-7]、抗肿瘤[8]及抗胃溃疡[9]等,在功能食品开发方面展现出良好的应用潜力[10-12]。多糖类物质普遍缺乏特异的发光或发色基团,这为深入研究多糖的吸收代谢、生理功能机理、生物分子间相互作用等科学问题带来阻碍[13]。这一情况同样存在于CHS的研究中。对多糖进行特异性标记是克服上述问题的有效策略,目前常用的标记方法包括同位素标记法、荧光标记法等几类。相比于同位素标记法,荧光标记法能够避免放射性危害,且标记产物亦具有良好的检测灵敏度及特异性[14]。韩章润等[15]对鲨鱼头骨来源的硫酸软骨素进行荧光标记,并利用标记产物成功研究了该糖与蛋白质的相互作用。苗本春等[16]实现了海洋硫酸多糖911的荧光标记,并将荧光标记物作用于淋巴细胞和巨噬细胞,以寻找海洋硫酸多糖911的抗体。胡锦珍等[17]用异硫氰酸荧光素对壳聚糖进行标记,通过测定荧光标记物经小鼠口服后在体内各组织中的分布及排泄情况,研究了壳聚糖在动物体内的药物代谢动力学。
关于CHS的荧光衍生尚鲜见文献报道。多糖荧光标记需根据多糖的结构特征合理选择或设计荧光染料及衍生方法。常见的多糖衍生荧光染料包括6-氨基荧光素(6-aminofluorescein,FA)、异硫氰酸荧光素、异硫氰酸罗丹明B等,可以用于连接荧光染料的多糖结构基团包括羟基、氨基、羧基、半缩醛基等,衍生方法包括溴化氰活化法[18-19]、末端还原胺化反应[20-21]、碳酰化反应法[22-24]、1-乙基-3-(3-二甲基氨丙基)-碳化二亚胺/N-羟基琥珀酰亚胺偶联法[15]、二甲基亚砜/二月桂酸二丁基锡法[25-28]等。溴化氰活化法针对羟基进行衍生,对于多糖类化合物有较好的普适性,且具有操作过程简单、省时等优点;FA作为荧光素类染料中重要的荧光探针之一,具有高选择性、高稳定性和高灵敏性的优点。
本研究拟利用溴化氰活化法对CHS的羟基进行活化衍生,进而尝试以FA对CHS进行标记。通过薄层色谱法(thin layer chromatograph,TLC)及串联有荧光检测器与示差检测器的凝胶排阻高效液相色谱(high performance size exclusion chromatograph coupled with florescence detector and refractive index detector,HPSEC-FLD-RID)对衍生标记前后的多糖进行分析,判断标记的效果;利用HPSEC-FLD-RID、离子色谱及傅里叶变换红外光谱,分析标记前后多糖化学组成及结构的变化;进一步考察不同pH值及NaCl浓度环境中标记产物的荧光强度及稳定性,以探讨标记产物的适用范围,旨在实现CHS的荧光标记,以期为该多糖的吸收代谢过程、功能机理、生物分子间相互作用等进一步研究提供有力工具。
1 材料与方法
1.1 材料与试剂
鲜活仿刺参(Apostichopus japonicas)购于青岛南山水产市场;CHS按照Xu Xiaoqi等[29]的方法进行提取,海参体壁匀浆后以木瓜蛋白酶进行蛋白酶解,向蛋白酶解液中加入氯化十六烷基吡啶沉淀粗多糖,粗多糖经Express-Ion D离子交换树脂分离后得到纯化的CHS组分。
G60F254硅胶板 德国Merck有限公司;Express-Ion D离子交换树脂 英国Whatman公司;Sephadex G25凝胶填料美国GE公司;6-氨基荧光素 上海Aladdin有限公司;Dextran系列分子质量标准品(5、12、50、148、410、670、1 400 kDa) 美国Sigma公司;其他试剂购于国药集团化学试剂有限公司。
1.2 仪器与设备
Nicolet iS10傅里叶变换红外光谱仪 美国Thermo公司;ICS-2000离子色谱仪 美国Dionex公司;1260高效液相色谱仪 美国Agilent公司;TSK-gel Super AWM-H色谱柱(150 mm×6.0 mm) 日本Tosoh公司;Sephadex G25色谱柱、ÄKTA prime plus蛋白纯化系统 美国GE公司;ALPHA 1-4LD冷冻干燥机 德国Christ公司;F-4600荧光光谱仪 日本日立有限公司;KQ-250DE数控超声波清洗机 昆山市超声仪器有限公司;GIS-2008数码凝胶成像仪 天能科技(上海)有限公司。
1.3 方法
1.3.1 CHS的荧光衍生
以FA为荧光染料,通过共价衍生的方式对CHS进行荧光标记,反应条件及试剂比例如下:将4.0 mL CHS溶液(25 mg/mL)与875 μL溴化氰溶液(85 mg/mL)混合,以0.2 mol/L NaOH溶液调节混合液pH值至11.0,25 ℃振荡下活化反应15 min,之后超声处理5 min;利用Sephadex G25色谱柱将反应液中的缓冲液置换为0.2 mol/L pH 8.0 Na2B4O7-H3BO3缓冲液,后续加入17.5 mg FA固体试剂,溶解后25 ℃避光反应12 h;利用Sephadex G25色谱柱将反应物中的缓冲液置换为水,以脱除反应物中的游离FA及盐,产物真空冷冻干燥后避光保存用于后续分析,记为CHS-FA[30]。
以TLC分析CHS及CHS-FA,从而判断荧光标记是否成功。TLC分析采用G60F254预制硅胶板,展开剂为正丙醇-水溶液(3∶1,V/V),展开后利用凝胶成像仪在365 nm波长紫外光源的照射下采集荧光信号。
以HPSEC-FLD-RID对比分析CHS及CHS-FA,进一步确证荧光标记的效果。高效液相色谱仪测定条件如下[31-32]:色谱柱为TSK-gel Super AWM-H(150 mm×6.0 mm);流动相为0.2 mol/L NaCl;流速为0.6 mL/min;柱温30 ℃;荧光检测器激发波长设为495 nm,发射波长设为520 nm。
以pH 8.0的50 mmol/L Na2HPO4-NaH2PO4缓冲液(含0.1 mol/L NaCl)将FA与CHS-FA样品分别配制成2 μmol/L和0.1 mg/mL的溶液,利用荧光分光光度计的3D扫描模式对CHS-FA及FA进行全波长扫描,确定CHS-FA最佳激发波长与发射波长,波谱扫描范围:激发波长450~550 nm,发射波长450~600 nm。
荧光标记物CHS-FA的标记度定义为单位物质量的多糖标记物中含有的FA的物质的量,按照下式进行计算。

式中:CHS-FA中FA的物质的量以CHS-FA在激发波长495 nm和发射波长520 nm处的荧光值进行定量,物质溶解于pH 8.0的50 mmol/L Na2HPO4-NaH2PO4缓冲液(含0.1 mol/L NaCl)中,以FA为标准品制作标准曲线。CHS-FA物质的量以其还原端物质的量表征,还原端的物质的量测定采用3,5-二硝基水杨酸法。
1.3.2 衍生前后样品的化学组成及结构分析
依据高效凝胶排阻色谱法的原理,根据HPSEC-FLD-RID谱图中CHS及CHS-FA的洗脱时间计算其分子质量,利用系列分子质量的Dextran标准品(5、12、50、148、410、670、1 400 kDa)建立分子质量与洗脱时间的标准曲线。
以离子色谱法测定衍生前后多糖的SO42-含量[33]。取待测样品减压干燥1 d,称量2~5 mg于安瓿瓶中,加入1 mL 2 mol/L三氟乙酸并封口,于110 ℃下水解10 h。水解完毕后80 ℃挥干三氟乙酸,以超纯水定容到25 mL,0.45 μm微孔滤膜过滤后准备上样。以离子色谱仪测定样液中的SO42-含量:色谱柱为Ionpac AS11-HC(250 mm×4 mm);保护柱为Ionpac AG11-HC(50 mm×4 mm);柱温为30 ℃;抑制器为ASRSULTRAⅡ阴离子抑制器(抑制电流50 mA);检测器为电导检测器;淋洗液为20 mmol/L KOH溶液;流速1.2 mL/min。以无水NaSO为标准品建立标准曲线标定S24的量,样品SO24-含量以多糖中SO24-的质量分数表征。
利用傅里叶变换红外光谱法对衍生前后多糖的结构信息进行对比分析,取1 mg干燥的样品与KBr均匀混合并压制成片,以傅里叶变换红外光谱进行分析,光谱仪参数如下:扫描范围400~4 000 cm-1,扫描次数64 次,分辨率4.0。
1.3.3 环境因素对CHS-FA荧光强度的影响
将CHA-FA分别溶解于pH 2~12的缓冲液中(pH 2~6使用50 mmol/L Na2HPO4-C6H8O7缓冲液,pH 7~8使用50 mmol/L Na2HPO4-NaH2PO4缓冲液,pH 9~10使用50 mmol/L甘氨酸-NaOH缓冲液,pH 11~12使用50 mmol/L Na2HPO4-NaOH缓冲液),质量浓度为0.01 mg/mL。测定不同pH值条件下CHS-FA的荧光强度(激发波长495 nm、发射波长520 nm),以此考察环境pH值对标记产物荧光强度的影响。样品在室温下贮存7 d,每隔24 h进行取样,测定荧光强度随时间变化的情况,并利用TLC及HPSEC-FLD-RID对贮存终点样品进行分析,以考察不同pH值条件下CHS-FA荧光的稳定性。
向CHS-FA溶液(0.01 mg/mL,溶于pH 8.0的50 mmol/L Na2HPO4-NaH2PO4缓冲液)中加入NaCl,调节溶液NaCl浓度为0~2 mol/L,测定不同条件下CHS-FA的荧光强度(激发波长495 nm、发射波长520 nm),以考察NaCl浓度对标记产物荧光强度的影响。样品在室温下贮存7 d,每隔24 h进行取样,测定荧光强度随时间变化的情况,并利用TLC及HPSEC-FLD-RID对贮存终点样品进行分析,进而考察不同NaCl浓度条件下CHS-FA荧光的稳定性。
1.4 统计分析
实验及测试均进行3 次或以上,结果以 ±s表示。实验数据处理采用SPSS 16.0分析软件,显著性差异分析采用Duncan’s ANOVA检测,以P<0.05作为显著性差异的判断标准。
2 结果与分析
2.1 CHS-FA的制备

图1 CHS及荧光标记反应产物CHS-FA的TLC分析Fig. 1 TLC analysis of fluorescence-labeled CHS and CHS-FA
相对于衍生前多糖CHS,衍生产物CHS-FA的得率为(62.3±4.9)%。TLC分析表明(图1),未经荧光衍生的原始CHS未表现出荧光,证实其本身缺乏荧光基团;衍生产物CHS-FA呈现可见的荧光,表明经衍生反应后的多糖衍生产物带有荧光发色物质;同时,CHS-FA的荧光集中在TLC原点位置,与CHS高分子质量多糖的分子特征相符合,并与游离FA荧光染料的迁移率有明显差异,证明CHS-FA中的荧光物质并非游离FA而是与CHS形成共价结合。TLC分析结果初步证明CHS荧光标记成功。
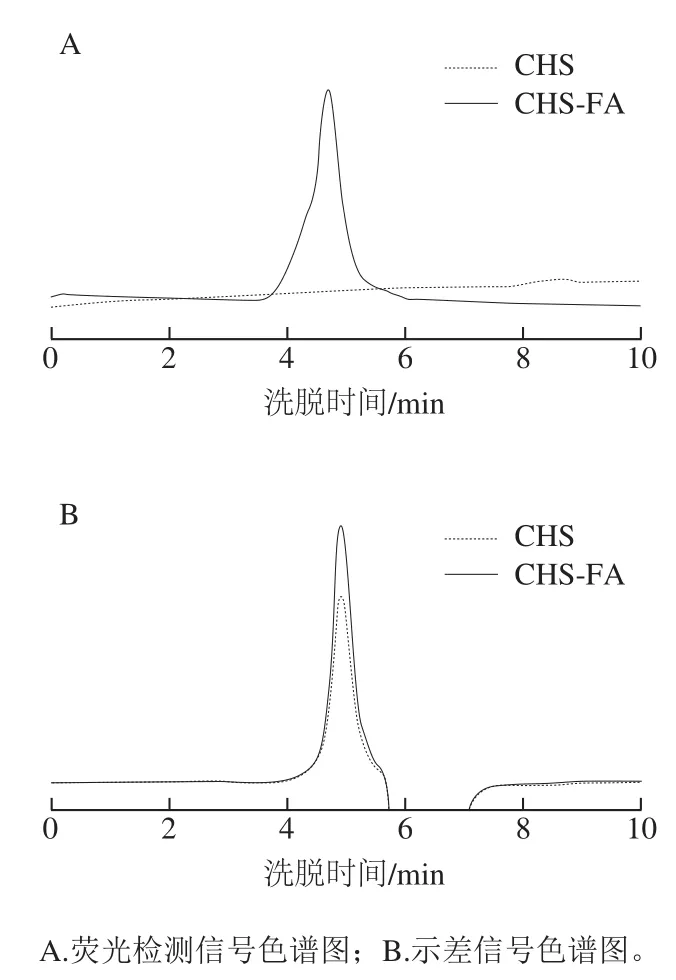
图2 CHS及CHS-FA的HPSEC-FLD-RID分析色谱图Fig. 2 HPSEC-FLD-RID spectra of CHS and CHS-FA

图3 CHS-FA和FA的3D全波长扫描图Fig. 3 3D scanning spectra of CHS-FA and FA
如HPSEC-FLD-RID图谱(图2)所示,CHS未见荧光信号而标记产物CHS-FA展现出清晰的荧光信号峰;CHS-FA荧光检测器信号及示差检测器信号的洗脱时间相符,表明荧光基团与CHS发生结合。上述结果进一步确证荧光衍生过程可赋予CHS荧光发色基团,即成功实现了CHS的荧光标记。
CHA-FA呈现出典型的荧光光谱特性(图3)。CHS-FA在激发波长为495 nm、发射波长为520 nm的条件下荧光强度最大(图3A),荧光染料FA的最佳激发波长为490 nm、发射波长为520 nm(图3B),两者荧光光谱特征相似。

标记产物CHS-FA的标记度为4.4±0.3,即经衍生后每分子CHS约含4.4分子FA。Glabe等[30]利用FA标记硫酸软骨素,其标记度为2.9;在Arnosti等[34]研究中,1分子硫酸软骨素可被1.5分子FA所标记。依据参考文献[30,34]判断,CHS的标记度水平合理。标记度过低,标记物的荧光强度不足,不利于后续的观察分析。而标记度过高,可能导致标记物的结构特征发生明显变化,从而改变原有功能,为功能机理研究、构效关系研究等带来干扰。基于此背景,本研究进一步研究了FA衍生对CHS结构的影响。
2.2 荧光衍生对CHS化学组成及结构的影响
如HPSEC-FLD-RID分析色谱图(图2B)所示,荧光标记前后的多糖在凝胶排阻色谱柱上的洗脱时间未发生明显变化,根据洗脱时间计算CHS及CHS-FA的分子质量,测得CHS的分子质量为(58.0±5.2)kDa,CHS-FA的分子质量为(59.4±2.8)kDa,两者间不存在显著的统计学差异。上述结果表明,衍生标记前后CHS的分子质量无显著变化,CHS在衍生过程中未发生明显降解。根据FA分子的分子质量及CHS-FA的标记率进行理论计算,FA的引入将增加CHS分子质量约1.5 kDa,仅为原始CHS分子质量的2.6%,与实际测定的结果基本吻合。
CHS中富含SO42-,属于硫酸多糖的一种。现有研究充分表明SO42-对硫酸多糖的空间结构、物化特性(如水溶性、负电性等)以及生理调节功能等分子特征发挥着至关重要的作用,SO42-的脱落可导致某些硫酸多糖丧失抗癌及抗凝血功能[35-36]。利用离子色谱法测得CHS的SO42-质量分数为(22.17±2.41)%,CHS-FA的SO42-质量分数为(22.30±1.48)%,两者间不存在显著的统计学差异,表明荧光标记过程中SO42-未发生脱落。

图4 CHS及CHS-FA红外光谱图Fig. 4 Infrared spectra of CHS and CHS-FA
红外光谱是确认已知化合物结构、比对化合物结构信息的可靠手段。CHS及CHS-FA的红外光谱图,其峰形基本相同(图4),尤其在“指纹区”即500~1 800 cm-1范围内,谱线基本重叠,表明CHS-FA保持了CHS的结构特征。这一观察结果与上述分子质量、SO42-的对比分析结果相吻合。然而,FA苯环骨架在1 600 cm-1及1 500 cm-1的振动峰(骨架伸缩振动)等结构特征[37]却不明显,可能由于FA基团的量在CHS-FA中不占优势,导致FA的特征谱带响应较弱,结构信息被多糖所掩盖,这一现象与上述CHS-FA标记度的测定结果相吻合。结构是生物大分子展现特定物化特性、发挥生理功能的基础,CHS在衍生过程中结构特征未发生显著变化,这有利于后续将CHS-FA应用于CHS的生理功能、消化吸收代谢、相互作用等领域的研究。
2.3 环境因素对CHS-FA荧光强度的影响
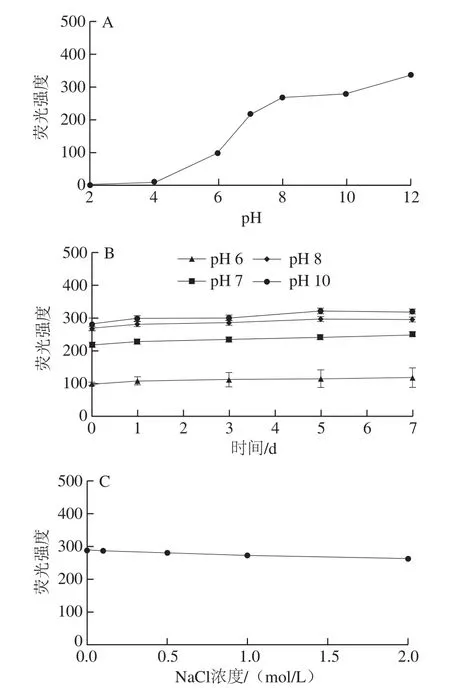

图5 不同pH值及NaCl浓度对CHS-FA的荧光强度及荧光稳定性的影响Fig. 5 Fluorescence intensity and stability of CHS-FA under different pH and NaCl concentrations
对不同pH值下CHS-FA的荧光强度测定结果表明,随着溶液pH值的升高,CHS-FA的荧光强度逐渐增大。在中性及碱性的溶液环境中,CHS-FA展现出较强的荧光信号(图5A),且在7 d内无显著变化(图5B)。但在酸性环境(pH≤6)中荧光强度相对较弱。上述结果与文献报道的pH值对荧光素及其衍生物(FA即是一种荧光素衍生物)的影响结果相一致[38]。荧光素类化合物对pH值变化敏感,当溶液pH值升高时,荧光素及其衍生物的荧光强度增强,原因是荧光素及荧光素衍生物为有机弱酸,当溶液的pH值升高,该弱酸的分子向相应的离子型体转化,电子构型的改变进而增强了荧光强度[38]。
随着NaCl浓度的升高,CHS-FA的荧光强度有所降低,但降低的幅度相对有限,当溶液NaCl浓度为2 mol/L时,CHS-FA的荧光强度为0 mol/L NaCl下的91.0%;且在NaCl浓度小于等于1 mol/L的范围内,CHS-FA的荧光强度无显著差别,仅存在数值上的差异。在考察的各NaCl浓度下,CHS-FA的荧光强度7 d内均无显著变化,展现出良好的稳定性。并且,与新鲜配制的CHS-FA溶液(0.01 mg/mL,溶于pH 8.0的50 mmol/L Na2HPO4-NaH2PO4缓冲液)相比,各pH值及NaCl浓度条件下放置7 d后的样品其TLC及HPSEC-FLD-RID未发生变化,表明在各条件下,CHS-FA未发生降解。
上述结果综合表明,CHS-FA适用于中性及碱性条件下的荧光观察及存放,且受NaCl浓度的影响小,提示CHS-FA具有较宽的应用范围。
3 结 论
本研究成功实现了CHS的荧光标记,证实以FA为荧光染料并配合溴化氢活化法是对CHS进行荧光衍生的有效方式。标记产物CHS-FA标记度为4.4,其最佳荧光激发波长为495 nm、发射波长为520 nm,与FA的特征波长基本相符。分子质量测定、SO24-质量分数测定及傅里叶变换红外光谱比较分析的结果表明,标记前后多糖的化学组成及结构特征未发生明显变化。标记产物在中性及碱性环境中展现出较强的荧光强度及稳定性,溶液环境中的NaCl对CHS-FA的影响有限。CHS荧光标记产物的成功制备为今后研究CHS的吸收代谢、功能机理及分子相互作用提供了良好工具,有利于CHS的后续深入研究及进一步开发利用。
参考文献:
[1] MYRON P, SIDDIQUEE S, AZAD S A. Fucosylated chondroitin sulfate diversity in sea cucumbers: a review[J]. Carbohydrate Polymers,2014, 112(21): 173-178. DOI:10.1016/j.carbpol.2014.05.091.
[2] CHEN S G, HU Y Q, YE X Q, et al. Sequence determination and anticoagulant and antithrombotic activities of a novel sulfated fucan isolated from the sea cucumber Isostichopus badionotus[J]. Biochimica et Biophysica Acta, 2012, 1820(7): 989-1000. DOI:10.1016/j.bbagen.2012.03.002.
[3] LUO L, WU M Y, XU L, et al. Comparison of physicochemical characteristics and anticoagulant activities of polysaccharides from three sea cucumbers[J]. Marine Drugs, 2013, 11(2): 399-417.
[4] POMIN V H. Holothurian fucosylated chondroitin sulfate[J]. Marine Drugs, 2014, 12(1): 232-254.
[5] CHEN S G, LI G Y, WU N, et al. Sulfation pattern of the fucose branch is important for the anticoagulant and antithrombotic activities of fucosylated chondroitin sulfates[J]. Biochimica et Biophysica Acta, 2013,1830(4): 3054-3066. DOI:10.1016/j.bbagen.2013.01.001.
[6] HU S W, CHANG Y G, WANG J F, et al. Fucosylated chondroitin sulfate from sea cucumber in combination with rosiglitazone improved glucose metabolism in the liver of the insulin-resistant mice[J]. Bioscience,Biotechnology, and Biochemistry, 2013, 77(11): 2263-2268. DOI:10.1271/bbb.130529.
[7] 胡世伟, 王静凤, 王玉明, 等. 海地瓜岩藻糖基化海参硫酸软骨素对Ⅱ型糖尿病小鼠胰岛素抵抗改善作用的研究[J]. 中国海洋药物,2014(1): 58-64. DOI:10.13400/j.cnki.cjmd.2014.01.010.
[8] 徐雷雷, 王静凤, 李辉, 等. 岩藻糖基化海参硫酸软骨素抑制肿瘤血管新生作用的研究[J]. 中国海洋药物, 2012(4): 14-19. DOI:10.13400/j.cnki.cjmd.2012.04.010.
[9] 刘艳青, 李国云, 高焱, 等. 海参硫酸软骨素对大鼠酒精性胃溃疡的保护作用[J]. 食品科学, 2011, 32(19): 201-204.
[10] LIU X X, HAO J J, SHAN X D, et al. Antithrombotic activities of fucosylated chondroitin sulfates and their depolymerized fragments from two sea cucumbers[J]. Carbohydrate Polymers, 2016, 152: 343-350.DOI:10.1016/j.carbpol.2016.06.106.
[11] HU X Q, TAO N P, WANG X C, et al. Marine-derived bioactive compounds with anti-obesity effect: a review[J]. Journal of Functional Foods, 2016, 21: 372-387. DOI:10.1016/j.jff.2015.12.006.
[12] SULERIA H A R, GOBE G, MASCI P, et al. Marine bioactive compounds and health promoting perspectives; innovation pathways for drug discovery[J]. Trends in Food Science & Technology, 2016, 50: 44-55. DOI:10.1016/j.tifs.2016.01.019.
[13] 唐惠玲, 陈涛, 王莹, 等. 虫草多糖荧光标记的方法学研究[J].药学与临床研究, 2010, 18(3): 279-281. DOI:10.3969/j.issn.1673-7806.2010.03.025.
[14] 吕志华. 海洋多糖药物PS916的荧光标记及其药代动力学研究[D].青岛: 中国海洋大学, 2008: 25-32.
[15] 韩章润, 王玉峰, 刘鑫, 等. 糖胺聚糖的荧光标记及其与硫酸软骨素抗体的相互作用[J]. 分析化学, 2011, 39(9): 1352-1357. DOI:10.3724/SP.J.1096.2011.01352.
[16] 苗本春, 耿美玉, 李静, 等. 海洋硫酸多糖911免疫增强作用的探讨[J]. 中国海洋药物, 2002, 21(5): 1-4. DOI:10.3969/j.issn.1002-3461.2002.05.001.
[17] 胡锦珍, 张家骊, 程沁园, 等. 壳聚糖在小鼠体内的组织分布与排泄[J]. 食品与生物技术学报, 2009, 28(5): 611-615. DOI:10.3321/j.issn:1673-1689.2009.05.006.
[18] ARNOSTI C, KEITH S C, BLOUGH N V. Application of fluorescence spectroscopic techniques and probes to the detection of biopolymer degradation in natural environments[J]. Marine Chemistry, 2000,71(3/4): 321-330. DOI:10.1016/S0304-4203(00)00061-X.
[19] 郝冉, 王正明, 查学强, 等. 霍山石斛多糖的肠黏膜免疫调节活性及在小肠中的吸收分布[J]. 食品科学, 2014, 35(9): 256-259.DOI:10.7506/spkx1002-6630-201409050.
[20] 丁涛. 灰树花多糖的FITC荧光标记及Caco-2细胞模型对其的吸收与转运研究[D]. 徐州: 江苏师范大学, 2014: 19-20.
[21] 李福川, 耿美玉, 李英霞, 等. 海洋硫酸多糖911的荧光标记研究[J].高等学校化学学报, 2002, 23(9): 1704-1708. DOI:10.3321/j.issn:0251-0790.2002.09.011.
[22] 陈忱, 蔡慧珍, 唐华丽, 等. 枸杞多糖的组成分析及其荧光标记研究[J].时珍国医国药, 2014(10): 2312-2315.
[23] 范妮, 薛伟明. 壳聚糖荧光标记反应研究[J]. 云南大学学报(自然科学版), 2010, 32(1): 77-81.
[24] 贺继东, 夏文水. 异硫氰酸荧光素标记壳聚糖的研究[J]. 安徽农业科学, 2007, 35(34): 10939-10940. DOI:10.3969/j.issn.0517-6611.2007.34.001.
[25] HEILIG A, GÖGGERLE A, HINRICHS J. Multiphase visualisation of fat containing β-lactoglobulin-κ-carrageenan gels by confocal scanning laser microscopy, using a novel dye, V03-01136, for fat staining[J].Food Science & Technology, 2009, 42(2): 646-653. DOI:10.1016/j.lwt.2008.08.006.
[26] MATIGNON A, MOULIN G, BAREY P, et al. Starch/carrageenan/milk proteins interactions studied using multiple staining and confocal laser scanning microscopy[J]. Carbohydrate Polymers, 2014, 99(1): 345-355.DOI:10.1016/j.carbpol.2013.09.002.
[27] NÚÑEZ-SANTIAGO M C, TECANTE A, GARNIER C, et al. Rheology and microstructure of κ-carrageenan under different conformations induced by several concentrations of potassium ion[J]. Food Hydrocolloids, 2011, 25(1): 32-41. DOI:10.1016/j.foodhyd.2010.05.003.
[28] PERRECHIL F A, CUNHA R L. Stabilization of multilayered emulsions by sodium caseinate and κ-carrageenan[J]. Food Hydrocolloids, 2013,30(2): 606-613. DOI:10.1016/j.foodhyd.2012.08.006.
[29] XU Xiaoqi, XUE Changhu, CHANG Yaoguang, et al. Conformational and physicochemical properties of fucosylated chondroitin sulfate from sea cucumber Apostichopus japonicus[J]. Carbohydrate Polymers, 2016,152: 26-32. DOI:10.1016/j.carbpol.2016.06.061.
[30] GLABE C G, HARTY P K, ROSEN S D. Preparation and properties of fluorescent polysaccharides[J]. Analytical Biochemistry, 1983, 130(2):287-294.
[31] 罗立. 当归多糖ASP1体内外特异性肝靶向研究[D]. 武汉: 华中科技大学, 2012: 28-29.
[32] 苏玲, 胡静, 李雨婷, 等. 树舌荧光多糖的制备及在小鼠脾淋巴细胞中的定位[J]. 中国农业大学学报, 2013, 18(1): 147-152.
[33] 李国云, 尹利昂, 陈士国, 等. 海参多糖硫酸根含量的离子色谱法测定及其差异分析[J]. 食品工业科技, 2011, 32(7): 403-406.DOI:10.13386/j.issn1002-0306.2011.07.023.
[34] ARNOSTI C. Fluorescent derivatization of polysaccharides and carbohydrate-containing biopolymers for measurement of enzyme activities in complex media[J]. Journal of Chromatography B, 2003,793(1): 181-191. DOI:10.1016/S1570-0232(03)00375-1.
[35] MARUYAMA T, TOIDA T, IMANARI T, et al. Conformational changes and anticoagulant activity of chondroitin sulfate following its O-sulfonation[J]. Carbohydrate Research, 1998, 306(1/2): 35-43.DOI:10.1016/S0008-6215(97)10060-X.
[36] 闫亚美, 冉林武, 刘兰英, 等. 硫酸酯化多糖生物活性及其构效关系研究进展[J]. 安徽农业科学, 2009, 37(24): 11374-11375. DOI:10.3969/j.issn.0517-6611.2009.24.017.
[37] 潘惠英, 葛凤燕, 陈立功. 氨基荧光素的合成、分离和表征[J]. 应用化学, 2006, 23(2): 193-197. DOI:10.3969/j.issn.1000-0518.2006.02.018.
[38] 邓樱花, 曾琴. 荧光素及其衍生物的荧光性质研究[J]. 华中师范大学学报(自然科学版), 2010, 44(3): 443-447.

