六氢β-酸环糊精包合物与食品添加剂的协同抗氧化活性
徐海宁,刘玉梅*
近年来,随着人们对食品安全的认识和保健要求的逐步提高,合成食品添加剂的潜在危害受到各界广泛关注[1-2],寻找和开发天然来源的食品添加剂已成为功能性食品领域研究的热点[3-4]。如天然来源的纳他霉素、壳聚糖以及乳酸链球菌素[5]等均在发挥防腐作用的同时也具有其他重要的生理功效。啤酒花中重要的树脂成分β-酸,在啤酒酿造中不但具有协调风味、弥补苦味不足等作用,更重要的是具有明显的抑菌作用。但β-酸化学性质活泼,极易被氧化[6],直接作为食品抑菌或防腐剂不易利用。然而,通过控制一定的反应条件,将β-酸加氢还原[7],得到的氢化衍生物六氢β-酸(hexahydroβ-acids,HH)不但具有比β-酸更好的稳定性[8],且在抗菌[9]、防腐、抗氧化[10]和抑制肿瘤生长[11-12]等方面也呈现出更强的生物活性。但不足之处是,HH的疏水性很强,会在一定程度上限制其使用范围。环糊精(cyclodextrin,CD)及其衍生物是由多个D-吡喃葡萄糖形成的具有“锥筒”状的“内疏水,外亲水”的化合物,其特殊的空腔以及内部的疏水环境能与一些极性、大小、理化性质相匹配的客体分子或基团形成包合物,对提高客体分子的稳定性,改善客体分子的溶解性,以及缓释效果等方面有较大的影响[13-14]。目前,在很多药物研发中常采用CD包合以增加药物分子的水溶性。通过前期的实验研究发现,采用CD及其衍生物包合可明显改善HH的水溶性,进而可达到扩展其在更多食品中应用的目的,但HH与各种食品中常用添加剂之间是否存在相互作用尚鲜见文献报道。
本研究在比较了7 种HH-CD包合物清除1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基和·OH活性的基础上,筛选出4 种HH-CD包合物,分别与食品添加剂柠檬酸,氯化钠(sodium chloride,NaCl),蔗糖,VC等进行单独和混合复配,考察复配溶液体系对DPPH自由基和·OH清除活性;通过计算协同系数,评价HH-CD包合物与上述食品添加剂的协同抗氧化活性。通过上述研究,以期为天然来源的HH作为功能性食品抑菌防腐剂的应用和开发提供理论参考。
1 材料与方法
1.1 材料与试剂
HH(纯度≥99%)、六氢β-酸-2-甲基-β-环糊精(hexahydro-β-acids-2-methyl-β-cyclodextrin,HH-M-β-CD)、六氢β-酸-γ-环糊精(hexahydro-β-acids-γcyclodextrin,HH-γ-CD)、六氢β-酸-羟丙基-β-环糊精(hexahydro-β-acids-hydroxypropyl-β-cyclodextrin,HH-HP-β-CD)、六氢β-酸-2,6-二甲基-β-环糊精(hexahydro-β-acids-2,6-dimethyl-β-cyclodextrin,HHDM-β-CD)、六氢β-酸-β-环糊精(hexahydro-βacids-β-cyclodextrin,HH-β-CD)、六氢β-酸-α-环糊精(hexahydro-β-acids-α-cyclodextrin,HH-α-CD)、六氢β-酸-2,3,6-三甲基-β-环糊精(hexahydro-β-acids-2,3,6-trimethyl-β-cyclodextrin,HH-TM-β-CD)包合物,实验室自制[7,15-16];其中各种环糊精样品购自山东滨州智源生物科技有限公司。
1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 美国Sigma-Aldrich公司;邻二氮菲 天津市天新精细化工开发中心;30% H2O2新疆洁普乐生物科技有限公司;NaCl、苯甲酸钠 上海山浦化工有限公司;硫酸亚铁、柠檬酸 西安化学试剂厂;蔗糖 中国上海试剂一厂;磷酸氢二钠、磷酸二氢钠、VC、甲醇 天津永晟精细化工有限公司。以上试剂均为分析纯。
1.2 仪器与设备
BS210S型电子天平 德国赛多利斯公司;DHP-420型电热恒温培养箱 北京市永光明医疗仪器厂;UV-5300PC型紫外-可见分光光度计 上海元析仪器有限公司。
1.3 方法
1.3.1 样品的配制
1.3.1.1 HH甲醇溶液的配制
准确称取HH 5.00 mg,用甲醇定容到10 mL容量瓶中,得到质量浓度为0.50 mg/mL的HH-甲醇溶液,放置4 ℃冰箱中,待用。
1.3.1.2 HH-CD包合物及食品添加剂水溶液的配制
分别准确称取相应质量的各种包合物及苯甲酸钠、VC、NaCl、柠檬酸、蔗糖于100 mL容量瓶中,蒸馏水溶解并定容,得到质量浓度分别为0.12 mg/mL的各种包合物(以包合物中HH质量浓度计算)、0.12 mg/mL的苯甲酸钠、0.10 mg/mL的VC、4.00 mg/mL的NaCl、3.00 mg/mL的柠檬酸、8.00 mg/mL的蔗糖等水溶液。
1.3.1.3 双组分复配溶液的配制
·OH体系双组分溶液的配制:将前述质量浓度为0.12 mg/mL的HH-M-β-CD、HH-γ-CD、HH-HP-β-CD、HH-TM-β-CD包合物分别和苯甲酸钠溶液配制成质量浓度为12.00、10.00、8.00、6.00、4.00 μg/mL的系列混合液,分别与0.10 mg/mL的VC、4.00 mg/mL的NaCl、3.00 mg/mL的柠檬酸、8.00 mg/mL的蔗糖溶液按体积比1∶1混合后得到双组分复配溶液体系。
DPPH自由基体系双组分溶液的配制:将前述质量浓度为0.12 mg/mL的HH-M-β-CD、HH-γ-CD、HHHP-β-CD、HH-TM-β-CD包合物分别和苯甲酸钠溶液配制成质量浓度为120.00、100.00、80.00、60.00、40.00、20.00 μg/mL的系列混合液,分别与5.00 μg/mL的VC、4.00 mg/mL的NaCl、3.00 mg/mL的柠檬酸、8.00 mg/mL的蔗糖溶液按体积比1∶1混合后得到双组分复配溶液体系。
1.3.1.4 多组分复配溶液的配制
·OH体系多组分溶液的配制:将前述质量浓度为0.12 mg/mL的HH-M-β-CD、HH-γ-CD、HH-HP-β-CD、HH-TM-β-CD包合物溶液配制成质量浓度为12.00、10.00、8.00、6.00、4.00 μg/mL的系列溶液,分别与含0.10 mg/mL VC、4.00 mg/mL NaCl、8.00 mg/mL蔗糖混合溶液按体积比1∶1混合后作为多组分复配溶液体系。
DPPH自由基体系多组分溶液的配制:将前述质量浓度为0.12 mg/mL的HH-M-β-CD、HH-γ-CD、HHHP-β-CD、HH-TM-β-CD包合物溶液配制成质量浓度为120.00、100.00、80.00、60.00、40.00、20.00 μg/mL的系列溶液,分别与含5.00 μg/mL VC、4.00 mg/mL NaCl、3.00 mg/mL柠檬酸混合溶液按体积比1∶1混合后作为多组分复配溶液体系。
1.3.2 ·OH体系抗氧化能力的评价
采用邻二氮菲-Fe2+氧化法[17]。取0.75 mmol/L邻二氮菲溶液1 mL于试管中,依次加入pH 7.4、0.20 mmol/L磷酸盐缓冲溶液2 mL、样品液1 mL,充分混匀,再加0.75 mmol/L FeSO4溶液1 mL、体积分数0.01% H2O2溶液1 mL,混匀后,37 ℃下温育1 h,于536 nm波长处测其吸光度,记为AS;AP为1 mL样品液用1 mL蒸馏水替代时测得的吸光度;AB为1 mL样品液和1 mL的H2O2用2 mL蒸馏水替代时测得的吸光度。测试样品对·OH的清除率(experimental scavenging capacity,ESC)计算如式(1)。

1.3.3 DPPH自由基体系抗氧化能力的评价
DPPH自由基清除实验参照文献[18]完成。取不同样品液1 mL于试管中,加入0.04 mg/mL DPPH溶液3 mL,充分混匀,避光静置40 min后,测定其在517 nm波长处的吸光度,记为A样。以1 mL甲醇代替样品液作空白对照,记为A控;为减少测试误差,所有测试均采用1 mL样品液加3 mL甲醇作参比,记为A0。测试样品对DPPH自由基清除率计算如式(2)。

1.3.4 抗氧化协同系数的计算
抗氧化协同系数(synergistic effect,SE)为各体系实验得到的清除率ESC和理论计算的清除率(theoretical scavenging capacity,TSC)之间的比值[19],即SE=ESC/TSC。当SE>1表示有协同作用;SE<1表示无协同作用。
因测试体系的样品组成不同,理论清除率的计算如式(3)[20]。

式中:ESC1,...,ESCn分别是单一样品的实验清除率/%;n代表体系中组分数量。
1.4 数据统计分析
实验数据的处理及统计分析结果均采用Microsoft Excel 2007或Origin Pro8.6软件处理,实验数据均用¯x±s表示(n≥3)。
2 结果与分析
2.1 清除·OH的抗氧化活性评价
2.1.1 HH-CD包合物、食品添加剂单组分体系清除·OH的能力

图1 ·OH体系中HH-CD包合物的清除率曲线Fig. 1 Hydroxyl radical scavenging effect of hexahydro-β-acidcyclodextrin inclusion complexes
一些抗氧化物质主要通过自身的氧化还原反应来抑制氧化作用,如含有酚羟基、烯醇键类物质[21-22]。由实验可知,未包合的7 种CD均无清除·OH的活性,因此在图1中未显示,而所有包合物具有明显的清除·OH的作用,且清除率都高于同质量浓度下的HH甲醇溶液,并随质量浓度的增加而逐渐增加;当阳性对照BHT质量浓度为60 μg/mL时,其清除率低于10 μg/mL的HH甲醇溶液以及包合物溶液,由此可以说明包合物具有较好的抗氧化活性。分析原因可能是CD包合HH后,HH的烯醇键裸露在包合物外面,从而在一定程度上提高了抗氧化的能力。在6.00~10.00 μg/mL质量浓度范围内,HH-β-CD、HH-α-CD和HH-DM-β-CD包合物尽管也有较高的清除率,但因其溶解度较差,使用上可能会存在一定的局限,而HH-M-β-CD、HH-γ-CD、HH-HP-β-CD、HH-TM-β-CD包合物抗氧化或水溶性均较好,有望应用于更多的食品体系,因此后续的实验考察上述4 种CD包合物与食品添加剂的协同作用。食品添加剂均参考GB 2760—2014《食品安全国家标准 食品添加剂使用标准》[23]中果蔬汁类饮料标准添加。表1为单一食品添加剂溶液以及不同质量浓度苯甲酸钠溶液对·OH的清除率。

表1 苯甲酸钠与食品添加剂在·OH体系的清除率Table 1 Hydroxyl radical scavenging effect of sodium benzoate and food additives
2.1.2 双组分复配体系清除·OH的抗氧化活性


图2 HH-CD包合物、苯甲酸钠与食品添加剂双组分复配体系对·OH清除率的影响Fig. 2 Hydroxyl radical scavenging effect of binary combinations of hexahydro-β-acid-cyclodextrin inclusion complexes, sodium benzoate and food additives
由图2可知,随着包合物质量浓度的增加,复配液清除·OH的能力也逐渐增加,其中在质量浓度为5.00 μg/mL时HH-HP-β-CD包合物与NaCl的复配液和HH-γ-CD包合物与蔗糖的复配液对·OH清除率呈现下降趋势,具体原因尚需更深入的研究探明;而随苯甲酸钠质量浓度的增加,其复配液的清除率远远低于包合物的复配液,且增长幅度不显著,并也在质量浓度增加时出现了下降趋势。在双组分复配体系中,食品添加剂柠檬酸与包合物复配呈现促氧化作用(其清除率均为负值),可能是柠檬酸中多羟基结构可以螯合Fenten反应体系产生的Fe3+所致,但随包合物质量浓度的增加,对氧化反应的抑制作用也在不断增强,说明包合物的加入抑制了柠檬酸促氧化反应。
2.1.3 多组分复配溶液清除·OH的抗氧化活性
鉴于在双组分复配体系中包合物与VC、NaCl、蔗糖之间均具有协同增效作用,且在实际应用中,通常为多种食品添加剂混合添加。因此后续又考察了包合物与VC-NaCl-蔗糖混合溶液多组分复配体系的协同抗氧化活性。图3为多组分复配体系清除·OH的清除率曲线。

图3 HH-CD包合物与0.05 mg/mL VC-2.00 mg/mL NaCl-4.00 mg/mL蔗糖溶液多组分复配体系对·OH清除率的影响Fig. 3 Hydroxyl radical scavenging effect of hexahydro-β-acidcyclodextrin inclusion complexes in 0.05 mg/mL vitamin C-2.00 mg/mL sodium chloride-4.00 mg/mL sucrose solution
由图3可知,复配液清除·OH能力随包合物质量浓度的增加而增加,HH-M-β-CD包合物复配液的清除率明显高于含有其他包合物的复配液,说明HH-M-β-CD包合物的复配液具有较好的抗氧化活性。总体上来看,多组分复配体系的清除活性要弱于双组分复配体系,说明随着体系组分的增加,包合物对·OH的清除活性呈现下降的趋势。
2.2 清除DPPH自由基的抗氧化活性评价
2.2.1 HH-CD包合物、食品添加剂单组分体系清除DPPH自由基的活性

图4 DPPH自由基体系中HH-CD包合物的清除率曲线Fig. 4 DPPH radical scavenging effect of hexahydro-β-acidcyclodextrin inclusion complexes
因实验测得未包合的7 种CD和HH-α-CD包合物均无清除DPPH自由基的活性,因此图4中仅有6 种CD包合物和HH甲醇溶液清除DPPH自由基的清除曲线。结果表明,HH对DPPH自由基的清除能力要明显小于对·OH的清除能力。当溶液质量浓度为100.00 μg/mL时,HH甲醇溶液清除DPPH自由基的清除率为36.85%,据相关文献可知,啤酒花中的另一个重要活性成分——黄腐酚在质量浓度为500.00 μg/mL时,清除率为仅为39.13%[24],说明HH甲醇溶液清除DPPH自由基的活性高于黄腐酚。HH-TM-β-CD、HH-HP-β-CD、HH-M-β-CD、HHDM-β-CD包合物随质量浓度的增加,抗氧化活性不断增强,其清除率远远高于质量浓度为100.00 μg/mL时阳性对照品BHT溶液;且均高于HH甲醇溶液,其可能原因是HH中的羟基与CD分子中的羟基群相互作用,从而增强了包合物的抗氧化能力[25];由此说明,CD包合作用不仅改善了HH的溶解性,并且在一定程度上提高了其抗氧化活性。
由于VC清除DPPH自由基的活性远远强于清除·OH的活性,考虑到在复配体系中VC的抗氧化活性不能太强,因此,选择VC的质量浓度为·OH体系的1/20。表2为单一食品添加剂溶液以及不同质量浓度苯甲酸钠溶液的清除率。

表2 苯甲酸钠与食品添加剂在DPPH自由基体系的清除率Table 2 DPPH radical scavenging effect of sodium benzoate and food additives
2.2.2 双组分复配体系清除DPPH自由基的抗氧化活性
由图5可知,加入VC、NaCl、柠檬酸、蔗糖后,所有复配体系均有清除DPPH自由基的作用,且清除率与各自的质量浓度呈正相关,但当质量浓度达到一定值后,其清除率接近平缓趋势;其中,HH-TM-β-CD包合物与4 种添加剂两两复配后的清除率最高,HH-M-β-CD包合物次之。而苯甲酸钠与食品添加剂的复配体系基本没有对DPPH自由基的清除活性,且不随其质量浓度的增加发生改变,与其单组分体系的测定结果一致。
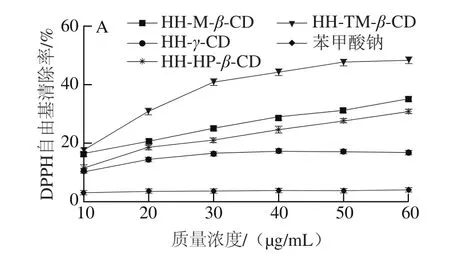

图5 HH-CD包合物、苯甲酸钠与食品添加剂双组分复配体系对DPPH自由基清除率的影响Fig. 5 DPPH radical scavenging effect of binary combinations of hexahydro-β-acid-cyclodextrin inclusion complexes and sodium benzoate with food additives
2.2.3 多组分复配体系清除DPPH自由基的抗氧化活性
双组分复配体系中包合物与VC、NaCl、柠檬酸之间具有较好的协同增效作用,因此有必要考察包合物与VC-NaCl-柠檬酸混合溶液之间的协同抗氧化作用。图6为多组分复配体系清除DPPH自由基的曲线图。

图6 HH-CD包合物与2.50 µg/mL VC-2.00 mg/mL NaCl-1.50 mg/mL柠檬酸溶液多组分复配体系对DPPH自由基清除率的影响Fig. 6 DPPH radical scavenging effect of hexahydro-β-acid-cyclodextrin inclusion complexes in 2.50 µg/mL vitamin C-2.00 mg/mL sodium chloride-1.50 mg/mL citric acid solution
由图6可知,4 种包合物复配体系的清除率均随包合物质量浓度的增加而增加,其中含HH-M-β-CD包合物的复配液的清除率最高。在10~60 μg/mL的线性范围内,其对应的F值分别为133.59、69.62、88.88、25.93、275.37、198.83(F>>F0.01(3,8)=7.59,记为⋆⋆),可以得出当质量浓度大于40.00 μg/mL时,复配液清除DPPH自由基能力的组间差异较质量浓度小于40.00 μg/mL时显著。
2.3 抗氧化协同系数的计算
2.3.1 双组分复配体系协同系数的计算
为计算两个或两个以上的组分是否具有抗氧化的协同作用,可用协同系数来衡量复合体系协同增效作用的大小。表3为双组分复配体系的协同系数。
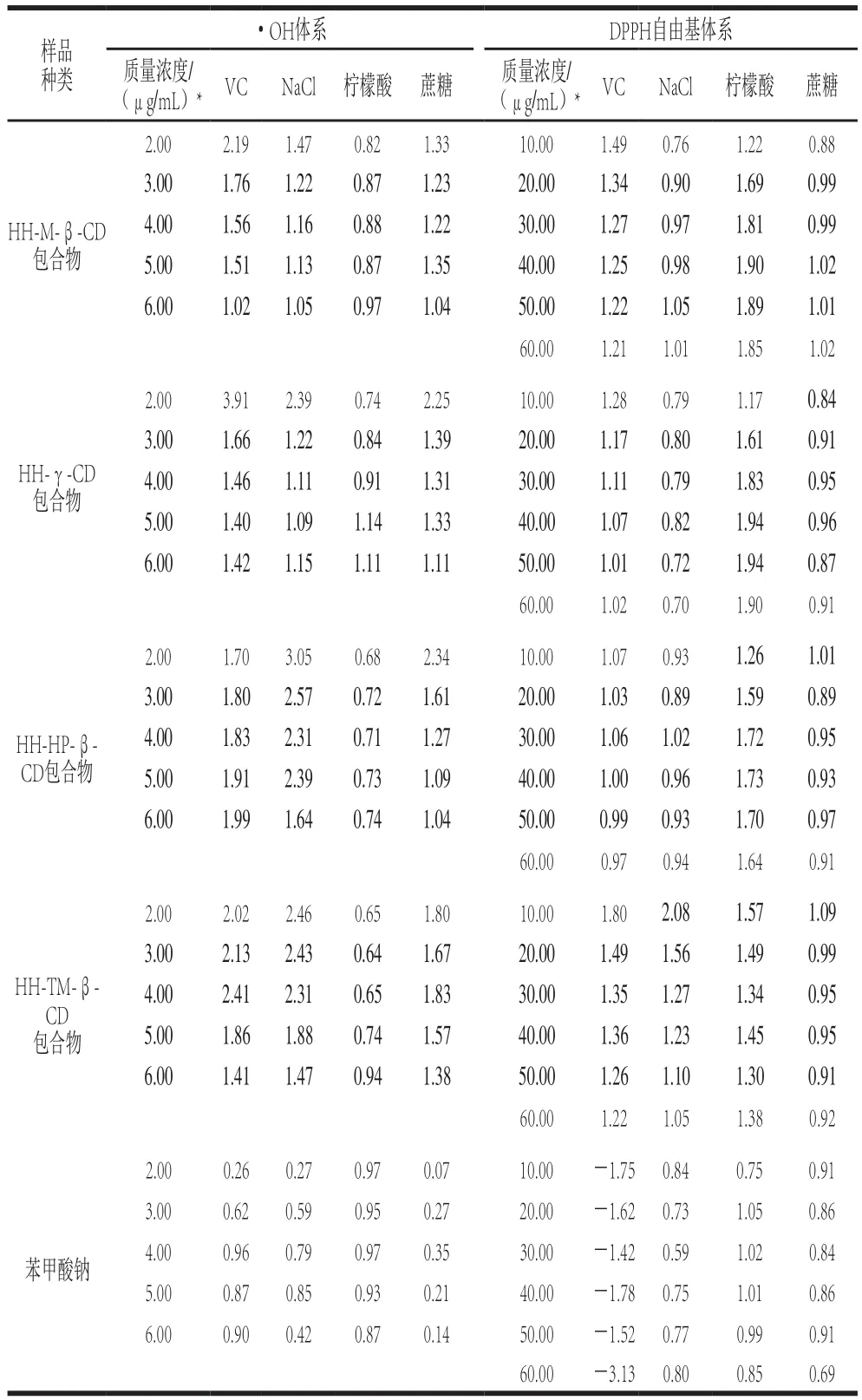
表3 双组分复配体系的协同系数Table 3 Synergistic effect (SE) of binary combinations
数据表明,在·OH体系中,4 种包合物与柠檬酸溶液复配后的协同系数均小于1,表现出无协同增效作用;与VC、NaCl、蔗糖复配后的协同系数均大于1,即包合物与VC、NaCl、蔗糖均具有一定的协同增效作用。这可能是因为VC具有较强的还原性,可还原被氧化的HH,增加其在体系内的有效浓度;中性盐NaCl中和了包合物表面的大量电荷,使水化膜破坏,有助于HH暴露出供氢体或供质子体,从而使其抗氧化活性增强[26];蔗糖含有较多的羟基,可与HH中烯醇键上的羟基形成分子间氢键,使得烯醇键上的羟基更容易脱氢,进而起到了协同抗氧化的作用[27-28]。
在DPPH自由基体系中,4 种包合物与柠檬酸溶液之间的协同系数均大于1,说明包合物与柠檬酸之间具有协同增效作用;其中HH-M-β-CD和HH-γ-CD在高质量浓度时的协同作用较强,其原因可能是柠檬酸的加入,其分子中多羟基结构不但有利于抗氧化剂的稳定,而且可以螯合助氧化作用的金属离子,因而表现出协同增效的作用[29]。HH-TM-β-CD、HH-M-β-CD包合物与VC之间都有较好的协同抗氧化性,但随质量浓度的增加,协同增效作用有减小的趋势;而HH-γ-CD包合物仅在10.00~30.00 μg/mL之间与VC有协同抗氧化性,HH-HP-β-CD包合物与VC无协同增效作用。在与NaCl复配时,仅有HH-TM-β-CD包合物与NaCl存在协同抗氧化作用。
在·OH和DPPH自由基体系,苯甲酸钠与食品添加剂复配液的协同系数均小于1,表明它们之间无协同增效的作用。
2.3.2 多组分复配体系的协同系数

表4 多组分复配体系的协同系数Table 4 Synergistic effect of quaternary combinations
由表4可知,在·OH体系中,复配液的协同系数都小于1;在DPPH自由基体系中,复配液的协同系数均大于1,说明复配液在·OH体系中无协同增效作用,而在DPPH自由基体系具有较好的协同增效作用。其原因可能是在DPPH自由基体系中,柠檬酸与VC共同使用时,柠檬酸可与VC被氧化后的自由基作用,使抗氧化剂VC获得再生,从而表现出协同增效的作用[30]。其中,HH-γ-CD包合物表现清除DPPH自由基的协同作用最强,HH-M-β-CD次之。
3 结 论
啤酒花中重要树脂成分β-酸的氢化衍生物HH自身具有特殊的共轭烯醇式结构,有着较好的抗氧化活性。经7 种CD包合后,除α-CD包合物无清除DPPH自由基的活性外,其余所有HH的CD包合物都表现出了比其自身更强的清除·OH和DPPH自由基的活性,并且增加了其水溶性;其中,HH-M-β-CD、HH-γ-CD、HHHP-β-CD、HH-TM-β-CD包合物的效果尤为显著。上述4 种HH-CD包合物与常用食品添加剂VC、NaCl、蔗糖、柠檬酸所形成的双组分复配体系在不同程度上均表现出协同抗氧化作用,而多组分体系仅表现出清除DPPH自由基的协同抗氧化性;对照品苯甲酸钠与4 种食品添加剂组成的双组分体系均无协同抗氧化作用。啤酒花应用具有非常悠久的历史,其安全性已在长期的使用中得以证实,上述研究可为天然来源的HH作为功能性食品抑菌防腐剂的开发和应用提供理论参考,也为拓宽啤酒花的应用领域提供了参考。
参考文献:
[1] ZHANG J B, ZHANG H, WANG H L, et al. Risk analysis of sulfites used as food additives in China[J]. Biomedical and Environmental Sciences, 2014, 27(1): 147-154. DOI:10.3967/bes2014.032.
[2] 吴欢欢, 黄雨薇, 卓晓强, 等. 食品安全中食品添加剂的功能及危害[J]. 现代农业科技, 2013(15): 307-308. DOI:10.3969/j.issn.1007-5739.2013.15.195.
[3] JIANG J, XIONG Youling L.. Natural antioxidants as food and feed additives to promote health benefits and quality of meat products: a review[J]. Meat Science, 2016, 120: 107-117. DOI:10.1016/j.meatsci.2016.04.005.
[4] CASTRO R J S D, SATO H H. Biologically active peptides: processes for their generation, purification and identification and applications as natural additives in the food and pharmaceutical industries[J].Food Research International, 2015, 74: 185-198. DOI:10.1016/j.foodres.2015.05.013.
[5] 陈智理, 李健, 郭静婕, 等. 乳酸链球菌素在食品中的应用研究[J]. 广西轻工业, 2011, 27(8): 6-7. DOI:10.3969/j.issn:1003-2673.2011.08.003.
[6] 刘玉梅. 啤酒花的化学成分及药理作用研究进展[J]. 食品科学,2009, 30(23): 521-527. DOI:10.3321/j.issn:1002-6630.2009.23.117.
[7] 刘玉梅, 汤坚, 刘奎钫, 等. 新型抑菌剂六氢-β-酸的合成工艺研究[J]. 食品工业科技, 2008, 29(11): 225-229. DOI:10.13386/j.issn1002-0306.2008.11.044.
[8] 肖小年, 马永花, 吴小堃, 等. 六氢β-酸抗菌实验研究[J]. 食品科技,2008, 33(6): 100-103. DOI:10.3969/j.issn.1005-9989.2008.06.030.
[9] 肖小年, 吴凌伟, 范青生, 等. 酒花浸膏及其异构化衍生物抗食品腐败菌的初步研究[J]. 天然产物研究与开发, 2001, 13(4): 47-50.DOI:10.3969/j.issn.1001-6880.2001.04.015.
[10] 肖小年, 马永花, 易醒, 等. 六氢β-酸的抗氧化功能研究[J]. 江西农业大学学报, 2008, 30(3): 517-520. DOI:10.13836/j.jjau.2008105.
[11] LIU C B, CHEN L H, CHENG A C, et al. Hexahydro-β-acids induce apoptosis through mitochondrial pathway, GADD153 expression, and caspase activation in human leukemia cells[J]. Food and Chemical Toxicology, 2011, 49(4): 1033-1042. DOI:10.1016/j.fct.2011.01.016.
[12] HSU C H, HO Y S, LAI C S, et al. Hexahydro-β-acids potently inhibit 12-o-tetradecanoylphorbol 13-acetate-induced skin inflammation and tumor promotion in mice[J]. Agricultural and Food Chemistry, 2013, 61(47): 11541-11549. DOI:10.1021/jf403560r.
[13] 童林荟. 环糊精化学: 基础与应用[M]. 北京: 科学出版社, 2001: 38-45.
[14] MAELLE M, MARC L, DAVID L, STEVEN R, et al. Cyclodextrins:a promising drug delivery vehicle for bisphosphonate[J]. 2017, 156:285-293. DOI:10.1016/j.carbpol.2016.09.030.
[15] 刘玉梅, 徐海宁. 一种新型抑菌剂六氢β-酸环糊精包合物的制备方法: 201610551294.6[P]. (2016-11-09) [2016-12-13].
[16] 吴婕, 刘玉梅. 黄腐酚-环糊精包合物的研制[J]. 安徽农业科学,2015, 43(20): 23-26. DOI:10.13989/j.cnki.0517-6611.2015.20.009.
[17] 黄海兰, 王海媛, 王宗花, 等. 霞草提取物的抗氧化活性研究[J]. 食品工业科技, 2012, 33(4): 114-116; 121. DOI:10.13386/j.issn:1002-0306.2012.04.017.
[18] THAMMARAT A, SUCHADA J. Enhancement of antioxidant activity of green tea epicatechins in β-cyclodextrin cavity:single-crystal X-ray analysis, DFT calculation and DPPH assay[J]. Carbohydrate Polymers,2016, 151: 1139-1151. DOI:10.1016/j.carbpol.2016.05.113.
[19] FUHRMAN B, VOLKOVA N, ROSENBLAT M, et al. Lycopene synergistically inhibits LDL oxidation in combination with vitamin E, glabridin, rosmarinic acid, carnosic acid, orgarlic[J].Antioxidants and Redox Signaling. 2000, 2(3): 491-506.DOI:10.1089/15230860050192279.
[20] MILDE J, ELSTNER E F, GRASSMANN J. Synergistic effects of phenolics and carotenoids on human low-density lipoprotein oxidation[J]. Molecular Nutrition and Food Research, 2007, 51(8):956-961. DOI:10.1002/mnfr.200600271.
[21] ZHENG G Y, HE L, GAO L P, et al. Antioxidant activity of polyprenols from pine needles of Pinus massoniana L. in vitro and in vivo[J]. Chemistry and Industry of Forest Products, 2013, 33(4): 15-21. DOI:10.3969/j.issn.0253-2417.2013.04.003.
[22] 郑立辉, 王鹏君, 李伟, 等. 白芷精油成分分析及清除DPPH自由基活性[J]. 食品科学, 2014, 35(14): 180-183. DOI:10.7506/spkx1002-6630-2014140035.
[23] 中华人民共和国国家卫生和计划生育委员会.食品安全国家标准食品添加剂使用标准: GB 2760—2014[S]. 北京: 中国标准出版社,2014: 222.
[24] 吴婕, 刘玉梅. 黄腐酚与食品酸味剂的协同抗氧化活性研究[J]. 中国食品添加剂, 2015(8): 91-96. DOI:10.3969/j.issn.1006-2513.2015.08.007.
[25] 李进霞, 于肯明, 张慧芝, 等. 芹菜素-环糊精包合物在溶液中的制备、表征及抗氧化性[J]. 山西大同大学学报(自然科学版), 2015,31(6): 40-43. DOI:10.3969/j.issn.1674-0874.2015.06.013.
[26] 林松毅, 郭洋, 王莹, 等. 蛋清抗氧化钛增效剂的优化[J]. 华南理工大学学报(自然科学版), 2010, 38(8): 100-104. DOI:10.3969/j.issn.1000-565X.2010.08.019.
[27] 唐宁. 玉米抗氧化肽的制备、分离纯化及结构鉴定[D]. 长春: 吉林大学, 2014: 53-60.
[28] 贺丰霞, 芮汉明, 廖彩虎, 等. 微量铁离子对蔗糖结晶过程的影响[J]. 食品科学, 2009, 30(13): 117-119. DOI:10.3321/j.issn:1002-6630.2009.13.027.
[29] 祝亚云, 潘良军, 赵良容, 等. 山奈酚与水的氢键作用对其抗氧化活性影响的理论研究[J]. 天然产物研究与开发, 2013, 25(6): 792-795.DOI:10.16333/j.1001-6880.2013.06.028.
[30] 张志清, 向建军, 周利茗, 等. 麦苗中阿魏酸、抗坏血酸(VC)、总黄酮协同抗氧化能力分析[J]. 中国粮油学报, 2013, 28(7): 5-11; 18.DOI:10.3969/j.issn.1003-0174.2013.07.002.

