健脾益肾方对前列腺癌患者手术去势后性激素、PSA的影响研究*
李明林
河南省南阳市中心医院泌尿外科(南阳 473009)
前列腺癌(PCa)是男性生殖系最常见的恶性肿瘤之一,逐渐成为全球男性的首要健康难题。我国PCa发病率较低,仅为2.41/10万男性人口[1],随着我国人口老龄化的进一步加剧,PCa发病率和死亡率呈逐年上升趋势[2]。PCa好发于50岁以上男性,通常早期无临床症状,临床确诊时多为晚期。目前,临床上针对PCa仍局限在手术切除、放疗和化疗,而这些手段均为非特异性,会产生显著的毒副作用[3]。中医药治疗肿瘤,尤其是在延缓肿瘤转移,提高生活质量、减轻不良反应等方面已被证实具有明显优势[4]。PCa多为高龄,脾肾虚衰,肿瘤形成后,进一步耗伤正气[5],肾为先天之本,脾为后天之本,当从脾肾着手,重在培元固本。故应用健脾益肾方治疗手术去势后前列腺癌,探讨其对性激素、PSA的影响,为临床用药提供指导。
资料与方法
1 一般资料
受试者均来自2014年4月至2016年12月我院泌尿、男科门诊和住院的94例手术去势后前列腺癌患者,根据其就诊顺序随机分为对照组与健脾益肾组,每组47例。对照组:年龄56~80岁,平均(67.42±9.34)岁;病程6~14个月,平均(10.84±1.49)个月;腺癌41例,腺鳞癌4例,未分化癌2例;临床分期T3-4N0M1b23例,T3-4N0M1c24例;Gleason评分为2~4分8例,5~6分18例,7~10分21例。健脾益肾组:年龄54~84岁,平均(68.63±9.52)岁;病程6~16个月,平均(11.21±1.54)个月;腺癌38例,腺鳞癌4例,未分化癌5例;临床分期为T3-4N0M1b20例,T3-4N0M1c27例;Gleason评分为2~4分5例,5~6分20例,7~10分22例。两组临床基线资料比较无差异(P>0.05),具有均衡性。所有患者均经直肠前列腺穿刺活检病理证实,同时结合胸片、骨扫描、CT、MRI、PET-CT等影像学检查,明确临床分期。参照中国抗癌协会泌尿肿瘤专业委员会。中国去势抵抗性前列腺癌诊治专家共识[6]中PCa诊断标准。参照国家卫生部《中药新药临床研究指导原则(试行)》[7]和《中医诊疗常规》[8]中脾肾两虚证为主症:尿频、尿急、尿流中断、小便不畅、尿线细弱或尿流涓滴不成线,点滴而下。次症:疲乏无力,形体消瘦,面色无华,不思饮食,口苦干不思饮。舌脉:舌质淡红,舌体瘦小,脉沉细无力。凡具备主症3项和次症3项以上,并结合舌脉,即可诊断。影像学、前列腺穿刺活检确诊PCa,中医证型属脾肾两虚型;已行PCa手术去势治疗6个月以上;全身一般情况良好,生活能自理;知情同意,自愿受试并签署知情同意书。排除标准:预计生存期<6个月;伴严重心、肝、肾、肺等重要器官功能障碍;内分泌等其他疾病可影响效果判定;有神经疾病史,不能配合完成试验。
2 治疗方法
均予标准手术去势(双侧睾丸切除)。对照组根据美国国立综合癌症网络(NCCN)指南,予最大限度雄激素阻断(Maximal androgen blockade,MAB)治疗,即比卡鲁胺胶囊(生产批号20140106)50 mg/次,1次/d,连续服用6个月;健脾益肾组在上述基础加用中药健脾益肾汤剂,基本组方如下:党参、黄芪各30 g,茯苓、女贞子、菟丝子各15 g,补骨脂、焦白术各20 g,龟板、白花蛇舌草各12 g,半枝莲10 g,炙甘草9 g。脾气虚者加山药、茯苓、白术;肾虚者加菟丝子、牛膝;阴虚者加女贞子、山萸肉;血瘀者加土鳖虫、泽兰、王不留行;疼痛明显者加延胡索,伴有血尿者加小蓟炭、白茅根,上诸药煎煮200 ml,分早晚温服。两组均每月复查PSA一次,均连续治疗3个月。
3 疗效评价标准 应用电化学发光法检测血清睾酮(T)、雌二醇(E2)、孕激素(P)、卵泡刺激素(FSH)、黄体生成素(LH)水平,试剂盒均由美国DPC公司生产;应用瑞典Can Ag Diagnostics AB公司的Can Ag OSA EIA试剂盒检测血清前列腺特异抗原(Prostate Specific Antigen,PSA)、游离前列腺特异抗原(free Prostate Specific Antigen,fPSA)水平。中医证候评分:参照PCa 中医症候问卷标准,评价尿痛尿不适(排尿刺激症状)、尿频尿不畅(排尿梗阻症状)、神疲乏力、食欲不振、腰酸背痛主要症候,根据证候轻重程度划分为无、轻、中、重、严重5个等级,分别计0、1、2、3、4分[9]。生活质量:应用生活质量综合评定问卷(GQOL-74)从心理功能、物质生活、躯体功能、社会功能等方面评价生活质量,分数越高,生活质量越好。参照《中医病证诊断疗效标准》[10]拟定临床疗效评价标准,根据下腹胀痛、尿频、尿道灼热感、尿血、尿潴留、骨骼疼痛等临床症状的变化,治疗效果临床评分为症状消失、症状改善、症状无改善、症状加重。缓解率=(症状消失例数+症状改善例数)/总例数×100%。
4 统计学方法
使用SPSS 17.0统计学软件进行数据分析,计量资料组内予单因素方差分析,若有意义两两比较予LSD法,组间予独立样本t检验,等级资料予秩和检验,以P<0.05有统计学意义。
结 果
1 血清性激素水平比较
与治疗前比较,治疗后1、3个月两组血清T、E2、P水平均升高(P<0.05),FSH、LH均降低(P<0.05);与同时间段对照组比较,治疗后1、3个月健脾益肾组T、E2、P水平均较高(P<0.05),FSH、LH均较低(P<0.05),见表1。
2 血清PSA、fPSA水平比较 与治疗前比较,治疗后1、2、3个月两组血清PSA、fPSA水平均降低(P<0.05);与同时间段对照组比较,治疗后1、2、3个月健脾益肾组PSA、fPSA水平均较低(P<0.05),见表2。
3 中医证候评分比较 与治疗前相比,对照组尿痛尿不适、尿频尿不畅评分降低(P<0.01),神疲乏力、食欲不振、腰背酸痛评分无变化(P>0.05),健脾益肾组尿痛尿不适、尿频尿不畅、神疲乏力、食欲不振、腰背酸痛评分降低(P<0.01)。与对照组比较,健脾益肾组尿痛尿不适、尿频尿不畅、神疲乏力、食欲不振、腰背酸痛评分较低(P<0.01),见表3。
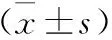
表1 两组血清性激素水平比较
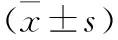
表2 两组血清PSA、fPSA水平比较
4 生活质量比较 与治疗前比较,两组心理功能、物质生活、躯体功能、社会功能等评分均升高(P<0.01);与对照组比较,健脾益肾组心理功能、物质生活、躯体功能、社会功能等评分均较高(P<0.01),见表4。
5 临床疗效 经3个月治疗后,对照组症状消失10例,症状改善14例,症状无改善12例,症状加重11例,缓解率为51.06%(24/47)。健脾益肾组症状消失20例,症状改善14例,症状无改善7例,症状加重6例,缓解率为72.34%(34/47),经统计学处理有差异(Z=-2.415,P<0.05)。

表3 两组中医证候评分比较(分)

表4 两组生活质量评分比较(分)
讨 论
PCa是全世界范围最常见的男性恶性肿瘤之一,随着人口老龄化、生存环境、饮食结构和生活方式等方面的改变,在我国PCa发病率有逐年增高的趋势[11]。据2013年流行病学调查显示,我国从1998年至2008年PCa患病率年均增加12.07%[12]。目前,PCa主要治疗方法有手术、放疗、低温手术、化疗、内分泌治疗等[13],此外饮食干预和调整生活方式在一定程度上阻止疾病进展。其中内分泌治疗是晚期PCa首选治疗方案,手术去势(双侧睾丸切除术)则是永久性去除睾丸分泌的雄性激素,已被有效应用了几十年,现仍认为是内分泌治疗的“黄金标准”[14]。但将会对患者造成一定的不良影响,长期不良反应主要有性欲降低、勃起功能障碍、抑郁等,而常见不良反应有阵发性潮热、乳房胀痛、女性化等[15]。
中医诊治PCa拥有独特自身优势,着眼于患者个体化特征,并侧重缓解PCa症状和术后康复,效果显著,理论研究散见于“淋证”、“癃闭”等范畴。本病病位在肾,与脾关系密切。其主要病机为肾气亏虚,癌肿耗伤正气,病延日久,更兼脾虚弱,气血生化乏源,致使正气更亏,正虚邪恋,互为因果,形成恶性循环,则病情迁延[16],故当以健脾益肾,重在培元固本。方中重用党参、黄芪共为君药,相须为用,进一步加强益气健脾的功效;女贞子、菟丝子、补骨脂共为臣药,滋补肝肾、填精;白术、茯苓、龟板、白花蛇舌草、半枝莲共为佐药,清热解毒,利水健脾;炙甘草为使药,调和诸药。全方共奏健脾益精、滋肾填精,阴阳双补的作用。中药有较强的抑瘤、调整免疫力等作用,并已被现代药理学证实。党参可直接作用垂体,增强机体免疫功能、抗应激作用,并对生殖系统影响生殖力,同时党参多糖具有抗肿瘤活性[17]。黄芪多糖对细胞免疫、体液免疫和单核-巨噬细胞吞噬功能均有良好的促进作用,诱导淋巴细胞产生IL-2和IFN,直接或间接参与细胞因子网络和免疫系统的调控[18],从而杀灭肿瘤细胞。甘草中含有的甘草酸能通过调节Th2细胞、抑制二乙基亚硝胺等机制,广泛用于黑色素瘤、肝癌等恶性肿瘤,同时可增强M细胞吞噬功能和辅助性T淋巴细胞的增殖能力和活性。PCa本身存在免疫功能低下,尤其是手术去势和内分泌治疗阻断雄激素更会进一步加重机体免疫抑制状态。在症状缓解率比较上,健脾益肾组72.73%明显高于对照组的51.52%,这与健脾益肾方提高免疫功能,从而促进机体肿瘤细胞杀伤力存在一定联系。
PCa细胞经去雄激素后,可激活细胞生长停止和凋亡通路[19],PCa细胞对雄激素的依赖性使治疗PCa原则是降低雄激素含量。手术去势后,由于睾丸被切除,使外周睾酮显著下降,破坏了下丘脑垂体-性腺轴的负反馈调节,从而使垂体叶分泌LH、FSH增加。去势后,来自睾丸和T芳香化转化的E2消失或减少,同时亦可使P浓度下降。因此,PCa去势后性激素变化对判断疗效和治疗反应具有重要意义。PSA是前列腺上皮细胞分泌的单链糖蛋白,其在PCa患者血清中呈高表达[20],是国内外应用最广泛的PCa筛查和治疗效果评价的指标。正常生理下,前列腺腺泡与导管腔、血液系统存在组织屏障,当受肿瘤影响时,该屏障被破坏,从而使血清PSA浓度升高。本研究发现,健脾益肾组血清性激素、PSA、fPSA改善情况明显优于对照组,提示健脾益肾方对PCa患者血清性激素、PSA含量调控具有积极作用。在中医主要症候与生活质量比较上,健脾益肾组亦显著优于对照组,提示健脾益肾方能提高PCa生活质量,尤其是神疲乏力、食欲下降等手术去势以及内分泌治疗后出现的去势综合征,亦体现扶正培本治疗肿瘤的学术思想。
综上所述,健脾益肾方能有效改善手术去势后前列腺癌患者临床症状,并提高生活质量,同时对机体性激素、PSA调控具有积极作用。
[1] 陈一鸣, 徐仁芳, 许贤林,等. 全身炎症指标与前列腺癌去势抵抗的相关性[J]. 江苏医药, 2017, 43(6):403-407.
[2] Heijnsdijk EA,Wever EM,Auvinen A,etal.Quality-of-life effects of prostate-specific antigen screening[J].N Engl J Med,2012,367(7): 595-605.
[3] 孙 文, 余 良, 孙 航,等. 手术去势与药物去势治疗前列腺癌的疗效对比分析[J]. 癌症进展, 2016, 14(4):363-365.
[4] 蔡忠林, 刘强照, 李 慧,等. 雄激素受体在去势抵抗性前列腺癌进展中的作用及研究进展[J]. 现代肿瘤医学, 2016, 24(23):3844-3848.
[5] 邢 瑞, 苏 静, 邢召全,等. 前列腺癌去势后脂类和能量代谢通路变化的蛋白表达研究[J]. 医学与哲学, 2016, 37(20):66-69.
[6] 中国抗癌协会泌尿肿瘤专业委员会. 中国去势抵抗性前列腺癌诊治专家共识[J]. 中华外科杂志, 2016, 54(7):1133-1136.
[7] 中华人民共和国卫生部.中药新药临床研究指导原则[S].北京:中国医药科技出版社,1993:175-178.
[8] 中国中医研究院广安门医院.中医诊疗常规[M].北京:中医古籍出版社,1989:324-325.
[9] 王丽丽, 王海涛, 霍 彬,等. Polo样激酶1在去势抵抗性前列腺癌中的表达及意义[J]. 天津医药, 2017, 45(4):389-392.
[10] 国家中医药管理局.中医病证诊断疗效标准[M].南京:南京大学出版社,1994:274.
[11] 张国辉.局限性前列腺癌的治疗进展[J].癌症进展,2014,12(1):1-2.
[12] 常德贵, 李 响, 邹建华,等. 芪蓝胶囊对去势后气虚血瘀型前列腺癌患者临床增效作用研究[J]. 中华男科学杂志, 2017, 23(7):646-651.
[13] 胡云峰, 崔 洁, 雷 侠,等. 富含亮氨酸蛋白LRP130抗体在恶性肿瘤中的表达和临床意义[J]. 陕西医学杂志, 2017, 46(5):674-676.
[14] Heidenreich A,Bellmunt J,Bolla M,etal.EAU guidelines on prostate cancer. Part 1: screening, diagnosis, and treatment of clinically localised disease[J].European Urology,2011,59(1):61-71.
[15] 张 赛, 邱明宁, 汤焕城,等. 去势抵抗性前列腺癌发生多西紫杉醇耐药的相关机制及其治疗进展[J]. 肿瘤, 2016, 36(10):1165-1170.
[16] 冯 静, 廖绍光, 程惠华,等. 沙利度胺联合化疗治疗骨转移去势抵抗性前列腺癌的疗效观察[J]. 中国癌症杂志, 2017, 27(4):287-292.
[17] 徐 明, 单玉喜, 王少雄,等. 160W绿激光经尿道汽化减瘤术治疗合并难治性肉眼血尿的去势抵抗性前列腺癌短期效果观察[J]. 山东医药, 2017, 57(23):66-68.
[18] 李 飞, 朱彦锋, 陈静瑶,等. 染料木黄酮对去势抵抗性前列腺癌VCaP细胞增殖的影响[J]. 中华男科学杂志, 2016, 22(12):1065-1070.
[19] 谭 政, 宋争放, 雷乃军,等. 多西他赛单药或联合血管内皮生长因子抑制剂治疗去势抵抗性前列腺癌疗效和安全性的Meta分析[J]. 现代泌尿外科杂志, 2016, 21(2):122-128.
[20] 吴 杰,赵睿哲,黄 源,等. PSA灰区前列腺癌预测模型及随访系统的建立[J]. 中华泌尿外科杂志,2016,37(4):583-586.

