美沙拉嗪联合薁磺酸钠治疗溃疡性直肠炎疗效及对患者血清炎性因子水平影响研究
郭佳佳
齐齐哈尔医学院附属第三医院消化二科(齐齐哈尔 161000)
美沙拉嗪联合薁磺酸钠治疗溃疡性直肠炎疗效及对患者血清炎性因子水平影响研究
郭佳佳
齐齐哈尔医学院附属第三医院消化二科(齐齐哈尔 161000)
目的:研究美沙拉嗪缓释颗粒联合薁磺酸钠对溃疡性直肠炎患者疗效及血清炎性因子水平的影响。方法:选取溃疡性直肠炎患者78例,采用随机数字法将其分为对照组和研究组各39例。对照组给予口服美沙拉嗪治疗,在此基础上,研究组加施薁磺酸钠保留灌肠治疗,所有患者均连续用药4周。比较两组患者的治疗总有效率、血清炎性因子水平、腹泻症状缓解情况、不良反应发生率,同时比较两组治疗前后的溃疡性结肠炎活动指数(DAI)及日常生活能力(ADL)评分。结果:研究组治疗后总有效率(94.49%)明显高于对照组(79.49%)(χ2=4.13,P=0.04);研究组DAI、IL-8水平均明显低于对照组(P<0.01),而ADL评分、IL-10水平明显高于对照组(P<0.01);,研究组患者黏液脓血便消失时间(7.53±3.46)d,与对照组(13.24±3.63)d比较,差异有统计学意义(P<0.05);腹泻症状恢复正常时间(10.73±4.12)d明显低于对照组(16.42±6.31)d,差异有统计学意义(P<0.01);两组患者的不良反应发生率比较无明显差异(P>0.05)。结论:美沙拉嗪缓释颗粒联合薁磺酸钠治疗溃疡性直肠炎的疗效显著,可纠正抗炎细胞因子与促炎细胞因子失衡,缓解腹泻症状,提高患者生活质量,且安全可靠,值得临床推广。
溃疡性直肠炎为临床常见的炎症性肠病,是溃疡性结肠炎的一个临床亚型,其病变主要累及结肠、直肠及乙状结肠粘膜及粘膜下层,主要临床表现为腹泻、腹痛、便血等消化道症状[1]。美沙拉嗪对溃疡性结、直肠炎具有显著的治疗效果,其含有两个5-氨基水杨酸分子,作用于肠道后偶氮链发生断裂[2],能够释放双倍的5-氨基水杨酸,进而有效消除机体内自由基及病变肠道炎症介质,最终实现修复受损肠粘膜的功效。薁磺酸钠是愈创薁的衍生物之一,其可直接作用于有炎症的黏膜,快速促进黏膜愈合,且副作用较小[3]。本研究笔者就对两种药物联合治疗溃疡性直肠炎疗效展开报道,旨在为临床提供指导。
资料与方法
1 一般资料 选取我院2015年9月到2016年12月间收治的溃疡性直肠炎患者78例,纳入标准[4]:①所有患者均符合中华医学会炎症性肠病学组制定的诊断标准,且经肠镜证实为活动性溃疡性直肠炎;②临床上有持续性或反复发作性腹痛和黏液血便症状;③均无合并严重的心肝肾肺等器官组织疾病;④大便培养2次或2次以上无致病菌者;⑤患者及家属均知晓此次研究内容并签署知情同意书。排除标准:①近期1月内曾接受免疫抑制剂或糖皮质激素类药物治疗者;②伴有严重感染性疾病、免疫功能或血液系统疾病者;③合并严重精神系统疾病或恶性肿瘤者;④对本研究药物过敏或伴有影响药物吸收疾病者;⑤处于妊娠期或哺乳期妇女。随机将78例患者分为对照组和研究组,每组39例。对照组中,男性26例,女性13例,年龄19~68岁,病程3~12个月。研究组中,男性23例,女性16例,年龄21~64岁,病程在1~11个月。两组在性别、年龄、病程等一般资料数据进行比较,差异无统计学意义(P>0.05),具有可比性。
2 治疗方法 所有患者均口服美沙拉嗪缓释颗粒(H20143164,500 mg)1.0 g/次,4次/d。研究组在此基础上加施0.03%薁磺酸钠溶液(H20051566,)100 ml保留灌肠。所有患者均连续治疗4周,同时期间免服影响消化道动力及其他止泻、助消化药。
3 观察指标与疗效判定 ①比较两组患者的治疗总有效率;②比较两组患者治疗前后的血清白细胞介素-8(IL-8) 、IL-10水平;③比较两组患者的DAI、ADL评分;④比较两组患者的腹泻症状缓解情况;⑤比较两组患者的皮肤过敏、腹胀、纳差、肝肾功能损害、血尿常规异常等不良反应发生率。参照2012年中华医学会消化病学会会议标准进行疗效评定[5]。
4 统计学方法 采用SPSS 22.0统计学软件,计量资料以均数±标准差形式表示,采用t检验。计数资料以例(%)表示,采用χ2检验;P<0.05 代表有统计学差异。
结 果
1 两组治疗总有效率比较 研究组患者经治疗后的显效率和治疗总有效率分别为64.10%、94.87%,对照组分别为35.90%、79.49%,研究组显效率和治疗总有效率均明显高于对照组(χ2=4.13,P=0.04),见表1。
2 两组血清IL-8、IL-10水平比较 两组患者治疗前血清IL-8、IL-10水平比较差异无统计学意义(P>0.05);两组患者治疗后IL-8水平均较治疗前出现明显降低(P<0.01),而IL-10水平则较治疗前明显提高(P<0.01),同时研究组的IL-8水平明显低于对照组(t=10.58,P=0.00),研究组的IL-10水平明显高于对照组(t=5.26,P=0.00),见表2。
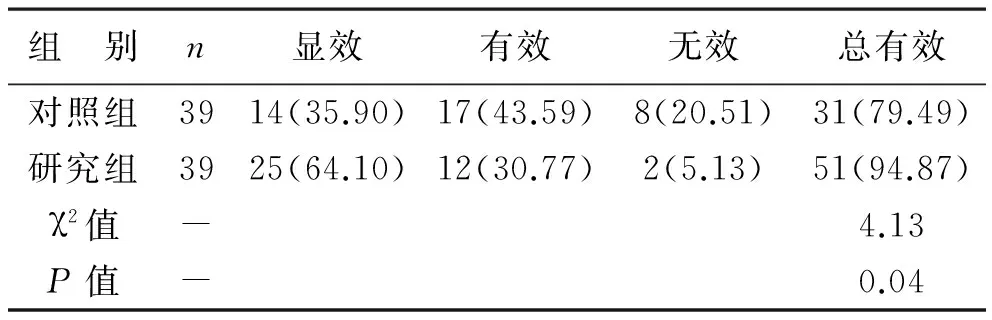
表1 两组患者的治疗总有效率比较[例(%)]
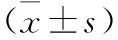
表2 两组血清IL-8、IL-10水平比较
注:与本组治疗前比较,*P<0.01
3 两组DAI、ADL评分比较 两组患者治疗前DAI、ADL评分评分比较,差异无统计学意义(P>0.05);两组患者治疗后DAI均较治疗前出现明显降低(P<0.05),而ADL评分则较治疗前明显提高(P<0.01),同时研究组患者的DAI(2.49±0.93),明显低于对照组(5.65±1.12)(t=13.56,P=0.00),研究组患者的ADL评分(81.29±7.87),明显高于对照组(70.48±7.52)分(t=7.94,P=0.00),见表3。
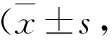
表3 两组DAI、ADL评分比较分)
注:与本组治疗前比较,*P<0.05
4 两组腹泻症状缓解情况比较 与对照组比较,研究组患者黏液脓血便消失时间[(7.53±3.46)d 与 (13.24±3.63)d]明显缩短(t=7.11,P=0.00),同时腹泻症状恢复正常时间[(10.73±4.12)d 与(16.42±6.31)d]亦明显缩短(t=4.72,P=0.00)。
5 两组不良反应发生率比较 两组患者治疗期间均未出现严重的肝肾功能损害、血尿常规检查结果异常等,其中对照组患者共出现1例皮肤过敏、2例腹胀、1例纳差,总不良反应发生率为10.25%;研究组患者共出现1例皮肤过敏、3例腹胀、1例纳差,总不良反应发生率为12.82%。两组在不良反应发生率比较上未见差异(P>0.05),且所有不良反应均经针对性治疗后明显改善。
讨 论
溃疡性直肠炎是溃疡性结肠炎的一个亚类,是指距齿状线15 cm以下的直肠非特异性慢性炎症,近年来,受环境污染加剧、生活节奏加快以及饮食结构变化等因素影响,其发病率呈明显上升之势。研究认为溃疡性直肠炎是由中介淋巴细胞导致的自身免疫性疾病[6],其中抗炎细胞因子与促炎细胞因子之间的平衡失调是其最为关键的发病机制。IL-8 是一种低分子量的多肽,主要由单核巨噬细胞产生,研究证实其与自身免疫性疾病、多种炎性反应疾病及肿瘤的发生发展密切相关,同时具有调节免疫状态、促进炎性反应过程及刺激血管的形成等多种功能[7]。作为一种促炎性细胞,IL-8 可参与细胞免疫反应,激活并趋化中性粒细胞到达炎症部位,进而引起多种炎症介质的释放,最终导致各种炎症反应的发生,引起机体各个部位组织受损。IL-10是一种多源的细胞因子,主要由单核巨噬细胞和T细胞亚群等活化免疫细胞产生。研究指出[8],其对免疫应答主要起抑制作用,能够显著抑制TNF、IL-6、IL-8等促炎因子的表达,但不影响抑炎因子的表达。
美沙拉嗪缓释颗粒,又名5-氨基水杨酸,其核心为美沙拉嗪和赋形剂颗粒,可通过上消化道以有效浓度到达远端肠管。作为治疗溃疡性结、直肠炎的药物,美沙拉嗪缓释颗粒已逐渐应用于临床,且具有良好疗效。研究证实其主要作用机制为[9]:①通过抑制炎性介质白三烯的形成和引起炎症的前列腺素的合成,进而降低机体内炎性因子水平;②抑制局部免疫反应(免疫球蛋白产生和肠巨噬细胞移动),阻滞炎性介质的释放;③清除氧自由基并拮抗血小板活化因子,可实现抑菌、消除炎症的目的,最终起到加速机体病损组织修复、改善溃疡面微循环的作用。 但有研究发现[10],美沙拉嗪缓释颗粒治疗后患者多出现不同程度的恶心呕吐、头痛等症状,对患者生活质量造成一定影响。薁磺酸钠是愈创薁的衍生物之一[11],其可直接作用于有炎症的黏膜,快速促进黏膜愈合,且副作用较小。同时有文献报道称[12],通过保留灌肠,能够使药液直达病灶,充分作用于溃疡部位,且病灶局部浓度高,可有效抑制炎症性肠病的炎症反应。本研究表2数据显示,研究组的IL-8水平明显低于对照组,IL-10水平则明显高于对照组,说明两药联用可通过降低IL-8的表达同时上调IL-10的表达,实现抗炎细胞因子与促炎细胞因子平衡的功效。目前,薁磺酸钠常用于治疗胃溃疡及十二指肠溃疡,但关于艾迪莎联合薁磺酸钠治疗溃疡性直肠炎疗效及安全性尚缺乏足够文献支持。本研究结果显示,研究组在治疗总有效率以及治疗后的ADL评分均明显高于对照组,治疗后的DAI明显则低于对照组,同时研究组的腹泻症状缓解情况明显优于对照组,证实两种药物联合治疗可实现疗效协调效果,共同促进肠道轴膜损伤的修复,实现改善患者腹泻症状的功效。同时研究发现,两组患者均无发现明显不良反应,证实两种药物治疗的安全性可靠,与目前报道一致[13]。
综上所述,本研究中采用了美沙拉嗪缓释颗粒联合薁磺酸钠对溃疡性直肠炎患者进行治疗,结果证实了联合用药对其的治疗效果显著,可纠正抗炎细胞因子与促炎细胞因子失衡,缓解腹泻症状,提高患者生活质量,且安全可靠。
[1] Jiang XL, Guo N, Xing H,etal. Curative effect of sodium azulene sulfonate liquid and mesalazine suppository for ulcerative proctitis[J]. Chinese Journal of Digestion & Medical Imageology, 2013,3(5):233-235.
[2] 彭 洪, 林中超, 杨祖奎,等. 曲安奈德联合甲硝唑灌肠治疗溃疡性直肠炎疗效观察[J]. 实用医院临床杂志, 2014, 11(1):134-136.
[3] 赵 敏, 桑畅野, 王振军,等. 艾迪莎联合美沙拉嗪栓治疗溃疡性直肠炎的疗效观察[J]. 海南医学院学报, 2016, 22(12):1243-1245.
[4] Fukunaga K, Ohda Y, Hida N,etal. Placebo controlled evaluation of Xilei San, a herbal preparation in patients with intractable ulcerative proctitis[J]. Journal of Gastroenterology & Hepatology, 2012, 27(12):1808-15.
[5] Sandborn WJ, Bosworth B, Zakko S,etal. Budesonide foam induces remission in patients with mild to moderate ulcerative proctitis and ulcerative proctosigmoiditis[J]. Gastroenterology, 2015, 148(4):740-750.e2.
[6] 冉 玉. 消溃愈疡汤联合艾迪莎治疗溃疡性结肠炎50例[J]. 西部中医药, 2013, 26(3):101-102.
[7] 王小琴, 孔超美, 张予蜀. 美沙拉嗪缓释颗粒(艾迪莎)对溃疡性结肠炎患者肠黏膜组织病理学改变及血清ICAM-1水平的影响[J]. 实用临床医药杂志, 2010, 14(17):66-67.
[8] Lawrance IC, Baird A, Lightower D,etal. Efficacy of rectal tacrolimus for induction therapy in patients with resistant ulcerative proctitis[J]. Clinical Gastroenterology & Hepatology the official Clinical Practice Journal of the American Gastroenterological Association, 2017,13(6):258-160.
[9] 李 毅, 刘 艳, 许永攀,等. 康复新液联合美沙拉嗪治疗溃疡性结肠炎的疗效及对血清炎性因子和T淋巴细胞亚群水平的影响[J]. 华西药学杂志, 2017, 32(1):111-112.
[10] Bosworth BP, Sandborn WJ, Rubin DT,etal. Baseline oral 5-ASA use and efficacy and safety of budesonide foam in patients with ulcerative proctitis and ulcerative proctosigmoiditis: Analysis of 2 phase 3 studies[J]. Inflammatory Bowel Diseases, 2016, 22(8):1881.
[11] Yamamoto T, Shimoyama T, Matsumoto K. Consecutive monitoring of faecal calprotectin during mesalazine suppository therapy for active rectal inflammation in ulcerative colitis[J]. Alimentary Pharmacology & Therapeutics, 2015, 42(5):549-558.
[12] 郑莲莲. 甘草泻心汤联合美沙拉嗪对溃疡性结肠炎患者血清炎症因子水平的影响及疗效观察[J]. 中国中西医结合消化杂志, 2015,(10):687-689.
[13] 李晓玲. 美沙拉秦不同给药途径治疗活动期溃疡性结肠炎的疗效及对血清炎性因子的影响[J]. 河北医学, 2016, 22(10):1595-1597.
(收稿:2017-07-05)
直肠炎/药物疗法 溃疡 氨基水杨酸类/治疗应用 @薁磺酸病 炎症介导素类/分析
R574.6
A
10.3969/j.issn.1000-7377.2018.03.036

