基于光纤氧气传感器的细胞培养氧分压测试实验
刘建斌,王诚诚,樊慧英,李 海,杨初平,曾应新,徐初东,陈荣声,2
(1.华南农业大学 a.电子工程学院;b.兽医学院,广东 广州 510642;2. Nuffield Department of Clinical Neurosciences, University of Oxford, Oxford OX3 9DU, UK)
一般情况下,细胞培养是把传代好的细胞放入培养瓶或培养皿中,然后把培养瓶或培养皿放入设置好温度和二氧化碳体积分数的培养箱中进行培养. 由于细胞在代谢过程中需要消耗氧气,有氧气交换过程,因此培养瓶或培养皿的盖子不能拧紧. 在培养液中氧的体积分数和空气中的氧的体积分数处于平衡状态下,细胞的生存、繁殖、变异会受培养液中的氧分压的影响[1-6]. 在平衡态下,气相中氧气的体积分数21%对应液相中氧分压21kPa. 然而,在实际的细胞培养中,培养液中的氧分压尽管接近21kPa,但是也要受到2个因素的影响:其一是媒质给细胞的供氧能力;其二是细胞的耗氧能力. 通常情况下,在培养细胞时,不会考虑培养液中的氧分压,因为,在培养过程中会给细胞提供足够的氧. 但是,在某些情况下,比如活体干细胞的培养和移植过程中,干细胞的生长对氧分压非常敏感,2008年SimonandKeith以及Lin等研究表明,干细胞适于在低氧分压环境下生存. 在低氧环境下,通过改变氧分压的值,可以修改干细胞的外型[7-8]. 因此,一些研究者认为,细胞周围的氧分压是能够反映细胞的功能状态(包括细胞分化、生长、线粒体的能量代谢)的重要因素之一[3]. 因此,对细胞培养过程中的氧分压进行监测具有重要的意义.
活体外的氧分压监测的标准方法为Clarke-type电极法[5-6]:电极法的传感器由电解液以及处于其中的阴极和阳极组成,电解液由外层能够渗透氧气的膜包围. 当氧气通过薄膜和电解液扩散到达阴极时,阴极附近的氢氧根离子会减少. 阴极提供电子给氧分子,同时在阴极和阳极间的电流与样品的氧分压成正比. 由于电极本身消耗氧气,因此电极法测得的氧分压值将低于实际值. 在Pettersen等的研究中[9],用微电极监测静态条件下的细胞培养的氧分压,测量发现细胞周围的氧含量和环境空气中的氧含量有显著差别. 另一方法是使用氧敏感的荧光体溶解在介质中测量氧分压[1],但是敏感的荧光团可能对细胞有毒性. 以上传感方法存在缺点(如费用高、有限的使用寿命、响应时间长等),不适合持续监测细胞培养过程中的氧分压变化. 因为电化学传感器本身消耗氧气,再者溶氧敏感荧光团的组织培养需要远离培养箱才能读取有用的信息. 为了克服这些缺点,基于荧光淬灭的氧传感器为测量活体外氧分压提供了另一种选择[10-12]. 有研究报道,把柔性的传感器放到细胞培养瓶中监测氧分压值[13],但是大体积的光学系统很难放入传统的细胞培养箱中.
本文介绍将光纤氧气传感器用于监测培养液中细胞的氧分压的实验方法. 以含铂金Pt(Ⅱ)的复合物,Platinum-Octaethyl-Porphyrin(PtOEP),作为氧传感发光材料,以聚乙烯(甲基丙烯酸乙酯,PEMA)作为基体固定发光体. 把氧传感发光材料涂覆在圆柱形光纤的抛光面上,光纤后端有光纤分接头,可以与LED激发光源和计算机处理系统相连,这样就组成了基于光纤氧传感器的细胞培养氧分压的监测系统. 该系统可以测量液相中的氧分压变化,实验结果表明:细胞密度越高,处于空气环境的培养液中的氧分压越低.
1 原理与方法
1.1 原理
光纤氧气传感器的基本原理是基于氧气的荧光淬灭. 在动态的淬灭过程中,发光强度和发光寿命都与氧气的体积分数有关,而且满足Stern-Volmer[14]关系:

1.2 光纤氧气传感器
1.2.1 高分子材料
为了获得传感器的最佳性能,预先研究了不同聚合物基体材料对传感器的敏感度和响应时间的影响[15]. 使用甲基丙烯酸甲酯(PMMA)、甲基丙烯酸乙酯(PEMA)和甲基丙烯酸丙酯(PPMA)作为基体固定铂金Pt(II)复合物. 实验研究结果表明:以PEMA为基体的传感器在敏感度和信噪比方面要优于PMMA和PPMA. 此外,还测试了CO2分压对PEMA传感器的敏感度和响应时间的影响. 实验结果表明:把传感器分别放在CO2分压为0和5 kPa的水中,看不到CO2分压对PEMA传感器的敏感度和响应时间有任何影响[8]. 因此,选定高分子材料PEMA作为基体固定发光体.
1.2.2 传感器的制作
在传感器制作中,PtOEP和PEMA分别作为发光体和基体材料,使用二氯甲烷作为溶剂溶解发光体和基体材料. 混合液的配制:1 mg PtOEP,100 mg PEMA,1 mL二氯甲烷. 把配比好的混合液放到1.5 mL的玻璃瓶中,用聚丙烯盖子盖好. 搅动玻璃瓶确保PEMA和PtOEP充分溶解在溶剂中. 去掉单模多模石英光纤的端截面处的氟化聚合物包覆层,然后用异丙醇清洁和裂解,接着浸渍在10 mL的PEMA和PtOEP的混合液中以形成传感头. 光纤的规格是:无水光纤(Low OH),高数值孔径0.43,长2.5 m,芯径200 μm. 传感头放到空气中干燥至少24 h.
1.2.3 传感器的稳定性
传感器系统包括海洋光学公司提供的LED光源和接收系统,以及自制的传感头. 光纤传感器产品的稳定性测试是通过连续测量光传感元件的发光寿命在室内空气环境中要超过100 h. 图1所示为117 h荧光寿命的测量数据,结果表明该传感器的性能稳定,在117 h内发光寿命的变化小于0.65 μs.
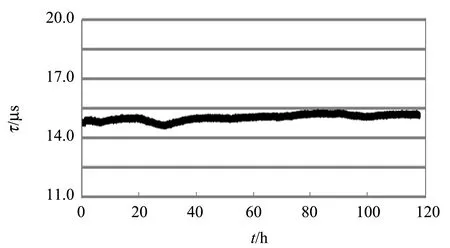
图1 传感器随时间的稳定性测试图
1.3 细胞培养
实验使用猪肾细胞(PK-15). 先把传代好的细胞放到培养液中,再放入温度为37 ℃、CO2的体积分数为5%的培养箱中进行培养. 当培养瓶中的细胞长满70%~80%时(一般2~3 d),就要进行细胞传代. 当细胞长满90%~100%时即可进行实验.
准备5个培养瓶,分别滴入0,1,2,3,4 mL的细胞培养液,然后,加入消化液使每个培养瓶的体积都是5 mL. 接着将5个细胞培养瓶放入培养箱2 h,准备进行测试.
2 实验与结果
2.1 传感器定标
使用发光相位检测系统在液体测试瓶中进行定标. 定标过程中,水可以作为液体定标的参考介质. 把光纤氧气传感端伸入37 ℃充满O2和N2的混合气体的液体测试瓶中. O2和N2的混合体积比例是0/100,2/98,5/95,15/85,21/79,40/60,分别对应测试液体的氧分压为0,2,5,15,21,40 kPa.
定标曲线如图2所示,图2显示了用光纤氧气传感器测试的37 ℃测试液中发光寿命随氧分压变化的情况.
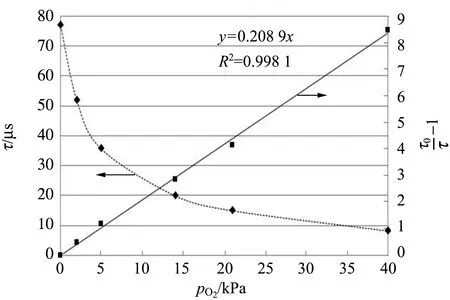
图2 37 ℃下荧光寿命随氧分压变化曲线及荧光寿命随氧分压变化响应曲线
2.2 细胞培养氧分压测试
图3是实验装置示意图,LED光源是美国海洋公司(OCEAN OPTICS)生产的NeFox荧光探测器.
在细胞培养的实验室进行细胞培养氧分压测试实验. 实验中光纤氧气传感器的传感头放置在细胞培养瓶的固定位置,并且靠近培养瓶的底部. 5个不同细胞密度的培养瓶分别放置在有玻璃罩的环境温度为37 ℃的实验平台上(该实验平台具有杀菌和消毒功能). 每个培养瓶中的氧分压使用发光相位测量系统(NeroFox)进行测量,测量数据记录在电脑里. 在每个培养瓶的底部附近测量了几个数据点,得到每组数据的测量平均值为氧分压值.
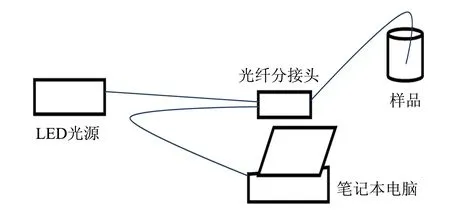
图3 实验装置示意图
图4显示了不同时间的5个不同细胞密度的氧分压数据记录结果. 记录过程中,先测量细胞密度比较小的培养瓶,再依次测量细胞密度大的培养瓶. 细胞密度的大小可以在细胞培养过程中,通过传代细胞实现. 从图4中可以看出,随着细胞密度的增加,细胞消耗的氧增加,从而使氧分压降低.
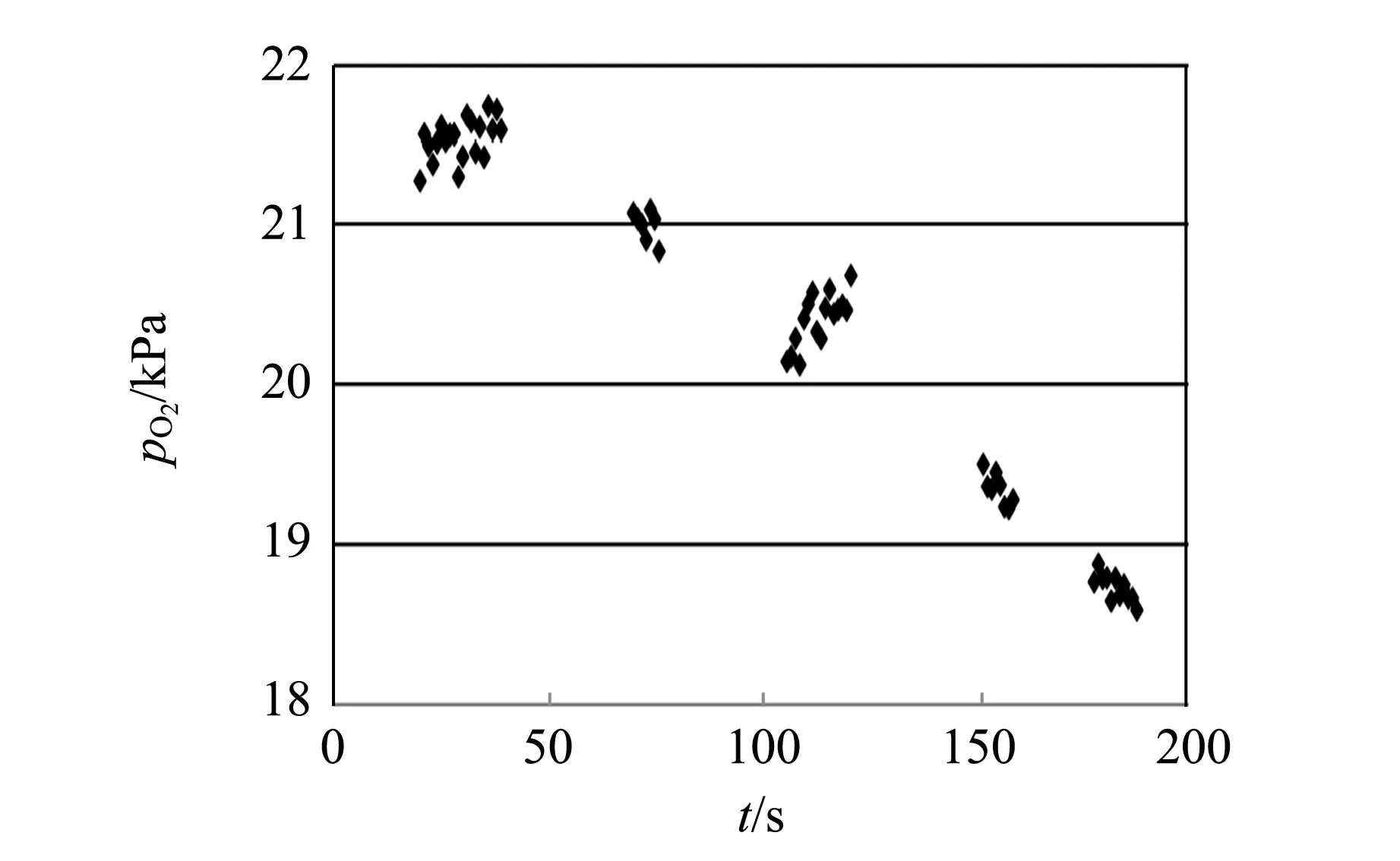
图4 不同PK-15的细胞密度下氧分压随时间变化情况
2.3 细胞计数
测量5个细胞培养液样品的氧分压后,使用1 mL 0.25%胰蛋白酶消化这些细胞样品约5 min,然后在5 mL细胞培养基(DMEM)中重新悬浮培养. 取大约20 μL的细胞悬液用于细胞计数系统进行计数. 计数系统的仪器型号是Counter Star System,该系统可以很好地估计出5个培养液中细胞的数量. 表1为使用光纤氧气传感器测量的氧分压值和在每个细胞培养瓶中的PK-15细胞密度.

表1 氧分压值和在每个细胞培养瓶中的PK-15细胞密度
3 结 论
以PK-15细胞为实验样品,对细胞周围的氧分压值进行了测试. 实验结果表明:随着细胞密度的增高,测得的氧分压的数据越小. 通过与细胞计数的结果进行对比,也实验证明了光纤氧气传感器能够对培养液中细胞周围的氧分压进行监测,细胞培养中液相中的氧分压水平不仅依赖于细胞培养环境气相中的氧分压,而且也依赖于细胞的密度和细胞代谢. 因此在细胞培养过程中需要监视和控制氧分压水平,以维持在一般生理条件下的细胞培养,并且使实验条件具有可复制性和可比性.
参考文献:
[1] Swartz H M. On tissue oxygen and hypoxia [J]. Antiviral Therapy, 2007,12(2):1111-1113.
[2] Demas J N, Degraff B A, Coleman P B. Oxygen sensors based on luminescence quenching [J]. Anal. Chem., 1999,71(23):793A-800A.
[3] Weiszenstein M, Pavlikova N, Elkalaf M, et al. The effect of pericellular oxygen levels on proteomic profile and lipogenesis in 3T3-L1 differentiated preadipocytes cultured on gas-permeable cultureware [J]. Plos One, 2016,11(3):e0152382.
[4] Clark L C Jr, Lyons C. Electrode systems for continuous monitoring in cardiovascular surgery [J]. Ann. N. Y. Acad. Sci., 1962,102(1):29-45.
[5] Hahn C E. Electrochemical analysis of clinical blood-gases gases and vapours [J]. Analyst, 1996,123(6):57R-86R.
[6] Oqino H, Asakura K. Development of a highly sensitive galvanic cell oxygen sensor [J]. Talata, 1995,42(2):305-310.
[7] Lin Q, Kim Y, Alarcon R M, et al. Oxygen and cell fate decisions [J]. Gene Regul. Syst. Biol., 2008,2(2):43-51.
[8] Simon M C, Keith B. The role of oxygen availability in embryonic development and stem cell function [J]. Nat. Rev. Mol. Cell Biol., 2008,9(4):285-296.
[9] Pettersen E O, Larsen L H, Ramsing N B, et al. Pericellular oxygen depletion during ordinary tissue culturing, measured with oxygen microsensors [J]. Cell Proliferation, 2005,38(4):257-267.
[10] Chen R S, Farmery A D, Obeid A, et al. A cylindrical-core fibre-optic oxygen sensor based on fluorescence quenching of a platinum complex immobilized in a polymer matrix [J]. IEEE Sensors Journal, 2012,12(1):71-75.
[11] Sharma A, Wolfbeis O S. Unusually efficient quenching of the fluorescence of an energy transfer-based optical sensor for oxygen [J]. Anal. Chim. Acta, 1998,212(1/2):261-265.
[12] Choi M M F, Xiao D. Linear calibration function of luminescence quenching-based optical sensor for trace oxygen analysis [J]. Analyst, 1999,124(5):695-698.
[13] Chen R, Hahn C E, Farmery A D. A flowing liquid test system for assessing the linearity and time-response of rapid fibre optic oxygen partial pressure sensors [J]. Respiratory Physiology & Neurobiology, 2012,183(2):100-107.
[14] Kojima M, Takehara H, Akagi T, et al. Flexible sheet-type sensor for noninvasive measurement of cellular oxygen metabolism on a culture dish [J]. Plos One, 2015,10(12):e0143774.
[15] Chen R, Formenti F, McPeake H, et al. Experimental investigation of the effect of polymer matrices on polymer fibre optic oxygen sensors and their time response characteristics using a vacuum testing chamber and a liquid flow apparatus [J]. Sensors and Actuators B Chemical, 2016,222(169):531-535.

