氯沙坦对百草枯中毒致大鼠急性肾损伤的保护作用
喻 莉 ,张剑锋 ,李 霁 ,叶 喆
百草枯是一种有效且广泛应用于农业的触灭型除草剂,其中毒易导致多组织器官衰竭,最为常见的靶器官为肺脏和肾脏,其中约50%的中毒患者出现急性肾损伤(acute kidney injury,AKI)[1]。如何防治百草枯中毒导致的AKI是当前研究的热点和难点之一。笔者所在课题组前期研究发现,百草枯肾损伤后出现核因子κB(nuclear factor κB,NF-κB)和白介素-6(interleukin-6,IL-6)升高[2],证实过度炎性反应参与了百草枯肾损伤。文献[3]研究表明,血管紧张素Ⅱ受体拮抗剂氯沙坦,可降低炎性因子的表达,从而保护内皮细胞免受损伤。氯沙坦是否对百草枯中毒致AKI具有保护作用,目前尚无相关报道。本研究拟建立百草枯灌胃诱导大鼠AKI模型,观察应用氯沙坦干预后,对肾组织肿瘤坏死因子 -α(tumor necrosis factor-α,TNF-α)、IL-6及NF-κB蛋白表达的影响,以探究氯沙坦对百草枯中毒大鼠AKI的作用机制。
1 材料与方法
1.1 实验动物 健康成年雄性斯泼累格·多雷(Sprague-Dawley,SD)大鼠54只,无特定病原体(specific pathogen free,SPF)级,体质量 200~250 g,由广西医科大学动物中心提供,动物使用许可证:SYXK桂2014-0003。饲养温度(20±2) ℃,自由进水,普通饲料喂养。
1.2 主要试剂、药品和仪器 二氯百草枯结晶体(Sigma公司,美国),氯沙坦钾片(默沙东公司,美国),兔抗大鼠NF-κB抗体(CST公司,美国),兔抗大鼠IL-6抗体(abcam公司,美国),兔抗大鼠TNF-α抗体(GeneTeX公司,美国),辣根过氧化物酶山羊抗兔IgG(Milipore公司,美国)。病理图像分析系统(Leica 公司,德国)。
1.3 方法
1.3.1 模型制作与分组 将54只大鼠按照随机数字法分成3组,其中生理盐水对照组(NS组)18只,百草枯模型组(PQ组)18只,氯沙坦干预组(LT组)18只。PQ组和LT组均给予100 mg/kg的百草枯一次性灌胃;NS组给予大鼠与百草枯等量的生理盐水灌胃。LT组在灌胃后立即给予60 mg/kg的氯沙坦继续灌胃,并每24 h重复给予氯沙坦一次,分别于灌胃后1 d、3 d、7 d后处死并留取标本,本实验动物处置方法符合动物伦理学标准。
1.3.2 标本采集 10%水合氯醛以0.03 ml/kg进行腹腔注射麻醉,4%多聚甲醛固定左肾48 h,脱水、浸蜡、包埋、切片,行苏木精-伊红染色(hematoxylin-eosin staining,HE)、免疫组织化学染色。
1.3.3 肾组织形态学观察 取左肾组织经固定、脱水、透明及包埋后切片、HE染色,树脂封片,光镜下观察肾脏组织病理学改变[4]。AKI造模成功评定标准为光镜下观察肾组织病理出现典型的急性肾小管坏死。
1.3.4 免疫组织化学染色观察 采用免疫组织化学法评估肾组织TNF-α、IL-6及NF-κB蛋白的表达,依次通过切片、脱蜡、水化、抗原修复后,加血清封闭液孵育,滴加一抗(NF-κB抗体1∶800,TNF-α抗体1∶400,IL-6抗体1∶500)过夜,磷酸盐缓冲液(phosphate buffered saline,PBS)冲洗,加入二抗孵育,PBS冲洗,二氨基联苯胺(diaminobenzidine,DAB)显色肉眼看到棕色立即终止染色,透明及封片,光学显微镜下观察阳性细胞,每张切片在400倍镜下随机选择5个视野计数,取其平均值并做统计判断。
1.4 统计学处理 应用SPSS 20.0统计学软件进行统计学分析,正态分布计量资料以表示,不同时间点TNF-α、IL-6及NF-κB水平比较采用重复测量方差分析,两两比较采用LSD-t检验,以双侧P<0.05为差异具有统计学意义。
2 结 果
2.1 大鼠基本情况 NS组大鼠表现为:食欲、呼吸正常,精神状况良好,行动灵活。PQ组大鼠多在染毒后2 h内即可出现中毒症状,表现为倦怠、烦躁、进食进水量不同程度减少、口鼻见血性分泌物、毛发蓬松,动作迟缓易捕捉等。LT组大鼠也出现上述中毒反应,但较PQ组轻。
2.2 肾组织形态学观察 NS组光镜下观察可见肾小管、肾小球结构清晰,肾间质及血管周围无充血、无炎性细胞浸润(图1A、图1D)。PQ组于染毒后2 h内即可观察到肾间质不同程度充血、水肿,可伴炎性细胞浸润,肾小球内开始出现红细胞增多;中毒后第3天可观察到肾小管上皮细胞大片空泡样变性、炎性细胞浸润,肾小球内也可见淋巴细胞浸润,管腔轻度狭窄,偶出现上皮细胞脱落坏死(图1B);第7天肾小管空泡样变性较第3天组稍减少,炎性细胞浸润,出现部分脱落坏死细胞,管腔狭窄(图1E)。LT组用药干预后第1天、第3天(图1C)仍有不同程度充血水肿、炎性细胞浸润及肾小管空泡样变性,但较PQ组轻;干预后第7天肾上皮细胞轻度水肿,脱落细胞数减少,肾小管轻度空泡样变性,部分淋巴细胞浸润(图1F)。
2.3 TNF-α、IL-6及NF-κB免疫组化

图1 大鼠肾组织结构变化(HE,×200)
2.3.1 大鼠肾组织NF-κB蛋白表达 重复测量分析结果显示,重复测量数据的方差协方差矩阵满足H型条件(P=0.736)。不同时间点的大鼠NF-κB蛋白表达量均值之间差异有统计学意义(F=8.551,P=0.001),分组与时间有交互作用(F=22.740,P<0.001)。组间比较:PQ组和LT组各时间点大鼠NF-κB表达均高于NS组(P<0.05);LT组与PQ组比较, NF-κB在第1天无明显差异,但在第3天LT组明显降低并持续至第7天(P<0.05)。组内比较:NS组各时间点NF-κB蛋白表达水平差异无统计学意义(F=1.429,P=0.270);PQ组大鼠NF-κB表达至第3天达高峰,随后逐渐下降;LT组3 d间差异均有统计学意义。见表1、图2。
2.3.2 大鼠肾组织TNF-α蛋白表达 重复测量分析结果显示,重复测量数据的方差协方差矩阵满足H型条件(P=0.101)。不同时间点的大鼠TNF-α蛋白表达量均值之间差异有统计学意义(F=12.193,P<0.001),分组与时间有交互作用(F=21.335,P<0.001)。组间比较:PQ组和LT组各时间点大鼠TNF-α表达均高于NS组(P<0.05);LT组与PQ组比较,TNF-α在第1天无明显差异,但在第3天LT组明显降低并持续至第7天(P<0.05)。组内比较:NS组各时间点TNF-α蛋白表达水平比较,差异均无统计学意义(F=0.012,P=0.989);PQ组大鼠TNF-α表达至第3天达高峰,随后逐渐下降;LT组3 d间差异均有统计学意义。见表1、图3。
2.3.3 大鼠肾组织IL-6蛋白表达 重复测量分析结果显示,重复测量数据的方差协方差矩阵满足H型条件(P=0.695)。不同时间点的大鼠IL-6蛋白表达量均值之间差异有统计学意义(F=53.419,P<0.001),分组与时间有交互作用(F=13.573,P<0.001)。组间比较:PQ组和LT组各时间点大鼠IL-6表达均高于NS组(P<0.05); LT组各时间点IL-6蛋白表达水平均低于PQ组,差异有统计学意义(P<0.05)。组内比较:NS组各时间点IL-6蛋白表达水平比较,差异均无统计学意义(F=1.662,P=0.223),PQ组大鼠IL-6在第1天表达即明显升高,后缓慢下降;LT组3 d间差异均有统计学意义。见表1、图4。
表1 各组大鼠 NF-κB 、TNF-α与IL-6蛋白表达水平比较

表1 各组大鼠 NF-κB 、TNF-α与IL-6蛋白表达水平比较
注:NF-κB,核因子κB;TNF-α,肿瘤坏死因子-α;IL-6,白介素-6;NS组为生理盐水对照组;PQ组为百草枯模型组;LT组为氯沙坦干预组;与NS组同时间点比较,①P<0.05;与PQ组同时间点比较,②P<0.05;与同组第1天比较,③P<0.05;与同组第3天比较,④P<0.05
指标 只数 NS组 PQ组 LT组NF-κB第1天 6 5.67±3.67 70.00±9.48① 70.83±13.57①第3天 6 3.50±1.76 95.83±4.91①③ 51.67±16.33①②③第7天 6 6.33±3.32 84.17±6.64① 29.17±5.84①②③TNF-α第1天 6 3.50±2.07 71.67±12.11① 78.33±8.16①第3天 6 3.50±2.51 95.00±3.16①③ 63.33±16.33①②③第7天 6 3.67±1.96 85.00±6.32① 40.67±35.09①②③④IL-6第1天 6 4.50±2.34 94.17±5.84① 64.17±4.91①②第3天 6 2.83±1.47 85.83±3.76①③ 50.83±8.01①②③第7天 6 2.67±1.86 73.33±8.75① 29.17±3.76①②③④

图2 大鼠肾脏NF-κB蛋白质表达水平(IHC,×400)
3 讨 论
急性百草枯中毒易导致多个器官功能损伤,主要的靶器官之一是肾脏。肾脏是人体最大、最主要的排泄器官,百草枯中毒后,大部分毒物通过肾脏排泄,其余部分则重吸收进入血液循环,通过肾脏的二次排泄清除,如此循环,对肾脏造成严重损伤,而肾损伤又是影响百草枯中毒患者预后的重要因素之一[5]。百草枯中毒造成的肾脏损伤包括早期的炎性细胞大量浸润,肾小管上皮细胞充血水肿至肾小管脱落坏死,严重时可致急性肾功能坏死,进而造成不可逆性损伤,最终导致肾衰竭。但是其具体机制尚未完全阐明,细胞凋亡、氧自由基损伤、炎性因子及细胞因子的网络激活、肾脏血流动力学改变及毒物本身的影响等诸多因素均可能参与其中,而过度炎性反应与氧化应激可能占据重要地位[6]。
本实验以100 mg/kg百草枯的剂量一次性经口灌胃建立急性百草枯中毒大鼠模型。染毒后,PQ组大鼠肾脏组织中TNF-α、IL-6及NF-κB蛋白表达显著升高,其中TNF-α、NF-κB的蛋白表达量均在第3天达到峰值,并且伴随炎性因子的表达升高,肾组织病理损伤加重,出现大片的空泡变性、坏死。而后缓慢下降,至第7天大鼠肾组织TNF-α、IL-6及NF-κB蛋白表达量仍高于正常生理盐水对照组。提示IL-6、TNF-α、NF-κB三者均参与百草枯致肾损伤的过程,其中IL-6表达水平与炎性损伤程度呈正相关。

图3 大鼠肾脏TNF-α蛋白质表达水平 (IHC,×400)
有研究者发现,NF-κB家族是由多个具有高度同源性的多肽组合而成的,其中包括5个亚单位:p65、c-Rel、p525、p50和 RelB[7]。在静息状态下,主要以无活性复合体的潜在状态形式存在于胞浆中。当病毒感染、脱氧核糖核酸(deoxyribonucleic acid,DNA)受损及TNF-α等外界因素刺激后,IκB激酶复合体自身活化将IκB磷酸化而后被泛素-蛋白酶体系统(ubiquitinproteasome system, UPS)所降解,暴露出NF-κB亚基上的转运信号和DNA位点,进而使游离的NF-κB核内移,与靶基因NF-κB结合位点紧密结合,进一步诱导靶基因信使核糖核酸(message ribonucleic acid,mRNA)及相应蛋白质的迅速合成及分泌[8]。NF-κB作为一种多效转录因子,在基因层面启动包括TNF-α、IL-6、IL-8等炎性因子和炎性介质的表达,参与细胞免疫应答、抗感染、组织损伤修复和局部组织炎性反应等不同的病理生理全过程。TNF-α是由活化的单核-吞噬细胞产生并分泌,是百草枯中毒致急性炎性反应的始动因子和枢纽因子,通过激活NF-κB与其他细胞因子构成复杂的细胞因子网络,发生一系列的连锁反应,引起全身炎性反应综合征,对肾脏产生潜在的损害作用[9]。NF-κB信号通路转导途径又是TNF-α发挥功能的关键通路之一,其发挥作用是通过TNF-α与细胞膜表面的TNF受体发生特异性结合,引起TNF受体死亡蛋白(TNF receptor-associated death domain protein,TRADD)的激活和增加,活化的TRADD又可与TNF受体偶联因子2(TNF receptor-associated factor 2,TRAF2)结合并迅速激活NIK,IκBα发生磷酸化继而激活NF-κB途径,使其继续产生相关连锁反应[10]。研究者们也证实了百草枯中毒导致肾损伤的过程中,肾组织TNF-α浓度随时间的增加而升高,TNF-α的浓度尤其在NF-κB表达后显著升高,且在时间上与肾组织病理损害程度相关[11]。
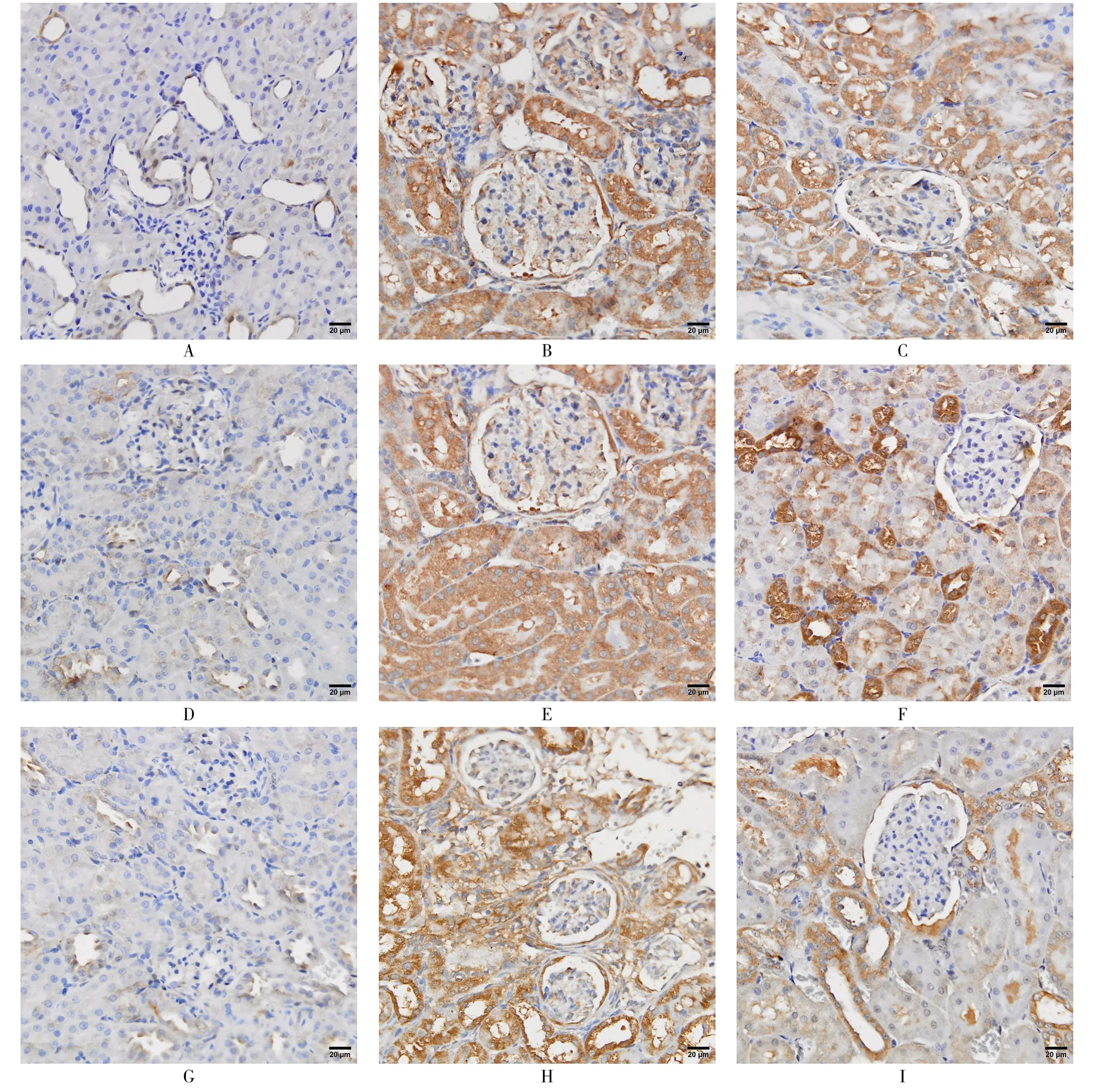
图4 大鼠肾脏IL-6蛋白质表达水平 (IHC,×400)
氯沙坦是血管紧张素Ⅱ1型受体(angiotensinⅡtype1 receptor,AT1R)拮抗剂,可选择性地作用于AT1R,从内源性和外源性两方面阻断血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)所产生的各种不同的生理反应。AngⅡ通过与AT1R结合,参与调控炎性、细胞增生及纤维化等反应,导致血管通透性增加,炎性细胞募集在肾脏,多形核白细胞活化,以及上调黏附分子、趋化因子和细胞因子水平,最终导致肾损害[12,13]。可见,AngⅡ可能与百草枯所致的AKI乃至多脏器功能障碍有关。有学者研究发现氯沙坦可通过阻断AngⅡ介导的球管反馈移动,减弱AngⅡ参与肾的自我调节的次级机制[14],从而增加远端肾单位体积和钠的排出。Milan等[15]发现AT1R拮抗剂氯沙坦可降低高血压患者的肾小管损伤程度,且在高血压患者缺血性急性肾功能衰竭发作期间无特别的肾功能恶化风险。文献[16-18]报道,氯沙坦可通过提高肺组织的抗氧化能力和降低NF-κB mRNA表达从而发挥对肺组织的保护作用。
本研究应用氯沙坦干预百草枯中毒大鼠肾损伤模型,发现肾组织TNF-α、IL-6及NF-κB蛋白表达量较中毒模型组下降,且随时间的推移,下降越明显。氯沙坦1 d干预组的蛋白表达量较中毒模型组下降不明显,3 d、7 d干预组蛋白表达量相对于中毒模型组下降较明显,提示该药物对百草枯中毒致AKI可能具有一定程度的保护作用,但其具体保护作用机制有待进一步研究。
【参考文献】
[1]Kim S J, Gil H W, Yang J O, et al. The clinical features of acute kidney injury in patients withacute paraquat intoxication [J]. Nephrol Dial Transplant, 2009, 24(4):1226-1232. DOI: 10.1093/ndt/gfn615.
[2]张 伟, 张剑锋, 李 浩, 等. 甘草酸二铵对百草枯中毒大鼠肾组织TOLL样受体4表达的影响[J].中华急诊医学杂志, 2015, 24(11): 1210-1215. DOI: 10.3760/cma.j.issn.1671-0282.2015.11.006.
[3]谢启应, 孙泽琳, 陈美芳, 等. 氯沙坦保护ox-LDL诱导的内皮细胞损伤与ADMA的关系[J]. 中南大学学报(医学版), 2006, 31(1): 66-69. DOI: 10.3321/j.issn:1672-7347.2006.01.016.
[4]朱 哲, 王 娜, 赵 敏. 百草枯中毒早期大鼠肾组织中不规则趋化因子的表达[J]. 实用药物与临床, 2017,(1): 1-4. DOI: 10.14053/j,cnki,ppcr.201701001.
[5]许佳俊, 郑建涛, 朱景法. 肿瘤坏死因子-α诱导蛋白6治疗减轻百草枯中毒大鼠AKI [J]. 中华危重病急救医学 , 2014, 26(6): 405-408. DOI: 10.3760/cma.j.issn.2095-4352.2014.06.008.
[6]杨 霞 , 张景鸿 , 陈 威 , 等 . IL-17、RORγt在百草枯中毒小鼠急性肺损伤中的表达[J]. 实用医学杂志,2017, 33(11): 1757-1761. DOI: 10.3969/j.issn.1006-5725.2017.11.010.
[7]陈铁楼, 苏 丹, 许 兵, 等. NF-κB分子生物学特性及其在牙周炎等炎症性疾病中的作用[J]. 口腔医学 , 2010, 30(4): 242-245. DOI: 10.13591/j.cnki.kqyx.2010.04.009.
[8]郭少清. 不同时期和不同亚型偏头痛患者血浆NF-kB和IL-6变化研究[J]. 齐齐哈尔医学院学报,2017, 38(8): 869-871. DOI: 10.3969/j.issn.1002-1256.2017.08.001.
[9]郑 丹, 吴 斌, 卢中秋. 急性百草枯中毒肾损伤机制及治疗进展[J]. 医学研究杂志, 2015, 44(4): 167-169.DOI: 10.11969/j.issn.1673-548X.2015.04.047.
[10]严 明, 陈万涛. NF-κB信号转导通路和肿瘤发生、转移关系的研究进展[J]. 北京口腔医学, 2007, 15(1):53-55. DOI: 10.3969/j.issn.1006-673X.2007.01.021.
[11]时 晔, 樊英华, 尚 亮, 等. 核因子-κB在急性百草枯中毒大鼠肾脏中的表达及其意义[J]. 陕西医学杂志,2013, 42(7): 780-783. DOI: 10.3969/j.issn.1000-7377.2013.07.004.
[12]Ruiz-Ortega M, Ruperez M, Esteban V,et al. AngiotensinⅡ: a key factor in the inflammatory and fibrotic response in kidney diseases [J]. Nephrol Dial Transplant, 2006, 21(1): 16-20. DOI: 10.1093/ndt/gfi265.
[13]Zhang Z, Ruan C, Chen D, et al. Activating transcription factor 3 SUMOylation is involved in angiotensin Ⅱ-induced endothelial cell inflammation and dysfunction [J]. J Mol Cell Cardiol, 2016, 92: 149-157. DOI: 10.1016/j.yjmcc.2016.02.001.
[14]Loutzenhiser R, Griffin K, Williamson G, et al. Renal autoregulation: new perspectives regarding the protective and regulatory roles of the underlying mechanisms [J].Am J Physiol Regul Integr Comp Physiol, 2006, 290(5):R1153-R1167. DOI: 10.1152/ajpregu.00402.2005.
[15]Ivanov M, Mihailović-Stanojević N, Grujić M J, et al.Losartan improved antioxidant defense, renal function and structure of postischemic hypertensive kidney [J].PLoS One, 2014, 9(5): e96353. DOI: 10.1371/journal.pone.0096353.
[16]郭 芳, 孙应彪, 李 盛, 等. 氯沙坦对百草枯急性染毒大鼠肺组织氧化损伤的影响[J]. 中国药理学与毒理学杂志 , 2014, 28(4): 510-514. DOI: 10.3867/j.issn.1000-3002.2014.04.006.
[17]刘 军, 张朋书, 于 涛, 等. 氯沙坦抑制肺树突状细胞活化对小鼠急性肺损伤的保护效应[J]. 中华医学杂志,2014,94(41): 3216-3219. DOI: 10.3760/cma.j.issn.0376-2491.2014.41.004.
[18]管 绯,胡洪磊,李爱凤. 氯沙坦对肺源性心脏病肺通气功能及右室结构的影响[J]. 临床荟萃,2005,20(23): 1367-1368. DOI: 10.3969/j.issn.1004-583X.2005.23.024.

