三阳性乳腺癌与Her-2过表达型乳腺癌预后对比的临床研究
刘海盟,王晓珍,李嗣杰,赵 刚,范廷廷,范志民*
(吉林大学第一医院 1.乳腺外科;2.肾病科,吉林 长春130021)
人类表皮生长因子受体2(Her-2)是与乳腺癌预后有密切关系的癌基因,在20%-30%的乳腺癌中可以检测到该基因的扩增或表达[1,2]。在近50%的Her-2阳性乳腺癌中,雌激素受体(ER)/孕激素受体(PR)和Her-2存在共同表达[3,4]。ER、PR和Her-2均表达的乳腺癌称为三阳性乳腺癌。在临床工作中发现,三阳性乳腺癌虽然可以使用内分泌治疗,但是其预后并没有明显优于Her-2过表达型乳腺癌。近年来研究表明三阳性乳腺癌激素受体(HR)和Her-2介导的信号传导通路存在相互交叉,削弱了内分泌治疗和分子靶向治疗的效果,进而影响了三阳性乳腺癌的预后[5]。本文通过对三阳性与Her-2过表达型乳腺癌预后的比较,分析不同雌孕激素表达水平对曲妥珠单抗获益的影响,评价三阳乳腺癌使用曲妥珠单抗的有效性。
1 资料与方法
1.1一般资料回顾性分析2010年1月—2015年12月吉林大学第一医院乳腺外科收治的3758例原发性乳腺癌患者的临床病理资料,其中符合入组标准者共281例,其中三阳性乳腺癌141例,Her-2过表达型乳腺癌140例。临床病理特征包括年龄、家族史、病理分期、肿瘤大小、淋巴结状况、组织学分级、ER、PR、Ki-67、术后治疗状况等。根据患者复发风险和分子分型制定综合治疗方案,包括手术治疗、化疗、内分泌治疗、分子靶向治疗和放疗。化疗方案一般为TAC、AC-T、TCH或AC-TH;内分泌治疗方案主要为他莫昔芬、芳香化酶抑制剂、他莫昔芬序贯芳香化酶抑制剂、卵巢功能抑制联合芳香化酶抑制剂。分子靶向治疗一般是使用曲妥珠单抗1年。放疗主要根据患者肿瘤大小、腋窝淋巴结状态、是否为保乳手术等视情况而定。
1.2随访情况术后每1年进行一次电话随访,中位随访时间为39个月(4-88个月),失访10人,随访率为96.44%。三阳性乳腺癌组中位随访时间为36个月(5-88个月),Her-2过表达乳腺癌组中位随访时间为40个月(4-86个月)。局部复发是指临床查体、辅助检查、活组织病理学检查证实的治疗侧乳房、区域淋巴结(腋窝、内乳和锁骨上下)复发,远处转移指辅助检查或活组织病理学检查证实有远处转移病灶。无病生存期(DFS)是初次治疗到第1次复发(局部复发、远处转移或对侧乳房发病)的时间间隔,总生存期(OS)是指从确诊之日到不论任何原因的死亡日期或最后随访日期。
1.3统计学分析采用SPSS 24.0软件进行统计分析。生存分析采用Kaplan-Meier法绘制生存曲线,通过Log-rank检验进行组间比较,以P<0.05为差异具有统计学意义。
2 结果
2.1三阳性与Her-2过表达型乳腺癌临床病理特征比较
通过对三阳性和Her-2过表达型乳腺癌临床病理资料比较,两组年龄、肿瘤大小、淋巴结状况、病理分期、组织学分级、Ki-67等预后的重要影响因素无明显差异,临床病理特征基本一致。
2.2三阳性与Her-2过表达型乳腺癌患者的生存分析
三阳性乳腺癌使用曲妥珠单抗组和未使用组复发转移率分别为3.6%、15.3%;Her-2过表达型乳腺癌分别为10%、26.3%。三阳性和Her-2过表达型乳腺癌使用曲妥珠单抗组DFS均明显优于未使用组(P=0.033、P=0.034);虽然两者OS也得到改善,但差异无统计学意义(P=0.521、P=0.397)。见表1。三阳性乳腺癌的OS优于Her-2过表达型乳腺癌(P=0.025),而两者DFS无统计学差异;亚组分析结果显示无论有无使用曲妥珠单抗,三阳性乳腺癌预后优于Her-2过表达型乳腺癌,但两组DFS和OS差异均无统计学意义。见表2。
2.2不同雌孕激素受体表达水平对于三阳性乳腺癌预后的影响
根据不同雌孕激素受体表达水平,比较有无使用曲妥珠单抗对三阳性乳腺癌患者预后的影响。ER、PR均≥50%定义为HR≥50%组,否则为HR<50%组。结果显示:当HR<50%和PR<50%时,三阳性乳腺癌使用曲妥珠单抗组DFS明显优于未使用组,两组差异有统计学意义(P=0.038、P=0.045);而当HR≥50%和PR≥50%时曲妥珠单抗没有明显提高三阳性乳腺癌患者DFS(P=0.7、P=0.616)。见图1-4。
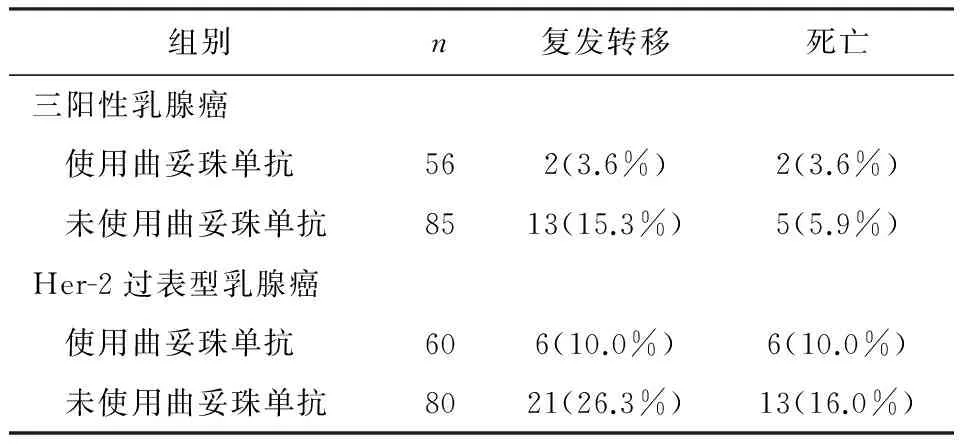
表1 三阳性与Her-2过表达型乳腺癌患者不良事件情况
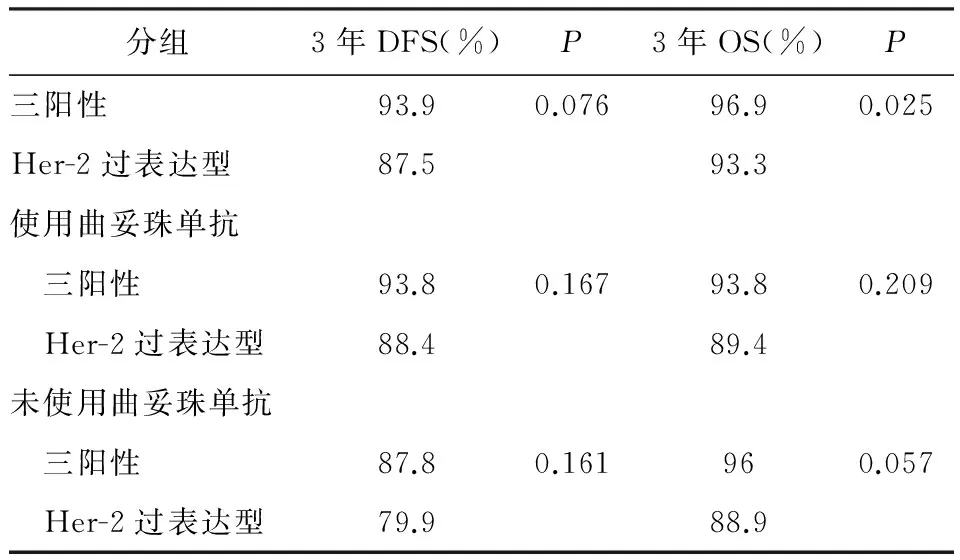
表2 三阳性与Her-2过表达型乳腺癌预后比较
3 讨论
Her-2阳性乳腺癌具有恶性度高、生存期短、预后差等特点[6]。随着分子靶向治疗药物曲妥珠单抗的应用,Her-2阳性乳腺癌患者预后得到明显改善[7]。近年来人们对乳腺癌分子分型的认识不断加深,发现不同分子分型的Her-2阳性乳腺癌曲妥珠单抗获益不同。理论上三阳性乳腺癌预后应明显优于Her-2过表达型乳腺癌,因为前者可以使用内分泌治疗,然而在临床研究中发现三阳乳腺癌并没有达到预期的预后效果。
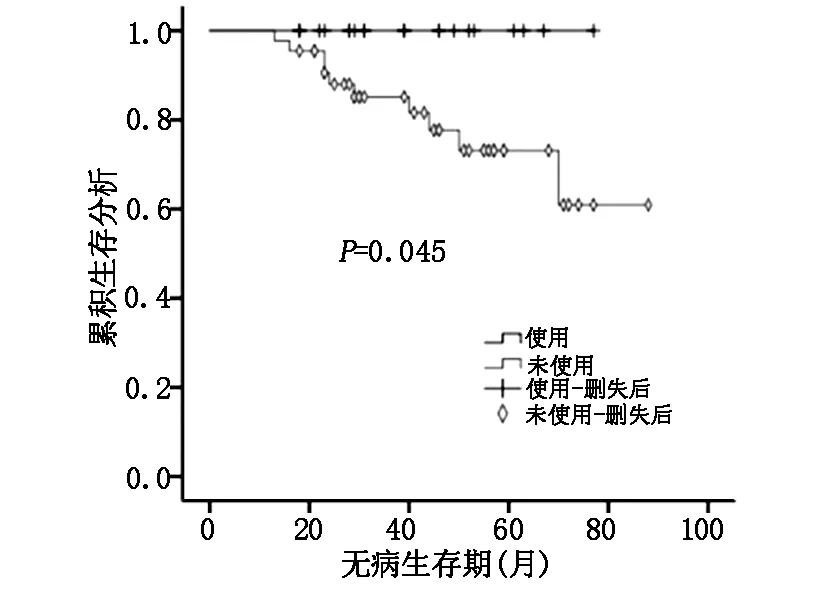
图1 HR<50%,三阳性乳腺癌使用曲妥珠单抗组与未使用组DFS比较
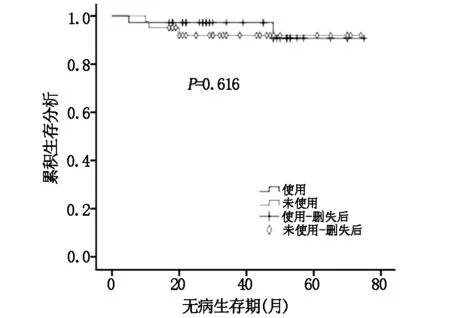
图2 HR≥50%,三阳性乳腺癌使用曲妥珠单抗组与未使用组DFS比较
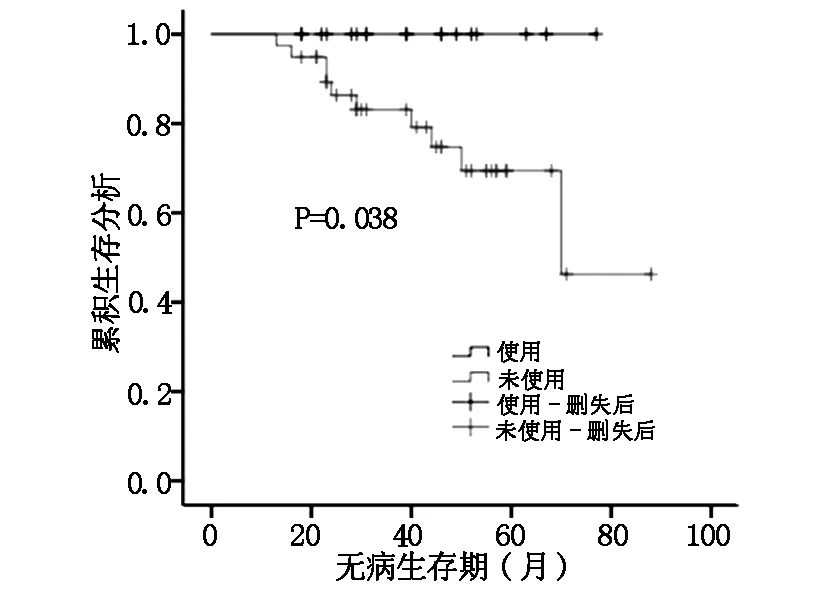
图3 PR<50%,三阳性乳腺癌使用曲妥珠单抗组与未使用组DFS比较
HERA试验表明曲妥珠单抗能明显提高Her-2阳性乳腺癌患者的DFS和OS,但亚组分析显示,HR阳性曲妥珠单抗获益要比HR阴性小,HR阳性乳腺癌实验组和对照组复发转移率分别为10.1%、14.4%(HR 0.68; 95% CI:0.51-0.89),而HR阴性乳腺癌分别15.5% 、23.5%(HR 0.62;95% CI:0.5-0.77)[8]。意大利的一项多中心回顾性研究根据雌孕激素受体表达水平分析了三阳性乳腺癌患者使用曲妥珠单抗与预后的关系。入组872例三阳性乳腺癌患者,其中曲妥珠单抗联合化疗组506例,单纯化疗组366例。研究终点是无复发生存率(RFS)和乳腺癌特异性生存率(BCSS)。中位随访78个月后结果显示在各亚组中曲妥珠单抗均能改善三阳性乳腺癌患者的RFS和BCSS,但对于HR>30%组的BCSS和HR>50%组的RFS,曲妥珠单抗联合化疗和单纯化疗两组差异无统计学意义[9]。本研究也得到相似的结果,三阳性乳腺癌使用曲妥珠单抗组和未使用组复发转移率分别为3.6%、15.3%;Her-2过表达型乳腺癌分别为10%、26.3%,可见三阳性乳腺癌曲妥珠单抗获益相对较小。三阳性乳腺癌使用曲妥珠单抗组DFS优于未使用组(P=0.033),当HR<50%和PR<50%时,曲妥珠单抗能明显改善三阳乳腺癌患者DFS(P=0.038、P=0.045),而当HR≥50%和PR≥50%时,两组差异无统计学意义(P=0.7、P=0.616)。由此可以发现:对于Her-2阳性乳腺癌,HR阳性比HR阴性曲妥珠单抗获益低,HR高表达比HR低表达曲妥珠单抗获益低。
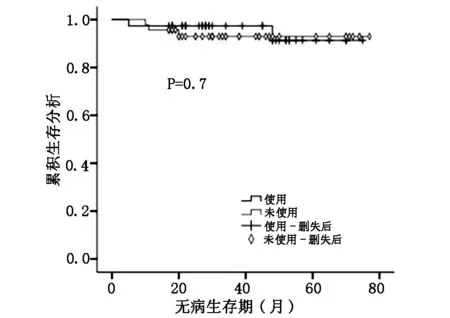
图4 PR≥50%,三阳性乳腺癌使用曲妥珠单抗组与未使用组DFS比较
基础研究表明三阳性乳腺癌HR和Her-2介导的信号传导通路在多个环节上相互交叉,影响了内分泌治疗以及曲妥珠单抗的疗效进而产生交叉耐药现象。Her-2过表达介导PI3K/Akt/mTOR 和 p42/44 MAPK通路的激活,下调ER和PR的表达进而影响内分泌治疗效果;ER与雌二醇或他莫昔芬结合触发EGFR、Her-2、IGFR1及其下游通路,进而促进细胞抗细胞凋亡作用影响分子靶向治疗的效果[10]。
综上所述,三阳性乳腺癌预后优于Her-2过表达型乳腺癌,HR高表达比HR低表达的Her-2阳性乳腺癌曲妥珠单抗获益低,主要机制是HR和Her-2存在相互影响的信号传导通路,影响了内分泌治疗和分子靶向治疗的效果。目前三阳性乳腺癌交叉耐药的程度和具体机制尚不清楚,还需进一步探索。本研究入组例数不足,随访时间尚短,需进一步扩大病例数,延长随访时间,提高结果的客观性。
参考文献:
[1]Vici P,Pizzuti L,Natoli C,et al.Triple positive breast cancer:a distinct subtype?[J].Cancer Treat Rev,2015,41(2):69.
[2]Slamon DJ,Clark GM,Wong SG,et al.Human Breast Cancer Correlation of Relapse and Survival with Amplification of the HER-2neu Oncogene[J].Science,1987,235(4785):177.
[3]Lal P,Tan LK,Chen B.Correlation of HER-2 status with estrogen and progesterone receptors and histologic features in 3655 invasive breast carcinomas[J].Am J Clin Pathol,2005,123(4):541.
[4]Konecny G,Pauletti G,Pegram M,et al.Quantitative association between HER-2/neu and steroid hormone receptors in hormone receptor-positive primary breast cancer[J].J Natl Cancer Inst,2003,95(2):142.
[5]Arpino G,Wiechmann L,Osborne CK,et al.Crosstalk between the estrogen receptor and the HER tyrosine kinase receptor family:molecular mechanism and clinical implications for endocrine therapy resistance [J].Endocr Rev,2008,29(2):217.
[6]Valaehis A,Mauri D,Polyzos NP,et al.Trastuzumah combined to neoadjuvant chemotherapy in patients with HER2-positive breast cancer: A systematic review and metaanalysis[J].Breast,2011,20(6):485.
[7]Demonty G,Bernard-Marty C,Puglisi F,et al.Progress and new standards of care in the management of HER-2 positive breast cancer[J].Eur J Cancer,2007,43 (3):497.
[8]Untch M,Gelber RD,Jackisch C,et al.Estimating the magnitude of trastuzumab effects within patient subgroups in the HERA trial[J].Ann Oncol,2008,19(6):1090.
[9]Vici P,Pizzuti L,Sperduti I,et al.“Triple positive” early breast cancer:an observational multicenter retrospective analysis of outcome[J].Oncotarget,2016,7(14):17932.
[10]Schettini F,Buono G,Cardalesi C,et al.Hormone Receptor/Human Epidermal Growth Factor Receptor 2-positive breast cancer:Where we are now and where we are going[J].Cancer Treat Rev,2016,2016(46):20.

