乳腺导管原位癌超声造影特征的临床研究
袁聪聪,陈 曼
上海交通大学医学院附属瑞金医院超声诊断科,上海 200025
随着影像学技术的进步,乳腺癌得以早期发现和诊断。近20年来,中国女性乳腺导管原位癌(ductal carcinomain situ,DCIS)的发病率成倍增长[1],如何准确检出DCIS,使患者早治疗、早获益值得探讨。DCIS由乳腺导管腔内克隆性增殖的恶性细胞组成,在腔内集聚,但没有超越上皮基底膜侵犯邻近的乳腺基质[2]。62%~98%的DCIS患者早期发现钼靶上的钙化灶,但特异性低,需其他检查或穿刺确诊[3]。MRI相比钼靶灵敏度更高,可检出非钙化性原位癌,DCIS在MRI上多表现为非肿块样强化(60%~81%)[4]。超声造影(contrast-enhanced ultrasound,CEUS)可实时提示更多肿块滋养血管及微循环信息,显示乳腺肿块的微血管结构并鉴别乳腺肿块良恶性[5-7]。有研究发现,DCIS具有较典型的恶性CEUS特征[8]。本研究拟探讨单纯DCIS及DCIS伴浸润性乳腺癌的CEUS特征,为临床更好地早期诊治提供更多依据。
1 资料和方法
1.1 一般资料
2014年7月—2015年5月,上海交通大学医学院附属瑞金医院乳腺疾病诊治中心住院患者在术前行常规超声定位检查,诊断为美国放射协会乳腺影像报告和数据系统(Breast Imaging Reporting and Data System,BI-RADS)4A~4C者行CEUS。这些患者无任何造影禁忌证,造影前已签署知情同意书。根据2012版世界卫生组织(World Health Organization,WHO)乳腺肿瘤分类,手术病理证实14例为单纯DCIS,29例为DCIS伴浸润性乳腺癌。排除标准:① 合并有心脑血管、肝脏及肾脏等严重原发性疾病者;② 术前未做CEUS者;③ 新辅助化疗者;④ 资料不全者。入组的43例患者均为女性,平均年龄53.7岁(32~82岁),其中2例行乳房象限切除术,6例行保乳手术,35例行乳房切除术。本研究严格按照医院伦理学审查机构和协议进行。
1.2 仪器与试剂
超声仪器选用意大利Esaote公司MyLabTM90超声诊断仪,LA523(频率4~13 MHz)探头用于常规超声扫查,LA522(频率3~9 MHz)探头用于CEUS检查。造影剂SonoVue(购自意大利Bracco公司)主要成分为六氟化硫(SF6)微泡。将1支造影剂(剂量为59 mg)加入4.8 mL 0.9%NaCl溶液,剧烈振荡,制成混悬液。
1.3 超声检查方法
造影前对乳腺病灶进行常规超声扫查,记录病灶大小、位置及血流情况,选择合适切面。造影时取造影剂2.4 mL经肘部静脉注射,随后注射5 mL 0.9%NaCl溶液冲管。造影持续时间3 min,记录造影图像[9]。
1.4 造影图像分析方法
14例单纯DCIS(A组)按常规超声表现分为肿块型和非肿块型,从以下5个方面对其CEUS图像进行定性分析[10]:① 灌注顺序;② 灌注强度;③ 灌注边缘;④ 有无灌注区;⑤ 有无周围血管样灌注。所有图像均由两名观察者分别分析,有分歧时由第3名高年资医师判定。
根据日本Matsukuma等[11]的研究,将29例乳腺DCIS伴浸润性乳腺癌患者分为2组,分别为B组(DCIS成分≥20%)和C组(DCIS成分<20%)。按上述定性方法分别对B、C组进行分析。
采用QontraXt软件分析CEUS图像,所分析造影图像为以开始注入造影剂为起始点所截取的1 min图像,感兴趣区为病灶中灌注最强区域。根据时间-强度曲线获得的参数有峰值强度(peak intensity,PI)、达峰时间(time to peak,TTP)、曲线下面积(area under curve,AUC)及上升斜率(ascending slope,AS)。为减小误差,由同一人包裹病灶区域3次,获3次参数值,取均值。此外,将时间-强度曲线分为3种类型:平台型(曲线达到峰值强度后缓慢下降)、尖峰型(曲线达到峰值强度后快速下降)和无灌注型(始终无明显峰值强度出现)。详见图1。

图 1 超声造影时间-强度曲线分型
1.5 统计学处理
定量分析采用SPSS 18.0统计软件,分别对A、B及C组进行两两组间比较,计量资料采用t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 CEUS定性分析
14例单纯DCIS (A组)中,10例常规超声表现为非肿块型(图2),4例为肿块型。在灌注顺序上,13例(92.86%)呈边缘到中央型灌注(9例非肿块型、4例肿块型),1例(7.14%)呈弥散型灌注(为非肿块型);在灌注强度上,11例(78.57%)表现为区域高强度灌注(9例非肿块型、2例肿块型),3例(21.43%)为中/低强度灌注(1例为非肿块型);在灌注边缘上,9例(64.29%)表现为灌注边缘不清晰(7例非肿块型、2例肿块型),5例(35.71%)灌注边缘清晰(3例非肿块型、2例肿块型);在有无无灌注区中,12例(85.71%)未见无灌注区(9例非肿块型、3例肿块型),2例(14.29%)可见无灌注区(1例非肿块型、1例肿块型);在周边血管样灌注方面,9例(64.29%)周边可见粗大血管样灌注(非肿块型5例、肿块型4例),5例(35.71%)周边未见明显血管样灌注(5例均为非肿块型)。详见表1。

图 2 非肿块型单纯DCIS的超声及超声造影表现
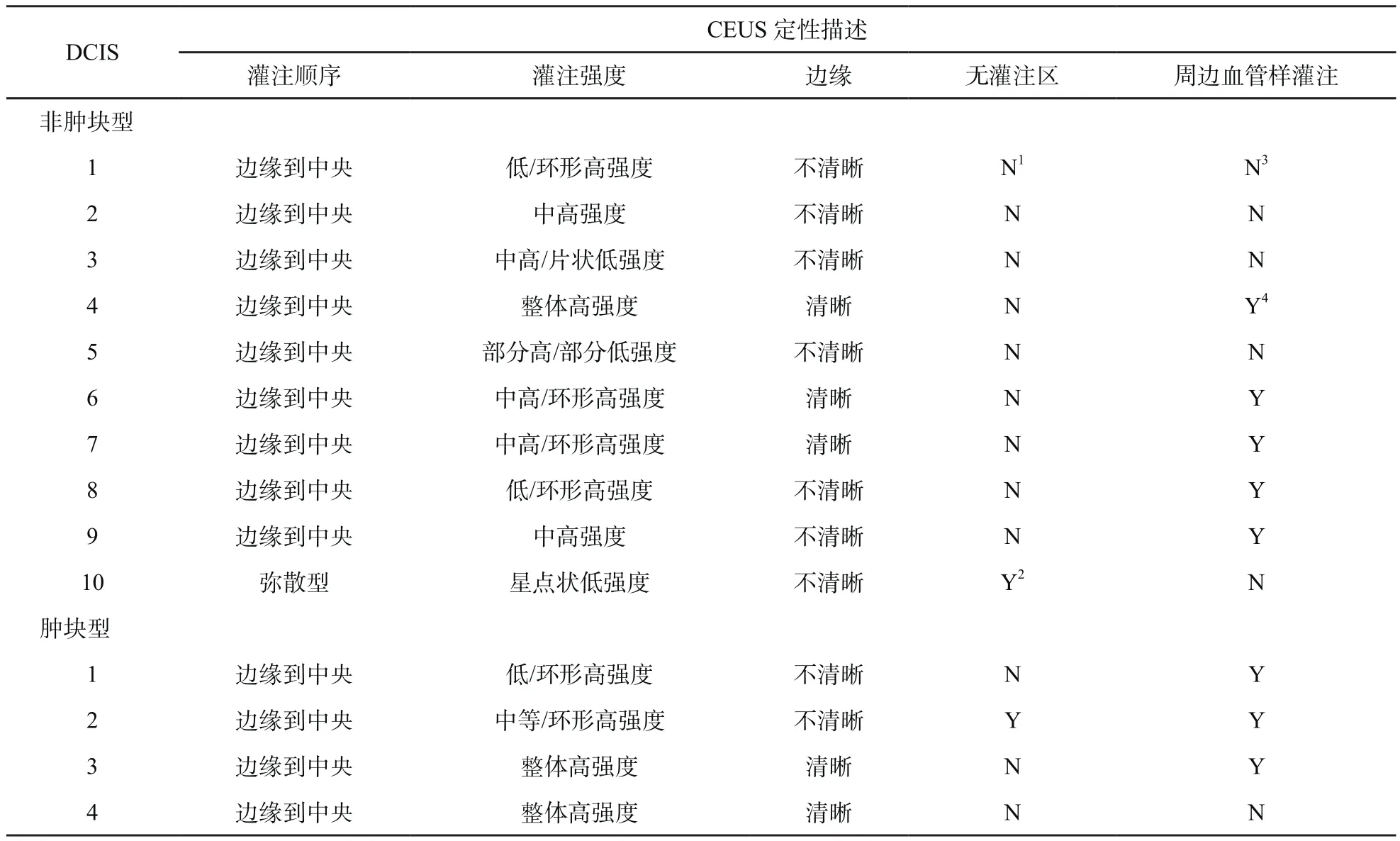
表 1 14例单纯DCIS的CEUS定性分析
29例DCIS伴浸润性乳腺癌病灶中,B组14例,C组15例。在灌注顺序上,20例(68.97%)呈边缘到中央型灌注(B组11例、C组9例),8例(27.59%)呈弥散型灌注(B组3例、C组5例),1例(3.45%)呈中央到边缘型灌注(C组1例);在灌注强度上,14例(48.28%)表现为高强度灌注(B组5例、C组9例),15例(51.72%)为中或低强度灌注(B组9例、C组6例);在灌注边缘上,26例(89.66%)表现为灌注边缘不清晰(B组13例、C组13例),3例(10.34%)表现为灌注边缘清晰(B组1例、C组2例);在有无无灌注区中,24例(82.76%)可见无灌注区(B组13例、C组11例),5例(17.24%)表现为灌注较均匀,未见无灌注区(B组1例、C组4例);在周边血管样灌注方面,18例(62.07%)周边可见粗大血管样灌注(B组9例、C组9例),11例(37.93%)周边未见明显血管样灌注(B组5例、C组6例)。
2.2 CEUS定量分析
CEUS定量分析结果见表2,A组与B组的AUC和AS差异有统计学意义(P=0.016、0.018),A组与C组之间4个定量参数差异均无统计学意义,B组与C组之间AS差异有统计学意义(P=0.037),余参数组差异无统计学意义。
A组中,平台型8例、尖峰型5例、无灌注型1例;B组中,平台型8例、尖峰型4例、无灌注型2例;C组中,平台型6例、尖峰型6例、无灌注型3例(图3)。

表 2 单纯DCIS与DCIS伴浸润性乳腺癌的CEUS定量分析

图 3 A组、B、C组的时间-强度曲线类型分布
3 讨 论
从DCIS到浸润性导管癌是逐渐发展的过程,可出现原位癌与浸润性癌并存的状态,此时浸润性癌与DCIS的生物学行为已发生改变。关于CEUS鉴别乳腺良恶性病灶的研究[6,12]提示,乳腺恶性病灶多表现为高强度灌注,周边可见粗大或蟹足样血管灌注,符合恶性病灶多有丰富滋养血管的病理特征。本研究回顾性探讨单纯DCIS及DCIS伴浸润性乳腺癌在CEUS上的表现,在灌注强度方面,单纯DCIS与DCIS伴浸润性乳腺癌均可表现为高强度灌注模式,但前者较后者更多(78.57%vs48.28%)。分析原因,可能与浸润性癌的病理特征相关[13],其肿瘤细胞生长快速,肿块内部易发生坏死、液化或钙化,加上肿瘤本身存在大量纤维硬化组织,导致病灶内部血供较差,因此,DCIS伴浸润性癌比单纯DCIS更多表现为病灶造影灌注差,甚至表现为星点状低灌注。
DCIS在MRI上多为非肿块样强化,表现多种多样,导管线样强化多具有提示意义[14-15]。尽管CEUS不能像MRI一样多切面断层显示乳腺导管病变特征,但相对于常规超声,CEUS仍可针对可疑非肿块区域给予更多诊断鉴别信息。本研究发现,10例非肿块型DCIS的CEUS多表现为边缘到中央型灌注(9/10,90%),可见高强度灌注区(9/10,90%),边缘不清晰(7/10,70%),未见无灌注区(9/10,90%)。
CEUS定量分析发现,A组比B组的AUC大,AS高,且差异有统计学意义;两组间PI及TTP无显著差异,但A组PI均值比B组高,TTP均值比B组小。一旦肿瘤发生侵袭性变化,侵袭性越高,无灌注型曲线的概率相应提高(A组:1/14,7%;B组:2/14,14%;C组:3/15,20%)。表明随着肿瘤生物学行为改变,其微血管的变化要早于肿瘤形态学改变。在肿瘤从原位癌到浸润性癌的发展过程中,当肿瘤细胞的克隆和血管生成不能满足浸润性癌的快速进展时,肿瘤内发生坏死或液化,此时CEUS上表现为无灌注或低灌注。
综上所述,DCIS在CEUS上具有一定的特征性表现,单纯DCIS多表现为边缘到中央型整体中高强度灌注,大部分可见周边血管样灌注;单纯DCIS较DCIS伴浸润性乳腺癌表现出一定的差异,且其侵袭性越高,无灌注型曲线的概率越大。因此,从肿瘤的血管生成和微血流情况分析,CEUS对DCIS的早期诊断有一定的优势。
[参 考 文 献]
[1] SI W, LI Y, HAN Y, et al. Epidemiological and clinicopathological trends of breast cancer in Chinese patients during 1993 to 2013 [J]. Medicine, 2015, 94(26):e820.
[2] BURSTEIN H J, POLYAK K, WONG J S, et al. Ductal carcinomain situof the breast [J]. N Engl J Med, 2004,350(14): 1430-1441.
[3] RAUCH G M, HOBBS B P, KUERER H M, et al.Microcalcifications in 1 657 patients with pure ductal carcinomain situof the breast: correlation with clinical,histopathologic, biologic features, and local recurrence[J]. Ann Surg Oncol, 2016, 23(2): 482-489.
[4] GREENWOOD H I, HELLER S L, KIM S, et al. Ductal carcinomain situof the breasts: review of MR imaging features [J]. Radiographics, 2013, 33(6): 1569-1588.
[5] STUHRMANN M, ARONIUS R, SCHIETZEL M. Tumor vascularity of breast lesions: potentials and limits of contrastenhanced Doppler sonography [J]. AJR Am J Roentgenol,2000, 175(6): 1585-1589.
[6] ZHAO H, XU R, OUYANG Q, et al. Contrast-enhanced ultrasound is helpful in the differentiation of malignant and benign breast lesions [J]. Eur J Radiol, 2010, 73(2): 288-293.
[7] WANG Y, FAN W, ZHAO S, et al. Qualitative, quantitative and combination score systems in differential diagnosis of breast lesions by contrast-enhanced ultrasound [J]. Eur J Radiol, 2016, 85(1): 48-54.
[8] 许 萍, 王 怡, 胡蓉菲, 等. 实时灰阶超声造影在乳腺导管原位癌诊断中的初步评价 [J]. 中国超声医学杂志,2011, 27(2): 119-122.
[9] ZHANG J X, CAI L S, CHEN L, et al. CEUS helps to rerate small breast tumors of BI-RADS category 3 and category 4[J]. Biomed Res Int, 2014: 572532.
[10] LIU H, JIANG Y X, LIU J B, et al. Evaluation of breast lesions with contrast-enhanced ultrasound using the microvascular imaging technique: initial observations [J].Breast, 2008, 17(5): 532-539.
[11] MATSUKUMA A, ENJOJI M, TOYOSHIMA S. Ductal carcinoma of the breast. An analysis of proportions of intraductal and invasive components [J]. Pathol Res Pract, 1991, 187(1): 62-67.
[12] BALLEYGUIER C, OPOLON P, MATHIEU M C, et al. New potential and applications of contrast-enhanced ultrasound of the breast: Own investigations and review of the literature [J]. Eur J Radiol, 2009, 69(1): 14-23.
[13] HANBY A M. The pathology of breast cancer and the role of the histopathology laboratory [J]. Clin Oncol (R Coll Radiol), 2005, 17(4): 234-239.
[14] MOSSA-BASHA M, FUNDARO G M, SHAH B A, et al.Ductal carcinoma in situ of the breast: MR imaging findings with histopathologic correlation [J]. Radiographics, 2010,30(6): 1673-1687.
[15] 韩 露, 张 伟, 王慧颖, 等. 单纯乳腺导管原位癌(DCIS)MRI特征与HER-2表达及病理核分级的相关性研究[J]. 放射学实践, 2015, 20(6): 643-646.

