常规超声及超声造影在乳腺癌腋窝淋巴结状态评估中的应用
杜丽雯 ,栗翠英 南京医科大学第一附属医院超声诊断科,江苏 南京 210029
淋巴转移和血行转移是乳腺癌的两大主要转移途径,其中淋巴转移大多早于血行转移。腋窝淋巴结状态对乳腺癌患者的治疗及预后至关重要。乳腺癌患者腋窝淋巴结评估可通过传统的腋窝淋巴结清扫,但术后可能出现肩关节活动度降低、上肢水肿及局部感觉障碍等并发症[1]。体格检查评估腋窝淋巴结灵敏度仅有33%~68%[2]。影像学检查可以发现部分临床触诊阴性的淋巴结。常规超声术前评估可用于指导临床。超声检查未见可疑淋巴结时行前哨淋巴结活检,可减少不必要的腋窝淋巴结清扫;超声检查可疑时行细针穿刺,可减少不必要的前哨淋巴结活检,从而降低假阴性率。常规超声联合超声造影评估乳腺癌腋窝淋巴结状态已获得广泛临床认可,但其诊断标准仍有争议[3]。本研究对常规超声及超声造影在腋窝淋巴结状态评估中的应用进行综述。
1 二维超声及彩色多普勒超声检查
根据胸小肌的相对位置,将腋窝淋巴结分为:
Ⅰ区:在胸小肌的外侧,包括乳腺外侧组、中央组、肩胛下组及腋静脉淋巴结;Ⅱ区:胸小肌深面的腋静脉淋巴结及胸大小肌之间的Rotter淋巴结;Ⅲ区:胸小肌内侧锁骨下静脉淋巴结。内乳区淋巴结:内乳区淋巴结可为前哨淋巴结,乳腺内侧肿块应注意扫查内乳区淋巴结[4]。乳腺癌引流淋巴结转移常按较低水平至较高水平有序发生,偶有跳跃转移。
韩峰等[5]研究发现,超声显示腋下组、腋中组及腋上组淋巴结的灵敏度分别为97.8%、77.8%及66.7%,特异度分别为80.0%、100%及97.9%,假阳性率分别为20.0%、0及2.1%,假阴性率分别为2.2%、22.2%及33.3%。乳腺癌腋窝淋巴结转移时,癌细胞首先通过输入淋巴管和包膜下窦,然后侵犯小梁旁窦及髓窦,逐渐侵犯淋巴结实质[6],因此,淋巴结皮质的形态变化更为重要。常规超声诊断腋窝淋巴结转移,关注淋巴结的形态变化及整体回声。良性淋巴结表现为薄且均匀的低回声,皮质厚度<3 mm,淋巴门清晰可见[7]。恶性肿瘤细胞进入淋巴结,引起淋巴结形态变化,体积增大,纵横比降低。恶性淋巴结表现为淋巴结增大,球形,皮质局灶性增厚或弥漫性厚度≥3 mm,淋巴门偏心移位或消失,无淋巴门型血流[8-10]。Nori等[8]诊断可疑淋巴结包括:① 球状形态和(或)纵横比>50%;② 淋巴门脂肪回声消失;③ 皮质偏心性增厚。根据这些指标,常规超声检测腋窝转移性淋巴结的灵敏度、特异度、阳性预测值(positive predictive value,PPV)、阴性预测值(negative predictive value,NPV)和准确率分别为45.2%、86.6%、61.3%、77.2%和73.5%。Bedi等[11]将淋巴结分为5型:
Ⅰ:整体呈高回声,几乎未见淋巴结皮质;Ⅱ:薄而均匀的低回声皮质(<3 mm);Ⅲ:均匀低回声皮质(≥3 mm)和表面有浅分叶;Ⅳ:均匀低回声皮质,表面大分叶;Ⅴ:低回声皮质局部呈分叶状;Ⅵ:淋巴门消失。Ⅰ~Ⅳ型为良性淋巴结,Ⅴ~Ⅵ型为可疑淋巴结。其灵敏度性、特异度、PPV、NPV及准确率分别为77.0%、80.0%、36.0%、96.0%及80.0%。有研究表明,超声表现中皮质局限性增厚和异常淋巴门对应细胞学检查的准确率为81.7%(P<0.05)[10]。Choi等[12]根据淋巴结皮质分为4型:薄且均匀的皮质、向心性皮质增厚、局限性皮质增厚和不规则结节状皮质增厚。转移性淋巴结更多表现为后两种(图1、2)。淋巴门消失预测转移性淋巴结具有低灵敏度、高特异度(94.6%)的特点。多变量分析结果表明,淋巴结皮质厚度≥3 mm是最准确的转移预测因子。皮质厚度≥3 mm比皮质厚度<3 mm的相对风险增加2倍。淋巴门消失比淋巴门存在的转移相对风险增加4倍[12]。辛灵等[13]回顾性分析323例浸润性乳腺癌患者的资料,病理证实腋窝淋巴结转移129例,其中,83例超声检查未见可疑淋巴结,超声检查假阴性率为64.3%,灵敏度为35.6%(46/129),特异度为98.9%(181/183),PPV为95.8%(46/48),NPV为68.6%(181/264)。
超声分辨率直接影响腋窝淋巴结评估的准确性,高频超声探头可对最大径>5.0 mm的淋巴结进行评估。造成常规超声低灵敏度及假阴性率的原因,可能与转移淋巴结的大小、位置及转移个数有关。当转移程度不足以引起淋巴结形态改变时,超声易漏诊[14]。林盈等[15]研究表明,淋巴结转移组与未转移组长径差异无统计学意义,但转移组淋巴结的纵横比及皮髓比的中位数值分别为1.5 (1.0~2.6)及2.0(0.8~4.0),与淋巴结无转移组的1.9(1.0~4.5)及0.5(0.2~2.0)比较差异均有统计学意义(P<0.05)。取淋巴结纵横比<2.0诊断淋巴结转移的灵敏度及特异度分别为45.2%~80.0%及86.6%~94.0%;取淋巴结皮髓比≥1.0诊断淋巴结转移的灵敏度及特异度分别为75.3%及86.4%[7,16-18]。
Na等[19]认为,恶性淋巴结血流多表现为淋巴门型血流偏心或缺如、异常放射状和多灶状血流、周围型血流。Matsuzawa等[20]将淋巴结血管主要分为中央型和边缘型。Yang等[16]将淋巴结血流模式分为淋巴门型、中央型、边缘型及混合型(图3、4)。中央型及淋巴门型血流在良性组(18%、54%)的比例高于恶性组(5%、18%)(P<0.05)。然而,恶性淋巴结常表现为周围型及混合型血流,可能是由于肿瘤的瘤巢取代淋巴结组织,原有的淋巴结血管扭曲或增生转变为异常肿瘤血管。彩色多普勒超声可以为淋巴结诊断提供信息,但仅限于淋巴结的大血管[20]。
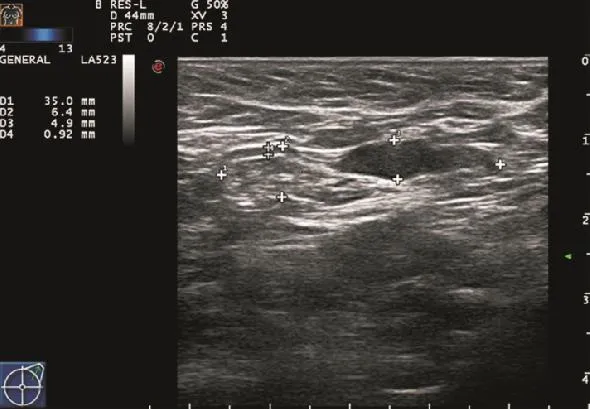
图 1 乳腺癌患者左侧腋窝Ⅰ区转移性淋巴结常规超声声像图

图2 乳腺癌患者右侧腋窝Ⅰ区转移性淋巴结常规超声声像图

图 3 乳腺癌患者左侧腋窝Ⅰ区正常淋巴结彩色多普勒血流图

图4 乳腺癌患者左侧腋窝Ⅰ区转移性淋巴结彩色多普勒血流图
2 超声造影检查
超声造影可以反映组织的微循环灌注,其在腋窝淋巴结中的应用主要包括腋窝淋巴结良恶性评估及前哨淋巴结定位。目前,最常用的超声造影剂是SonoVue及Sonaziod。SonoVue的膜材料由聚乙二醇4000及磷脂组成,微泡内为六氟化硫气体,采用冻干干燥法制得。微泡平均直径2.5 μm,90%的微泡<8 μm,微泡密度为(1.0~5.0)×108个/mL。SonoVue对声压抵抗性好,回声散射强,持续时间长,半衰期为6 min,超过80%的造影剂11 min后由肺呼出。六氟化硫微泡的特点是膜稳定性好,气体溶解性低,在血液中循环时间长,微泡直径均匀一致,可改善低声压模式下的背向散射和谐波信号。Sonaziod为外覆磷脂类、内含全氟丁烷气体的造影微泡,大小相对均匀(3 μm),无毒性,微泡谐波频谱宽,嗜网状内皮系统,增强效果好[21]。
超声造影注射方式包括经静脉推注、乳晕皮下及皮内注射、肿块周围皮下及皮内注射、肿块周围腺体注射等。根据文献报道,对比乳腺癌腋窝淋巴结超声造影检查的不同注射方式,增强特征可分为5型:
Ⅰ:整体均匀增强的前哨淋巴结;Ⅱ:整体非均匀性增强的前哨淋巴结,内见低灌注或无灌注区域(图5);Ⅲ:淋巴管正常显像,而整个前哨淋巴结仅边缘增强;Ⅳ:淋巴管增强,而前哨淋巴结仅淋巴门微弱增强;Ⅴ:淋巴管增强,整个前哨淋巴结无增强[6,20,22-23]。良性及炎性反应性前哨淋巴结多表现为Ⅰ、Ⅱ型,转移性淋巴结多表现为Ⅲ、Ⅴ型。
经皮下注射的超声造影对转移性前哨淋巴结的各项统计学参数均较高,灵敏度为81.8%,特异度为95.2%,PPV为90.0%,NPV为90.9%,准确率为90.6%(图6)。王琰娟等[24-25]研究乳腺癌前哨淋巴结增强模式,主要分为3型:
① 均匀增强型:整个淋巴结明显均匀增强;② 非均匀增强型;③ 淋巴管增强、淋巴结不增强。均匀增强型及非均匀增强型中,转移性淋巴结主要表现为非均匀性增强,灵敏度为81.3%,特异度为85.1%,准确度率为85.4%,阳性似然比为5.5。转移性淋巴结超声造影表现为:不均匀性增强(包括不增强及低增强区);仅淋巴管增强,淋巴结未增强。病理检查显示,转移性淋巴结局部受肿瘤细胞浸润,造影剂不能顺利进入淋巴结部分区域或在其他区域堆积,出现充盈缺损而呈不均匀性增强。当主淋巴管被癌细胞不同程度堵塞时,造影剂进入淋巴结的量减少,整个淋巴结低回声增强或不增强。李艺等[26]研究兔乳腺癌腋窝淋巴结转移,发现转移性淋巴结造影模式主要表现为不均匀性灌注及无灌注,良恶性淋巴结超声造影特征为:灌注情况、开始灌注时间及灌注强度差异均有统计学意义(P=0.001)。Dellaportas等[10]观察发现,良性淋巴结超声造影均匀性增强,晚进晚出;而转移淋巴结呈不均匀增强,早进早退。在常规超声及超声造影后,转移性淋巴结比良性淋巴结有更长的增强持续时间(P=0.004)和更多的外周血管(P<0.05)。对比度增强和增强持续时间是淋巴结恶性肿瘤的独立预测因子[27]。Rubaltelli等[28]最早提出充盈缺损,超声造影早期充盈缺损、早进及早消退提示乳腺癌淋巴结转移,结合二维图像可以提高诊断恶性淋巴结的准确率[29]。

图 5 乳腺癌患者左侧腋窝Ⅰ区转移性淋巴结经肘静脉超声造影图

图 6 乳腺癌患者左侧腋窝前哨淋巴结经皮超声造影图
3 超声、MRI和PET/CT等检查方法的应用
蒋蓓琦等[30]对将前哨淋巴结进行了更细致的解剖学定位:以纵向的胸外侧血管、横向的肋间臂神经为标志,将胸小肌外侧腋静脉下方的Ⅰ区进行细分,统计表明,前哨淋巴结最常见于胸外侧动脉周围、肋间臂神经下方的区域内(98.2%)。根据术前腋窝超声,可为82.6%(96/116)的患者提供前哨淋巴结定位信息。有研究显示,PET/CT对乳腺癌腋窝淋巴结评估的灵敏度、特异度、PPV和NPV分别为20.0%、97.0%、75.0%和74.0%[31]。增强CT的灵敏度、特异度、PPV和NPV分别为27.0%、97.0%、80.0%和76.0%。殷正昕等[32]研究发现,1 893例乳腺癌患者中,超声的灵敏度、特异度、PPV和NPV达60.0%、90.6%、80.2%和78.0%,MRI的灵敏度、特异度、PPV和NPV达50.5%、90.8%、77.9%和74.0%;两种检查联用的灵敏度为70.6%,特异度为97.2%。两种检查之间4项指标差异均无统计学意义(P>0.05),亚组分析中两种检查的准确率及预测价值差异亦无统计学意义(P>0.05)。若超声及MRI均认为阳性,则可考虑免去前哨淋巴结活检而直接进行腋窝淋巴结清扫。但是,单独超声评估腋窝淋巴结可疑不能作为一种决定腋窝淋巴结清扫的方法。乳腺癌患者在超声引导下行细针穿刺,灵敏度可达86.4%~94.7%,特异度为85.7%~100%[33]。超声引导下空芯针穿刺活检的灵敏度为30.6%~62.0%,特异度为100%,超声下引导穿刺与病理结果的一致性较好,特异度增加[34]。当超声检查可疑,细针穿刺活检阴性时,患者需行前哨淋巴结活检;若细针穿刺活检阳性,患者可直接行腋窝淋巴结清扫,从而使15%~25%的患者避免不必要的前哨淋巴结活检[35]。
4 预测腋窝淋巴结转移的影响因素
余小琴等[18]研究转移组与未转移组之间肿块最大直径、间质纤维结构改变、血流分级、穿支血管和淋巴结长短径比值、最大皮质厚度、皮髓比值、血流类型等的差异均有统计学意义(P<0.01),对判断乳腺癌淋巴结转移有一定的提示作用。肿块距体表距离是乳腺癌淋巴结转移的危险因素,距体表距离≤1 cm者比>1 cm者发生淋巴结转移的概率增大约5.666倍。转移淋巴结血供增加,淋巴结转移组肿块微血管密度明显高于无转移组[36]。Cunningham等[37]对209例T1或T2期乳腺癌的研究发现,肿块距体表距离越近,其转移率越高。分析原因,可能是筋膜对肿瘤生长具有一定的限制作用,而乳腺浅层仅有一层浅筋膜,深部有浅筋膜深层及深筋膜两层,因此,肿瘤更易向表面生长,突破浅筋膜浅层而发生淋巴结转移。傅俊惠等[38]认为,原发肿瘤最大径<1 cm时,腋窝淋巴结转移发生率为3%~22%。Wang等[39]研究发现,淋巴结转移更可能出现在肿瘤面积≥5.37 cm2、长径≥2.35 cm、高≥1.95 cm的患者中。按N0到N1-3浸导的面积划分,当肿块面积≥5.37 cm2时,曲线下面积(area under curve,AUC)=0.84,灵敏度为71.0%,特异度为79.0%。
王琰娟等[24-25]对比不同分子分型乳腺癌的超声造影表现,验证了HER-2是乳腺癌腋窝淋巴结转移的危险因素之一。HER-2在正常乳腺细胞中(甚至不典型增生)低表达或不表达,在乳腺癌中扩增和(或)过度表达。其能增强细胞的运动能力,从而促进肿瘤侵袭和转移,在细胞分裂增殖、分化中起重要作用。HER-2的过度表达可提高乳腺癌细胞的转移潜能。有研究发现,乳腺癌患者免疫组织化学Ki-67≥14%的患者与Ki-67<14%的患者之间前哨淋巴结转移差异有统计学意义(P<0.01)[39-40]。然而,Jones等[41]对453例乳腺癌患者进行的分析证实,分子分型与淋巴结转移无明显相关。表明目前所使用的分子分型尚无法预测乳腺癌区域淋巴结的侵袭状态,4种分子标志物不能完全揭示肿瘤的生物学特性。
5 总 结
综上所述,常规超声及超声造影对腋窝淋巴结评估具有重要意义,在临床工作中需结合及运用多种定性及定量诊断标准,扩大样本量进行证实。
[参 考 文 献]
[1] LYMAN G H, TEMIN S, EDGE S B, et al. Sentinel lymph node biopsy for patients with early-stage breast cancer:American Society of Clinical Oncology clinical practice guideline update [J]. J Clin Oncol, 2014, 32(13): 1365-1383.
[2] DE FREITAS JR R, COSTA M V, SCHNEIDER S V, et al. Accuracy of ultrasound and clinical examination in the diagnosis of axillary lymph node metastases in breast cancer[J]. Eur J Surg Oncol , 1991, 17(3): 240-244.
[3] XIE F, ZHANG D, CHENG L, et al. Intradermal microbubbles and contrast-enhanced ultrasound (CEUS) is a feasible approach for sentinel lymph node identi fication in early-stage breast cancer [J]. World J Surg Oncol, 2015,13(1): 319.
[4] JAMES T A, KRAG D N. Axillary lymph node dissection[M]. In: Breast surgical techniques and interdisciplinary management. New York: Springer, 2011: 505-517.
[5] 韩 峰, 邹如海, 唐 军, 等. 乳腺区域淋巴结的超声定位显像及临床应用 [J]. 中华医学超声杂志(电子版),2010, 7(11): 10-12.
[6] 马丽园, 米成嵘. 经不同部位注射超声造影剂检测乳腺癌前哨淋巴结的对比 [J]. 宁夏医科大学学报, 2014,36(11): 1247-1250.
[7] BOUGHEY J C, BALLMAN K V, HUNT K K, et al.Axillary ultrasound after neoadjuvant chemotherapy and its impact on sentinel lymph node surgery: results from the American College of Surgeons Oncology Group Z1071 Trial(Alliance) [J]. J Clin Oncol, 2015, 33(30): 3386-3393.
[8] NORI J, VANZI E, BAZZOCCHI M, et al. Role of axillary ultrasound examination in the selection of breast cancer patients for sentinel node biopsy [J]. Am J Surg, 2007,18(4): 359-360.
[9] VIJAYARAGHAVAN G R, VEDANTHAM S, KATAOKA M, et al. The relevance of ultrasound imaging of suspicious axillary lymph nodes and fine-needle aspiration biopsy in the post-ACOSOG Z11 era in early breast cancer [J]. Acad Radiol, 2017, 24(3): 308-315.
[10] DELLAPORTAS D, KOUREAS A, CONTIS J, et al.Contrast-enhanced color Doppler ultrasonography for preoperative evaluation of sentinel lymph node in breast cancer patients [J]. Breast Care, 2015, 10(5): 331.
[11] BEDI D G, KRISHNAMURTHY R, KRISHNAMURTHY S, et al. Cortical morphologic features of axillary lymph nodes as a predictor of metastasis in breast cancer: in vitro sonographic study [J]. Am J Roentgenol, 2008, 191(3):646.
[12] CHOI Y J, KO E Y, HAN B K, et al. High-resolution ultrasonographic features of axillary lymph node metastasis in patients with breast cancer [J]. Breast, 2009, 18(2):119-122.
[13] 辛 灵, 陈路增, 张 虹, 等. 乳腺癌腋窝淋巴结转移的超声诊断价值及临床病理相关性分析 [J]. 中华外科杂志,2014, 52(12): 924-928.
[14] 李洪林, 姜玉新, 郝玉芝, 等. 超声诊断乳腺癌腋窝淋巴结转移的价值 [J]. 中华医学超声杂志(电子版), 2006,3(4): 237-239.
[15] 林 盈, 薛恩生, 林礼务, 等. 高频彩色多普勒超声诊断乳腺癌腋窝淋巴结转移的价值 [J]. 中华医学超声杂志(电子版), 2009, 6(1): 27-29.
[16] YANG W T, CHANG J, METREWELI C. Patients with breast cancer: differences in color Doppler flow and grayscale US features of benign and malignant axillary lymph nodes [J]. Radiology, 2000, 215(2): 568-573.
[17] 林清萍, 欧阳秋芳, 赵红佳, 等. 超声造影对乳腺癌腋窝淋巴结转移的诊断价值 [J]. 中华乳腺病杂志(电子版),2009, 3(2): 14-17.
[18] 余小琴, 高军喜, 姚兰辉, 等. 乳腺癌超声征象与淋巴结转移关系的单因素及多因素分析 [J]. 中华超声影像学杂志, 2010, 19(4): 317-320.
[19] NA D G, LIM H K, BYUN H S, et al. Differential diagnosis of cervical lymphadenopathy: usefulness of color Doppler sonography [J]. Am J Roentgenol, 2013, 168(5): 1311-1316.
[20] MATSUZAWA F, OMOTO K, EINAMA T, et al. Accurate evaluation of axillary sentinel lymph node metastasis using contrast-enhanced ultrasonography with Sonazoid in breast cancer: a preliminary clinical trial [J]. Springer Plus,2015, 4(1): 509.
[21] 徐智章, 刘吉斌, 主编. 实用超声造影诊断学[M]. 北京:人民军医出版社, 2013: 22-23
[22] 孙艳娟, 米成嵘. 经静脉与经皮下注射超声造影剂检测乳腺癌前哨淋巴结的对比研究 [J]. 宁夏医科大学学报,2012, 34(5): 480-482.
[23] 孙艳娟, 米成嵘. 经静脉注射与经皮下注射超声造影剂检查乳腺癌前哨淋巴结的比较 [J]. 中国超声医学杂志,2012, 28(7): 601-604.
[24] 王琰娟, 米成嵘, 王 文. 经皮下注射超声造影剂对不同分子分型乳腺癌腋窝淋巴结转移的诊断价值 [J]. 中国超声医学杂志, 2013, 29(10): 890-893.
[25] 王琰娟, 米成嵘, 王 文. 经皮下注射超声造影剂研究luminal A型乳腺癌前哨淋巴结的增强模式 [J]. 中国超声医学杂志, 2014, 30(6): 500-502.
[26] 李 艺, 王 燕, 常 婷, 等. 经皮超声造影对乳腺癌腋窝前哨淋巴结良恶性鉴别诊断的价值 [J]. 中国超声医学杂志, 2015, 31(6): 546-548.
[27] YANG W T, METREWELI C, LAM P K, et al. Benign and malignant breast masses and axillary nodes: evaluation with echo-enhanced color power Doppler US [J]. Radiology,2001, 220(220): 795-802.
[28] RUBALTELLI L, KHADIVI Y, TREGNAGHI A, et al.Evaluation of lymph node perfusion using continuous mode harmonic ultrasonography with a second-generation contrast agent [J]. J Ultrasound Med , 2004, 23(23): 829-836.
[29] OHTA T, NISHIOKA M, NAKATA N, et al. Five cases of axillary lymph node metastatic breast cancer on contrastenhanced sonography [J]. J Ultrasound Med , 2015,34(6): 1131-1137.
[30] 蒋蓓琦, 章 华, 庄志刚. 腋窝超声在乳腺癌前哨淋巴结活检中应用价值 [J]. 中华临床医师杂志(电子版),2013, 7(5): 1975-1979.
[31] MONZAWA S, ADACHI S, SUZUKI K, et al. Diagnostic performance of fluorodeoxyglucose-positron emission tomography/computed tomography of breast cancer in detecting axillary lymph node metastasis: comparison with ultrasonography and contrast-enhanced CT [J]. Ann Nuclear Med, 2009, 66(10): 779.
[32] 殷正昕, 沈坤炜, 李亚芬, 等. 术前乳腺B超及MRI检查对乳腺癌患者腋窝淋巴结状态评估的准确性 [J]. 中华普通外科杂志, 2013, 28(4): 259-262.
[33] 米成嵘, 韩 涛, 王 文. 乳腺癌前哨淋巴结超声引导细针穿刺抽吸研究初探 [J]. 中国超声医学杂志, 2011,27(4): 313-316.
[34] NORI J, VANZI E, BAZZOCCHI M, et al. Role of axillary ultrasound examination in the selection of breast cancer patients for sentinel node biopsy [J]. Am J Surg, 2007,193(1): 16.
[35] LEENDERS M W, BROEDERS M, CROESE C, et al.Ultrasound and fine needle aspiration cytology of axillary lymph nodes in breast cancer. To do or not to do? [J].Breast, 2012, 21(4): 578.
[36] 高 林, 唐建武, 王莉芬, 等. 乳腺癌CD31、CD34及能量多普勒超声检测与腋窝淋巴结转移的关系 [J]. 中国超声医学杂志, 2005, 21(2): 106-109.
[37] CUNNINGHAM J E, JURJ A L, OMAN L, et al. Is risk of axillary lymph node metastasis associated with proximity of breast cancer to the skin? [J]. Breast Cancer Res Treat,2006, 100(3): 319-328.
[38] 傅俊惠, 柯 斌, 周厚强, 等. 术前彩色Dopple检查定位及术中亚甲蓝注射法在乳腺癌前哨淋巴结活检中的临床应用(附30例报告) [J]. 中国医师杂志, 2006, 8(3): 406-407.
[39] WANG Z, ZHOU Q, LIU J, et al. Tumor size of breast invasive ductal cancer measured with contrast-enhanced ultrasound predicts regional lymph node metastasis and N stage [J]. Int J Clin Exp Pathol, 2014, 7(10): 6985-6991.
[40] OZEMIR I A, ORHUN K, EREN T, et al. Factors affecting sentinel lymph node metastasis in Turkish breast cancer patients: predictive value of Ki-67 and the size of lymph node [J]. Bratislavske Lekarske Listy, 2016, 117(8): 436.
[41] JONES T, NEBOORI H, WU H, et al. Are breast cancer subtypes prognostic for nodal involvement and associated with clinicopathologic features at presentation in early-stage breast cancer? [J]. Ann Surg Oncol, 2013, 20(9): 2866-2872.

