计算机辅助检测对乳腺钙化灶标记的临床意义
杨开颜,刘小娟,司丽芳,蒋 涛
首都医科大学附属北京朝阳医院放射科,北京 100020
随着现代影像学技术的发展,MRI已成为一项有效地检测乳腺癌的手段。最新一项关于乳腺癌筛查的研究指出,90%的乳腺癌可通过MRI明确诊断;相比之下,乳腺X线结合超声对乳腺癌的检出率仅为37.5%[1]。鉴于我国国情,对每位患者进行MRI检查,或应用MRI筛查乳腺癌的可能性尚小,乳腺X线结合超声仍是目前应用最广泛的乳腺癌早期检出和诊断方法[2]。此外,MRI及超声对钙化均不敏感,特别是MRI,而微钙化甚至经常是乳腺癌早期唯一的征象,如导管原位癌,此时MRI检测也会出现漏诊[1]。因此,乳腺X线摄影仍无可替代,特别是其在显示钙化灶方面有绝对优势。计算机辅助检测(computer-aided detection,CAD)系统在数字化乳腺X线摄影中的应用可帮助放射科医师发现病变并协助诊断[3-4]。本研究旨在评价CAD在全数字化乳腺X线摄影系统中对乳腺内钙化灶标记的准确率和灵敏度,以及钙化灶特征与乳腺癌的相关性。
1 资料和方法
1.1 患者选择
通过医院统计室调取2014—2015年于首都医科大学附属北京朝阳医院住院行手术治疗的所有乳腺病患者。患者术前均行带有CAD系统的全数字化乳腺X线摄影,去除因CAD系统故障未能产生CAD信息的44人次检查,穿刺活检确诊为恶性且行新辅助化疗后所进行的42人次检查,以及临床手术资料不全无法进行影像与手术切除部位相对应病灶分析的13人次检查,共计426例患者449人次的图像资料入组。患者年龄17~87岁,平均年龄50岁。
1.2 设备选择
使用美国GE公司Senographe DS全数字化乳腺X线摄影系统及与之配套使用的Second Look Digital CAD系统。
1.3 阅片程序
屏蔽患者的所有临床及病理信息,保留患者的姓名、性别、年龄、出生日期、病历号、影像号及乳腺X线检查日期等基本信息,通过影像归档和通信系统(Picture Archiving and Communication Systems,PACS)调取乳腺X线图像至乳腺X线检查专用工作站,每个患者的图像必须包括单侧或双侧乳腺的头尾位和内外侧斜位两个标准体位。
依据美国放射学会制定的乳腺影像报告和数据系统(Breast Imaging Reporting and Data System,BI-RADS)诊断标准[5],将乳腺单纯钙化性病灶分为典型良性钙化、中间性钙化及高度恶性可能钙化3种亚型。记录每个观察到的病灶的钙化灶形态、数量、分布特征及分布象限,采用BI-RADS标准进行初步X线诊断。然后,开启CAD系统,对CAD标记的每个部位进行分析,并与上述观察到的病灶进行对比,结合初步诊断及CAD标记情况进行最终X线诊断。对于放射科医师没有发现或没有认定为病灶的CAD标记部位,重新阅读CAD标记区域并根据BI-RADS分级给予相应的最终X线诊断(图1)。

图1 患者,女性,53岁,左乳头尾位片
根据患者临床病历,核实上述X线观察到的病灶及CAD标记区域是否进行手术切除,并做相应记录,以病理结果为金标准,判定CAD标记的准确率。CAD标记的准确率根据病灶病理诊断及CAD是否对该病灶部位进行标记来判定,分别记录为真阳性标记、真阴性标记、假阳性标记及假阴性标记。只要相应的CAD标记在头尾位或内外侧斜位任意一个以上体位图像显示,且标记部位与手术切除病变部位及放射科医师在X线图像上的怀疑病灶部位一致,均视为有效标记。
1.4 统计学处理
应用SPSS 17.0统计学软件对上述数据进行分析。计算CAD标记的准确率和灵敏度,应用χ2检验及相关性分析评价CAD标记的准确率、灵敏度及其与病灶X线表现的相关性。
2 结 果
2.1 CAD标记钙化灶的准确率及灵敏度
放射科医师评价的并经手术病理证实的、乳腺X线表现为单纯钙化性的病灶有45个,其中,良性钙化灶11个,恶性钙化灶34个。按BIRADS诊断标准,中间性钙化灶19个,高度恶性可能钙化灶26个。中间性钙化灶中,经病理证实良性钙化灶11个,恶性钙化灶8个;高度恶性可能钙化灶的病理均为恶性。CAD标记钙化的总体准确率为73.3%(33/45),灵敏度为94.1%(32/34),阳性预测值为76.2%(32/42)(表1~2)。
2.2 钙化灶特征对CAD标记准确率及灵敏度的影响
CAD标记中间性钙化灶的准确率(42%,8/19)及灵敏度(88%,7/8)均低于高度恶性可能钙化灶(均为96%,25/26),准确率下降尤其明显。CAD对成簇、线样及节段性分布的单纯钙化性病灶的标记准确率及灵敏度高,对双乳弥漫或散在分布及区域性分布的单纯钙化性病灶的标记准确率及灵敏度明显下降。对于中间性钙化,钙化灶的数量为5~20个时,CAD标记的准确率及灵敏度较高(准确率为67%,6/9;灵敏度为100%,6/6);对于高度恶性可能钙化,钙化灶数量>20个时,CAD标记的准确率及灵敏度均为100% (21/21)(表1~2)。
2.3 钙化灶特征与CAD标记准确率及灵敏度的关系
对于单纯钙化性病灶各亚型,C A D标记的准确率与病灶类型、分布特征均相关(P=0.000),而与钙化点数量不相关(P=0.196);CAD标记的灵敏度仅与钙化数量相关(P=0.026),而与钙化灶类型及分布特征不相关(P>0.05,表3)。

表 1 乳腺单纯钙化性病灶分布特征及CAD标记情况

表 2 乳腺单纯钙化性病灶中钙化灶数量及CAD标记情况
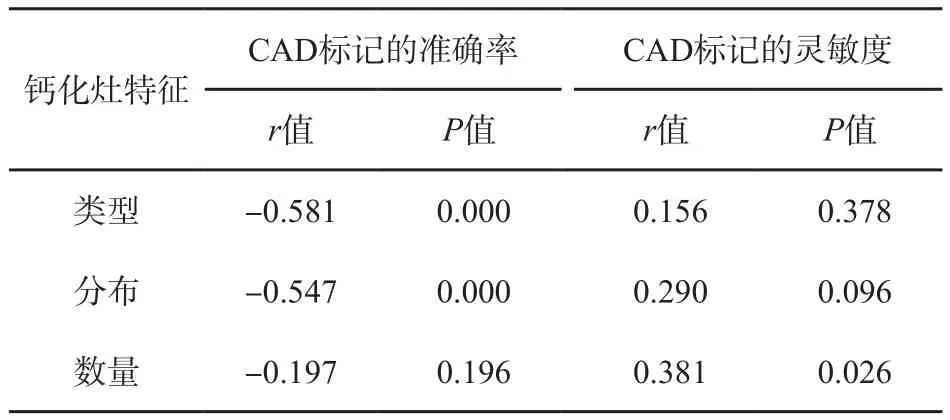
表 3 钙化灶特征与CAD标记准确率及灵敏度的关系
3 讨 论
既往有关乳腺CAD的研究中,一般以病理证实的恶性病灶的检出情况为依据来评价CAD的灵敏度及特异度,或CAD系统应用对阅片医师有无影响[3-4,6-7]。本研究首次分析了CAD标记准确率及标记恶性病灶的灵敏度与乳腺X线可见病灶特征是否相关。阅片方式完全模拟CAD模式下的乳腺X线诊断日常工作阅片程序,记录X线的异常征象并进行CAD应用前后对比分析,最大限度地减少回顾性研究所带来的诊断偏倚。同时,样本中未将良性患者剔除,也是为了能更准确地判断CAD标记的准确率。
乳腺内钙化灶非常常见,BI-RADS诊断标准将乳腺单纯钙化性病灶分为典型良性钙化、中间性钙化及高度恶性可能钙化3种类型。细小的多形性钙化和线样或线样分支状钙化(铸型钙化)一般高度提示恶性可能[5]。一般认为,钙化的病理基础与细胞坏死后的钙盐沉积及癌细胞的异常生物学行为有关,50%~75%的乳腺癌中可见到微钙化。乳腺导管肌上皮的损伤或缺失会导致雌激素受体表达丧失及肿瘤抑制因子表达减低,导致诱发新生血管形成的一些因子过度表达,细胞异常增殖。高级别导管癌中导管肌上皮更易变薄或缺失,更易发生坏死,所以钙化征象较低级别导管癌更为常见[8]。也有学者对导管癌病理分级与X线钙化灶特征的相关性进行了深入研究[9]。微钙化通常是乳腺癌早期甚至唯一的表现,因此,早发现、早治疗可大大提高患者的生存质量。
对于单纯钙化性病灶亚型,单纯中间性钙化病灶的CAD标记准确率及恶性灵敏度(分别为42%和88%)均低于单纯恶性钙化病灶(均为96%),准确率下降尤其明显,与既往研究[10-11]报道结果基本一致。此外,对于单纯钙化性病灶,CAD标记的准确率与钙化灶类型和分布特征显著相关,而与钙化数量不相关。关于钙化数量的标记,与所用设备有关,不同CAD系统运算法有所不同。本研究使用的Second Look CAD系统用于分析直径不大于4.1 mm范围内的3个以上相互独立存在的多形性微小钙化[12]。由于本研究中少于系统规定的3个以下成簇钙化点的患者极少(钙化点少于5个仅3例),其余42例单纯钙化性病灶的成簇钙化点数量均多于5个,所以CAD对单纯钙化性病灶标记的准确率与钙化灶数量没有相关性,正符合Second Look CAD系统对钙化标记的核心运算法则,另一方面也佐证了CAD标记的准确率。
并非所有乳腺X线可见恶性病灶都能被目前提供的CAD系统标记,乳腺X线检查的最终诊断仍需依靠放射科医师来判断。对于日常工作量较大的医院或大规模的乳癌筛查,CAD的作用还是不容忽视的。国家癌症中心于2012—2013年对中国9个省14个城市的40~69岁女性进行乳腺癌筛查,最终采集到12 440名调查对象的数据[2]。乳腺X线摄影标准是双侧投照,每侧常规采取头尾位及内外侧斜位两个体位,即共有49 760幅图像需医师分析,工作量巨大。鉴于CAD标记恶性钙化有较高的灵敏度(94.1%)及阳性预测值(76.2%),且不受腺体密度的影响,可帮助阅片医师避免因工作时间过长、精神及视觉疲劳造成的漏诊或误诊。
综上所述,CAD标记乳腺内钙化灶的准确率及恶性灵敏度均很高,对病灶性质判断具有价值,临床工作中可协助放射科医师作出较正确的诊断,值得推广应用。
[参 考 文 献]
[1] CHRISTOPHER C R, NIKOLAUS L, CLEMENS B, et al.Triple-modality screening trial for familial breast cancer underlines the importance of magnetic resonance imaging and questions the role of mammography and ultrasound regardless of patient mutation status, age, and breast density[J]. J Clin Oncol, 2015, 33(10): 1128-1135.
[2] 秘子涵, 任建松, 张洪召, 等. 2012—2013年中国城市人群乳腺癌筛查结果分析 [J]. 中华预防医学杂志, 2016,50(10): 887-892.
[3] YANG S K, MOON W K, CHO N, et al. Screening mammography-detected cancers: sensitivity of a computeraided detection system applied to full-field digital mammograms [J]. Radiology, 2007, 244(1): 104-111.
[4] VAN DEN BIGGELAAR F J, KESSELS A G, VAN ENGELSHOVEN J M, et al. Computer-aided detection in full-field digital mammography in a clinical population:performance of radiologist and technologists [J]. Breast Cancer Res Treat, 2010, 120(2): 499-506.
[5] D’ORSI C J, BASSETT L W, BERG W A, et al. BI-RADS:Mammography [M]. 4thed. Reston VA: American College of Radiology, 2003.
[6] FREER T W, ULISSEY M J. Screening mammography with computer-aided detection: prospective study of 12 860 patients in a community breast center [J]. Radiology,2001, 220(3): 781-786.
[7] DESTOUNIS S, HANSON S, MORGAN R, et al.Computer-aided detection of breast carcinoma in standard mammographic projections with digital mammography[J]. Int J CARS, 2009, 4(4): 331-336.
[8] YAMADA T, MORI N, WATANABE M, et al. Radiologicpathologic correlation of ductal carcinomain situ[J].Radiographics, 2010, 30(5): 1183-1198.
[9] 文婵娟, 廖 昕, 徐维敏, 等. 乳腺癌线样或线样分支状钙化的病理类型和分子表达的关系[J]. 放射学实践,2014, 29(8): 945-948.
[10] SOO M S, ROSEN E L, XIA J Q, et al. Computer-aided detection of amorphous calcifications [J]. AJR Am J Roentgenol, 2005, 184(3): 887-892.
[11] SADAF A, CRYSTAL P, SCARANELO A, et al.Performance of computer-aided detection applied to fullfield digital mammography in detection of breast cancers[J]. Eur J Radiol, 2011, 77(3): 457-461.
[12] MALICH A, FISCHER D R, BÖTTCHER J. CAD for mammography: the technique, results, current role and further developments [J]. Eur Radiol, 2006, 16(7): 1449-1460.

