扁桃离体枝条培养方式比较和筛选
李 鹏 ,田 嘉 ,张 琦 ,董胜利 ,章世奎 ,李 疆
(1.新疆农业大学 林学与园艺学院,新疆 乌鲁木齐 830052;2.新疆农业科学院 轮台果树资源圃,新疆 轮台 841600)
栽培扁桃在我国主要分布在新疆喀什地区莎车县、英吉沙县及其周边地区[1],2014年栽培面积约7.5万hm2,结果面积约4万hm2,盛果面积约1.3万hm2,总产量约4万t[2],已成为南疆振兴地方经济和少数民族农民脱贫致富的重要组成部分[3]。但新疆扁桃单株产量较低,仅是美国加州扁桃单株产量的1/10~1/5[1],尤其是近年来新疆频繁出现的极端低温天气严重影响了扁桃产业的发展[4]。所以,很有必要探明中国当地栽培扁桃品种、国外引进扁桃品种抗寒性及低温下生理生化指标变化,如糖类物质[5]、脯氨酸、丙二醛等抗寒相关物质含量变化[6],SOD、POD等相关酶活性变化[7],SIZ1、ICE1、CBF/DREB1、WRKY21、HOS1、ANK等抗寒相关基因表达量变化[8-9]。由于扁桃树体较大,童期较长,不易在大田中进行低温胁迫试验,只能在实验室内模拟自然低温对扁桃离体枝条进行低温处理,所以很有必要筛选出适宜扁桃离体枝条培养的最佳方式。李鹏等人[3]剪取处于露红期的扁桃枝条,带回实验室后水培在1/2MS+20 g/L蔗糖培养液中,能较好地进行花蕾抗寒性试验。Mousavi S等剪取处于大蕾期的扁桃枝条,水培在5%蔗糖溶液中,经低温处理后,对耐寒型(H型)以及冷敏感型(Sh12型)扁桃花药、子房进行了转录组测序分析[10]和miRNAs差异表达分析[11]。但以上2种扁桃离体枝条培养方法适用于春季扁桃枝条的短期培养,对休眠期扁桃枝条培养效果不佳,不能满足休眠期扁桃抗寒试验的需要。本试验剪取新疆主栽扁桃品种‘纸皮’休眠期枝条,通过在智能人工气候箱内用1/2MS+5%蔗糖溶液水培、培养土扦插和花泥固定1/2MS+5%蔗糖溶液培养的方法,观测扁桃花芽、叶芽生长情况,比较不同培养方式下‘纸皮’扁桃休眠期离体枝条的生长情况,筛选出适宜‘纸皮’扁桃休眠期离体枝条培养的最佳方式,为全面开展扁桃抗寒分子生物学研究提供理论基础。
1 材料与方法
1.1 试验材料
以新疆农业科学院轮台果树资源圃30年生‘纸皮’扁桃树为试验材料,于2017年1月1日剪取‘纸皮’扁桃1年生枝条90枝,用凡士林涂抹剪口,带回实验室后将枝条下端剪成斜口,长20 cm,并剥掉枝条下端5 cm内的芽。先将枝条下端浸泡在5 cm深的75%酒精中40~60 s,再浸泡在5 cm深的0.10%氯化汞中8~10 min,然后用清水冲洗干净,4 ℃保存。
1.2 试验方法
1.2.1 扁桃枝条培养方法
(1)1/2MS+5%蔗糖溶液水培
用无菌水配制1/2MS+5%蔗糖溶液,倒入烧杯中,深5 cm,然后将处理好的枝条插入培养液中。3组重复,每组10个枝条。
(2)培养土扦插
将泥炭土和蛭石按照2∶1体积比充分混合,80 ℃烘箱灭菌3 d,无菌水浇透,然后将处理好的枝条插入培养土中,深5 cm。3组重复,每组10个枝条。
(3)花泥固定1/2MS+5%蔗糖溶液培养
先把花泥(20 cm×10 cm×7 cm,不含保鲜剂)放入1/2MS+5%蔗糖溶液中吸满培养液,然后将处理好的枝条插入花泥中,深5 cm,再加入1/2MS+5%蔗糖溶液使花泥外的培养液深2 cm。3组重复,每组10个枝条。
(4)大田自然生长
以新疆农业科学院轮台果树资源圃自然生长‘纸皮’扁桃树上的枝条为对照,在东南西北4个方向上均匀选取30个1年生枝条进行试验。
1.2.2 智能人工气候箱的设置
用智能人工气候箱(型号RXZ-250B),模拟扁桃生长地气候变化设置4个培养阶段,每天设置为4个时间段,第1时间段和第3时间段空气湿度设置为50%,第2时间段设置为35%,第4时间段设置为70%。每个时间段具体时长、温度和光照设置如下:
(1)第一培养阶段5 d
第1时间段设置为5 h、10 ℃、6000 lx;第2时间段设置为3 h、13 ℃、8000 lx;第3时间段设置为5 h、10 ℃、6000 lx;第4时间段设置为11 h、5 ℃、0 lx。
(2)第二培养阶段5 d
第1时间段设置为5 h、15 ℃、8000 lx;第2时间段设置为3 h、18 ℃、10000 lx;第3时间段设置为5 h、15 ℃、8000 lx;第4时间段设置为11 h、8 ℃、0 lx。
(3)第三培养阶段10 d
第1时间段设置为5 h、20℃、10000 lx;第2时间段设置为3 h、23℃、11000 lx;第3时间段设置为5 h、20℃、10000 lx;第4时间段设置为 11 h、11℃、0 lx。
(4)第四培养阶段10 d
第1时间段设置为“5 h、23℃、11000 lx”;第2时间段设置为“3 h、25℃、12000 lx”;第3时间段设置为“5 h、23℃、11000 lx”;第4时间段设置为“11 h、14℃、0 lx”。
1.3 数据测量和统计分析
在智能人工气候箱培养30 d后,统计‘纸皮’扁桃的叶芽、花芽指标,并在盛花期(2017年4月5日)统计在大田自然生长的‘纸皮’扁桃的叶芽、花芽指标。统计花芽生长指标时选取1年生枝条上部10个花芽,每组100个花芽, 3组重复。统计叶芽生长指标时选取1年生枝条顶部叶芽,每组10个叶芽,3组重复。
用数显游标卡尺(型号DL91150)测量花瓣纵径、花瓣横径、花丝长度、雌蕊长度、叶片纵径和叶片横径,用分析天平(型号AL204-IC)称量单花质量、花瓣质量、花药质量、雌蕊质量和叶芽质量。
1.3.1 花粉量的测定
在盛花期收集已绽放花朵未散粉花药10粒于1.5 mL离心管中,将离心管敞口、直立置于密闭小盆中,于30 ℃烘箱中散粉24 h。取出离心管,用微量移液枪加入含有0.5%番红的50%酒精溶液200 μL,再加入800 μL蒸馏水,旋涡混合器震荡3 min,转速为650 r/min,迅速吸取溶液中部10 μL花粉悬浮液,滴于载玻片上(7~9滴),显微镜下统计花粉量a,则单花药花粉量近似为10×a,10组重复。
1.3.2 花粉活力的测定
在盛花期采摘刚散粉花药,用棉签将花粉均匀地播种在含有1%琼脂粉、5%蔗糖、0.01%硼酸的花粉培养基上,25℃避光培养4 h后在显微镜下统计1000个花粉粒的萌发情况,计算出花粉活力[12]。
1.4 数据分析
用Excel 2016完成数据统计,用SPSS 20.0单因素方差Duncan法检测差异显著性。将所测各指标看作单一变量,假设叶芽和花芽生长情况在评估枝条生长情况中所占比重相同、芽成活率和生长情况所占比重相同,则叶芽、花芽和枝条的相对生长值计算公式如下:

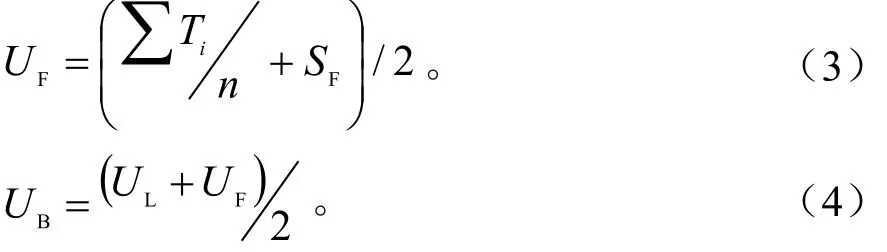
式中:n代表叶芽或花芽所测的指标数;i代表所测叶芽或花芽指标的编号,i=1,2,…,n;Ti指叶芽或花芽i指标的相对生长值;imax指大田自然生长叶芽或花芽的i指标;SL指叶芽成活率;SF指花芽成活率;UL指叶芽的相对生长值;UF指花芽的相对生长值;UB指枝条的相对生长值。
2 结果与分析
2.1 离体培养扁桃枝条的花芽生长情况
以自然生长的‘纸皮’扁桃花芽为对照,比较3种离体培养方式下扁桃花芽的生长情况。由表1可知,在1/2MS+5%蔗糖溶液水培条件下,花芽成活率仅有8.33%,大部分花芽枯死;花芽质量最小,为0.127 g,生长较差,花瓣较小,不能完全绽放;花药发育差,单花药花粉量仅是自然生长的1/2左右,花粉活力最低,花丝较短,仅65.67%花丝能正常伸展;雌蕊较短,质量较小,仅46.67%的柱头高于花药;花芽的相对生长值为35.44%,发育情况最差(见图1-E),不能满足试验需要。
在培养土扦插条件下花芽成活率为27.67%,花芽质量为0.174 g,花瓣较小,少部分能完全绽放;花药发育差,单花药花粉量约是自然生长的2/3,花粉活力较低,花丝短,84.67%的花丝能正常伸展;雌蕊短,质量一般,55.33%的柱头高于花药;花芽的相对生长值为52.47%,发育情况一般(见图1-I),也不能满足试验需要。

表1 离体培养扁桃枝条的生长情况†Table 1 The growth of almond branches in vitro culture
花泥固定1/2MS+5%蔗糖溶液培养枝条的花芽成活率较高,为83.33%,花芽质量达到了0.24 g,花瓣较大,大部分能完全绽放;花药发育较好,花粉量是自然生长的3/4左右,花粉活力较高,花丝较长,92.33%能正常伸展;雌蕊较长,74.67%的柱头高于花药。花芽相对生长值为85.87%,发育情况较好(见图1-M),接近大田自然生长的枝条(见图1-Q),可用于进行休眠期‘纸皮’扁桃花芽相关试验。
2.2 离体培养扁桃枝条的叶芽生长情况
扁桃枝条离体培养条件下叶芽生长情况和花芽生长情况基本相同。由表1可知,1/2MS+5%蔗糖溶液水培条件下叶芽成活率仅为33.33%,叶芽质量最小,为0.043 g;叶片纵径和叶片横径也最小,叶芽相对生长值最低,为36.86%,叶芽发育情况最差(见图1-E),不能满足试验需要。培养土扦插条件下叶芽成活率为56.67%,叶芽质量较小,为0.086 g,叶片纵径和叶片叶片横径也较小(见图1-I),叶芽相对生长值为58.86%,叶芽发育情况一般。花泥固定1/2MS+5%蔗糖溶液培养条件下叶芽成活率为86.67%,叶芽质量较高,叶片纵径和叶片横径也较大(见图1-M),叶芽相对生长值最高,为88.96%,发育情况最好,最接近大田自然生长的枝条(见图1-Q),可用于进行休眠期‘纸皮’扁桃离体枝条叶芽相关试验。

图1 离体培养的‘纸皮’扁桃枝条生长过程Fig.1 The growth process of ‘Zhipi’ almond branches in vitro culture
2.3 离体培养扁桃的枝条生长情况
由表1可知,1/2MS+5%蔗糖溶液水培条件下,枝条相对生长值为36.15%,枝条生长情况最差(见图1-E);培养土扦插条件下,枝条相对生长值为55.66%,枝条生长情况一般(见图1-I);花泥固定1/2MS+5%蔗糖溶液培养条件下,枝条相对生长值为87.41%,枝条生长情况较好(图1-M),最接近大田自然生长的枝条(图1-Q),可用于进行‘纸皮’扁桃休眠期抗寒相关试验。
3 讨 论
‘纸皮’扁桃枝条离体培养条件下需要进行灭菌处理,未灭菌处理的‘纸皮’扁桃枝条经3种培养方式培养均易被细菌、真菌感染。当温度高于18 ℃时,1/2MS+5%蔗糖溶液培养的枝条会长出大量细菌、真菌,2 d后培养液出现浑浊,3 d后培养液中会出现絮状真菌和黄色菌斑,5 d后培养液中会出现大量絮状真菌,表面会出现黑色菌块;花泥固定1/2MS+5%蔗糖溶液培养枝条上的细菌、真菌生长稍慢;培养土扦插枝条上的细菌、真菌生长最慢。1/2MS+5%蔗糖溶液培养枝条前,用75%酒精浸泡枝条下部40~60 s,能减缓细菌、真菌生长,但效果不佳;用75%酒精浸泡枝条下部40~60 s,再用0.10%升汞浸泡10~12 min[13],可有效控制细菌、真菌生长。
光照[14]、温度[15]、水分[16]都是扁桃离体枝条生长的重要因素。智能人工气候箱的光是模拟太阳光设计,含有植物光合作用所需的光区,有助于叶芽和花芽进行光合作用,也有助于杀死部分细菌、真菌。温度对扁桃离体枝条生长也十分重要[16],冬季花芽处于休眠期,生长较慢,随着温度的上升,花芽逐渐解除休眠,恢复生长,膨大并变成花朵[15]。所以,本试验依据扁桃枝条采样地的气候变化,将智能人工气候箱设置为4个逐渐升温的培养阶段,并将每天设置为4个时间段。水分是扁桃离体枝条光合作用、营养运输的重要参与者,大田条件下根压可为扁桃花芽、叶芽发育提供足够的水分,但离体培养条件下‘纸皮’扁桃枝条的水分供应主要来自渗透调节,空气湿度太小易导致芽失水过多,逐渐干枯,不能完全绽放;枝条出现栓塞,木质部导水率降低,进而影响枝条生长[16]。空气湿度太大又会诱发细菌、真菌大量繁殖,导致花芽、叶芽发霉并逐渐死亡。本试验依据扁桃枝条采样地的气候变化,将智能人工气候箱第1时间段和第3时间段空气湿度设置为50%,第2时间段空气湿度设置为35%,第4时间段空气湿度设置为70%,即满足了‘纸皮’扁桃离体枝条对水分的需求,又不会导致枝条花芽、叶芽发霉。另外,本试验还发现‘纸皮’扁桃离体枝条超过25 cm时,不利于水分运输,所以本试验将枝条剪成20 cm长。本试验模拟‘纸皮’扁桃自然生长地的气候条件,并结合‘纸皮’扁桃离体枝条生长的需要,来设置智能人工气候箱,完全能满足‘纸皮’扁桃离体枝条的生长需要。
本试验1/2MS+5%蔗糖溶液培养条件下,‘纸皮’扁桃花芽、叶芽的成活率最低,发育情况最差,这可能是因为休眠期枝条培养到花期所需时间较长,1/2MS+5%蔗糖溶液中空气含量少,不足以满足‘纸皮’扁桃离体枝条生长需要,导致枝条生长不良,逐渐干枯死亡。培养土扦插条件下花芽和叶芽成活率一般,发育情况一般,叶芽比花芽发育情况稍好,可能是因为花芽比叶芽更敏感,培养土透气透水性强,不能为花芽发育提供足够的水分。花泥固定1/2MS+5%蔗糖溶液培养条件下,‘纸皮’扁桃花芽、叶芽成活率最高,发育情况较好,这可能和花泥持水量大、透气性好,能为花芽和叶芽发育提供较多的水分和营养物质,有利于枝条生长有关。
4 结 论
1/2MS+5%蔗糖溶液水培条件下,花芽成活率仅有8.33%,相对生长值为35.44%;叶芽成活率仅为53.66%,叶芽相对生长值最低,为36.86%;枝条相对生长值为36.15%,‘纸皮’扁桃枝条生长情况最差,不适宜进行休眠期扁桃枝条抗寒相关试验。培养土扦插条件下,花芽成活率为27.67%,花芽相对生长值为52.47%;叶芽成活率为53.66%,叶芽相对生长值为58.86%;枝条相对生长值为55.66%,‘纸皮’扁桃枝条生长情况一般,不能满足休眠期扁桃花芽抗寒相关试验需要。花泥固定1/2MS+5%蔗糖溶液培养条件下,花芽成活率最高为83.33%,花芽相对生长值为85.87%;叶芽成活率为86.67%,叶芽相对生长值为88.96%;枝条相对生长值为87.41%;‘纸皮’扁桃枝条生长情况最好。花泥固定1/2MS+5%蔗糖溶液培养扁桃离体枝条的方法最好,可用于‘纸皮’扁桃休眠期抗寒试验研究。
参考文献:
[1] 田建保. 中国扁桃[M]. 北京: 中国农业出版社, 2008: 11.
[2] 李 疆. 中国果树科学与实践—阿月浑子、扁桃[M]. 陕西:陕西科学技术出版社, 2015: 96-98.
[3] 张 雯, 谢 辉, 张 平, 等. 南疆间作模式下扁桃树形差异对间作区域光环境及冬小麦相关产量指标的影响[J]. 新疆农业科学, 2016, 53(3): 411-419.
[4] 李 鹏, 罗淑萍, 田 嘉, 等. 低温冻害对扁桃花蕾抗寒机制的影响[J]. 经济林研究, 2015, 33(2): 20-25.
[5] 李 鹏, 田 嘉, 许 娟,等. 鹰咀扁桃花蕾在低温应激反应中糖含量的变化[J]. 经济林研究, 2016, 34(2): 62-66.
[6] 李 鹏, 田 嘉, 唐开文, 等. 基于隶属函数评估法的扁桃花蕾抗寒性研究[J]. 中南林业科技大学学报, 2017,37(2):39-43.
[7] 李 斌, 刘立强, 罗淑萍, 等. 扁桃花芽的抗寒性测定与综合评价[J]. 经济林研究, 2012, 30(3): 16-21.
[8] 王俊峰, 孔维国, 张 煜, 等. 植物抗寒基因表达调控研究进展[J]. 西北植物学报, 2012, 32(4): 852-858.
[9] Alisoltani A, Shiran B, Fallahi H,et al.Gene regulatory network in almond (Prunus dulcisMill.) in response to frost stress[J].Tree Genet Genomes, 2015, 11(5): 1-15.
[10] Mousavi S, Alisoltani A, Shiran B,et al.De Novo transcriptome assembly and comparative analysis of differentially expressed genes inPrunus dulcisMill. in response to freezing stress[J].Plos One, 2014, 9(8): e104541.
[11] Karimi M, Ghazanfari F, Fadaei A,et al. The Small-RNA Pro fi les of Almond (Prunus dulcisMill.) Re-productive Tissues in Response to Cold Stress [J]. Plos One, 2016, 11(6): e0156519.
[12] 李 鹏. 扁桃花蕾抗寒性分析和花药开裂过程观察[D]. 乌鲁木齐: 新疆农业大学, 2015: 33.
[13] 刘进平, 曹孜义, 李 唯, 等. 5个美国扁桃品种的微繁殖[J].北方果树, 2003(6): 1-3.
[14] Olsen J E, Junttila O, Nilsen J,et al.Ectopic expression of oat phytochrome A in hybrid aspen changes critical daylength for growth and prevents cold acclimatization[J]. Plant Journal, 1997,12(6): 1339-1350.
[15] Barros P M. Cold acclimation and fl oral development in almond bud break: insights into the regulatory pathways[J]. Journal of Experimental Botany, 2012, 63(12): 4585-4596.
[16] Mousavi S, Alisoltani A, Shiran B,et al. De Novo transcriptome assembly and comparative analysis of differentially expressed genes inPrunus dulcisMill. in response to freezing stress[J].Plos One, 2014, 9(8): e104541.

