柚木无性系苗期抗旱生理评价与选择的研究
(中国林业科学研究院 热带林业研究所,广东 广州 510520)
柚木Tectona grandisL. f.是世界名贵的用材树种,生长快,材质优良,用途广,投资回报率高,在亚洲、非洲、中美洲和南美洲广为种植[1-2]。我国引进柚木栽培历史悠久,在云南、海南、广东、广西、贵州和福建都有较大规模的种植,总面积约1.5万hm2[3]。近年来,柚木在我国云南干热河谷和贵州南部热区(罗甸)发展呈现良好的前景。有报道表明,柚木在干旱瘠薄地区生长比水肥条件好的地区慢一点,但木材质量好,心材比例高,纹理更加美观[4]。然而,这些热区的11月到次年5月为长时间的旱季,干旱在一定程度上成了柚木生长发育的限制因子。广大林农除了对柚木有速生的要求外,也对柚木耐干旱瘠薄提出了更高的要求。因此,尽快选育出抗旱性强的柚木优良新品系,是在我国云南干热河谷和贵州南部热区大力发展柚木商品林的基本前提。当前,柚木遗传育种研究主要集中在速生、干形、材质和耐寒方面,柚木抗旱方面的研究相对较少。在柚木抗旱育种方面,Husen[5]比较了两个不同复壮能力的柚木无性系(FG1和FG11)在控水若干天期间相对含水量、可溶性蛋白、相对渗透势、游离脯氨酸和可溶性糖等生理指标的变化,结果认为FG1比FG11抗旱性强。Rajendrudu等[6]研究发现两种叶片长宽比不同的柚木类型在控水3周后,气孔导度和蒸腾速率都与干旱程度呈负相关,认为宽叶类型比窄叶类型生长情况好,但易受干旱影响。在柚木抗旱机理方面,武勇等[7]用聚乙二醇-6000(PEG-6000)在室内模拟干旱条件,对1年生柚木苗进行不同程度的渗透胁迫后,发现游离脯氨酸、可溶性糖、超氧化物岐化酶等有明显变化,认为柚木在干旱胁迫下是通过增加渗透调解物质含量、降低水势、加强保水力来提高其耐旱能力;并通过增强抗氧化酶活性、提高抗氧化能力,以减轻干旱胁迫的伤害。本研究在前期研究的基础上,对我国正在推广和中试的一批柚木无性系开展了控水干旱胁迫,观察了胁迫处理期间的表现,并分析了重要生理指标的响应,综合评价了不同无性系的抗旱能力,以期选择出抗旱性强的柚木优良无性系,为我国柚木抗旱造林、引种和育种提供理论依据。
1 材料与方法
1.1 试验材料
参试材料为中国林科院热带林业研究所组培的21个柚木无性系,组培瓶苗在苗圃轻基质移植7个月后,移入塑料育苗盆,盆底垫厚纸壳,基质为1500 g的黄心土,试验对照为柚木无性系种子园优良家系种子培育的同龄盆栽实生苗,共22个号,来源信息详见表1,每个盆1株,每个号随机选择3株。
1.2 研究方法
干旱胁迫处理前盆栽5个月,进行日常管理。然后在广州8月的温室条件下,连续5 d,每日每株浇水100 mL,然后对所有植株进行取样,分析干旱处理前的生理指标,取样后迅速回到实验室进行生理指标分析。之后停止浇水,即采用自然干旱法,对参试材料进行干旱处理。根据前期预经验,分别在干旱胁迫后第3天上午(中度干旱)和干旱胁迫后第5天上午(重度干旱)对每株采样并进行生理指标分析。用土壤含水量速测 仪(Moisture Probe Meter,MPM-160B,12-Bit Resolution)测定中度干旱时土壤含水量为22%~25%,重度干旱时土壤含水量为15%~18%。干旱处理期间温度计测得温室白天温度在26~36℃之间,相对湿度在78%~96%之间。
1.3 测定指标
生理指标及其测定方法如下:游离脯氨酸(FPRO)含量的测定参照郝再彬等[8],SOD活性的测定参照Giannopolitis和Ries[9],相对电导率的测定参照陈建勋和王晓峰[10]。测定时,待指标数值稳定后取3次平均值。
1.4 数据分析
采用Excel软件统计出每个指标3次数据的平均值,用SAS软件进行方差分析和Duncan多重比较分析,用多维空间(欧几米德)En多向量综合评定法对不同无性系的抗旱性进行排序。
2 结果与分析
2.1 干旱胁迫后柚木无性系的生长情况观察
中度干旱胁迫后,柚木无性系叶片缺水,除了顶芽和最上面2对叶片外,其它叶片(老叶)开始出现下垂和发黄现象。重度干旱胁迫后,上述现象更加严重,大部分植株的顶芽和所有叶片都出现缺水萎蔫现象,叶柄弯曲,无力支撑叶片,大量叶片发黄,少量老叶出现缺水干枯现象。说明本试验中的中度干旱胁迫造成的缺水已经严重地抑制了柚木的正常生长,而随着时间的延长,重度干旱胁迫的抑制作用更加显著,直到停止生长。从外表观察来看,柚木无性系7544、7514、Z408、7137、7114、7509、7531、7219在重度干旱胁迫后,顶芽和上面第一对叶片仍保持良好生长态势。
本试验结束后对所有参试柚木无性系植株恢复正常供水,大部分植株叶片黄化枯萎,1~2周后,大部分无性系的顶芽能够恢复正常生长态势,少量植株顶芽干枯后又萌发出侧枝,没有植株死亡。说明柚木本身具有较强的抗旱性。
2.2 干旱胁迫对柚木无性系叶片生理指标的影响
2.2.1 干旱胁迫对柚木无性系叶片游离脯氨酸(FPRO)含量的影响
脯氨酸是水溶性最大的氨基酸,具有很强的水合能力,是分布最广的渗透剂,通过渗透调节作用来维持细胞一定的含水量和膨压势,脯氨酸的积累对植物抗旱具有重要意义[11]。干旱胁迫能刺激植物合成脯氨酸。随着干旱胁迫的加剧,抗旱性强的品种积累的脯氨酸比抗旱性弱的品种多,从而具有更强的渗透调节能力,表现出更强的抗旱性。对柚木各无性系的游离脯氨酸含量数据进行方差分析,结果显示,处理前、中度干旱处理后和重度干旱处理后柚木无性系脯氨酸含量差异都达到显著或极显著水平(P<0.0001、P=0.012和P=0.0069)。处理前后各柚木无性系脯氨酸值邓肯多重比较见表2。由表2可知,中度干旱胁迫和重度干旱胁迫后,除了少数柚木无性系外,大部分柚木无性系的脯氨酸含量比处理前都有所增加,且重度干旱胁迫后脯氨酸含量大于中度干旱胁迫后脯氨酸含量。说明随着干旱胁迫的加剧,干旱对柚木无性系生理的影响也越来越大,大部分柚木无性系通过脯氨酸的合成和积累,增强渗透调节能力,来减少干旱胁迫带来的伤害。从处理后与处理前脯氨酸含量分数的比值来看,不同柚木无性系脯氨酸的积累量不同,初步认为柚木无性系7531、7514、7137、7219和7509抗旱能力强,其次为柚木无性系7544和7114。

表2 干旱处理后柚木无性系游离脯氨酸的邓肯多重比较†Table 2 Duncan multiple comparison of free proline among teak clones after drought treatment
2.2.2 干旱胁迫对柚木无性系叶片超氧化物歧化酶(SOD)活性的影响
超氧化物歧化酶(SOD)在清除超氧自由基、过氧化氢和过氧化物及减少羟基自由基形成方面起重要作用,是细胞抵御活性氧伤害的膜保护系统[12]。有研究证明,在干旱胁迫下,植物SOD活性会升高,减少因胁迫产生的自由基对细胞膜系统的伤害,因此,SOD活性的高低能够很好地反映出植物抗旱能力的大小。对柚木无性系SOD活性数据进行方差分析,结果显示,处理前、中度干旱和重度干旱胁迫后,各柚木无性系SOD活性都呈极显著差异(P<0.0001、P=0.0002和P=0.0004)。从表3可知,中度干旱胁迫后,7509和7514柚木无性系SOD活性值比处理前有所增加;重度干旱胁迫后,大部分柚木无性系的SOD活性都大于处理前的SOD活性,且重度干旱胁迫后SOD活性大于中度干旱。说明在重度干旱胁迫下,柚木无性系的SOD活性发生了急剧的变化。从处理后SOD活性与处理前的比值来看,初步认为柚木无性系7509、7514、7531和7544具有很强的抗旱性,其次是柚木无性系Z408、7559、7013 和 7029。
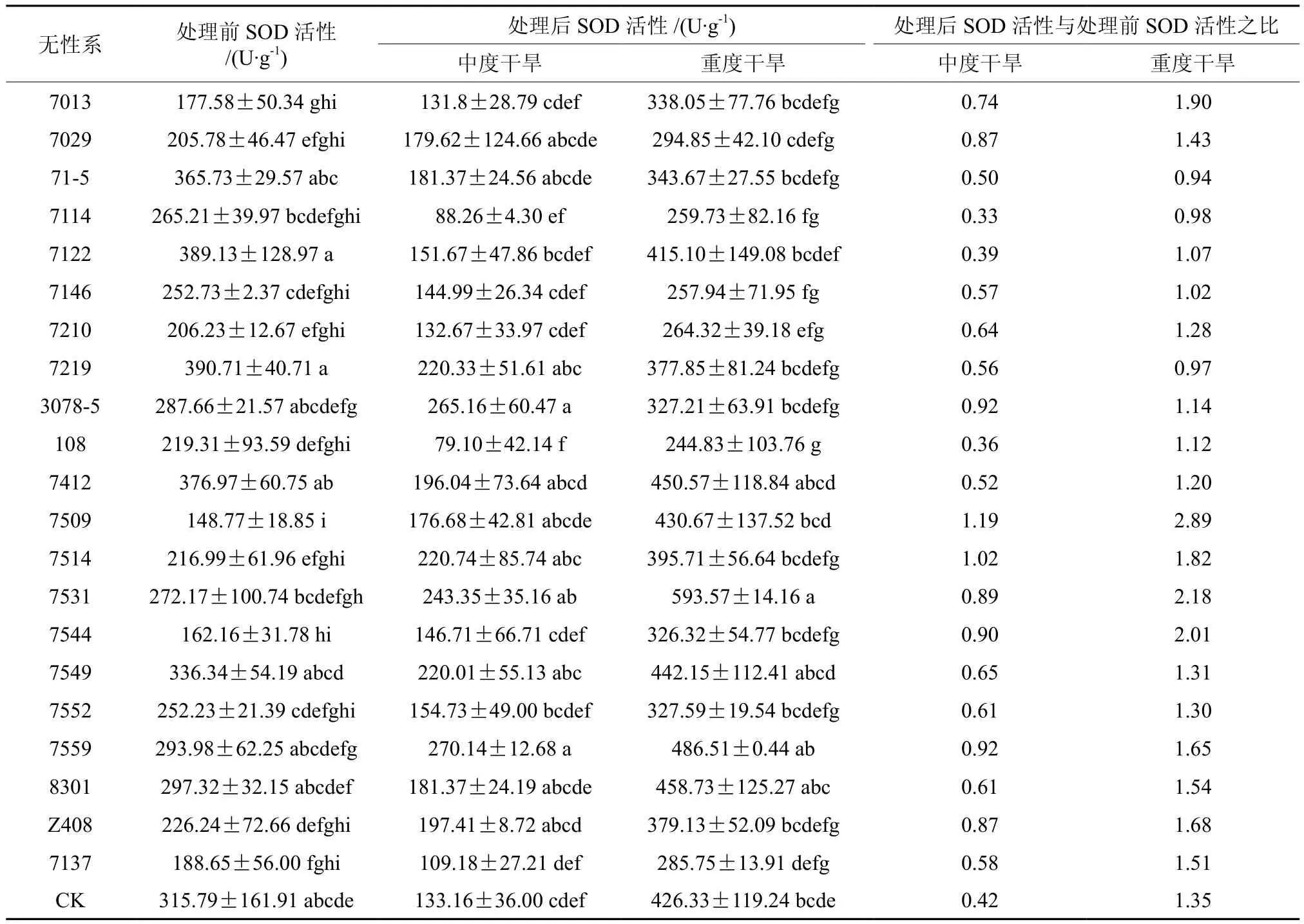
表3 干旱处理后柚木无性系SOD活性的邓肯多重比较Table 3 Duncan multiple comparison of superoxide dismutase activity among teak clones after drought treatment
2.2.3 干旱胁迫对柚木无性系叶片相对电导率(EC)的影响
方差分析结果表明,处理前和中度干旱处理后不同柚木无性系相对电导率差异达到显著水平(P=0.0367和P=0.0226);重度干旱处理后,不同柚木无性系相对电导率差异则不显著(P=0.0923)。植物遇到较强的胁迫时,会破坏细胞膜的稳定性,导致细胞膜内电解质外渗,从而相对电导率升高。本研究从处理前与处理后相对电导率的变化(见表4)来看,中度和重度干旱胁迫后大部分柚木无性系相对电导率比处理前有所降低,中度干旱处理后只有1个无性系(71-5)的相对电导率比处理前有所提高,重度干旱处理后有少量(6个)无性系相对电导率比处理前略有提高,大部分柚木无性系相对电导率无增加或少量增加。一般来说,干旱胁迫后无性系相对电导率变化越小,说明其对干旱胁迫不敏感,换言之,具有很强的耐旱性。基于此,柚木无性系7544、7514、108、7549和7137具有很强的耐旱性。
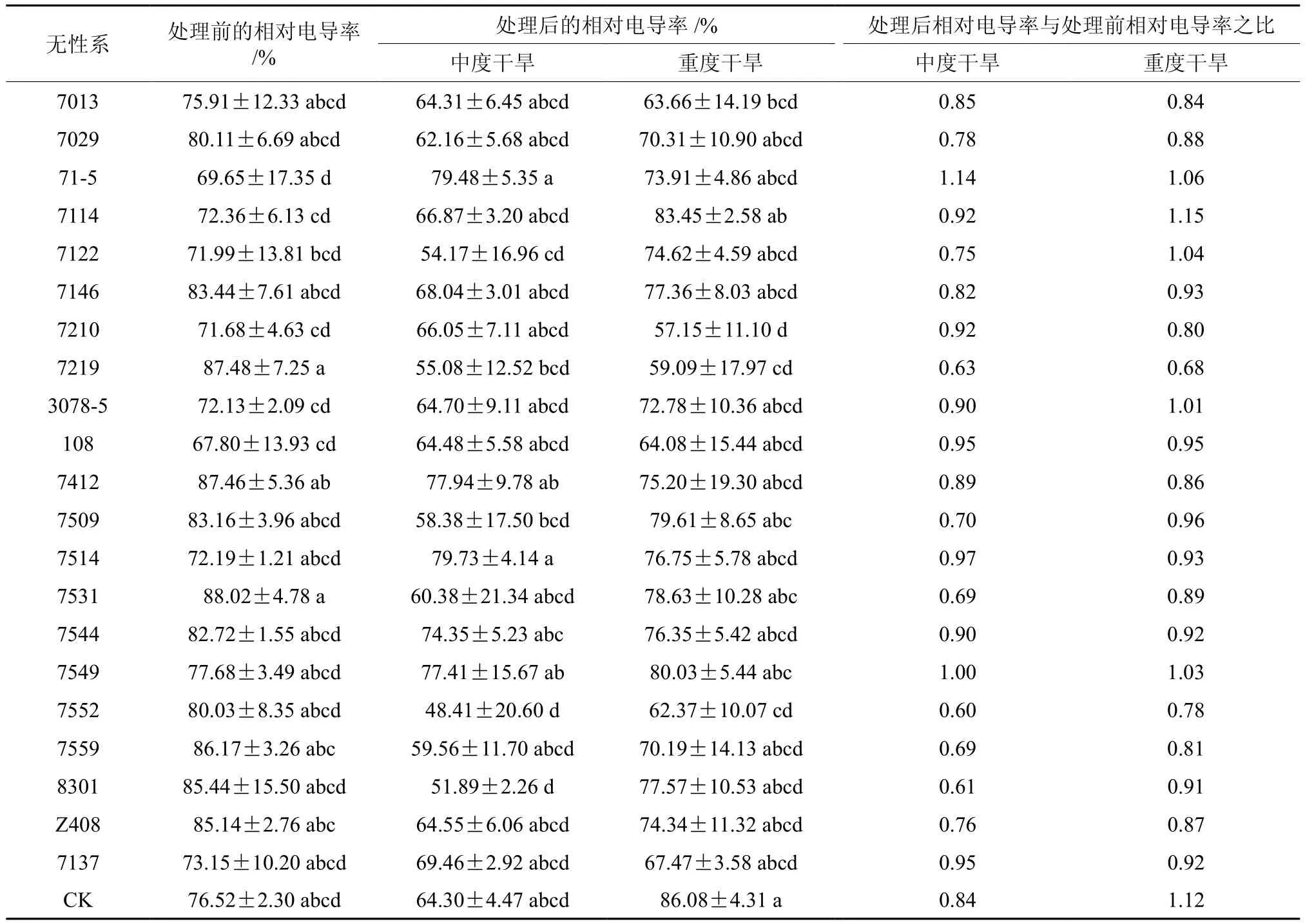
表4 柚木无性系干旱胁迫后电导率的邓肯多重比较Table 4 Duncan multiple comparison of relative conductivity among teak clones after drought treatment
2.3 柚木无性系抗旱性的综合评定
采用欧几米德多向量理论综合评定法对柚木无性系中度干旱胁迫和重度干旱胁迫各生理指标进行分析,根据离差平方和的大小排出评价序号,离差平方和的值越小说明抗旱能力越强;反之,说明抗旱性差。本研究将中度干旱胁迫和重度干旱胁迫的离差平方和取平均值进行柚木无性系抗旱性综合排序(见表5),可见,抗旱性强的柚木无性系有 7219、7509、7559、7122、Z408 和 7029。
3 结论与讨论
水分胁迫是植物生命过程中常遇到的逆境之一,会诱导植物体内发生各种生理生化反应,使植物细胞生理脱水,导致植株生长受到抑制甚至停止[13]。我国云南干热河谷和贵州南部热区,气候炎热干燥,降雨稀少且分布不均(70%~80%的雨水集中在6—8月份),土壤干旱瘠薄。水分因素是该类山区造林成败最主要的限制因子之一。柚木喜热量充足,本身具有较强的抗旱性,适合在干湿季明显的热区发展。有研究发现,分别在干旱和湿润地区种植的35年生柚木的心材与边材比例没有显著差异,通常认为湿润地区生长快的柚木边材比例高是没有根据的[14]。前期多年实践证明,柚木在我国干热河谷地区造林成活率和生长效果良好,发展前景十分广阔。因此,本研究评价柚木无性系的抗旱性,选择抗旱性强的柚木优良新品系,提高在干旱地区发展柚木商品林的产量和质量,具有十分重要的实践意义。
苗期是植物对环境敏感的关键时期,生理指标的变化可以反映苗期的抗性能力[15]。在柚木苗期抗寒生理评价方面,作者已报道了不同柚木无性系对冷害胁迫的生理响应[16],综合评价了各无性系的耐寒性差异,并结合大田冷害调查结果[17],选择出了一批耐寒性强的柚木优良无性系。Zhouet al.通过研究柚木苗期生理指标变化规律,发现接菌等外源物质诱导可以提高柚木无性系的耐寒性[18]。另外,目前已在柚木苗期开展了抗旱生理选育和抗旱生理机理研究[5-6]。上述研究提高了柚木早期选择的效果。
值得注意的是,生理指标的选择非常关键,单用一个指标很难说明植物复杂的抗性数量性状;只有采用多个指标进行综合评价,才能客观地反映植物的抗旱生理过程。作者在前期柚木冷胁迫生理试验过程中,对8个生理指标进行了全面评估,最终认为选择分析游离脯氨酸(FPRO)含量、超氧化物歧化酶(SOD)活性和相对电导率(EC)3个指标,可以很好的达到预期的选择效果,所得的结果和大田冷害调查结果相吻合[16-17]。本研究证明,该评价体系同样适用于柚木无性系抗旱性的生理评价。干旱胁迫后柚木无性系游离脯氨酸、超氧化物岐化酶表现出升高的变化趋势,且随着胁迫的加剧,增量更明显。由此说明,柚木在干旱胁迫下是通过增加渗透调解物质含量、降低水势、加强保水力来提高其抗旱能力;同时可通过增强抗氧化酶(SOD)活性提高抗氧化能力,以减轻干旱胁迫伤害。这与武勇等[7]对柚木抗旱机理研究的结果一致。

表5 欧几米德多向量理论综合评定柚木无性系抗旱性Table 5 Integrated evaluation of drought resistance among teak clones
本研究中度和重度干旱胁迫后柚木无性系相对电导率比处理前相对电导率无增加或个别无性系少量增加,与柚木冷胁迫和其他林木干旱胁迫后相对电导率上升的结果不同[16,19]。这可能有两个方面的原因:一是与柚木叶片大,夏季蒸腾作用快,而干旱处理过程中,供水严重不足导致了叶片失水萎蔫甚至发黄等特殊现象有关。二是柚木本身具有较强的抗旱性,本试验干旱胁迫可能还没有造成大量柚木无性系细胞膜透性增加、电解质外渗的情况。
本试验经过重度干旱处理结束后,对所有参试柚木无性系植株恢复正常供水,能够恢复生长,没有植株死亡,再次说明柚木本身具有较强的耐干旱能力。本研究比较分析了干旱处理前后不同柚木无性系3个生理指标的变化过程,发现从各单个生理指标分析来看,同一柚木无性系在不同生理指标中的抗旱排序会有所不同,即同一种植物材料在不同生理指标中可能表现不同[19-21],但这并不影响所有材料处理后生理指标变化的趋势规律和生理评价效果,也再次说明多个指标和多种方法综合评价的必要性。本研究综合考虑干旱处理胁迫后的表现观察结果和生理指标的评价结果,初步筛选出抗旱性强的柚木无性系有7544、Z408、7137、7114、7509、7531和7219,其次为7514、7559、7122和7029。结合大田测定速生选择结果[22],则柚木无性系Z408、7509、7029和7514可在我国云南干热河谷和贵州南部热区等地推广种植。
参考文献:
[1] White K J. Teak: some aspects of research and development [M].Yangon: San ThainKha Press, 1991: 70.
[2] Alcantara B K, Veasey E A. Genetic diversity of teak (Tectona grandisL.F.) from different provenances using microsatellite markers [J].Revista Arvore, 2013, 37(4): 747-758.
[3] 周铁烽. 中国热带主要经济树木栽培技术[M]. 北京: 中国林业出版社, 2001: 288-291.
[4] Montero R S, Moya R, Berrocal A,et al.General physical and mechanical properties, termites resistance and drying defects of lumber ofTectona grandisfrom plantations of different climatic and sites fertility condition [J]. J. Indian Acad Wood Sci., 2015,12(1):63–73.
[5] Husen A. Growth Characteristics, Physiological and Metabolic Responses of Teak (Tectona grandisLinn. f.) Clones Differing in Rejuvenation Capacity Subjected to Drought Stress [J]. Silvae Genetica, 2010, 59(2): 124-136.
[6] Rajendrudu G, Naidu C V, Mallikarjuna K. Effect of Water Stress on Photosynthesis and Growth in Two Teak Phenotypes [J].Photosynthetica, 2000, 36(4): 627-630.
[7] 武 勇,陈存及,刘 宝, 等. 干旱胁迫下柚木叶片生理指标的变化[J].福建林学院学报,2006,26(2):103-106.
[8] 郝再彬,苍 晶,徐 仲. 植物生理实验[M]. 哈尔滨:哈尔滨工业大学出版社, 2004: 104-106.
[9] Giannopolitis C N, Ries S K. Superoxide dismutase II. Purication and quantitative relationship with water-soluble protein in seedlings[J]. Plant Physiology, 1997, 59, 315-318.
[10] 陈建勋,王晓峰. 植物生理学实验指导[M]. 广州:华南理工大学出版社,2010:64-65.
[11] 王相娥,薛 立,谢腾芳, 等. 低温处理对6种园林绿化树种幼苗生理生化的影响[J].南京林业大学学报(自然科学版),2009,33(3): 139-142.
[12] Huner N P, Oquist G, Sarhan F. Energy balance and acclimation to light and cold [J]. Trends in Plant Science, 1998, 3(6):224-230.
[13] 吴志华, 曾富华, 马生健, 等.水分胁迫下植物活性氧代谢研究进展(综述Ⅰ) [J]. 亚热带植物科学, 2004, 33(2): 77-80.
[14] Thulasidas P K, Bhat K M. Log characteristics and sawn timber recovery of home-garden teak from wet and dry localities of Kerala, India [J]. Small-scale For, 2009, 8: 15-24.
[15] 孙一荣,朱教君,康宏樟. 水分处理对沙地樟子松幼苗膜脂过氧化作用及保护酶活性影响[J]. 生态学杂志,2008, 27(5):729-734.
[16] 黄桂华,梁坤南,周再知,等. 柚木无性系苗期抗寒生理评价与选择的研究[J].东北林业大学学报,2015,43(9): 12-17.
[17] 黄桂华,梁坤南,韦 海,等.柚木冷害调查及耐寒无性系选择[J]. 广东林业科技,2015,31(3):16-19.
[18] Zhou Zaizhi, Ma Huaming, Liang Kunnan,et al. Improved tolerance of teak (Tectona grandisL.f.) seedlings to lowtemperature stress by the combined effect of arbuscular mycorrhiza and paclobutrazol[J].Journal of Plant Growth Regulation, 2012, 31(3): 427-435.
[19] 唐洪辉,魏 丹,赵 庆,等. 干旱胁迫对宫粉羊蹄甲生理指标的影响[J]. 中南林业科技大学学报, 2017, 37(4): 7-13.
[20] 刘佳佳,王威力,王远东.陇东山地核桃抗旱保墒试验初报[J].河北林果研究,2016,31(4):367-369.
[21] 庞海颖,牛东伟,李彦慧,等.施用保水剂对仁用杏抗旱生理特性的影响[J].河北农业大学学报,2017,40(4):43-49.
[22] 黄桂华.柚木种质资源遗传变异和优良无性系早期选择的研究[D]. 北京: 中国林业科学研究院, 2015: 79-91.

