异常糖基化IgA1与儿童过敏性紫癜相关性研究
朱美君 宋磊 赵金华 邹蓉 陈艳红
过 敏 性 紫 癜(Henoch-Schonlein purpura,HSP)是儿童时期常见的一种由IgA介导的血管炎,临床上主要表现为皮肤紫癜、腹痛、关节肿痛以及肾脏受累(血尿和/或蛋白尿)。肾脏受累是影响HSP患儿预后的主要因素[1],部分患儿发展为终末期肾病。研究表明HSP血清及组织沉积的免疫复合物中,Ig A1铰链区存在半乳糖基缺乏,即异常糖基化Ig A1(galactosedef i cient Ig A1,Gd-Ig A1);异常糖基化Ig A1由抗多糖抗体识别,形成免疫复合物沉积于各组织器官的小血管壁,在HSP各脏器损伤中发挥重要作用[2-3]。本研究通过检测HSP患儿血清Gd-Ig A1水平,探讨异常糖基化IgA1与HSP各脏器损害的相关性。
1 临床资料
1.1 一般资料 选取2016年1月至12月本院儿科住院治疗初发 HSP患儿共72例。入选病例均符合HSP诊断标准[4];排除其他血管炎,且采取标本前均未使用激素及免疫抑制剂治疗。入选患儿按临床表现分为4组:(1)单纯紫癜组:主要表现为皮肤紫癜。(2)消化道受累组:除皮肤紫癜外,并发一系列消化道症状及体征。(3)关节受累组:除皮肤紫癜外,出现关节肿胀、疼痛、压痛及功能障碍等表现。(4)紫癜性肾炎(HSPN)组:除皮肤紫癜外,出现血尿和(或)蛋白尿。正常对照组50例,为同期本院儿保门诊体检的健康儿童。
1.2 标本采集 HSP患儿及对照组清晨空腹采集外周静脉血4ml,2000 r/min离心10min,分离血清置于-80℃冰箱冷冻待检。
1.3 血清 IgA、IgA1,及Gd-IgA1检测 采用散射比浊法测定血清IgA、IgA1;以蚕豆结合素(vicia villosa lectin-binding,VVL)亲和ELISA 法测定VVL 与血清Ig A1的结合力代表血清Ig A1 异常糖基化水平。
1.4 统计学方法 采用SPSS19.0统计软件。计量资料以(±s)表示,组间两两比较采用 LSD 检验,多组间比较采用方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 一般情况 72例HSP患儿,男42例,女30例;年龄3~14岁,平均年龄(7.2±2.5)岁。其中单纯紫癜组23例,男14例,女9例;年龄3.6~13.5岁,平均年龄(6.9±2.8)岁。消化道受累组16例,主要表现为腹痛伴呕血和(或)便血,男8例,女8例;年龄3.2~14岁,平均年龄(8.1±3.2)岁。关节受累组13例,男7例,女6例;年龄3~13.2岁,平均年龄(7.1±2.2)岁。紫癜性肾炎组20例,均有不同程度蛋白尿,伴或不伴血尿,其中男11例,女9例;年龄4.7~14岁,平均年龄(7.5±2.3)岁。正常对照组50例,男33例,女17例;年龄3~12岁,平均年龄(6.7±3.4)岁。各组间性别、年龄差异均无统计学意义(P>0.05),具有可比性。
2.2 各组指标比较 各临床类型HSP患儿中血清Gd-Ig A1、IgA、IgA1水平均高于对照组,差异有统计学意义(P均<0.05)。HSP四组间血清Gd-Ig A1水平差异有统计学意义(P均<0.01),血清Gd-Ig A1水平以紫癜性肾炎组最高,单纯紫癜组最低。而紫癜性肾炎组与其他组之间血清IgA及IgA1比较差异无统计学意义(P>0.05)。见表 1。
表1 各组血清IgA、IgA1、Gd-Ig A1水平比较(s)
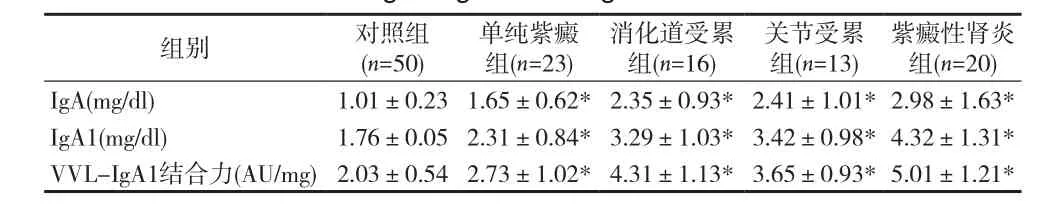
表1 各组血清IgA、IgA1、Gd-Ig A1水平比较(s)
注:HSP各组与对照组Gd-Ig A1、IgA、IgA1比较,*P<0.05
紫癜性肾炎组(n=20)IgA(mg/dl) 1.01±0.23 1.65±0.62*2.35±0.93*2.41±1.01*2.98±1.63*IgA1(mg/dl) 1.76±0.05 2.31±0.84*3.29±1.03*3.42±0.98*4.32±1.31*VVL-IgA1结合力(AU/mg)2.03±0.54 2.73±1.02*4.31±1.13*3.65±0.93*5.01±1.21*组别 对照组(n=50)单纯紫癜组(n=23)消化道受累组(n=16)关节受累组(n=13)
3 讨论
HSP 是一种由多种病因作用于有遗传背景的个体,由IgA介导,累及皮肤、胃肠道、关节、肾脏等多个系统的全身性血管炎症。研究表明,Ig A1分子异常糖基化参与了HSP的发病,免疫异常可能为主要的发病机制[5]。IgA主要由骨髓B细胞产生,包括IgA1及IgA2两个亚类。IgA1是一种糖蛋白,其分子的铰链区有-O-连接型聚糖链,其末端常被唾液酸化,通过与肝唾液糖蛋白受体结合而被清除。当患者血清中的IgA1发生异常的糖基化即去半乳糖基,去半乳糖基的IgA1失去了与肝细胞膜上特异性受体的结合能力,不能被肝细胞识别 、摄取和清除,并有自发聚合形成多聚IgA1或IgA1循环免疫复合物的倾向[6]。文献报道在 HSP 血清及毛细血管袢、肾小球系膜区、消化道黏膜组织等沉积的Ig A1均为半乳糖和/ 或唾液酸缺乏的 Ig A1,即 Gd-Ig A1[7]。国内最近一篇文献也报道难治性HSP、HSPN患儿的Gd-Ig A1水平均高于急性普通型HSP患儿,治愈组Gd-Ig A1水平与对照组比较无明显差异,提示Gd-Ig A1在HSP发病中发挥了关键作用[8]。
本研究显示,HSP 患儿各组IgA、IgA1水平及VVL和Ig A1结合力均显著高于对照组,提示IgA及其异常糖基化在HSP发病机制中起到重要作用。紫癜肾炎患儿血清异常糖基化Ig A1明显升高,提示异常糖基化Ig A1可作为过敏性紫癜肾脏损害的一个指标。同时也为临床中是否能够通过早期干预IgA1异常糖基化而阻止过敏性紫癜患儿发生肾脏损害提供了新的思路。
[1] Chen JY,Mao JH.Henoch-Schonlein purpura nephritis in children:incidence,pathogenesis and management.World J Pediatr,2015,11(1):29-34.
[2] Kawasaki Y, Ono A, Ohara S, et al. Henoch-Schönlein purpura nephritis in childhood: pathogenesis, prognostic factors and treatment. Fukushima J Med Sci,2013,59(1):15-26.
[3] Davin JC,Coppo R.Henoch-Schönlein purpura nephritis in children.Nat Rev Nephrol,2014,10(10):563-573.
[4] 胡亚美,江载芳.诸福棠实用儿科学.第八版.北京:人民卫生生出版社,2015:1204-1205.
[5] Park SJ,Suh JS,Lee JH,et al.Advances in our understanding of the pathogenesis of Henoch-Schönlein purpura and the implications for improving its diagnosis.Expert Rev Clin Immunol, 2013,9(12):1223-1238.
[6] Lau KK, Wyatt RJ, Moldoveanu Z, et al. Serum levels of galactosedeficient IgA in children with IgA nephropathy and Henoch-Schönlein purpura.Pediatric Nephrology,2007,22(12):2067-2072.
[7] Kawasaki Y, Ono A, Ohara S, et al. Henoch-Schönlein purpura nephritis in childhood: pathogenesis, prognostic factors and treatment. Fukushima J Med Sci, 2013,59(1):15-26.
[8] 袁芳,胡筱,王飞飞,等.过敏性紫癜患儿血清中 Ig A1 半乳糖基的缺失水平及临床意义.临床儿科杂志,2014,32(10):912-917.

