石墨烯材料在骨再生和抗菌领域应用的研究进展*
刘一飞 陈云丰*
石墨烯材料(graphene materials),泛指与石墨烯(graphene,G)相关的二维碳材料,主要包括石墨烯及其衍生物[1]。石墨烯于2004年英国曼切斯特大学科学家Novoselov等[2]通过微机械力剥离制备而得,其结构是由碳原子以sp2杂化轨道组成,只有一个碳原子厚度。由于石墨烯的独特理化性质和生物相容性,其不仅在电子器件、新型材料方面得到了广泛研究,在医用领域(包括生物传感、疾病诊断、药物载体和基因传递、抗菌和抗病毒材料、细胞和肿瘤成像、肿瘤的光热治疗以及组织工程)也具有潜在的应用前景[3]。
石墨烯相关的纳米材料有很多种,其中与生物医学领域相关的主要有氧化石墨烯 (graphene oxide,GO)、还原性氧化石墨烯 (reduced graphene oxide,rGO)、石墨烯纳米片(graphene nanosheets,GNS)等,它们在结构、尺寸、表面基团等方面各不相同,从而具有不同的应用价值[4]。本文将从石墨烯材料的生物相容性、成骨活性、抗菌能力等角度,总结近年来在骨科领域的研究进展,以期为未来基础和临床研究提供可取的信息。
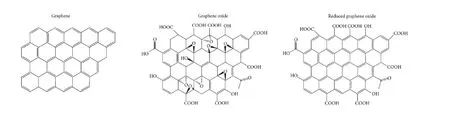
图1,石墨烯,氧化石墨烯,还原性氧化石墨烯的结构示意图。
1 石墨烯材料的生物相容性
石墨烯及其衍生物在生物医学领域的应用,首先应该评估其生物相容性。碳纳米材料的形状和物理化学特性对于细胞,组织和器官的相互作用起着非常重要的作用[5]。
1.1 细胞毒性
大量研究表明,石墨烯材料对于细胞的毒性,呈尺寸依赖性和浓度依赖性[6]。一般而言,高浓度、大尺寸的石墨烯材料颗粒,对细胞的损伤是不可忽略的,这些损伤包括:细胞坏死或凋亡、溶血与血栓、诱导免疫炎症反应等[6]。Wang等[6]测试了GO对人成纤维细胞的毒性,GO与细胞共培养5天后结果显示,小于20 g/mL的GO对细胞无明显毒性,而大于50 g/mL的GO可因介导细胞凋亡而显示出毒性。Chng等[7]报道了相同浓度的GO,大尺寸GO(310 nm×5000 nm)对 A549细胞的毒性要大于小尺寸 GO(100 nm×100 nm)。Peruzynska M[8]则比较了相同浓度下的单层GO和4层 GO对细胞的毒性,结果发现4层 GO的毒性低于单层GO,可能是由于单层GO暴露更多的含氧基团进而产生更多的氧自由基 ROS。由于GO合成工艺不同和尺寸大小不一,其细胞毒性的标准也因实验条件而异。但为了确保石墨烯材料的生物安全性,应至少保证其低浓度(<50 g/mL~80 g/mL)和小尺寸(<100 nm)。
1.2 石墨烯材料在体内的生物学行为
按照体内药代动力学原理分析,经静脉注射的石墨烯材料在体内的吸收和分布呈现一定的规律。一般而言,小尺寸GO(100 nm ~500 nm)主要积累在肝、脾中,而大尺寸GO(1 m~5 m)主要积累在肺部[11],可能与大尺寸GO能吸附血清蛋白形成较大的 GO蛋白复合物有关[12]。在高剂量(10 mg/kg)注射GO时,可以发现肉芽肿性损伤、肺水肿、炎性细胞浸润和纤维蛋白溶解[11]。石墨烯材料被细胞摄取的方式,也随尺寸大小而不同。Mu等人[13]研究小鼠间充质祖细胞C2C12与被蛋白修饰后GO(protein-coated GO,PCGO)的相互作用时发现,较大尺寸的GO(500 nm~1 m),由细胞吞噬作用形成吞噬小体 (phagosome)进入细胞,而较小尺寸的GO(~500 nm),由细胞胞吞作用形成胞内体 (endosome)进入细胞,两者均进入溶酶体进行降解(见图2)。
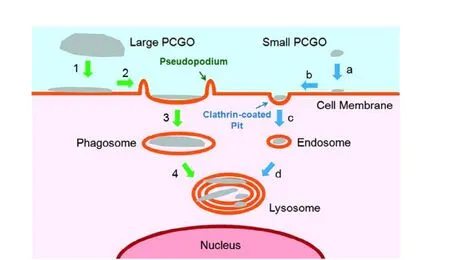
图2,细胞摄取大、小尺寸的GO过程示意图[13]。PCGO:蛋白修饰后的GO(protein-coated GO)。较大尺寸的GO(500 nm~1 m),由细胞吞噬作用形成吞噬小体进入细胞,而较小尺寸的GO(~500 nm),由细胞胞吞作用形成胞内体进入细胞,两者均进入溶酶体进行降解。
而对于石墨烯材料的降解,一般符合以下规律:尺寸越小越易降解[14];含氧量越高,可降解性越好,即GO>rGO>G[15]。在细胞层面,石墨烯的降解主要由中性粒细胞和吞噬细胞参与[16]。通过胞吞等方式进入细胞内的石墨烯最终达到溶酶体,在三种过氧化物酶:MPO、EPO、LPO共同参与下,完成生物降解过程[14],有学者使用气相色谱-质谱分析法(GC-MS)分析,证明了GO最终氧化产物是
1.3 石墨烯材料的功能化修饰
GO分子中有丰富的含氧基团(如-OH,-COOH等等),通过与这些含氧基团形成共价或非共价键,使某些有机大分子物质与GO相连,称为GO的功能化或功能化修饰。这些大分子包括:聚乙二醇(PEG)、壳聚糖(CS)、聚乙烯亚胺(PEI)、牛血清蛋白(BSA)等等。修饰大分子之后的GO大大减少了自身的细胞毒性,具有良好的生物相容性,可降解性,也赋予了GO负载药物和蛋白的功能(如抗肿瘤药物、BMP等)[18,19]。在用PEG化石墨烯以20 mg/kg注射小鼠后,在90天后通过组织学和血液学分析证实,没有显著的毒性[20]。功能化GO毒性降低可能由于以下几个原因:功能基团使其在不同的溶液中更加分散和稳定,避免聚集;减弱GO与细胞和组织之间的疏水相互作用;改变了表面电荷,降低了静电排斥,从而改善细胞摄取[21]。另外,功能化的 GO虽然细胞毒性降低,但仍保留一定对细菌的杀伤力,详见下文论述。
由于基于石墨烯的材料可以被功能化,其生物医学应用的前景越来越受到关注。尽管如此,功能化石墨烯的潜在长期不利影响也不容忽视。在材料可以在生物系统中大量使用之前,需要进一步研究其安全性、生物分布和不利影响。
2 石墨烯材料在干细胞成骨分化中的作用
2.1 石墨烯材料对MSC成骨分化的影响
骨组织重建,是骨科临床工作中最主要的问题。随着干细胞治疗思路的发展,基于人间充质干细胞(hMSC)的成骨分化能力进行骨组织重建一直是组织工程领域的研究热点。近年来,有多项研究表明,石墨烯材料对MSC有粘附和促成骨分化作用。
G加速了MSC的成骨分化并增加了骨钙素的表达和钙盐沉积。Nayak等人[22]使用化学气相沉积法(CVD),将石墨烯涂覆在四种具有不同的刚度和表面粗糙度的基底物(聚二甲基硅氧烷(PDMS),PET,玻璃载片和Si/SiO2)表面,并用这些基底物培养hMSC,以研究石墨烯对干细胞生长的影响。结果 如图3所示(纵坐标代表钙盐沉积程度),当没有BMP-2培养时,与没有石墨烯的基底物相比,具有石墨烯的所有四个基质显示出较高的钙盐沉积。此外,即使在与BMP-2一起培养后,具有石墨烯的组显示较高的钙盐沉积。同时石墨烯增强了骨钙素的表达,并加速了 hMSC中的钙沉积。这证明石墨烯不仅表现出促进 hMSCs的成骨趋势,而且与BMP-2一起协同作用于骨组织生成。
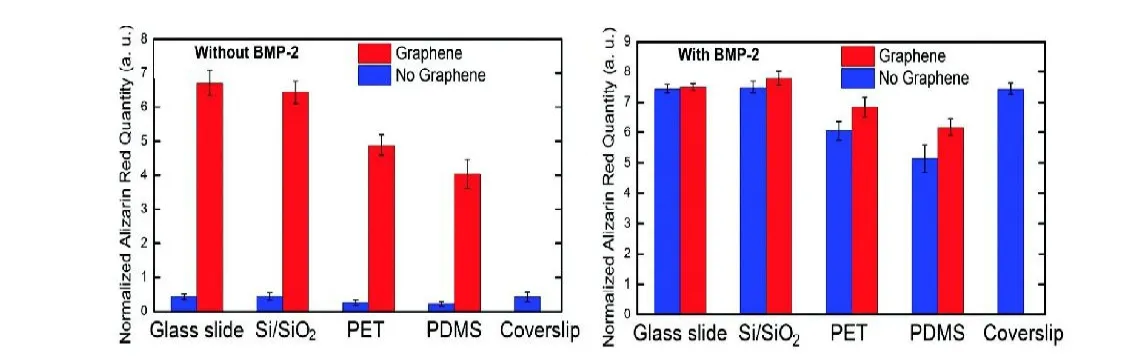
图3,不同细胞培养基底材质上有无石墨烯对hMSC中茜素红染色(钙盐沉积程度)的影响(左:未加入BMP-2;右:加入BMP-2)[22]
G和GO对成骨诱导剂有吸附浓缩的作用。Lee等人[23]使用石墨烯作为基底物培养 MSC,并在培养过程中,加入成骨诱导剂,如胰岛素,地塞米松,磷酸 -甘油酯和抗坏血酸。如图所示,含有成骨诱导剂和G/GO组的钙盐沉积高于其他组。与之前完成化学诱导的成骨分化需要21天[24]相比,使用石墨烯只需要12天。由于分子中芳香环和石墨烯基底层之间的 -堆叠,地塞米松可以被吸附[23]。而抗坏血酸的-OH部分和GO之间形成的氢键的程度,GO易于与抗坏血酸结合[23,25]。石墨烯材料吸附典型的成骨诱导剂如地塞米松和 -甘油磷酸酯的能力,最终加速了成骨分化过程[23,25]。由此可见,石墨烯材料可以通过吸附浓缩成骨诱导剂而加速干细胞成骨分化过程。

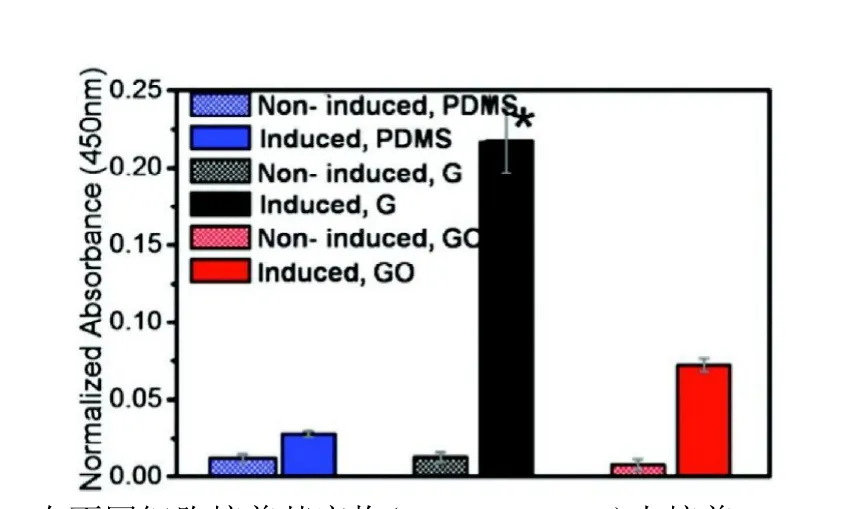
图4,A在不同细胞培养基底物(PDMS,G,GO)上培养BMSC 12小时后茜素红染色情况(i,iii,V有成骨诱导剂;ii,iv,vi无成骨诱导剂);B不同基底物和有无成骨诱导剂条件下,茜素红染色定量分析[23]。
MSC在G基底物表面,呈有利于成骨分化的纺锤形态生长。在Kalbacova等人[26]的实验中,在G和SiO2基底物上MSC细胞生长呈现显著差异。培养48小时后,在G上生长的MSC呈现纺锤形并均匀覆盖整个基底,而SiO2上生长的MSC呈现多边形并聚集成簇,形成相互分离的“岛”。MSC的细胞形态与不同谱系的分化方向有关[27],是调节生物过程如细胞增殖和进一步分化的主要因素之一[27,28]。与在氧化硅上培养的多边形细胞相比,石墨烯上的纺锤形 MSC和成骨细胞可显示更高的增殖率。细胞群体中这种形态分化可能与石墨烯的表面疏水性质、表面的粗糙度和形状、细胞与基底物的分子间作用力有关[29,30]。
2.2 石墨烯复合生物材料对MSC成骨分化的影响
2.2.1 石墨烯复合无机材料
羟基磷灰石(HA)是一种磷酸钙陶瓷,因为其与骨骼中天然磷灰石的化学相似性[31],通常用于骨修复或再生。GO添加到HA涂层可以增加钛上的涂层粘附强度,与纯HA涂层相比,GO/HA复合涂层的耐腐蚀性也更好。此外,与钛基底相比,GO改性的涂层具有更高的细胞活力[32]。在硅酸钙中添加1.5%的石墨烯,可以增强材料的耐磨性,并提高其细胞粘附性[33]。Lee等人[34]则证实了rGO与HA协同增强了hMSCs的自发成骨分化。Rameshwar[35]的团队合成了GO-CaP纳米复合材料,体外培养hMSCs以检测GO-CaP的成骨诱导能力。免疫荧光染色结果显示,GO-CaP成骨活性最高,其次是 CaP、GO、对照组,如图5。进一步的研究结果表明,GO-CaP纳米复合材料不仅促进了hMSCs的成骨,而且促进了成骨细胞的钙沉积。GO-CaP,2周后免疫荧光图像显示骨钙素(OCN)和碱性磷酸酶(ALP)的含量均为GO-CaP组最高(绿色代表OCN或ALP)[35]。
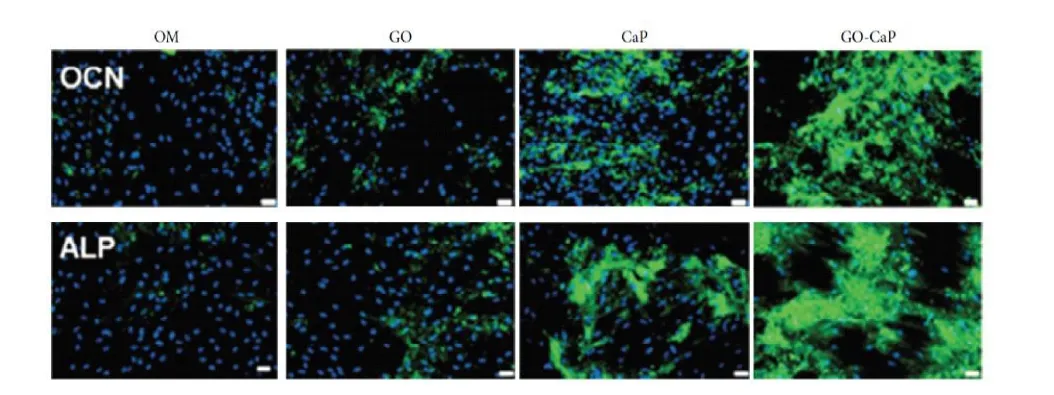
图5,GO-CaP的成骨诱导实验:MSC体外培养时加入分别GO、CaP、
2.2.2 石墨烯复合有机高分子材料
有机高分子聚合物经过石墨烯修饰,不仅材料性质发生变化,也能为细胞存活和分化提供了更好的环境。向明胶基复合物中加入1wt%的GO显着提高了拉伸强度,杨氏模量和断裂能分别为84%,65%和158%[36]。添加rGO后的壳聚糖的粗糙度和表面积的增加,从而增强了MSC的粘附和成骨细胞分化[37]。GO-聚己内酯(GO-PCL)在模拟体液中,可通过促进HA纳米颗粒的集结而增强生物矿化过程[38]。
另外,石墨烯可以通过胶体化学原理形成自支撑石墨烯水凝胶(SGH),由于石墨烯的固有波纹和相邻石墨烯片之间的溶剂化排斥,导致在SGH内集中的大量分离的石墨烯片[39]。在大鼠的皮下植入 SGH膜12周后可见形成微小新血管。SGH膜不仅允许BMSC的细胞粘附和增殖,还能够刺激干细胞的成骨分化而无需额外的化学诱导剂。这种能力可以归因于SGH膜的波纹结构和多孔表面,其可作为细胞粘附的锚定点并通过改变细胞骨架张力而影响细胞形态[39]。
3 石墨烯材料的抗菌作用
GO的抗菌作用由Hu等[40]在2010年首次报道。他们将浓度为85 g/mL的GO与大肠埃希菌共同培养2 h,发现大肠埃希菌数量减少了98.5%。随后众多研究者纷纷报道了GO的抗菌作用:GO对金黄色葡萄球菌、沙门菌、大肠埃希菌等G+菌和G-菌均有良好的抗菌作用,其抗菌活性成浓度依赖性和时间依赖性[41-43]。Liu等[43]评价了不类型的石墨烯材料的抗菌效果,结果显示rGO的抗菌效果最好,其次是GO。在此研究的基础上,近期的工作主要是研究石墨烯复合无机低分子和复合有机高分子材料的抗菌性能。Lim等[44]比较了CS(壳聚糖)、GO、rGO、CS/GO和CS/rGO对铜绿色假单胞菌的抗菌效果,结果发现CS/rGO在低浓度时,即可显示明显的抑菌效果。除此之外,聚乙烯亚胺(PEI)-rGO-AgNP复合纳米材料[45]、Ag@rGOFe3O4-PEI[46]复合材料等也被证明有很好的抗菌效果。
与骨科内植物相关的感染中,细菌形成生物膜是感染难以治愈的重要原因。近年来许多学者针对如何破坏生物膜做了大量研究,如朱晨等人[47,48]研究了人 防御素3有抑制细菌形成生物膜的作用。同样,石墨烯材料也被证明有抗生物膜作用。Guo等人[49]发现rGO在大于50 g/mL的浓度时可以显著抑制大肠杆菌和金葡菌的生物膜形成。Shatavari Kulshrestha等人利用GO复合纳米Ag,发现GO-Ag在94
g/mL和47 g/mL浓度下能分别抑制金葡菌和大肠杆菌生物膜的形成[50]。Sachin Kumar等人使用GO复合聚己内酯(GO-PCL),发现其对大肠埃希菌生物膜的形成有显著的抑制作用[51]。Jia等人制备了金属钛表面的GO涂层,观察到其对金葡菌生物膜具有破坏和抑制作用[52]。由此可见GO对游离细菌和细菌形成的生物膜,都具有杀伤作用。
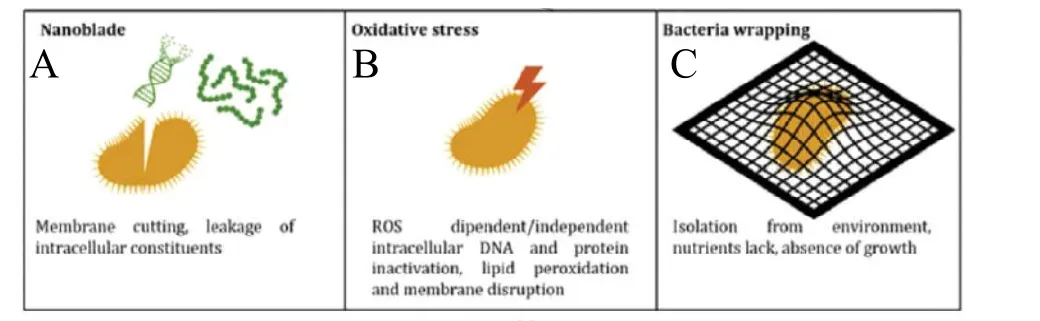
图6,氧化石墨烯的抗菌作用机制:A纳米刀片;B活性氧(ROS)诱导氧化应激;C网状包裹[53]。
4 总结与展望
由于独特的结构和卓越的性能,石墨烯及其衍生物具有巨大的生物医学应用潜力。石墨烯修饰的底物和材料有良好的生物相容性,允许细胞粘附和增殖,可以功能化以结合生物分子,加速MSC增殖分化,改变MSC的生长形态以促进其分化成成骨谱系,这些使得石墨烯材料作为成骨分化诱导剂有很好的前景。同时石墨烯材料以其不同于抗生素的杀菌能力,在解决抗生素耐药性领域也越来越受到关注。另外,由于石墨烯的功能化赋予了自身卓越的载药性能,在药物和活性蛋白的缓释方面也有不俗的表现。而在骨科领域,石墨烯材料以其优越的成骨活性和杀菌特性,在治疗骨感染方面可能有令人预料不到的优势。但在其临床应用之前,仍存在一些挑战:是石墨烯材料的细胞毒性和降解性,但由于对其毒性机制和降解机制的研究已经比较成熟,相信不久的将来会出现令人满意的解决方法。是缺乏对由石墨烯刺激的干细胞分化所涉及的机制和信号通路的的理解,目前尚未有学说予以解释。此外,应用于体内之前,一定要充分评估其在组织和器官中的生物分布及其代谢途径。尽管用于骨科领域的石墨烯的研究仍处于早期发展阶段,但鉴于其优越的性能,石墨烯材料会有光明的未来。
[1] 中国科学院金属研究所、东南大学、泰州石墨烯研究及检测平台、中国科学院半导体研究所、泰州巨纳新能源有限公司.Q/LM01CGS001-2013石墨烯材料的名称术语和定义[S]//中国石墨烯产业技术创新战略联盟.北京:2013.
[2] Novoselov K.S,Geim A.K,Morozov SV,et al.Electric field effect in atomically thin carbon films[J].Science,2004,306(5696):666-669.
[3] Nezakati T,Cousins BG,Seifalian AM.Toxicology of chemically modified graphene-based materials for medical application[J].Arch Toxicol,2014,88(11):1987-2012.
[4]Sanchez VC, Jachak A, Hurt RH, et al. Biological interactions ofgraphene—family nanomaterials: an interdiscip1inary review[J]Chem Res Toxieol, 2011, 25(1): 15-34.
[5] Zhang Y, Ali SF, Dervishi E, et al. Cytotoxicity effects of grapheneand single-wall carbon nanotubes in neural phaeochromocytomaderivedPC12 cells[J]. ACS Nano, 2010, 4(6): 3181-3186.
[6] Wang K,Ruan J,Song H,et al.Biocompatibility of Graphene Oxide[J].Nanoscale research letters,2011,6(1):8.
[7] Chng EL, Chua CK, Pumera M. Graphene oxide nanoribbons exhibitsignificantly greater toxicity than graphene oxide nanoplatelets[J]. Nanoscale, 2014, 6(18): 10792-10797.
[8] Peruzynska M, Cendrowski K, Barylak M, et al. Comparative invitro study of single and four layer graphene oxide nanoflakes -Cytotoxicity and cellular uptake[J]. Toxicology in vitro : an internationaljournal published in association with BIBRA. 2017,41: 205-213.
[9] Sasidharan A, Panchakarla LS, Chandran P, , et al. Differentialnano-bio interactions and toxicity effects of pristine versus functionalizedgraphene[J]. Nanoscale. 201, 3(6): 2461-2464.
[10]陈芳,刘琴,王丽平,等.纳米材料产生细胞毒性原因的研究进展[J].生物骨科材料与临床研究,2015,12(01):67-71.
[11]Zhang XY, Yin JL, Peng C, et al.Distribution and biocompatibilitystudies of graphene oxide in mice after intravenous administration[J]. Carbon, 2011, 49(3): 986-995.
[12]Hu W,Peng C,Lv M,et al.Protein coronamediated mitigation of cytotoxicity ofgraphene oxide[J].ACS Nano,2011,5:3693-3700.
[13]Mu Q,Su G,Li L,et al.Size-dependent cell uptake of protein-coated graphene oxide nanosheets[J].ACS Appl.Mater.Interfaces,2012,4(4):2259-2266.
[14]Bhattacharya K,Mukherjee SP,Gallud A,et al.Biological interactions of carbon-based nanomaterials:From coronation to degradation[J].Nanomedicine.2016,12(2):333-351.
[15]Holt BD,Wright ZM,Arnold AM,et al.Graphene oxide as a scaffold for bone regeneration[J].Wiley interdisciplinary reviews Nanomedicine and nanobiotechnology,2017,9(3):e1437.
[16]Girish CM,Sasidharan A,Gowd GS,et al.Confocal Raman imaging study showing macrophage mediated biodegradation of graphene in vivo[J].Adv Healthc Mater,2013,2:1489-500.
[17]Kotchey GP,Allen BL,Vedala H,et al.The enzymatic oxidation of graphene oxide[J].ACS nano,2011,5(3):2098-2108.
[18]SLiu Z,Robinson JT,Sun X,et al.PEGylated nanographene oxide for delivery of water-insoluble cancer drugs[J].Journal of the American Chemical Society,2008,130(33):10876-10877.
[19]Zhang LM,Xia JG,Zhao QH,et al.Functional graphene oxide as a nanocarrier for controlled loading and targeted delivery of mixed anticancer drugs[J].Small,2010,6(4):537-544.
[20]Yang K,Wan J,Zhang S,et al.In vivo pharmacokinetics,long-term biodistribution,and toxicology of PEGylated graphene in mice[J].ACS Nano,2011,5(1):516-522.
[21]Zhang Y,Nayak TR,Hong H,Cai W.Graphene:a versatile nanoplatform for biomedical applications[J].Nanoscale,2012,4(13):3833-3842.
[22]Nayak TR,Andersen H,Makam VS,etal.Graphene for controlled and accelerated osteogenic differentiation of human mesenchymal stem cells[J].ACS Nano,2011,5(6):4670-4678.
[23]WC.Lee,C.H.Y.X.Lim,H.Shi,et al.Origin of enhanced stem cell growth and differentiation on graphene and graphene oxide[J].ACS Nano,2011,9(5):7334-7341,2011.
[24]Pittenger MF,Mackay AM,Beck SC,et al.Multilineage potential of adult human mesenchymal stem cells[J].Science,1999,284(5411):143-147.
[25]Akhavan,E.Ghaderi,M.Shahsavar.Graphene nanogrids for selective and fastosteogenic differentiation ofhuman mesenchymal stem cells[J].Carbon,2013,59(7):200-211.
[26]Kalbacova M,Broz A,Kong J,et al.Graphene substrates promote adherence of human osteoblasts and mesenchymal stromal cells[J].Carbon,2010,48(15):4323-4329.
[27]R.McBeath,D.M.Pirone,C.M.Nelson,et al.Cell shape,cytoskeletal tension,and RhoA regulate stem cell lineage commitment[J].Developmental Cell,2004,6(4):483-495.
[28]Chen CS,Mrksich M,Huang S,et al.Geometric control of cell life and death[J].Science,1997,276(5317):1425-1428.
[29]Leenaerts O,Partoens B,Peeters FM.Water on graphene:hydrophobicity and dipole moment using density functional theory[J].Phys Rev B,2009,79:235440-235445.
[30]Akasaka T,Yokoyama A,Matsuoka M,et al.Thin films of singlewalled carbon nanotubes promote human osteoblastic cells(Saos-2)proliferation in low serum concentrations[J].Mater Sci Eng C-Mater Biol Appl,2010,30(3):391-399.
[31]Depan D,Girase B,Shah JS,et al.Structure-process-property relationship of the polar graphene oxide-mediated cellular response and stimulated growth of osteoblasts on hybrid chitosan network structure nanocomposite scaffolds Graphene oxide as a scaffold for bone regeneration[J].Acta biomaterialia,2011,7(9):3432-3445.
[32]M.Li,Q.Liu,Z.Jia et al.Graphene oxide/hydroxyapatite compos-ite coatings fabricated by electrophoretic nanotechnology for biological applications Graphene oxide as a scaffold for bone regeneration[J].Carbon,2014,67(34):185-197.
[33]Xie Y,Li H,Zhang C,et al.Graphene-reinforced calcium silicate coatings forload-bearing implants[J].Biomedical materials,2014,9(2):025009.
[34]Lee JH,Shin YC,Jin OS,et al.Reduced graphene oxide-coated hydroxyapatite composites stimulate spontaneous osteogenic differentiation of human mesenchymal stem cells[J].Nanoscale,2015,7(27):11642-11651.
[35]Tatavarty R,Ding H,Lu G,et al.Synergistic acceleration in the osteogenesis of human mesenchymal stem cells by graphene oxide-calcium phosphate nanocomposites[J].Chemical communications,2014,150(62):8484-8487.
[36]Wan C,Frydrych M,Chen B.Strong and bioactive gelatin-graphene oxide nanocomposites[J].Soft Matter,2011,7(13):6159-6166.
[37]J.Kim,Y.-R.Kim,Y.Kim,et al.Graphene-incorporated chitosan substrata for adhesion and differentiation of human mesenchymal stem cells[J].Journal of Materials Chemistry B,2013,1(7):933-938.
[38]Wan C,Chen B.Poly(epsilon-caprolactone)/graphene oxide biocomposites:mechanical properties and bioactivity[J].Biomedical materials,2011,6(5):055010.
[39]J.Lu,Y.-S.He,C.Cheng,et al.“Self-supporting graphene hydrogel film as an experimental plat form to evaluate the potential of graphene for bone regeneration”[J].Advanced Functional Materials,2013,23(28):3494-3502.
[40]Hu W,Peng C,Luo W,et al.Graphene-based antibacterial paper[J].ACS Nano,2010,4(7):4317-4323.
[41]Krishnamom Chy K,Veerapandian M,Zhang LH,et al.Antibacterial eficiency of graphene nanosheets against pathogenic bacteria via lipid peroxidation[J].J Phys Chem C,2012,116(32):17280-17287.
[42]Akhavan O,Ghaderi E.Toxicity of graphene and graphene oxide nanowalls against bacteria[J].ACS Nano,2010,4(10):5731-5736.
[43]Liu S,Zeng TH,Hofmann M,et al.Antibacterial activity of graphite,graphite oxide,graphene oxide,and reduced graphene oxide:membrane and oxidative stress[J].ACSNano,2011,5(9):6971-6980.
[44]Lim HN,Huang NM,Loo CH.Facile preparation of graphene-based chitosan films:Enhanced thermal,mechanical and antibacterial properties[J].J Non-cryst Solids,2012,358(3):525-530.
[45]Some S,Ho SM,Dua P,etal.Dualfunctionsofhighly potent graphene derivative-poly-L-lysine composites to inhibit bacteria and support human cells[J].ACS nano,2012,6(8):7151-7161.
[46]Wang N,Hu B,Chen ML,et al.Polyethylenimine mediated silver nanoparticle-decorated magnetic graphene as a promising photothermal antibacterial agent[J].Nanotechnology,2015,26(19):195703.
[47]朱晨,尚希福,孔荣,等.人 防御素3体内抑制耐甲氧西林葡萄球菌内植物生物膜感染的机制研究[J].生物骨科材料与临床研究,2017,14(04):1-5.
[48]朱晨,孔荣,方诗元,等.人工关节假体周围感染与无菌性松动界膜组织中人 -防御素3的表达差异分析[J].生物骨科材料与临床研究,2016,13(02):12-16.
[49]Guo Z,Xie C,Zhang P,etal.Toxicity and transformation of graphene oxide and reduced graphene oxide in bacteria biofilm[J].The Science of the total environment,2017,15(580):1300-1308.
[50]Kulshrestha S, Qayyum S, Khan AU. Antibiofilm efficacy of greensynthesized graphene oxide-silver nanocomposite using Lagerstroemiaspeciosa floral extract: A comparative study on inhibitionof gram-positive and gram-negative biofilms[J]. Microb Pathog,2017, 103: 167-177.
[51]Kumar S,Raj S,Kolanthai E,et al.Chemical Functionalization of Graphene To Augment Stem Cell Osteogenesis and Inhibit Biofilm Formation on Polymer Composites for Orthopedic Applications[J].ACS Appl Mater Interfaces,2015,7(5):3237-3252.
[52]Jia Z,Shi Y,Xiong P,et al.From Solution to Biointerface:Graphene Self-Assemblies of Varying Lateral Sizes and Surface Properties for Biofilm Control and Osteodifferentiation[J].ACS Appl Mater Interfaces,2016,8(27):17151-17165.
[53]Valentina Palmieri,Massimiliano Papi,Claudio Conti,et al.The future development of bacteria fighting medical devices:the role of graphene oxide[J].Expert Review of Medical Devices,2016,13(11):1013-1019.

