含纳米银颗粒的-磷酸三钙复合支架的抗菌性和促成骨性的研究*
管捷程坚谢幼专*卢建熙
骨损伤会显著降低患者的生活质量,骨植入物对于骨骼的修复至关重要。自体骨移植因其具有良好的骨传导性和骨诱导性而作为骨缺损植入的金标准[1,2]。然而,由于自体骨供应短缺和供体部位并发症,自体骨在临床上的应用仍是有限的[3]。在此基础上,人工骨替代材料引起了人们的极大关注。其中,-磷酸三钙( -TCP)生物陶瓷具有与无机骨相似的化学组成,在体内外表现出良好的生物相容性和骨诱导能力,在体内具有一定的降解能力,被越来越广泛的应用于骨科领域[4,5]。然而,骨科植入物感染是导致骨科手术失败的重要原因之一,且在本身存在活动性骨髓炎感染时,骨植入物因存在植入新感染灶的风险而被禁止使用[6-8]。因此,如何增强植入材料的抗菌性成为了骨组织工程材料研究的重要课题。
近年来,纳米银作为一种良好的杀菌剂而引起了研究者们的广泛关注。因其具有广谱抗菌性,即对革兰氏阳性菌和革兰氏阴性菌均具有良好的杀菌效果[9],且体内研究表明,低剂量纳米银对微生物高毒性而对哺乳动物毒性较低[10,11]。Zhong等[12]研究发现,复合2%纳米银(v/v)的乳酸-羟基乙酸共聚物(PLGA)支架,可控制耐万古霉素金黄色葡萄球菌引起的骨感染,并促进骨组织的生长。
本组在前期研究中,合成了一种含5%纳米银的多孔 -TCP复合支架( -TCP-Ag)。在近期研究工作中,建立了骨缺损的兔骨髓炎模型,并对 -TCP-Ag进行了体内外研究。
1 材料与方法
1.1 材料制备
首先定量称取作为造孔剂的聚甲基丙烯酸甲酯(PMMA)颗粒0.2 g,均匀倒入模具腔内,加丙酮固定15 min后用蒸馏水冲洗,使模具内PMMA固定成形;将65 g的 -TCP粉末溶解至100 g去离子水中制成 -TCP匀浆;再将 -TCP匀浆分成两组,一组不加纳米银粉,一组加入1.71 g纳米银粉颗粒。然后将各匀浆倒入模具中,分别制成100%-TCP支架胚体和含5%纳米银颗粒的 -TCP支架胚体( -TCP-Ag)。
胚体首先通过60℃,12 h干燥,以5℃/min升温至220℃保温16 h,再以0.5℃/min升温至260℃保温7 h,然后用LHT6/120气化炉以0.5℃/min升温至290℃保温30 min使有机物气化消除。随后在LH120/14-P300烧结炉内,以5℃/min升温至烧结温度1100℃,保温3 h。烧结后纳米银变成纳米氧化银颗粒,制备得到见图1所示的6 mm×12 mm含5%纳米银 -磷酸三钙支架( -TCP-Ag)和6 mm×12 mm纯的 -磷酸三钙支架( -TCP),封装后用环氧乙烷消毒保存。

图1,支架材料实物图:左侧为100%-TCP支架,右侧为含5%纳米银的 -TCP支架。
1.2 大鼠骨髓间充质干细胞(rBMSCs)分离和培养
将Sprague Dawley大鼠用颈椎脱臼法处死后放入75%乙醇溶液中消毒15 min。分离双侧股骨,注意股骨周围的肌肉组织应完全分离,并将骨膜剥离以减少成纤维细胞的污染。离断股骨两端,将骨髓冲洗至含90%培养基和10%胎牛血清的组织培养液中,并装于10 cm直径的培养皿中。每隔2天换一次组织培养液,用光学显微镜观察是否有杂细胞,待细胞80%近汇合后传代培养。后续实验所用rBMSCs均为第三至第五代细胞。
1.3 材料浸提液制备
将 -TCP-Ag和 -TCP分别放入200 mL组织培养液中在37℃下浸泡72 h后过滤,制备得到两种浸提液。
1.4 细胞毒性实验
制备rBMSCs浓度为1×105个/mL的浸提液细胞悬液和组织培养液细胞悬液 (作为空白对照组)加入96孔板中,每孔加100 L,在37℃细胞培养箱中分别培养1、3、5和7天,每 2天换浸提液,各时间点每孔加入 10 L Cell Counting Kit-8(CCK-8)试剂,用酶标仪检测450 nm波长下各孔OD值。
1.5 兔股骨骨髓炎模型建立
选取2.5 kg~3.0 kg的新西兰雄兔28只,购置于上海甲干生物科技有限公司,许可证号:SYXK(沪)2013-0087,本研究中的动物实验通过上海交通大学附属第九人民医院医学实验动物伦理委员会审批同意,伦理号:HKDL [2017]291。用临时配置的2.5%硫贲妥钠0.6 mL/kg肌肉注射麻醉,术中必要时耳缘静脉追加用药0.1 mL/kg维持良好的麻醉状态。麻醉后取仰卧位,将左膝关节周围剃毛,聚维酮碘消毒,铺巾。取左髌外侧纵切口,长约2 cm切开皮肤、皮下,显露股骨远端外上髁,用电动磨钻钻取直径3.5 mm的孔,实验组(24只)于孔内注入1×107CFU/mL金黄色葡萄球菌0.1 mL及0.1 mL 5%鱼肝油酸钠[13](见图2A,彩图见插页);对照组(4只)于孔内注入0.2 mL生理盐水,孔洞用无菌骨蜡封闭,缝合皮肤,术后拍摄X线片。所有兔子饲养4周后再次拍摄X线片,此期间内隔日测量体温和体重。
1.6 -TCP-Ag支架植入
待4周后挑选成功建立家兔骨髓炎模型组兔子,麻醉后,取仰卧位,将左膝关节周围剃毛,聚维酮碘消毒,铺巾。用临时配置的2.5%硫贲妥钠0.6 mL/kg肌肉注射麻醉,术中必要时耳缘静脉追加用药0.1 mL/kg维持良好的麻醉状态。在相同部位做约2 cm切口暴露股骨外上髁后用电动磨钻钻取直径6 mm的孔,植入 -TCP-Ag和 -TCP(见图2B,彩图见插页),缝合皮肤。术后分别正常饲养4周和12周。
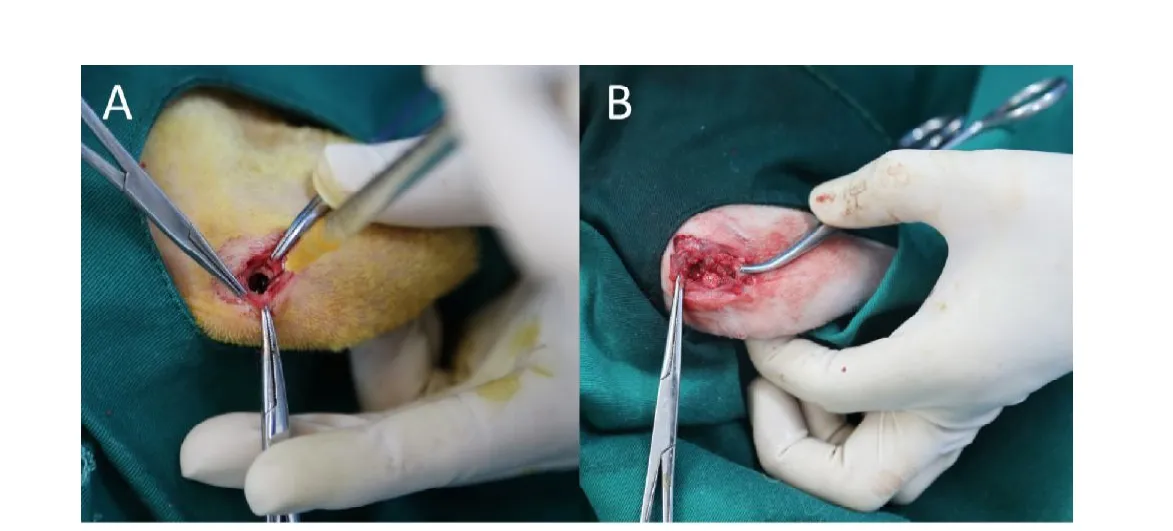
图2,A为兔股骨骨髓炎建模术中注射5%鱼肝油酸钠;B为建模后骨缺损支架植入( -TCP)术中。
1.7 金黄色葡萄球菌培养
支架植入术后4周用空气栓塞法处死实验兔子,无菌条件下取手术侧完整股骨标本,样本称重,取支架材料区域上下1 cm的骨组织,用咬骨钳咬成骨碎片,研钵磨碎成骨粉,按100 g骨组织加入100 mL灭菌生理盐水的计量进行操作,加入无菌生理盐水后置入振荡器上震荡20 min,用吸管吸取0.1 mL震荡液,做100倍稀释,取每个稀释后的悬液各0.1 mL涂布于水解酪蛋白胨 (MH)琼脂平板上,再用无菌刮铲将菌液在平板上涂抹均匀,24 h后计数MH平板上的金黄色葡萄球菌菌落个数。
1.8 显微电子计算机断层扫描(Micro-CT)观察及分析
待支架植入饲养12周后,用空气栓塞法处死实验组(-TCP-Ag)和对照组( -TCP)兔子,取手术侧完整股骨,用含4%多聚甲醛的通用组织固定液固定,做 Micro-CT扫描观察材料植入区域并进行三位重建,计算骨缺损区域骨小梁体积占该区域总骨组织体积的百分比(BV/TV)。
1.9 统计学分析
采用Graph prism 7.0软件进行数据处理和统计学分析,采用单因素方差分析和t检验分析,P<0.05为差异有显著性意义。
2 结果
2.1 rBMSCs的培养
如图3所示分离纯化后的rBMSCs,细胞状态良好,铺展均匀,在细胞间未见有明显的成纤维细胞等贴壁杂细胞。
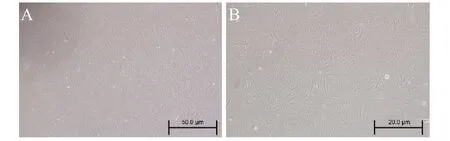
图3,光学显微镜下分离纯化后的大鼠骨髓间充质干细胞:A为40倍放大的光学显微镜下图;B为100倍放大的光学显微镜下图。
2.2 -TCP-Ag的体外毒性检测
如图4显示各时间点,各组间未见明显统计学差异。
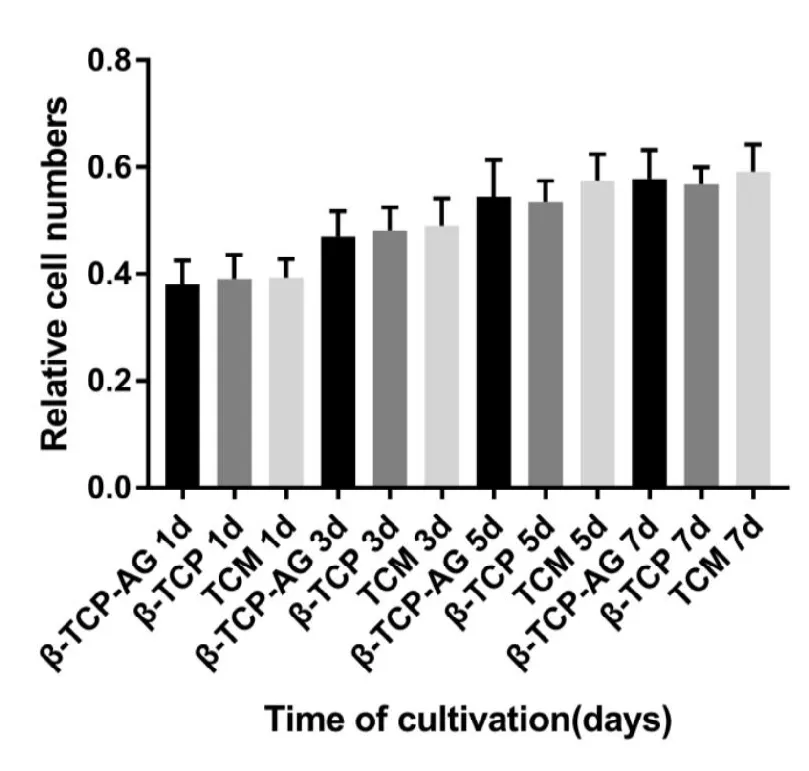
图4,CCK-8试剂检测细胞毒性的相对细胞个数(N=4)。
2.3 兔股骨骨髓炎模型建模评价
兔股骨骨髓炎模型建模手术中,实验组24只兔中1只兔子因麻醉剂过量的问题在术中死亡,统计分析时予以排除。术后饲养4周内,实验组其余23只兔均出现不同程度的体温升高,食欲减退。对照组4只兔子在手术一周后体温恢复正常,状态良好。见图5A显示术后兔骨髓炎模型建立的4周内,新西兰大白兔的体温变化情况,手术3天后实验组体温明显高于对照组。
兔股骨骨髓炎模型建模手术4周后拍摄 X线,实验组23只兔子中有20只出现不同程度的股骨远端干骺端正常骨组织结构破坏,可见死骨和新骨形成。见图5B和图5C分别显示实验组和对照组骨髓炎建模术后4周的术侧股骨 X线片,可见实验组术后4周干骺端变宽,股骨远端干骺端正常骨组织结构破坏且有骨膜反应。
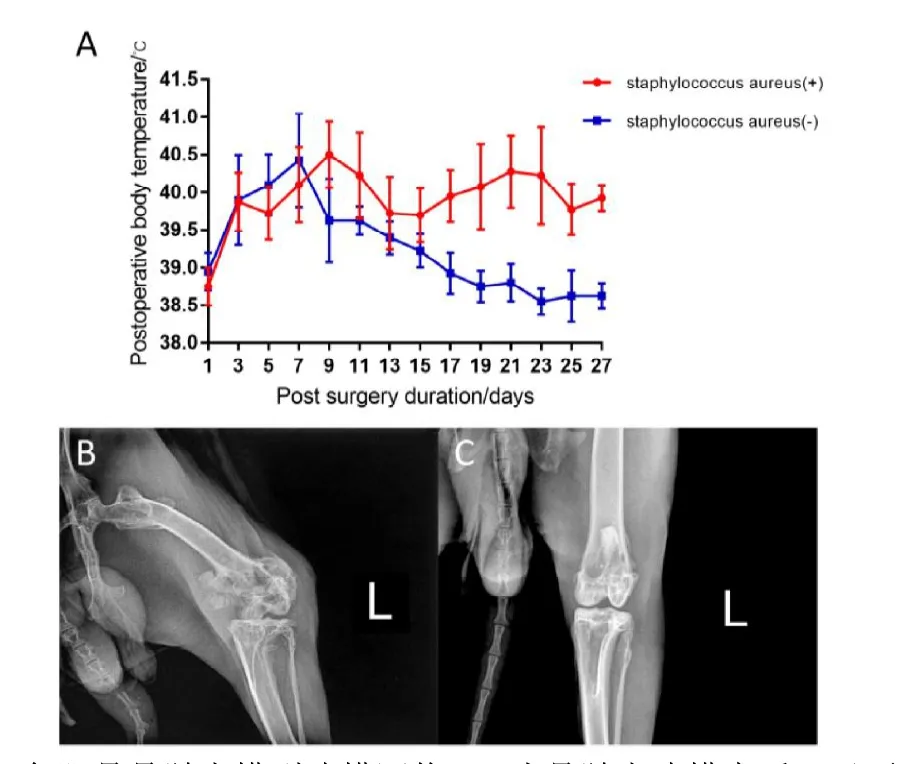
图5,兔股骨骨髓炎模型建模评价:A为骨髓炎建模术后1天至27天的隔日直肠温度平均值(N=4);B为实验组骨髓炎建模术后4周术侧股骨远端X线片;C为对照组术后4周术侧股骨远端X线片。
2.4 -TCP-Ag体内抗菌性
如图6显示涂布平板法培养的 -TCP-Ag组MH琼脂平板表面几乎未见金黄色葡萄球菌菌落(金黄色葡萄球菌的平均相对菌落数<5个),而 -TCP组可见MH琼脂平板上存在大量的金黄色葡萄球菌菌落(金黄色葡萄球菌的平均相对菌落数>160个), -TCP-Ag组MH琼脂平板表面金黄色葡萄球菌的平均相对菌落数较 -TCP组明显减少,且差异有统计学意义。
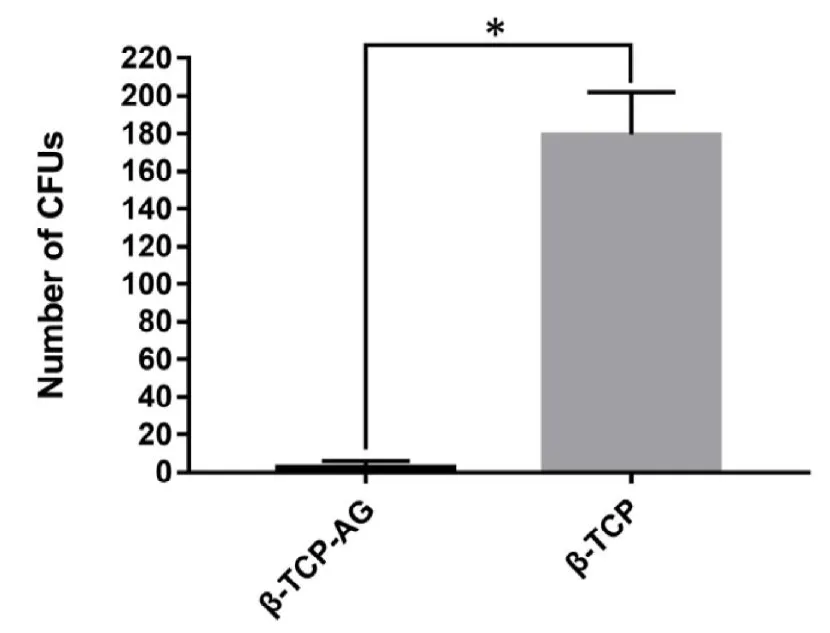
图6,骨缺损支架植入后4周,实验组和对照组MH琼脂平板表面金黄色葡萄球菌的平均相对菌落数(N=4),*P<0.05。
2.5 -TCP-Ag体内促成骨性
见图7A,C(彩图见插页)显示经三维重建后植入支架侧股骨远端骨组织结构,-TCP-Ag组股骨远端结构完整,皮质骨面光滑; -TCP组股骨远端畸形,骨皮质连续性破坏。见图7B,D(彩图见插页)显示 -TCP-Ag组支架区域骨量较 -TCP组明显增高。图7E显示支架植入12周后,-TCP-Ag组BV/TV平均值显著高于 -TCP组,且差异有统计学意义。
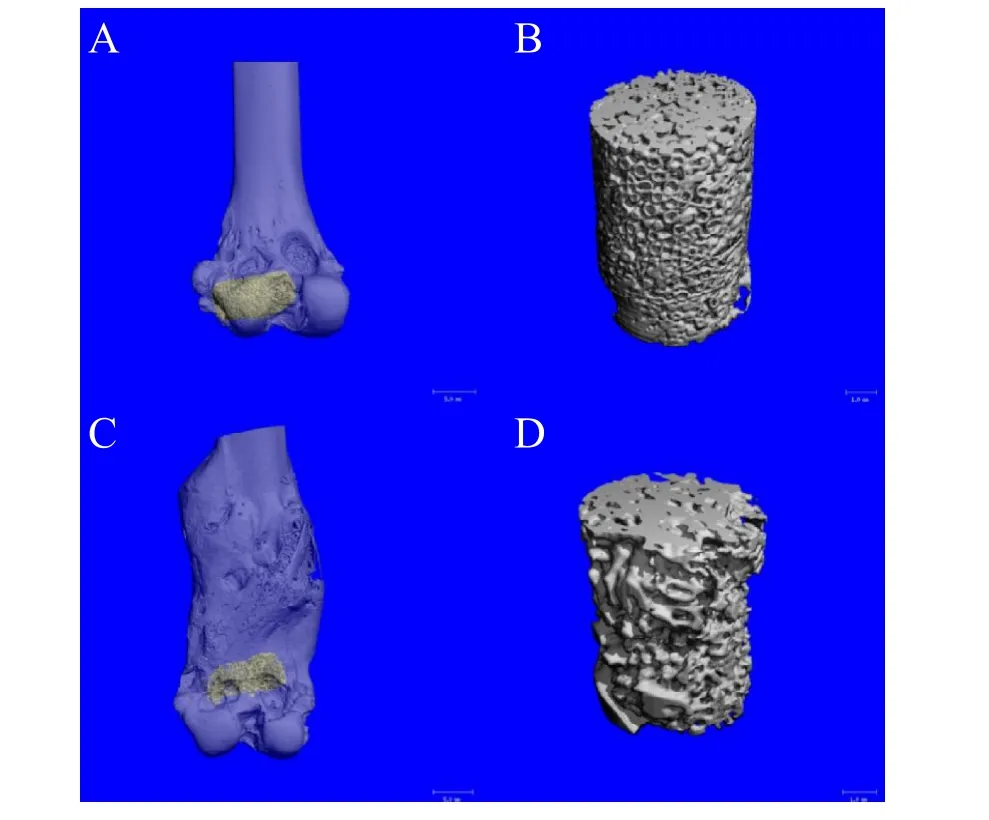
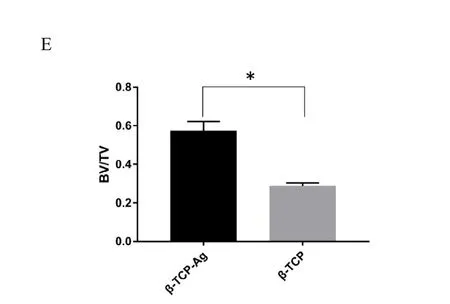
图7,A为骨缺损支架植入后12周,经三维重建后 -TCP-Ag组植入支架侧股骨远端骨组织结构;B为 -TCP-Ag组支架区域骨量;C为骨缺损支架植入后12周,经三维重建后 -TCP组植入支架侧股骨远端骨组织结构;D为 -TCP组支架区域骨量;E骨缺损支架植入后12周,骨缺损区域骨小梁体积占该区域总骨组织体积的百分比(BV/TV)(N=4),*P<0.05。
3 讨论
骨组织感染合并骨缺损是骨科临床棘手的难题,常用的治疗方法是彻底清除病灶,反复冲洗和开窗引流待感染控制后 II期植入松质骨或人工骨替代材料治疗骨缺损,治疗周期长,患者病痛且费用较高[7,14]。经过大量的体内外研究证明 -TCP是一种良好的骨缺损填充材料,现已广泛应用于临床治疗骨缺损[4,5],但其不具有抗菌作用,填充于感染部位后容易导致感染难以控制,而全身应用抗生素往往难以在病变部位达到有效浓度,局部用药很快被体液所稀释及很快吸收,难以长期在局部维持有效的药物浓度,且容易产生耐药,影响了效果。而低浓度的纳米银具有广谱的抗菌性和不易耐药的特性,且对哺乳动物毒副作用小,是一种较为理想的杀菌剂[15]。因此,本实验组制备了一种含5%纳米银的 -TCP复合支架。首先,本实验组在体外研究了其生物相容性,体外毒性试验发现(见图4), -TCP-Ag制备的浸提液组和对照组在各时间点未见明显差异,表明含5%纳米银的-TCP复合支架对rBMSCs未见明显的细胞毒性,即 -TCPAg具有良好的生物相容性。
本实验组采用 Norden等人[16]的方法,即采用金黄色葡萄球菌(ATCC25923)尝试建立了家兔股骨骨髓炎模型并对其进行评价。实验组23只兔均出现不同程度的体温升高,食欲减退。对照组4只兔子在手术一周后体温恢复正常,状态良好。兔股骨骨髓炎模型建模手术4周后拍摄 X线,实验组23只兔子中有20只出现不同程度的股骨远端干骺端正常骨组织结构破坏,可见死骨和新骨形成。经4周饲养后,如图3-4所示的体温测量和X线表现表明兔股骨骨髓炎模型已成功建立(见图6),经4周饲养后兔股骨骨髓炎模型已成功建立,骨髓炎建模成功率约为87%,这为后续材料植入验证 -TCP-Ag在体内治疗骨髓炎和促进成骨的作用提供了先决条件。Micro-CT三维重建后可见(见图7E)骨髓炎建模植入材料后12周时,-TCP-Ag组材料周围的骨小梁比率较 -TCP组更高。见图6显示材料植入后饲养4周,-TCP-Ag组内的骨髓炎病灶已基本得到控制,材料周围的金黄色葡萄球菌已基本被杀灭,从而通过多孔 -TCP支架促进骨长入,促进缺损部位的骨愈合。
近年来,许多研究人员针对纳米银颗粒的抗菌机理进行了研究,研究发现纳米银颗粒可通过多种途径抑制细菌的生长和繁殖。部分研究认为,纳米银颗粒在生物活性溶液中可释放Ag+发挥抗菌作用并诱导产生活性氧(ROS)进入细菌胞内,从而抑制细菌的呼吸链,引起细菌凋亡[17,18]。Sharma等[19]研究表明纳米银颗粒对多数细菌的抗菌性强于微米银和Ag+,并归因于小尺寸效应引起的表面电子结构特异性的改变可破坏细菌的细胞壁和细胞膜结构[18,20]。
综上所述,-TCP-Ag在体外表现出良好的生物相容性,在体内可有效控制植入物处骨感染的感染病灶,从而促进骨感染的治疗和骨缺损的愈合,为感染或潜在感染骨缺损的治疗提供新手段,是一种极具潜力的抗菌性骨缺损植入材料。但是,本实验尚存在一些不足之处,如体内的生物毒性实验未做进一步的研究,且纳米银在体内释放的规律尚不明确,这些问题将在接下来的研究工作中逐步完善,从而为含纳米银颗粒的多孔 -磷酸三钙支架提供的应用提供更为完整的科学依据。
[1] Kamitakahara M,Tatsukawa E,Shibata Y,et al.Effect of silicate incorporation on in vivo responses of-tricalcium phosphate ceramics[J].Journal of Materials Science Materials in Medicine,2016,27(5):97.
[2] Rentsch C,Rentsch B,Scharnweber D,et al.Knochenersatz[J].Der Unfallchirurg,2012,115(10):938-949.
[3] Dimitriou R,Mataliotakis GI,Angoules AG,et al.Complications following autologous bone graft harvesting from the iliac crest and using the RIA:a systematic review[J].Injury-international Journal of the Care of the Injured,2011,42 Suppl 2(5):S3-S15.
[4] Bauer TW,Muschler GF.Bone graft materials.An overview of the basic science[J].Clinical Orthopaedics&Related Research,2000,371(371):10.
[5] Shepherd JH,Best SM.Calcium phosphate scaffolds for bone repair[J].JOM,2011,63(4):83-92.
[6] Wagner C,Obst U,Hänsch GM.Implant-associated posttraumatic osteomyelitis:collateral damage by local host defense?[J].International Journal of Artificial Organs,2005,28(11):1172.
[7] Verhelle N,Van ZD,Liboutton L,et al.How to deal with bone exposure and osteomyelitis:an overview[J].Acta Orthopaedica Belgica,2003,69(6):481-494.
[8] Aidan H,Heppert VG,Suda AJ.Osteomyelitis[J].Archives of Orthopaedic&Trauma Surgery,2013,133(9):1183-1196.
[9]Yamanaka M,Hara K,Kudo J.Bactericidal Actions of a Silver Ion Solution on Escherichia coli,Studied by Energy-Filtering Transmission Electron Microscopy and Proteomic Analysis[J].Applied&Environmental Microbiology,2005,71(11):7589-7593.
[10]Taglietti A,Arciola CR,D'Agostino A,et al.Antibiofilm activity of a monolayer of silver nanoparticles anchored to an amino-silanized glass surface[J].Biomaterials,2014,35(6):1779-1788.
[11]Zhao L,Wang H,Huo K,et al.Antibacterial nano-structured titania coating incorporated with silver nanoparticles[J].Biomaterials,2011,32(24):5706-5716.
[12]Zheng Z,Yin W,Zara JN,et al.The use of BMP-2 coupled-Nanosilver-PLGA composite grafts to induce bone repair in grossly infected segmental defects[J].Oral&Craniofacial Tissue Engineering,2010,31(35):9293-9300.
[13]鲁嘉良,徐鹏,刘志勇,等.骨髓炎动物模型的研究进展[J].中国医药导报,2014,11(34):154-157.
[14]Li Y,Liu L,Wan P,et al.Biodegradable Mg-Cu alloy implants with antibacterial activity for the treatment of osteomyelitis:In vitro and in vivo evaluations[J].Biomaterials,2016,106:250-263.
[15]You C,Han C,Wang X,et al.The progress of silver nanoparticles in the antibacterial mechanism,clinical application and cytotoxicity[J].Molecular Biology Reports,2012,39(9):9193-9201.
[16]Norden CW.Experimental osteomyelitis.I.A description of the model[J].Journal of Infectious Diseases,1970,122(5):410.
[17]Taylor PL,Omotoso O,Wiskel JB,et al.Impact of heat on nanocrystalline silver dressings.Part II:Physical properties[J].Biomaterials,2005,26(35):7230-7240.
[18]吴宗山,胡海洋,任艺,等.纳米银的抗菌机理研究进展[J].化工进展,2015,34(5):1349-1356.
[19]Sharma VK,Yngard RA,Lin Y.Silver nanoparticles:green synthesis and their antimicrobial activities[J].Advances in Colloid&Interface Science,2009,145(1-2):83-96.
[20]Silver S.Bacterial silver resistance:molecular biology and uses and misuses of silver compounds[J].Fems Microbiology Reviews,2003,27(2-3):341-353.

