滏阳河河流水体中重金属污染特征及其对青海弧菌和斜生栅藻的毒性效应
张博文, 赵甲亭, 吴二威,, 李云云, 李娜, 李柏, 乔秀文, 吴刚, 高愈希,*
1. 中国科学院高能物理研究所纳米生物效应及安全性重点实验室, 北京 100049 2. 包头医学院基础医学与法医学院, 包头 014040 3. 石河子大学化学化工学院 新疆兵团化工绿色过程重点实验室, 石河子832003
滏阳河是海河水系子牙河的两大支流之一,发源于太行山东麓河北省邯郸市的峰峰矿区滏山南麓,因此得名。滏阳河流经河北省邯郸、邢台、石家庄、衡水、沧州等地,流域包括43个县,9 000多个乡村。滏阳河流域面积约2.28万km2,包括14条支流,全长约402 km,总人口超过1 500万。滏阳河流域年平均气温13.4 ℃,年平均降水量为550 mm,主要集中在7—9月。随着社会、经济的快速发展,滏阳河已成为一个典型的水资源短缺和分配不均的河流[1],也是水污染比较严重的流域。人们比较关注的主要污染物是 COD和氨氮[2]。由于沿途流经许多工业城市,如河流上游的邯郸是我国重要的冶金、电力、煤炭、建材、纺织、陶瓷、标准件生产基地,其钢铁年产能4 000万吨,新型铸管产能亚洲第一,标准件产能占全国40%,这些产业的发展可能导致滏阳河水体的重金属污染[3-4]。因此对滏阳河进行重金属含量检测,并进一步研究河流重金属污染对水生生物的毒性尤为必要。
青海弧菌Q67(Vibrio qinghaiensis sp. Q67)是朱文杰教授在青海湖所产的一种鲤鱼体表分离得到的,是少有的淡水型发光细菌。发光菌对外界环境很敏感,当其正常的生长发光条件受到外界污染物的破坏时,它的发光强度就会快速改变,因此发光强度就是其测定周围环境污染程度的主要参数,所以青海弧菌Q67常被用作环境水质监测。目前通常用EC50(半有效浓度)值来反应测试样品对环境的污染情况[5]。斜生栅藻(Scenedesmus obliquus)也是一种环境检测的模式生物,它是一种在淡水中生长的藻类。斜生栅藻细胞呈纺锤状,通常由2、4、8个细胞并排结合在一起,单个细胞长度为10~20 μm,宽度为4~9 μm,易于分离培养且可以直接在细胞水平上观察,是一种较为理想的实验材料。本研究选取了青海弧菌Q67和斜生栅藻作为模式生物,检测滏阳河河流水体中重金属对其产生的毒性效应。
1 材料与方法(Materials and methods)
1.1 水样的采集、处理和重金属含量测定
研究主要集中在滏阳河干流、主要支流、支流汇入地区以及排污口等地区。共设置了66个采样点,采样点位置分布如图1所示。滏阳河表层水体样品用有机玻璃采水器进行采集,每个采样点采集3份平行样品,去除漂浮物。水样用0.45 μm滤膜进行过滤,滤液装入500 mL玻璃瓶。4 ℃下密封保存并运回实验室进行实验分析。
取50.0 mL水样于250 mL的烧杯中,加硝酸1 mL,90 ℃加热至体积小于5 mL,冷却至室温,用2%硝酸溶液定容至5.00 mL待测。
用Thermo公司X7型电感耦合等离子体质谱(ICP-MS)在碰撞池模式下测定滏阳河水体样品中的金属元素Cr、Co、Cu、Cd、Mn、Pb、Fe、Ni、Se、Hg、As、Zn等的含量。采用同心雾化器,内标元素为209Bi和115In。用2%的HNO3溶液梯度稀释美国Spex Certiprep公司的含21种元素(浓度为100 mg·L-1)的质量控制标准品配制标准溶液,Hg的标准溶液用国家钢铁材料测试中心的Hg的单元素质量控制标准品(浓度1 000 mg·L-1)配制,相同操作条件下做各元素的工作曲线。曲线相关性系数控制在0.9999以上。
1.2 河水重金属污染对青海弧菌Q67的毒性测试
青海弧菌Q67由中国科学院生态环境研究中心提供,配制Q67 液体培养基[5-6]。另外,将 4.2 mg KCl、11.1 mg CaCl2、28.6 mg MgSO4、42.0 mg NaHCO3、4.2 g NaNO3溶于1 000 mL去离子水中配成模拟湖水,121 ℃高压灭菌20 min,冷却后备用。取低温保存的Q67 菌种接种在新配制的培养基斜面上,22 ℃恒温培养 24 h,然后将菌种接入装有液体培养基的锥形瓶内, 22 ℃恒温振荡(180 r·min-1)培养16~18 h,2 000 r·min-1下离心10 min,收集菌体,用模拟湖水将菌体制成菌悬液。调整菌悬液的密度,使其发光强度在200~600万RLU之间。以污染较严重的邯郸南郊2号采样点河水重金属含量(μg·L-1): Mn(1 164.00)、Fe(57 390.00)、Zn(25 370.00)、Cu(66.27)、Cr(3 109.00)、As(49.20)、Se(4.68)、Hg(0.18)、Cd(0.64)、Pb(11.49)为依据,用模拟湖水配制重金属污染河水,然后稀释成100%、40%、20%、13.33%、10%、4%、2%、1%、0.2%、0.1%、0.01%系列浓度的模拟河水,加入96孔微板中,以模拟湖水为空白对照,每个浓度设置4个平行。加入菌悬液震荡20 min后,用酶标仪(Infinite M200,TECAN)测定各孔的发光强度(RLU),以空白对照的 RLU的均值(I0)和各浓度的4个平行样的 RLU的均值(I)计算样品对发光菌发光的相对抑制率X(%),每块板重复3次以减少随机误差。其计算公式如下:
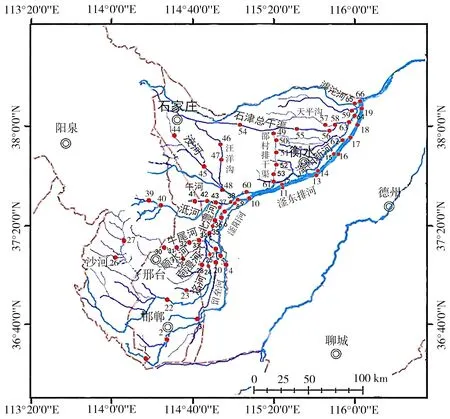
图1 滏阳河水系采样点分布Fig. 1 The sampling sites in Fuyang River System
X(%)=(1-I/I0)×100%
将样品浓度 (log c, 其中c值为相对于河水重金属含量的百分浓度)和对Q67发光菌的相对抑制率进行回归分析,求得相对抑制率是50%时所对应样品的浓度,即为模拟河水对Q67发光菌的EC50值[5-6]。
1.3 河水重金属污染对斜生栅藻(Scenedesmus obliquus)的毒性测试
斜生栅藻(Scenedesmus obliquus)藻种由中国科学院生态环境研究中心提供。在500 mL锥形瓶中加入200 mL藻类培养液BG-11(Duchefa Biochemie),挑取平板培养基上的单菌落斜生栅藻藻种,在超净台中接种。在光照培养箱中进行扩大繁殖,培养温度(25±1) ℃,光照强度3 000 lux,光暗比12 h:12 h,每天摇动锥形瓶3~4次,培养10 d左右,培养液呈绿色,水藻进入对数生长期,用于后续的毒性测试。
以河水重金属含量为依据 (log c, 其中c为河水重金属含量倍数),配制1 000×重金属浓度的模拟河水,梯度稀释成重金属含量为0、0.1%、1%、10%、100%、10×、100×、1000×的模拟河水,取模拟河水100 mL置于250 mL锥形瓶,加对数期生长的藻细胞悬液10 mL,放入培养箱中进行急性毒性测试,培养条件与扩大培养时相同。分别在培养24、48、72、96、120 h后取适量藻液测其在650 nm处的吸光值(OD值),计算出各时间段的藻细胞的相对生长抑制率。
相对生长抑制率(%)=(1-I/I0)×100%
其中,I0为空白对照组藻液的OD值,I为各实验组藻液的OD值。
河水样品对其暴露120 h后,收集藻细胞用于相关试验指标的测定。
叶绿素含量的测定:取15 mL藻液,5 000 r·min-1、4 ℃条件下离心10 min,收集藻细胞,加入5 mL 80%的丙酮振荡混匀,黑暗条件下提取24 h,10 000 r·min-1、4 ℃条件下离心10 min,取上清液,测其在645 nm和663 nm波长处的吸光值,80%的丙酮作为空白对照,叶绿素含量计算公式如下[7-8]:
C-a(叶绿素a)=12.21OD663-2.81OD645
C-b(叶绿素b)=20.13OD645-5.03 OD663
SOD酶的活性和丙二醛(MDA)含量的测定:取适量藻液,5 000 r·min-1、4 ℃条件下离心10 min收集藻细胞。加入预冷的磷酸盐缓冲液,冰浴条件下用细胞超声破碎仪进行超声破碎。将匀浆液8 500 r·min-1、4 ℃条件下离心15 min取上清液作为粗酶液用于酶的活性检测。藻细胞中的黄嘌呤及黄嘌呤氧化酶反应系统会产生超氧阴离子自由基,后者氧化羟胺形成亚硝酸盐,在显色剂的作用下呈现紫红色。样品中的SOD对超氧阴离子自由基有专一性的抑制作用,使形成的亚硝酸盐减少,从而测出样品中SOD酶的活力。本实验用购于南京建成生物工程研究所的SOD试剂盒测定SOD酶的活力,96孔板中加入20 μL藻细胞上清液,200 μL 底物溶液,20 μL黄嘌呤氧化酶工作液,37 ℃孵育20 min,用酶标仪在450 nm波长处测定其吸光度A,以20 μL纯水做对照,以酶稀释液代替酶工作液做空白。
SOD抑制率(%)=100×(A对照-A对照空白-A样品+A样品空白)/(A对照-A对照空白)
用硫代巴比妥酸法测定MDA含量, 用购于南京建成生物工程研究所的MDA试剂盒按照使用说明书测定斜生栅藻中MDA的含量。
用扫描电镜观察藻细胞的形态:取5 mL藻液,4 000 r·min-1离心收集藻细胞,置于2.5%戊二醛中固定6 h。0.1 mol·L-1PBS缓冲液冲洗3次。用梯度浓度的乙醇进行脱水2次。最后用无水乙醇悬浮藻细胞制成悬液,滴加于扫描电镜样品台,干燥,进行扫描电镜观察。
1.4 数据统计与分析
采用SPSS Statistics 22.0软件对数据进行方差分析,运用ANOVA方法分析实验组与空白对照组之间的差异(*代表P<0.05,**代表P<0.01),用Origin 8.0软件绘图。
2 结果 (Results)
2.1 滏阳河水体重金属污染特征
滏阳河66个采样点水体中重金属含量如表1。表中同时给出与国家地表水环境质量标准(GB3838—2002)对照得到的取样点水质分类,在GB3838—2002中铁、锰调整为集中式生活饮用水地表水源地补充项目,这里参考了地表水环境质量标准(GHZB1—1999)中规定的Fe、Mn标准值。
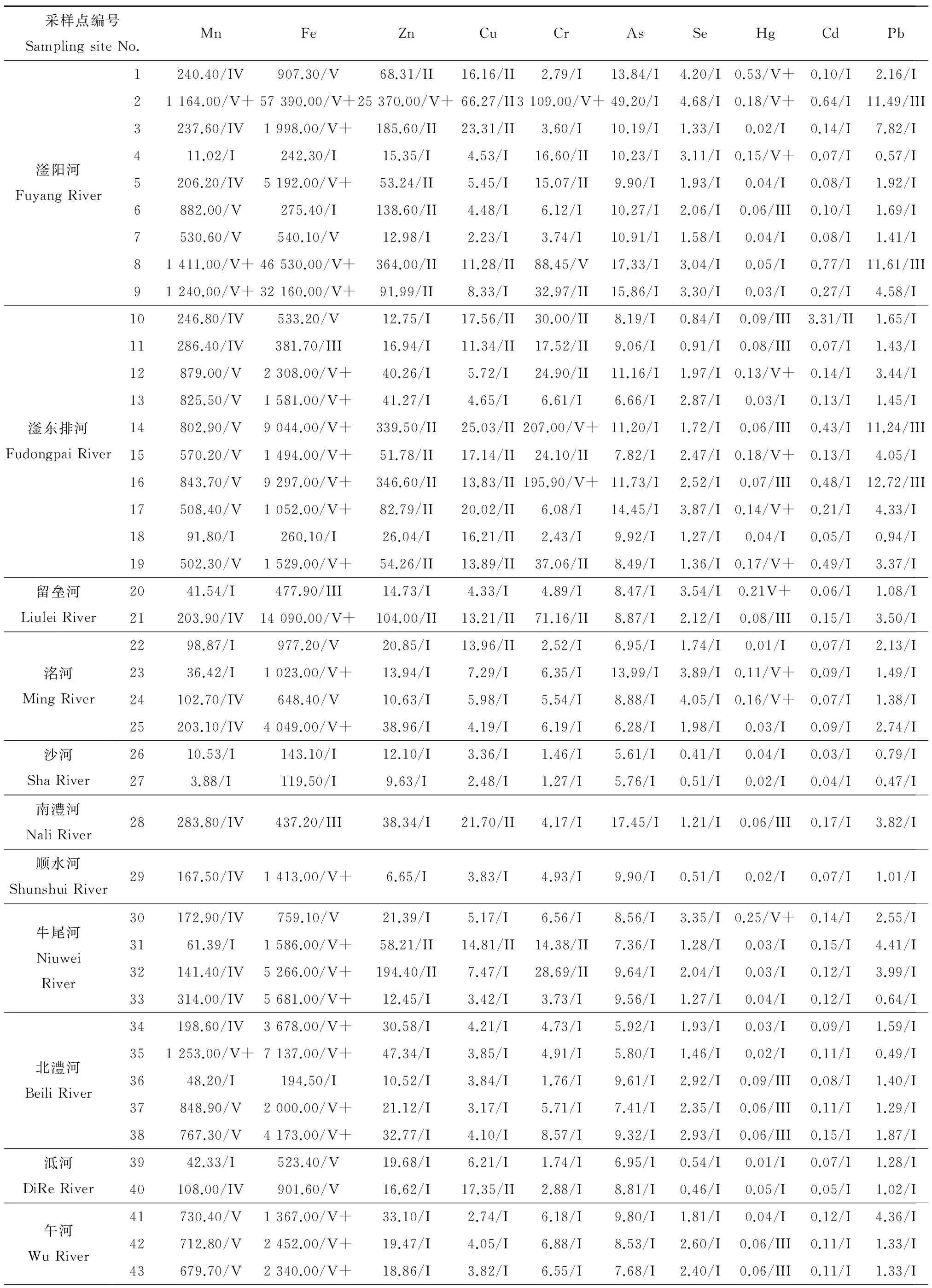
表1 滏阳河各采样点水体中的重金属元素含量 (μg·L-1)Table 1 The contents of the metals in the water samples from Fuyang River System (μg·L-1)
由表1可知,全流域水体中Fe、Mn含量均比较高,有约2/3的采样位点水体有较严重的Hg污染,主要是在滏阳河中上游的1、2、4、6号采样点,邢台市各支流牛尾河(30),沙河(28),洺河(23、24),留垒河(20、21),北澧河(36、37、38),午河(42、43),石家庄市的汪洋沟(46、47、48),洨河(44、45),邵村排干渠(51、53)水体含汞达三类水体甚至到劣五类。滏东排河、石津总干渠、滏阳新河水体汞含量普遍较高,近一半位点达劣五类水质。只有一半左右的采样点Zn、Cu、Cr含量可达到一类水体要求。Zn浓度最高位于滏阳河邯郸近郊的2号(25.37 mg·L-1)、邢台段的8号、滏东排河的14、16号、邵村排干渠,滏阳新河的60~62、64号采样位点的Zn含量也超过300 μg·L-1。Cr浓度最高位于滏阳新河的62号采样点(6.23 mg·L-1),在滏阳河邯郸近郊的2号、邢台段的8号、滏东排河的14、16号、洨河、邵村排干渠(49、50、52)、石津总干渠(54)、阜阳新河(61、64)等Cr含量也达到甚至超过了国家地表水环境质量V类标准。Cu浓度最高出现在邵村排干渠的53号采样点(265.10 μg·L-1),达到了国家地表水 II类水质标准。大多数采样位点Pb含量达一类水体要求,Pb含量最高(43.43 μg·L-1)也位于邵村排干渠53号采样点,滏东排河、石津总干渠、艾辛庄等部分位点Pb含量达III类水体要求。几乎全流域As、Se(汪洋沟46、47,邵村排干渠53号采样点除外)、Cd(滏东排河10号采样点除外)含量可达一类水体要求。全水系有12个采样点重金属含量符合国家地表水环境质量标准(GB3838—2002)的I类水体标准,包括:中游邢台段的7号、滏东排河13号、洺河25号、沙河上游26、27号、顺水河29、牛尾河33、北澧河34、35、泜河39、午河41、石津总干渠58号采样点。有29个位点河水重金属含量超过国家地表水环境质量标准III类水体的要求。重金属含量较高的水体位于上游的邯郸近郊2号、以及下游的滏东排河14、16号,位于石家庄市下游的汪洋沟47号、邵村排干渠53号、石津总干渠54号,滏阳新河62号采样点也有较高的重金属污染。
2.2 滏阳河水重金属污染对青海弧菌Q67的毒性
选择金属含量较高且具有较高生态风险的2号采样点的河水为代表,研究河流重金属污染对水生生物的毒性。为排除河水中有机污染的干扰,根据2号采样点水体的实测金属含量配制了模拟河水,梯度稀释,测定河流重金属污染对青海弧菌的毒性。结果见图2。

图2 重金属污染河水对青海弧菌Q67的剂量效应曲线Fig. 2 Dose-response curves of heavy metals in Fuyang River to Q67
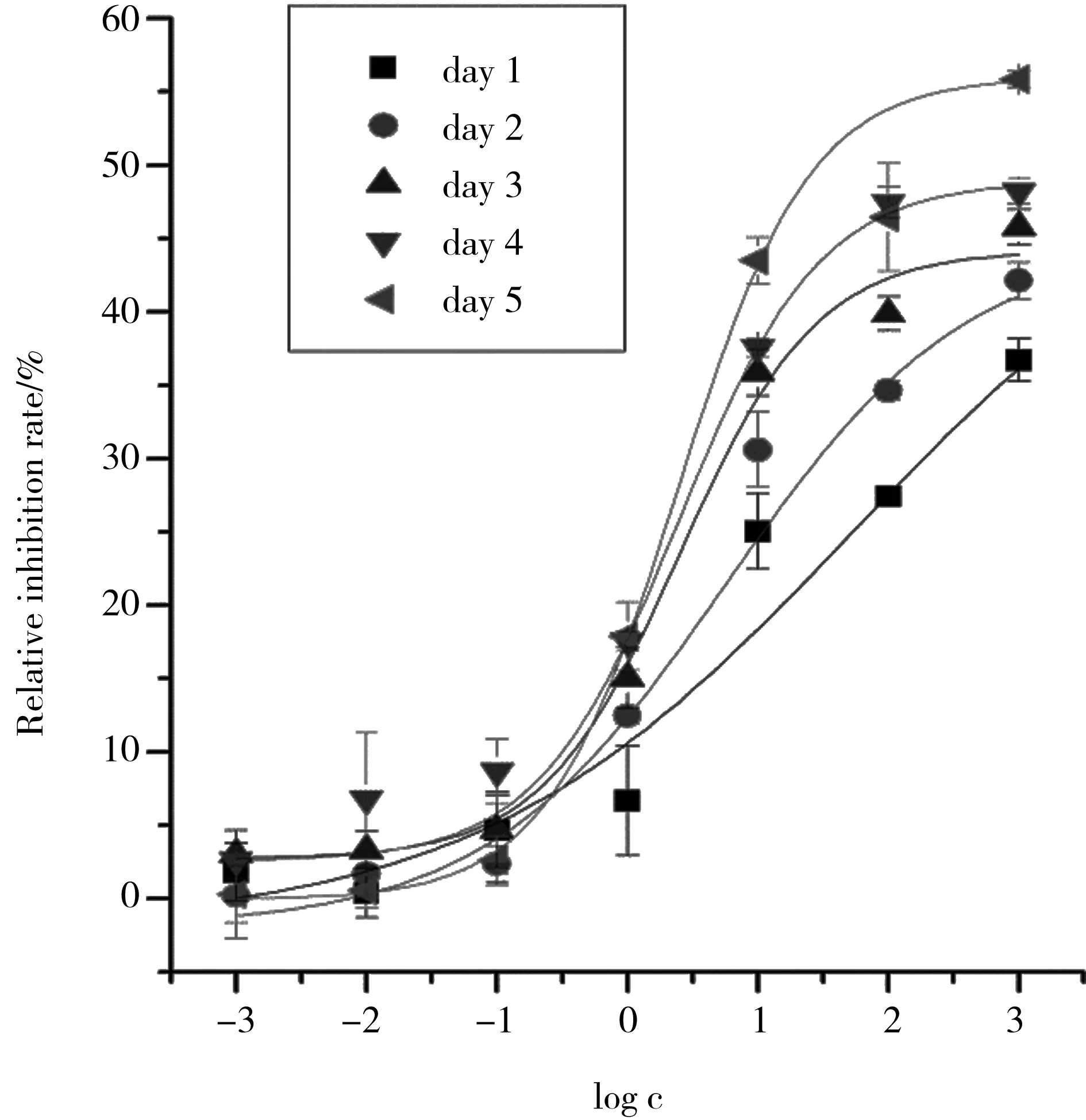
图3 河水重金属污染对斜生栅藻生长抑制的剂量效应曲线Fig. 3 Dose-response curves of heavy metals in Fuyang River to Scenedesmus obliquus growth
由图2可知,2号采样位点的河水重金属对青海弧菌Q67有明显毒性,随着河水重金属浓度的升高,毒性也随之增强。2号位点河水浓度在4%以下时,对青海弧菌Q67的发光强度抑制作用较弱,当浓度达到10%及以上时,对发光菌产生的发光抑制率已达80%以上,2号采样位点的河水对青海弧菌Q67的EC50值为6.65%。属于毒性极强的污染物。
2.3 滏阳河水重金属污染对斜生栅藻的毒性
试验了河水重金属污染对斜生栅藻的生长抑制作用,结果见图3,由图3可以看出:重金属污染河水对斜生栅藻的正常生长有一定的抑制作用,随着河水重金属浓度的增加,对斜生栅藻的生长抑制率逐渐升高。但在最高实验浓度条件(河水重金属浓度1 000倍)下,暴露4 d后生长抑制率也未达到50%,河水对斜生栅藻的生长抑制作用较弱。在河水原浓度的条件下,河水对斜生栅藻的抑制作用约为15%。提示斜生栅藻可能不适合作为评价河流重金属污染生态危害的模式生物。
2.4 河流重金属暴露时斜生栅藻的叶绿素含量
不同重金属含量暴露条件下,斜生栅藻叶绿素a和叶绿素b含量见图4 a和b,从图中可见,随着河水样品浓度的提高,叶绿素a、叶绿素b的含量逐渐降低,说明河水重金属对斜生栅藻叶绿素合成的抑制作用也逐渐增大;河水原浓度的重金属可以显著降低叶绿素含量。重金属对叶绿素a含量的影响更为明显。
2.5 河水重金属暴露条件下斜生栅藻的SOD活性及MDA含量
不同重金属含量河水暴露条件下斜生栅藻的SOD活性及MDA含量见图4c。从图可见:在较低金属含量(<10%)河水暴露条件下,随河水重金属含量增加,SOD酶活性逐渐增强,随着河水金属浓度的进一步提高,SOD酶的活性有逐渐减弱的趋势。与空白对照组相比,当河水暴露浓度为0.1%时,SOD活力单位增加0.43%;当暴露浓度为1%时,SOD活力单位增加3.43%;当暴露浓度为10%时,SOD活力单位增加6.86%;当暴露浓度为100%时,SOD活力单位降低3.71%;河水金属含量继续增加,SOD活力持续降低,当暴露浓度为1 000倍河水浓度时,SOD活力单位降低28.14%。
从藻细胞中MDA的含量总体趋势来看,MDA的含量随着河水重金属浓度的提高随之升高。在重金属浓度为原河水样品0.1%时,斜生栅藻细胞膜脂质过氧化产物MDA含量无显著变化。暴露浓度增加到1%,MDA 含量有所降低,暴露浓度超过10%时, MDA的含量也显著升高。重金属含量为河水样品浓度的100倍时,MDA的含量为对照组5.7倍,在本次实验最高暴露浓度1 000倍重金属含量条件下,MDA含量降低为对照组的3.8倍(P<0.01)。
3 讨论(Discussion)
3.1 滏阳河水系重金属污染特征
滏阳河流域水体中重金属含量相对较高的是位于邯郸近郊2号采样点,Fe 、Zn、As含量居于各采样点之首,Mn、Cr、Cu、Se、Pb也处于较高水平。其中Zn元素超出Ⅴ类水质标准12.5倍,Cr含量也超出Ⅴ类水质标准30倍以上。邯郸是中国重要的钢铁生产基地,滏阳河邯郸近郊水体Fe、Zn、Mn、Cr较高可能与钢铁企业的废水排放有关,对底泥重金属含量分析的结果也证实,该地重金属污染有相当高的生态风险(数据未给出),与郎超等[9]的结果相符。8、9号采样点Cr、Mn、Fe、Cu、Zn、Pb、As等元素的含量都较高,该采样区段位于艾辛庄地区,该地区有闸坝,河水流经此地,流速减慢,水体中的重金属元素与河流沉积物颗粒结合的较多,使重金属元素在此地区有一定的富集,造成重金属含量在这个区段相对较高的现象。洺河24、25号采样点水体有较高的Fe、Mn含量,该采样点位于滏阳河永年县境内,当地是全国知名的标准件生产基地[10],标准件加工企业超过2 000家。水体中Fe、Mn含量较高可能与这些标准件加工企业的生产废水排放有关。根据我们对底泥重金属含量分析的结果。洺河22号采样点有相当高的生态风险,24号采样点有很高的生态风险(数据未给出),洨河(44、45)和汪洋沟(46~48)较高的Fe、Zn、Cu、Cr、Hg可能与接纳石家庄市的生活污水和制药厂、化工厂废水有关[11]。底泥重金属含量分析表明:汪洋沟46、47号采样点重金属污染有很高的生态风险(数据未给出),49~53号采样点位于邵村排干渠,除Mn、Fe、Zn含量较高外,重要的特点是Cr含量普遍较高,这可能与该地区较多的皮革加工厂分布有关,皮革厂的生产废水、废物中含有大量的Cr元素,该地区工厂废水有明显的发黑现象[10]。对底泥金属含量分析的结果表明:49号采样点有中等程度的生态风险,51号采样点有很高的生态风险,52号采样点有相当高的生态风险。Cr可造成人体基因缺陷,引起癌症发生,对环境有持久性危害,因此,该地区应严格限制未达标工业废水的排放。位于石津总干渠的54~59号采样点的水体中,Mn、Fe、Cu、Cr、Hg和Pb的含量相对较高。这些重金属污染物可能主要来自于当地化工厂的污水排放。滏阳新河的60~64号采样点的Fe、Zn、Cr也较高,其中,60号采样点位于艾辛庄坝闸下游,61号位于邵村排干渠接入点,62~64号位于衡水市下游,此河段河水补给主要来源于城市生活污水。底泥重金属含量分析证实:60、61、63、66号采样点有中等程度的生态风险(数据未给出)。
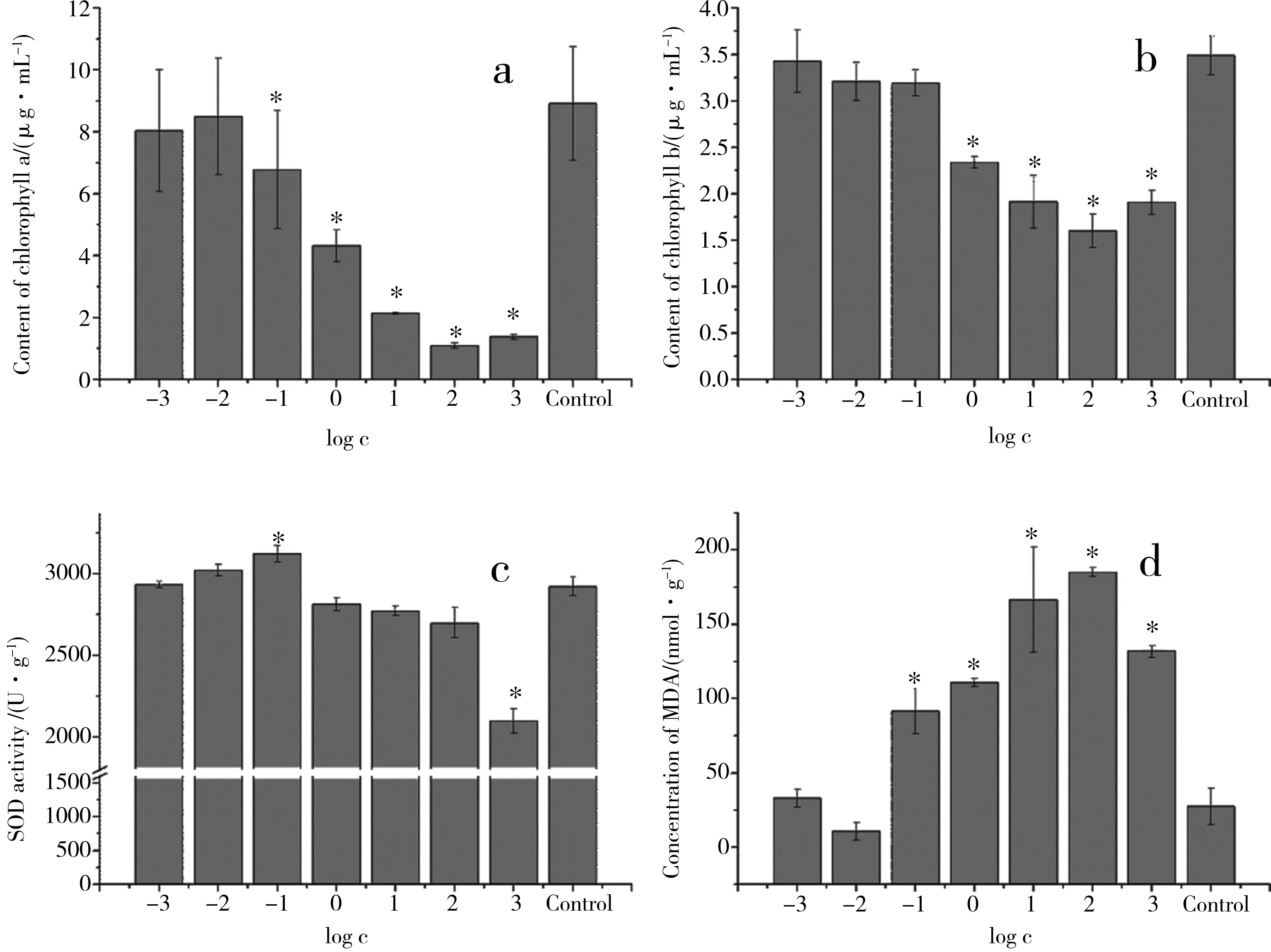
图4 滏阳河的邯郸近郊河水重金属污染对斜生栅藻叶绿素a(a)、叶绿素b(b)、MDA(d)含量及SOD活性(c)的影响Fig. 4 Contents of chlorophyll a, chlorophyll b and MDA, and SOD activity of Scenedesmus obliquus exposed to Fuyang River System water with different heavy metals pollution levels
3.2 滏阳河的邯郸近郊河水对Q67的毒性
邯郸南郊2号采样点水体的重金属污染较严重,2号采样点底泥重金属污染也有较高的生态风险,该河水样品的主要污染元素是Fe、Zn、Cr、Mn、Cu、Pb、Hg,其中,Zn、Cr、Hg含量超过现行国家地表水环境质量V类水标准。所以,以2号采样点河水为代表,研究河流重金属污染对水生生物的毒性。由于发光菌Q67体内的还原型黄素单核苷酸(FMNH2)分子中含有的-NH、-OH 均处在暴露的位置,而河水测试样品中的重金属离子易与这些基团相结合,这些重金属离子进而抑制了还原型黄素单核苷酸(FMNH2)与氧化型黄素单核苷酸(FMN)2种物质的活性,使它们之间的转化不能正常进行;另一方面,有文章指出,重金属离子往往会对生物体产生氧化损伤现象,诱导产生过量的氧自由基,导致生物体的细胞膜被破坏,生物体正常的呼吸代谢途径也被破坏,所以发光菌的呼吸代谢受到影响,测试样品中过量的重金属离子导致发光菌的发光受到抑制。我们选取采自邯郸市近郊的河水作为典型样品,研究重金属污染对模式生物Q67的毒性,该地河水重金属含量较高,其中Fe、Zn、As含量居于各采样点之首,Mn、Cr、Cu、Se、Pb也处于较高水平,所以由于重金属污染而有较高的生态风险,试验结果证明:该河水样品中的重金属对青海弧菌Q67的EC50值为6.65%。属于毒性极强的污染物,对发光菌Q67表现出明显的毒性作用。Q67可以敏感地反映出河流重金属污染的状态。
半最大效应浓度时河水重金属含量和单个重金属EC50值列于表2,相关重金属对Q67单独作用时的EC50值也列于表2。
从表2可见,滏阳河邯郸近郊河水中Fe、Zn含量已经超过了文献报道的单独作用EC50值,但金属含量为原河水的6.65%时,各金属含量均未超过相应元素单独作用时的EC50值,各种重金属毒性效应的叠加导致了河水重金属对Q67的强毒性。如果将河水EC50时的金属含量与单独作用EC50之比衡量河水所含各重金属对Q67毒性的贡献,可知河水对Q67的毒性主要来源于Zn、Fe,其次Cr、Mn、As、Cu、Pb也有较大贡献。
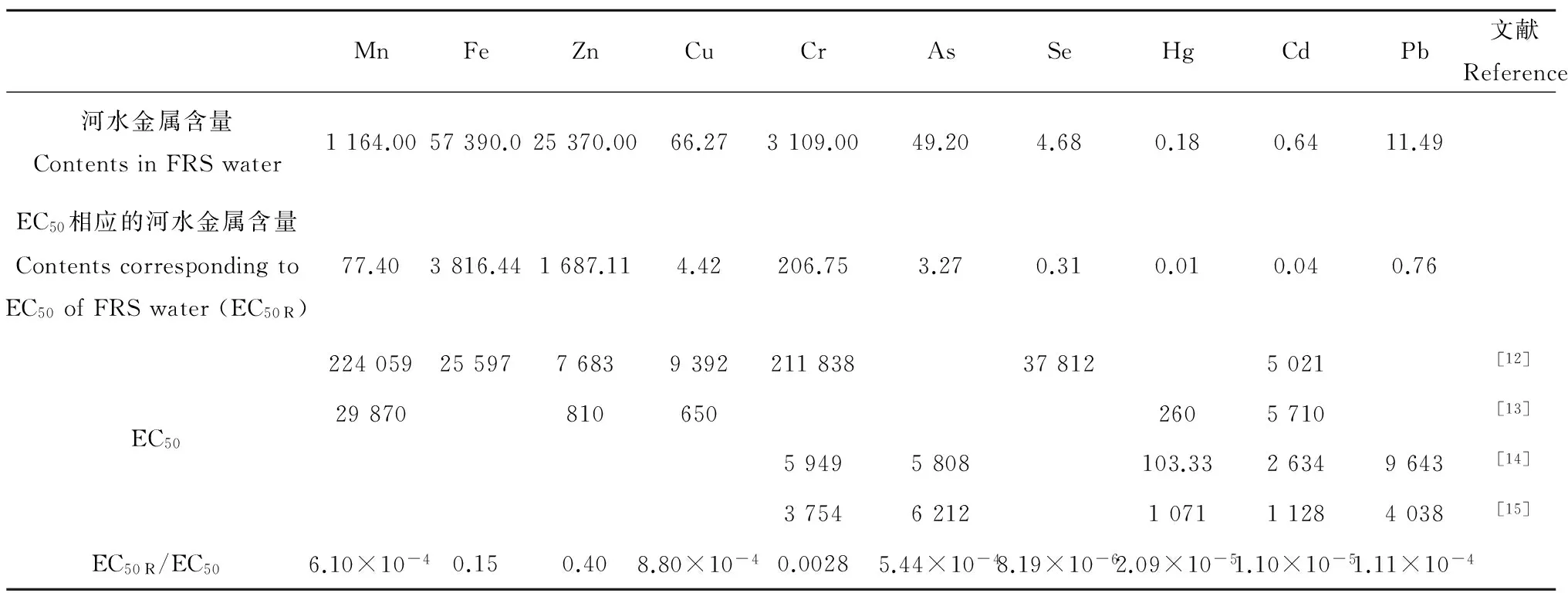
表2 滏阳河2号采样点河水对Q67半最大效应浓度时河水重金属含量(μg·L-1)和单个重金属EC50值Table 2 EC50 of heavy metals by Q67 bioassays and heavy metal contents (μg·L-1) corresponding to EC50 of Fuyang River System (FRS) water at sampling site No.2
3.3 滏阳河的邯郸近郊河水对斜生栅藻的毒性
用透射电镜观察了不同重金属含量河水暴露时斜生栅藻的细胞形态,结果表明:河水重金属污染能够改变斜生栅藻形态,空白对照组和暴露于低浓度的河水样品的斜生栅藻细胞呈纺锤型,细胞整体较饱满,表面结构完整。重金属含量相当于河水原浓度或更高时,斜生栅藻细胞整体形状变得狭长,出现了畸形细胞,藻细胞的表面结构完整性被破坏,细胞表面出现大量褶皱,细胞膜已破裂,出现了大量的藻细胞碎片,可能是河水重金属对其产生了严重的氧化损伤所致。虽然河水重金属污染对斜生栅藻的生长抑制作用不显著,暴露于重金属污染较重的滏阳河邯郸近郊河水4 d时,对斜生栅藻的生长抑制率也仅达到15%,但河水重金属污染能明显影响斜生栅藻的叶绿素、MDA含量及SOD活性。叶绿素a和叶绿素b是水藻细胞进行光合作用的2种主要色素物质,其含量的高低会直接影响到水藻细胞正常的代谢及生长。重金属进入藻细胞后,能与叶绿体中的蛋白质氨基酸残基结合,或取代了叶绿体中的Mg2+、Fe2+,从而破坏了叶绿体正常的结构和功能,使斜生栅藻叶绿素含量降低或功能发挥受限,重金属对叶绿素a含量的影响更为明显,这可能与藻细胞中叶绿素a自身含量较高有一定的关系。当重金属含量为原河水浓度的10%时,叶绿素a含量即显著降低,提示河流重金属污染影响了斜生栅藻正常的生理生化活动。很多文献都用叶绿素含量来反应植物体在环境中生长发育情况。本研究结果显示,2种叶绿素含量随河水样品浓度的提高,含量逐渐降低。藻细胞中叶绿素含量可以作为评价河流重金属污染的生态毒性的一项指标。
重金属离子可对斜生栅藻细胞造成氧化损伤,低浓度(低于所研究河水重金属含量)的河水重金属暴露导致其自身的抗氧化保护系统被激活,SOD酶活性提高,用来抵抗外界对其产生的损伤作用。当外界重金属污染物浓度继续增高时,超过了藻细胞抗氧化系统的自身调节能力,细胞受到过度的氧化损伤,正常结构和功能遭到破坏,引起藻细胞的死亡,SOD酶的总体活性又逐渐降低,达到所研究河水重金属含量3倍时,SOD活性显著降低。MDA是细胞内代谢产生或外界刺激诱导产生的超氧阴离子(·O2-)与生物膜系统中的不饱和脂肪酸发生反应生成的醛类物质(丙二醛),其含量的高低也可以间接地反映出生物体受到氧化损伤的程度。本次实验的结果显示,随着河水样品中重金属含量的提高,可能诱导和刺激斜生栅藻细胞产生了过量的·O2-,从而使其与膜质中的不饱和脂肪酸反应,在细胞中反应生成了大量的MDA,导致MDA的含量上升,当重金属含量相当于所研究河水的10%时。斜生栅藻体内MDA含量即显著上升,说明河流重金属污染给斜生栅藻带来了明显的氧化损伤。斜生栅藻MDA可以作为评估河流重金属污染生态风险的一项指标。
滏阳河流域水体中重金属污染较重,几乎全部66个采样点河水样品的Fe、Mn含量都很高,2/3的采样点Hg含量超过国家地表水环境质量标准的V类水体要求,Cr、Zn、Pb也有较严重的污染,66个采样点中,12个采样点重金属含量符合国家地表水环境质量标准(GB3838—2002)的I类水体标准,29个采样点重金属含量超过V类水体标准。以Fe、Zn、Mn、Cr、Cu、Pb、Hg金属含量较高的滏阳河2号采样点(邯郸近郊)河水为典型,研究重金属污染对发光菌Q67和斜生栅藻的毒性,发现河水重金属对发光菌Q67表现出明显的毒性,在重金属含量低于河水条件下,并不会对斜生栅藻生长产生明显的抑制作用。但对斜生栅藻叶绿素、MDA含量和SOD酶活性有明显影响,在重金属含量达到河水含量的10%时,叶绿素a含量即显著降低,MDA含量显著升高。河水重金属污染对水生生物有明显毒性,在关注滏阳河有机污染的同时,重金属污染对水生态系统的影响也应该给予重视。发光菌Q67的生长抑制率、斜生栅藻的叶绿素a和MDA含量可以作为评估河流重金属污染生态危害的指标。
参考文献(References):
[1]王金霞, 黄季煜. 滏阳河流域的水资源问题 [J]. 自然资源学报, 2004, 19(4): 424-429
Wang J X, Huang J Y. Water issues in the Fuyang River basin [J]. Journal of Natural Resources, 2004, 19(4): 424-429 (in Chinese)
[2]李亚楠, 孙宝盛, 张燕. 海河流域水质评价与预测[J]. 水土保持通报, 2014, 34(2): 177-181
Li Y N, Sun B S, Zhang Y. Evaluation and prediction of water quality in Haihe River basin [J]. Bulletin of Soil and Water Conservation, 2014, 34(2): 177-181 (in Chinese)
[3]Niu L L, Yang F X, Xu C, et al. Status of metal accumulation in farmland soils across China: From distribution to risk assessment [J]. Environmental Pollution, 2013, 176: 55-62
[4]张淑娜, 刘伟, 王德龙. 海河干流(市区段)表层沉积物重金属污染及变化趋势分析 [J]. 干旱环境监测, 2008, 22(3): 129-133
Zhang S N, Liu W, Wang D L. Heavy metal pollution and their history trend in the surface sediment of Haihe River [J]. Arid Environmental Monitoring, 2008, 22(3): 129-133 (in Chinese)
[5]刘清, 马梅, 童中华, 等. Cu、Zn、Cd、Hg对青海弧菌(Q67菌株)联合毒性作用的研究[J]. 中国环境科学, 1997, 17(4): 301-303
Liu Q, Ma M , Tong Z H, et al. Combined toxicity of Cu, Zn, Cd, Hg to Vibrio qinghaiensis sp. nov. (strain Q67) [J]. China Environmental Science, 1997, 17(4): 301-303 (in Chinese)
[6]刘保奇, 葛会林, 刘树深. 测定环境污染物对青海弧菌发光强度抑制的微板发光法研究[J]. 生态毒理学报, 2006, 1(2): 186-191
Liu B Q, Ge H L, Liu S S. Microplate luminometry for toxicity bioassay of environmental pollutant on a new type of fresh water luminescent bacterium (Vibrio qinghaiensis sp.-Q67) [J]. Asian Journal of Ecotoxicology, 2006, 1(2): 186-191 (in Chinese)
[7]徐晓宇, 魏颖, 唐红枫, 等. 甲胺磷、氯氰菊酯及其混合物对斜生栅藻的毒性[J]. 农业环境科学学报, 2007, 26(2): 718-722
Xu X Y, Wei Y, Tang H F, et al. Combined toxicity effect of methamiclophos and cypermethrin to Scenedesmus obliquus [J]. Journal of Agro-Environment Science, 2007, 26(2): 718-722 (in Chinese)
[8]胡芹芹, 熊丽, 田裴秀子, 等. 邻苯二甲酸二丁酯(DBP)对斜生栅藻的致毒效应研究[J]. 生态毒理学报, 2008, 3(1): 87-92
Hu Q Q, Xiong L, Tianpei X, et al. Toxic effect s of dibutyl phthalate (DBP) on Scenedesmus obliquus [J]. Asian Journal of Ecotoxicology, 2008, 3(1): 87-92 (in Chinese)
[9]郎超, 单保庆, 李思敏, 等. 滏阳河表层沉积物重金属污染现状分析及风险评价[J]. 环境科学学报, 2016, 36(1): 64-73
Lang C, Shan B Q, Li S M, et al. Pollution analysis and ecological risk assessment of heavy metals in surface sediments of Fuyang River [J]. Acta Scientiae Circumstantiae, 2016, 36(1): 64-73 (in Chinese)
[10]李珊珊, 单保庆, 张洪. 滏阳河河系表层沉积物重金属污染特征及其风险评价[J]. 环境科学学报, 2013, 33(8): 2277-2284
Li S S, Shan B Q, Zhang H. Characteristics and ecological risk assessment of heavy metal pollution in surface sediments of Fuyang River [J]. Acta Scientiae Circumstantiae, 2013, 33(8): 2277-2284 (in Chinese)
[11]Tang W Z, Zhang H, Shan B Q, et al. Accumulation and risk assessment of sedimentary trace metals in response to industrialization from the tributaries of Fuyang River system [J]. Environmental Earth Sciences, 2015, 73: 1975-1982
[12]邓辅财, 刘树深, 刘海玲, 等. 部分重金属化合物对淡水发光菌的毒性研究[J]. 生态毒理学报, 2007, 2(4): 402-408
Deng F C, Liu S S, Liu H L, et al. Toxicities of selected heavy metal compounds and their mixtures to photobacteria (Vibrio qinghaiensis sp. -Q67) [J]. Asian Journal of Ecotoxicology, 2007, 2(4): 402-408 (in Chinese)
[13]Ma M, Tong Z, Wang Z, et al. Acute toxicity bioassay using the fresh water luminescent bacterium Vibrio qinghaiensis sp. nov. -Q67 [J]. Bulletin of Environmental Contamination and Toxicology, 1999, 62(3): 247-253 (in Chinese)
[14]皇甫鑫, 廖翀, 杨坪, 等. 金属化合物对发光菌的毒性效应及不同发光菌的敏感度差异研究[J]. 环境科学学报, 2010, 30(9): 1787-1792
Huangfu X, Liao C, Yang P, et al. Toxicity of metal compounds to luminescent bacteria and sensitivity differences of different luminescent bacteria [J]. Acta Scientiae Circumstantiae,2010, 30(9): 1787-1792 (in Chinese)
[15]周世明, 赵清, 舒为群. 青海弧菌Q67新鲜培养菌液测试水中砷铬铅镉汞的急性毒性[J]. 预防医学情报杂志, 2008, 24(6): 403-406
Zhou S M, Zhao Q, Shu W Q. Use freshly prepared Vibrio qinghaiensis sp. -Q67 suspension to detect acute toxicity of metal chemicals in water [J]. Journal of Preventive Medicine Information, 2008, 24(6): 403-406 (in Chinese)

