微塑料污染的水生生态毒性与载体作用
陈启晴,杨守业,Henner Hollert,尹大强
1. 同济大学海洋与地球科学学院,上海 200092 2. 华东师范大学河口海岸学国家重点实验室,上海 200062 3. 同济大学环境科学与工程学院,上海 200092 4. 亚琛工业大学环境研究所,亚琛 52074,德国
2015年塑料的全球年产量已达3.22亿吨,并仍将持续增加[1]。随着塑料制品给社会生活带来便利的同时,“塑料时代”的消极面也逐渐显现出来。事实上,塑料在水环境中的累积不仅产生景观问题和一系列的生态影响,当它们降解、碎化成更小的颗粒——“微塑料”后,其被生物摄入的可能性将显著增加,该现象已引起科学界的广泛关注。微塑料的概念于2004年在《科学》杂志[2]上被定义,即尺寸小于5 mm的塑料碎片或者颗粒。根据欧盟海洋战略框架指令(Marine Strategy Framework Directive,MSFD)的分类和文献报道,尺寸大于25 mm的塑料碎片为大塑料(macroplastics),尺寸介于5~25 mm之间的塑料碎片为中塑料(mesoplastics),尺寸小于5 mm的塑料为微塑料(microplastics),而当尺寸小至纳米级别,介于1~100 nm之间的塑料称之为纳米级微塑料(nanoplastics)[3-5]。
微塑料是海洋中丰度最高的塑料污染,关于微塑料污染的研究已成为目前国际上的研究热点之一[6]。大量证据显示,微塑料在水生生态环境中广泛存在,并且这可能成为一个“长期”而“持久”的问题。从大型塑料碎片形成微塑料的过程较快,而从微塑料降解至更小颗粒直至矿化的过程却极为缓慢[7],微塑料的预测生命周期为几百到几千年[8]。然而至今为止,微塑料的释放迁移、环境赋存,及其自身引起的生态与健康危害尚不明确;同时,作为其他环境污染物“载体”的角色解析和生态风险仍不清晰。本文将以阐明上述问题为根本出发点,综述进展、深入讨论,并作出展望。
1 水体中微塑料的来源、分布与污染现状(The sources, distribution and concentrations of microplastics in the aquatic environment)
水环境中的微塑料主要来自大片塑料残骸的碎化和降解,塑料可以随着风力迁移或者雨水冲刷,从陆地进入地表水,最后进入淡水和海洋生态系统中[9-10];水体作业过程也可直接引入塑料污染,包括船舶运输和捕鱼等活动[11]。塑料进入水体后,在紫外辐射、水体扰动、波浪击打、物理磨损、生物栖息,以及冻融循环等作用下发生碎化和降解,逐渐形成微塑料[7]。另外,微塑料还可以通过直接排放的方式进入环境,比如,化妆品中的颗粒和服装的纤维等,这些小颗粒可以穿过污水处理系统,最终进入到水环境中[6]。
紫外辐射是微塑料降解形成的主要推动力。通常光氧化降解在沙滩表面相对高效,在深海或者河底沉积物中的效率较低,因而不同环境介质中微塑料的丰度差异较大[7, 12]。塑料颗粒的垂直分布还与其密度相关:高密度下沉、低密度上浮,多数常见塑料的密度低于淡水或者海水的密度,例如低密度聚乙烯(0.89~0.93 g·cm-3),高密度聚乙烯(0.94~0.98 g·cm-3),聚丙烯(0.83~0.92 g·cm-3),密度较低在水中上浮;而聚苯乙烯(1.04~1.1 g·cm-3)和聚氯乙烯(1.16~1.58 g·cm-3)密度较高易于下沉。同时生物作用也会改变微塑料的密度和分布位置[7]。例如,漂浮的塑料会因生物覆盖导致密度增加而沉入水下;一旦其上的生物被捕食,密度下降后塑料又可回至水体表层[7-8]。图1概括了微塑料在不同水生生态环境中平均丰度变化范围,在水体中的丰度范围为0.15~7 630个·m-3或0.01~34 mg·m-3,在沉积物中的丰度范围为1.8~1 445个·m-3或0.45~92 373 mg·m-3,总体而言微塑料丰度变化范围较大,不同海域的水体或沉积物丰度存在104~105数量级的差异。
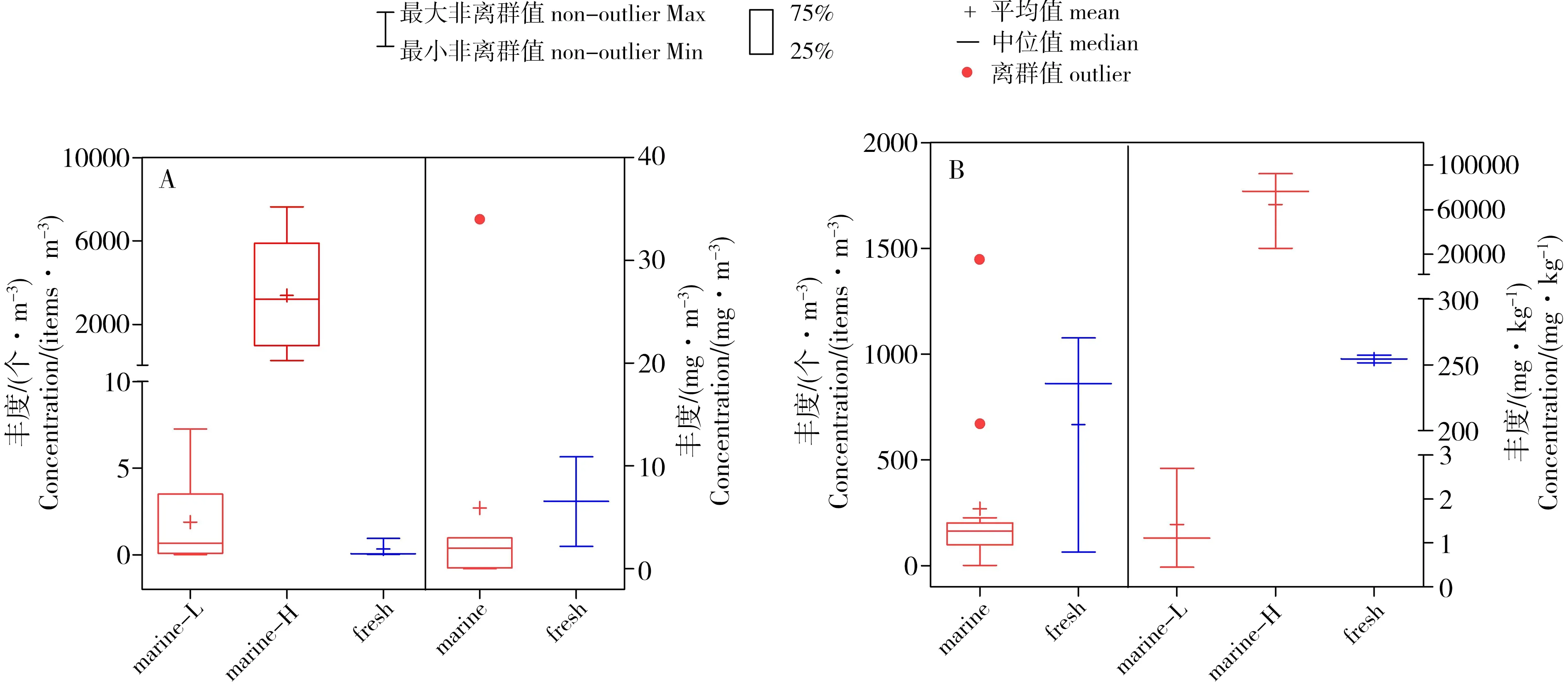
图1 微塑料在水体(A)和沉积物(B)中的环境丰度注: marine-L, 海洋环境(较低丰度);marine-H, 海洋环境(较高丰度);fresh, 淡水环境。Fig. 1 Microplastics concentrations in water (A) and sediment (B) environmentsNote: marine-L, marine environment (lower range); marine-H, marine environment (higher range); fresh, freshwater environment.
1.1 海洋环境中的微塑料
近年来,关于微塑料的赋存及污染水平研究主要集中在海洋环境。微塑料几乎在全球各处海域被检测到[8, 13],包括北冰洋及深海区域[14-16]。微塑料的丰度描述单位不尽一致,既有按照单位体积/面积来度量的,又有按照单位质量来度量的,同时对微塑料的表述也包含个数和质量2种,因此造成不同研究结果间难以比较。不过总体而言,海洋表层水体污染程度高于下层及深海区域,且微塑料易在海岸带沉积[17-20]。并且微塑料的丰度在不同海域间差异较大。在靠近工业中心或者大都市等人类聚居区的海域,通常具有微塑料高污染的特征。而封闭或者半封闭的海域,例如地中海、加勒比海[21-22],或是海洋中由于洋流运动形成的环流区域,也易于形成微塑料的高污染区,例如北太平洋和北大西洋的亚热带环流区都存在毫米级塑料的“大垃圾带”[9, 11, 23]。
通过对太平洋表层水的丰度监测发现,海洋表层水体中微塑料的丰度在0.022~8 654个·m-3的范围内,而表层以下水柱中的丰度在0.014~12.51 个·m-3之间[24]。不过在加勒比海沿岸水下4.5 m处也发现了8~9 180 个·m-3微塑料的高丰度区域[22],而我国长江三角洲表层水1 m深处的水柱中的微塑料赋存丰度也非常高,其范围为500~10 200 个·m-3[25]。海岸沉积物中微塑料的平均丰度为13~167 个·kg-1,高潮线处由于受潮汐影响较小,往往具有较高的微塑料丰度[26]。我国长江入海口沉积物中的微塑料丰度为20~340 个·kg-1[27],渤海海岸微塑料含量的范围为103~163个·kg-1,且研究者发现沉积物表层(2 cm)比深层(20 cm)的略高,海水浴场等旅游景区的微塑料含量较非景区高[19]。关于深海沉积物的微塑料丰度报道鲜见,大西洋、印度洋和地中海等海域300~3 500 m深处沉积物中微塑料的丰度在28~800个·L-1之间[15],因此Woodall等[15]认为深海也将成为一个重要的微塑料垃圾的“汇”。
1.2 淡水环境中的微塑料
至今为止,微塑料在淡水生态系统中的报道相对较少,现有测定主要集中在大型的湖泊与河流。与海洋污染相似之处在于,淡水沉积物中也具有微塑料污染的高风险,且在人口密集和旅游胜地的污染较为严重。
Lechner等[28]测定了2010年多瑙河(维也纳到伯拉第斯拉瓦段)的微塑料(部分粒径范围大于5 mm,粒径在0.5~20 mm之间)平均丰度为0.938个·m-3,该丰度较2012年测定时高出一个数量级(0.055 个·m-3),可能是由于塑料产品运输管道的泄漏引起的。湖泊中微塑料的丰度数据如下:北美的苏必略湖、休伦湖、伊利湖中的表层水微塑料平均丰度为0.043个·m-2[29],此浓度与瑞士日内瓦湖接近,其平均值为0.048个·m-2 [30]。亚洲湖泊中塑料颗粒含量较高,例如蒙古北部的库苏古尔湖表层水中微塑料平均丰度为20 264个·km-2[31],我国太湖表层水中丰度可达3.4~25.8 个·L-1[32]。不同地区间微塑料在淡水沉积物中的丰度差异较大。例如,我国太湖沉积物中的微塑料丰度为11~235 个·kg-1[32],而德国莱茵河与美因河的沉积物中微塑料丰度分别为228~3 763个·kg-1和786~1 368 个·kg-1[33]。并且,微塑料的分布也受到风向和水流作用的影响,比如意大利的加尔达湖北部沉积物丰度为1 108 个·m-2远高于湖泊南部(108 个·m-2)[34]。
综合各方面的资料发现:水体环境中,潮下带和深海沉积物中微塑料的丰度高,显示具有微塑料污染“汇”的特征;表层水和水柱中的微塑料通常在5 m水层以上检测到[35]。且水体中微塑料丰度变化范围较大,封闭、环流区域会形成局部高污染。目前,我国有关微塑料的存在与污染水平的报道仍然有限,主要集中在长江东海入海口、山东半岛海岸带,以及太湖流域等,亟需加大研究力度并尽早、尽快建立规范化的测定、表述及表征方法。
2 微塑料的水生态毒性(The aquatic ecotoxicology of microplastics)
微塑料可以被多种水生生物摄入,大部分残留在消化道中,并可以被快速排出体外,但也有部分研究证实,微塑料一旦进入生物体内,外排将变得缓慢,并可能产生一系列的生态毒理学效应。
2.1 水生生物对微塑料的摄取和排出
由于大多数水生生物主要依赖形状、大小和颜色判断食物,缺乏进一步的选择机制,因此很多低密度的微塑料可以被浮游的滤食性生物摄取,高密度的微塑料可以被以沉积物为食的底栖生物摄取[36]。
实验研究发现水生生物主要通过捕食行为摄取微塑料。例如,经10~45 μm聚乙烯微塑料(300 个·mL-1)暴露5 d后,31%的海胆(Tripneustes gratilla)幼虫的胃内都检测到了微塑料[37]。同样地,研究者也发现经微塑料暴露后,微塑料也可在挠足类浮游生物Centropages typicus的肠道中检测到[38]。微塑料还可以通过鳃的呼吸作用进入水生生物体内,例如贻贝(Mytilus edulis)和滨蟹(Carcinus maenas)都可以通过鳃呼吸摄入微塑料[39-40]。
而在野外调研过程中,研究者也证实了微塑料在实际水生生物体内的存在。通常,较低营养级生物的摄入量是比较低的。例如,平均每17个北太平洋的磷虾体内含有1个微塑料颗粒,平均每34个挠足类浮游生物Neuocalanus cristatus体内含有1个微塑料颗粒[41]。Goldstein等[42]还发现生活在水面表层的鹅颈藤壶(Lepas sp.)体内也含有微塑料,且主要集中在肠道部位。法国-比利时-荷兰海岸线上的贻贝和沙蚕(Arenicola marina)体内微塑料含量分别为(0.2±0.3)和(1.2±2.8) 个·g-1生物量[43]。随着营养级的增加,微塑料摄入量略有上升:在北太平洋涡流区约35%的食浮游生物的鱼类胃部检到了微塑料颗粒,平均含量为2.1个·鱼-1,塑料粒径在1~2.8 mm之间[44]。另外,人工养殖的水生生物体内含量更高,例如未经释放前贻贝和牡蛎(Crassostrea gigas)体内含量分别为0.47和0.35个·g-1软组织,经释放后仍有0.36和0.24 个·g-1的残留[45]。
虽然,在不同的水生生物体内都检测到了微塑料的存在,但大部分微塑料颗粒由于粒径较大而仅仅存在于胃肠道中,并能在几个小时或者几天内被排出体外[21]。但也有研究报道指出,在一些小颗粒微塑料的暴露实验中,微塑料可以进入胃肠道周边其他组织(例如,肝脏[46]),甚至是循环系统[47],而且微塑料的排出也会变得缓慢[48]。微塑料还可以通过肠道进入贻贝的循环系统。在经微塑料暴露结束48 d后,研究者仍在其血淋巴的组织中检测到了微塑料的存在[47],另一暴露实验发现,>0~80 μm尺寸的微塑料可以进入贻贝的胃部和消化腺,甚至是消化道的溶酶体系统中[40]。类似的现象也在滨蟹暴露实验中观察到,滨蟹在喂食经0.5 μm微塑料暴露的紫贻贝后,微塑料可以进入滨蟹的血淋巴组织,经21 d释放后体内颗粒才逐渐释放彻底[48]。当微塑料的尺寸降至纳米级,其对生物体的入侵能力进一步增强。研究者在经39.4 nm微塑料暴露后的青鱂胚胎卵黄区域的油滴中,以及经20 nm微塑料暴露后的大型蚤血淋巴组织周边的油脂储存细胞中,都发现了纳米级微塑料的存在[49-50]。这些微塑料还在青鱂成鱼的大脑、睾丸、肝脏和血液中检测到,证明纳米级别的微塑料可以穿过血脑屏障,并最终进入脑部组织[50]。
2.2 微塑料毒性和生物迁移
2.2.1微塑料对水生生物的毒性效应
至今有关微塑料对海洋和淡水生物的毒性效应研究均有开展,关于海洋生物的研究相对广泛。水生生物毒性效应的研究目前大多以短期暴露实验为主,微塑料对水生生物存活率等急性毒性作用不显著,效应主要集中在摄食速率、生长速率、氧化损伤、能量耗竭和行为异常等亚致死水平上(表1,图2)。
不同的效应之间是相互关联的,例如对食物摄入的下降,将导致能量储备的降低,继而引起一系列与之相应的生理功能损伤,包括繁殖率的下降和后代体型变小等[51-52]。暴露粒径对毒理效应也有显著影响,粒径小的微塑料通常在生物体内停留时间更久,并能迁移至其他组织,造成细胞及分子水平的毒害效应[49-50]。值得一提的是,大多数的效应出现在较高暴露水平下,后续的研究应结合野外环境中微塑料的污染现状进一步展开。
2.2.2微塑料的食物链迁移
部分研究证实微塑料可以发生食物链迁移。例如,将预先摄取微塑料的挠足类或者多毛类浮游动物喂食糠虾(Mysis relicta)之后,微塑料可累积在糠虾的肠道中[53]。而贻贝体内的微塑料也可以迁移到滨蟹,蓄积在胃部、鳃部、肝胰腺、卵巢和血淋巴组织中,并在暴露21 d后仍检测到体内颗粒的残留[48]。食物链迁移产生的生物效应不显著[54],但可能影响摄食行为[38]。例如藻类可以携带着微塑料被上一营养级生物摄取[55],但Cole等[56]也发现在将挠足动物同时暴露于藻类和20 μm微塑料后,其对小粒径的藻类摄入量(11.6~12.6 μm)显著上升。当微塑料的尺寸降至纳米级,生物效应将更为显著。例如,纳米级微塑料被证实可以沿着斜生栅藻—大型蚤—鲫鱼的水生食物链发生迁移,并影响鲫鱼的脂质代谢和行为活动[57]。
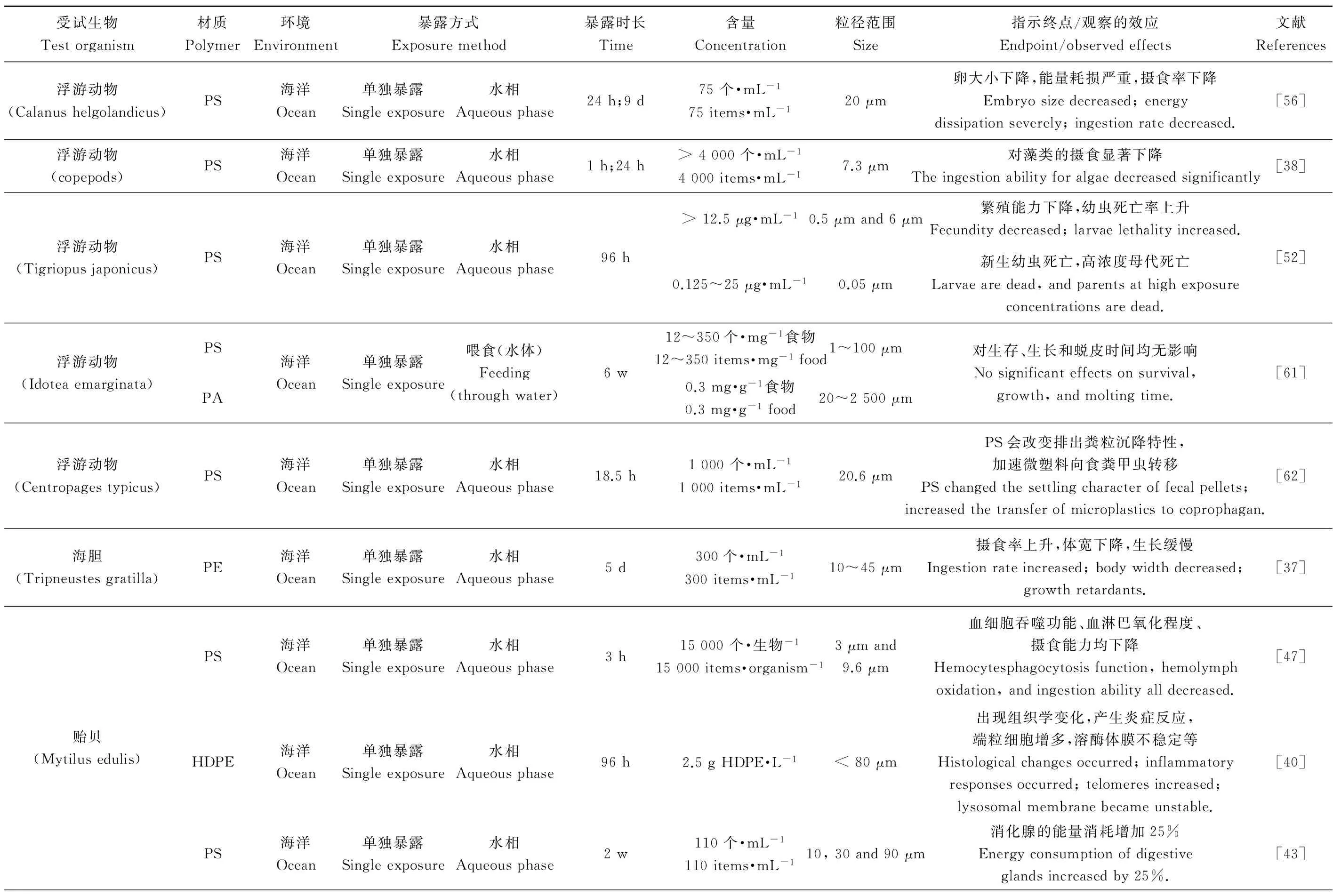
表1 微塑料对水生生物的毒性效应Table 1 The toxic effect of microplastics on aquatic organisms
注:PS,聚苯乙烯;PE,聚乙烯;HDPE,高密度聚乙烯;LDPE,低密度聚乙烯;PA,聚丙烯酸;uPVC,未经塑化的聚氯乙烯;PCBs,多氯联苯;h,小时;d,天;w,周;m,月;AChE,乙酰胆碱酯酶;IDH,异柠檬酸脱氢酶;Vtg I,卵黄蛋白原基因;Chg H,绒毛形成基因;ERα,雌激素受体基因。
Note: PS, polystyrene; PE, polyethylene; HDPE, high density polyethylene; LDPE, low density polyethylene; PA, polyacrylic; uPVC, unplasticized polyvinyl chloride; PCBs, polychlorinated biphenyls; h, hour; d, day; w, week; m, month; AChE, acetylcholinesterase; IDH, isocitratedehydrogenase; Vtg I, vitellogenin gene; Chg H, choriongenesis gene; ERα, estrogenic receptor gene.
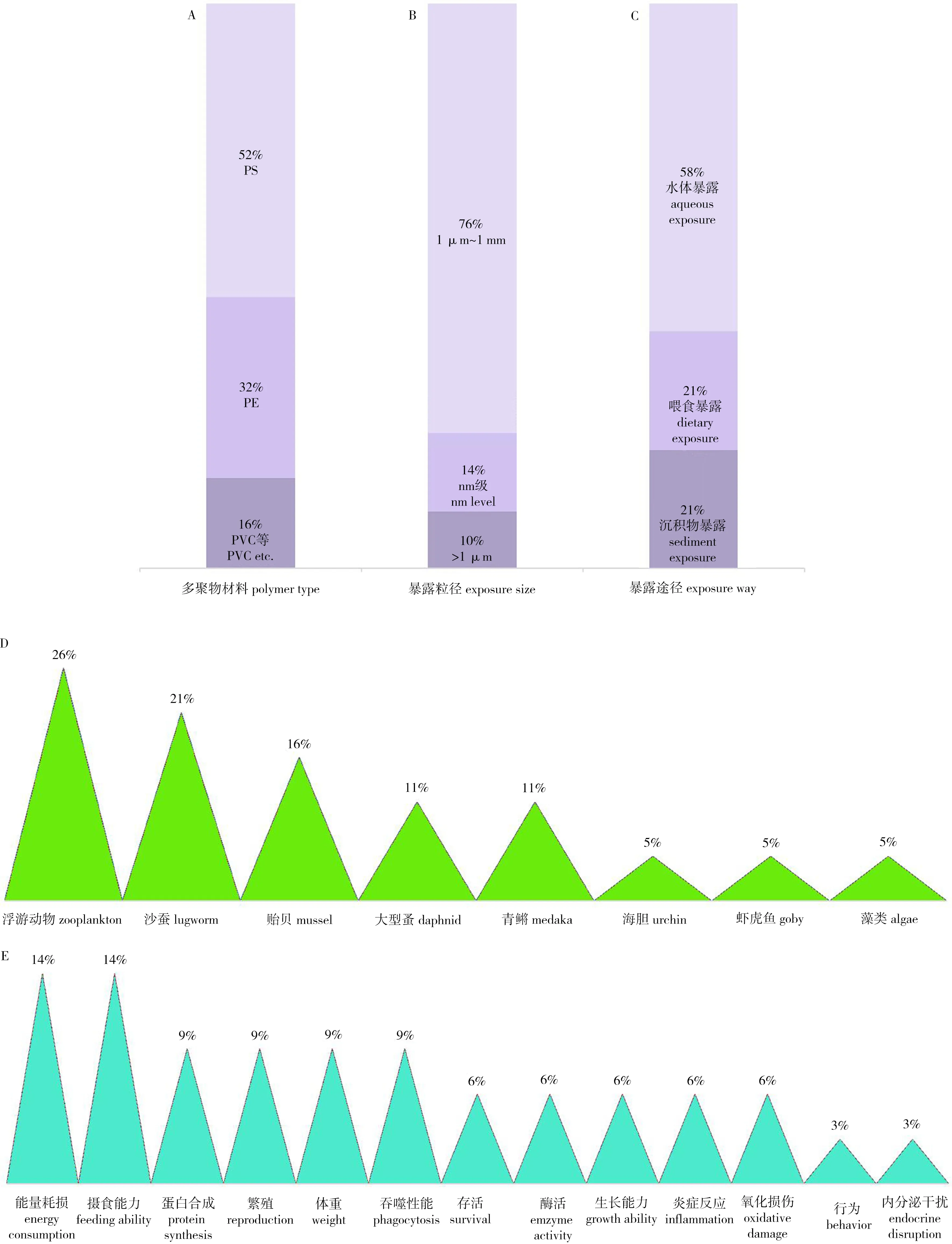
图2 微塑料对水生生物的毒性效应解析注:A,毒性暴露实验选用多聚物材料比例;B,微塑料暴露粒径分布情况;C,微塑料暴露途径的文献报道比例;D,受试生物的文献报道比例;E,水生生物经微塑料暴露后,毒性终点文献报道比例;PS,聚苯乙烯;PE,聚乙烯;PVC,聚氯乙烯。Fig. 2 The analysis of microplastics toxic effects to aquatic organismsNote: A, the ratio of different polymers used in exposure experiments; B, the microplastics size distribution; C, the microplastics exposure ways; D, the aquatic organisms have been tested; E, the toxic endpoints have been adopted according to literature; PS, polystyrene; PE, polyethylene; PVC, polyvinyl chloride.
另外值得注意的是,微塑料可能已经进入人类的食物链体系,如Liboiron等[58]报道,2.4%的人类食用的大西洋鳕鱼体内含有微塑料。而大型人类食用的大西洋马鲛和巴西鲨鱼体内平均含有2~6个微塑料颗粒[59]。同时,食用的海盐中也含有许多微塑料颗粒[60]。虽然微塑料的食物链迁移已被报道,但微塑料在食物网中的累积效应、是否具有生物放大效应,以及微塑料是否会沿着食物链进入人体并产生潜在的生态危害尚缺乏深入的研究。
综上,现有的研究表明水生生物可以摄入微塑料,但是关于其生态毒性效应的研究才刚刚起步。大部分情况下,颗粒仅在肠道中停留,随着暴露粒径下降,可进入周边组织和循环系统。微米尺寸以上的微塑料,易于被摄入也易于被排出;但过大的微塑料颗粒也可能会滞留在某些生物体的消化道内造成物理损伤,具有潜在增加暴露的风险。纳米尺寸的微塑料,一旦进入生物体内,排出缓慢,并可以穿过细胞膜进入周边组织及循环系统等,产生细胞和分子层面上的毒性效应。
3 微塑料的多重载体作用(The multiple carrier function of microplastics)
假设微塑料的存在是“持久”的,其质轻且具有良好的流动性,可随着水流做长距离的迁移,那么它将成为一种新型的生物、化学载体。微塑料具有较大的比表面积和良好的疏水性能,已被证实可以富集水体中的有机污染物;同时,由于塑料生产过程中为了满足不同的应用需要,往往添加了增塑剂、防火剂、抗菌剂、染料等化学组分,而这些添加剂会在塑料降解的过程中释放出来,并随着微塑料的流动而迁移;同时,在天然水体中,微塑料的表面极易被生物膜覆盖,是昆虫产卵、菌藻定植的良好栖居之所。因此,微塑料的多重载体作用已经成为其生态毒理效应研究的一大重要议题(图3)。
3.1 微塑料与水体污染物的结合
近年来,大量关于微塑料和疏水性有机污染物的相互作用的研究被报道。微塑料对污染物有较强的吸附性能,微塑料上的污染物富集浓度可较水体浓度高出几个数量级[6]。实验室研究发现,聚乙烯微塑料(10~180 μm)对多氯联苯类物质的吸附能力与沉积物中有机组分相当,而当粒径降至纳米级(70 nm),其吸附能力还将高出1~2个数量级[71]。野外样品测定结果发现,在日本海附近采集的聚丙烯微塑料上,检测到了多氯联苯(PCBs)、滴滴伊(DDE)、壬基酚的浓度分别为4~117 ng·g-1,0.16~3.1 ng·g-1和0.13~16 μg·g-1,其中PCBs和DDE主要来源于水体富集,其表观吸附参数可达105~106[72]。
虽然微塑料对污染物有良好的吸附性能,但其自身的迁移能力并不高。研究者通过建立塑料迁移模型,预测发现微塑料的迁移量比其他随着洋流迁移的物质低4~6个数量级[14],因此微塑料与共存污染物可能对原位水生生物的生态风险更高。当微塑料与污染物共存时,水生生物摄入微塑料既可能增加生物体的污染水平,又可能降低污染物在生物体内的累积,主要取决于污染物在微塑料和生物体之间的逸度梯度[73]。模型预测结果显示,在受到污染的生态系统中,微塑料稀释和清除污染物的作用超过其对污染物的载体作用。例如,Gouin等[74]利用平衡分配概念建立了持久性有机污染物(POPs)在大气、水体、沉积物和塑料之间的海岸生态系统分配模型。结果发现由于沉积物和溶解性有机质对POPs的竞争吸附作用,最终分配进入聚乙烯微塑料的污染物仅占<0.1%。同样地,Koelmans等[75]模拟了微塑料存在时开放海岸环境中POPs在沙蚕体内的富集状况,发现微塑料可减少POPs的富集,其对污染物的稀释和清除作用超过了其载体效应。但是,上述模型均以海岸为研究背景,存在复杂的竞争吸附和分配机制,且模型将生物体视为固定的常数,而未考虑因微塑料的摄入产生的物理应激效应,例如肠道阻塞、摄食速率和生长下降等可能导致污染物迁移的动力学参数变化的因素[73],与实际的生物富集状况存在差异。
相反地,实验室研究发现,微塑料和污染物共存时,往往能促进有机污染物在水生生物体内富集,并改变污染物的毒性效应和作用机制。近期,南京大学马旖旎等[67]发现50 nm的微塑料可以显著增加菲在大型蚤体内的富集,并和菲体现出加和毒性效应。同时,研究者们发现微塑料可以抑制菲及其代谢产物的降解,从而增加这些污染物在大型蚤体内的累积。也有报道指出,微塑料的存在会增加芘在胆汁中代谢产物的浓度,降低芘引发的虾虎鱼(Pomatoschistus microps)幼鱼死亡率,以及降低异柠檬酸脱氢酶的活性[68]。Rochman等[69]将海水浸泡老化之后的聚乙烯微塑料掺入喂食成年青鱂(Oryzias latipes),发现较未老化的微塑料暴露组,雄鱼的卵黄蛋白原基因表达量显著下调,并产生生殖细胞增殖的现象,而雌鱼的多个内分泌干扰效应相关的基因表达在老化和未经老化的微塑料暴露组均下调。上述结果说明微塑料和污染物的共存暴露会干扰成年青鱂的内分泌系统。
至今为止,关于微塑料通过水体暴露而富集,并在生物体内累积和对生物效应的影响的研究报道较少,模型预测和实验验证需进一步结合开展。海水和淡水中污染物分布特征和浓度不同,关于淡水生态系统的共存污染研究还需加强。
3.2 微塑料自身携带的添加剂等
前期研究结果表明,微塑料对水体有机污染物的载体作用相当或略高于水体中其他悬浮颗粒(有机质颗粒、浮游植物等)[73, 76-78]。但是值得注意的是,微塑料对污染物的迁移不仅仅止于富集水体污染物,其自身携带的大量添加剂也将对水生生物产生威胁,并且存在混合暴露的风险。
壬基酚、双酚A、苯甲醛和多氯联苯醚等物质是常用的塑料添加剂,并在微塑料中被检测到[72, 79]。也有证据表明防紫外辐射稳定剂、多种邻苯二甲酸酯类等具有雌激素效应或者抗雄激素效应的塑料添加剂也在微塑料上广泛存在[80]。另值得一提的是,塑料在降解过程中易释放聚合物单体,例如苯乙烯的单体可从塑料中释放出来,它们也具有降低网纹蚤(Ceriodaphnia dubia)的繁殖率等内分泌干扰效应[81]。
塑料添加剂的存在被普遍检测到,并且这些添加剂的存在会进一步增加微塑料的生态风险,但是关于其相互作用研究仍存在很大的研究空白。至今鲜有关于微塑料是否可以作为添加剂载体加速其向生物体迁移,或与其他水体污染物作用增加联合暴露风险的报道。
3.3 微塑料表面的生物膜
3.3.1塑料圈
塑料碎片相对于其他天然漂浮物质具有更长的半衰期,其疏水的表面为微生物提供了居所,促进了生物膜的形成,被称为“塑料圈(plastisphere)”[82]。研究发现生物膜的形成非常迅速[83],并且其上微生物群落会随着水体环境的不同而改变[82-85]。
例如,一些微塑料的表面成为了浮游海黾(Halobates sp.)的产卵场所,特别是近40年来,北太平洋副热带环流处的微塑料丰度增加了2倍,海黾的数量也随之增长,研究者在24%的塑料碎片上观察到了海黾虫卵[86-87]。微塑料表面的生物膜也往往含有大量的细菌和藻类,且多种因素可以影响微生物的群落分布。研究发现,在北太平洋环流处的塑料颗粒表面,芽孢杆菌(1 664±247 个·mm-2)和羽状硅藻(1 097±154 个·mm-2)丰度最高,也同时存在球状菌、中心硅藻、双鞭毛虫、颗石藻、放射虫等微生物。细菌在泡沫聚苯乙烯上含量高,硅藻的丰度随着塑料粗糙度的增加而增加[85]。另外,还有研究鉴定出某些微塑料的表面含有碳氢化合物的降解菌,这些细菌有助于微塑料的进一步降解和碎片化[82]。
因此,微塑料作为微生物的载体具有积极的影响,包括可以加速塑料降解和生物能量的迁移,并促进生态关联。但也有研究发现在微塑料表面发现了Vibrio属的人类致病菌,并在某些颗粒上占据主要生态位,因而可能会影响水质的安全,并对人类健康造成潜在威胁[82]。
3.3.2生物对微塑料在水体中垂直分布的影响
微塑料在海洋中的垂直分布也会改变其对水生生态系统的影响。在大多数情况下,高密度的微塑料下沉,而低密度的微塑料上浮、停留在水面表层(约占46%)[88]。但随着微生物的栖居,微塑料的疏水性下降,颗粒密度被修饰,浮力逐渐下降,从而影响其在水体中的垂直分布[83]。例如,许多藻类会排出胞外多糖,而胞外多糖可以在湍流等作用下形成粘性颗粒的团聚体[89-91],微塑料可以被包裹进入这些藻类团聚体[92]。通常,这些团聚的藻体是海洋残骸垂直运输到大洋底部的重要交通工具,因此微塑料也可能通过这一途径被垂直运输至水体底部,从而产生不同的生态效应[93]。另外,当微塑料被浮游动物摄入之后,还会改变其排出粪便的密度和结构完整性,对水生生态系统的垂直碳通量产生影响[38]。
至今为止,我们对微塑料和其上的微生物群落之间的相互作用关系了解还不够充分,亟待进一步的研究。而鉴定其上主要的微生物群落、不同水体环境的种群构成、微生物栖息之后对微塑料的影响,这些都将成为未来微塑料污染研究的关键问题。
4 展望(Outlook)
微塑料在水生生态系统中的广泛分布和累积,已经引起了人们关于其对水生生物的作用和潜在效应等方面的关注。从研究现状来看,未来亟待开展以下几个方面的研究:
(1)建立微塑料水环境测定方法,开展环境归趋研究
目前,有关微塑料赋存与丰度研究,主要存在丰度单位不尽相同(既有体积/面积单位,又有质量单位;既有按照微塑料个数计算的,又有按照微塑料重量计算的),以及粒径划分不一致等问题,导致研究数据之间难以比较,因此亟待建立合适的、统一的、规范的微塑料采集、分析和测定方法。微塑料可以在环境中不断降解,通过实验室模拟实验已经验证了纳米级微塑料的存在[94]。纳米级的颗粒具有更高的表面能和更强的穿透能力,将对水生生物产生不同于大颗粒的生物效应[95]。因此,纳米级微塑料在水环境中的赋存状态和环境归趋是亟待解决的问题。
(2)建立微塑料毒性测定方法,揭示生态毒性效应
由于微塑料与普通污染物的物理化学性质不同,亟需建立起标准毒性测试方法,或可参考纳米材料生物效应研究的经验。关于水生生物对微塑料的摄入研究较多,但对其毒性效应研究较少,主要集中于少数几种水生生物,毒性终点指标不够全面。未来有必要在进一步解析微塑料对这些生物的毒性作用机制的基础上,展开更为系统的生态毒理学研究。研究中采用的暴露浓度通常高于环境浓度,暴露时长较短。急性毒性测试往往不能提供全面的信息,因此有关微塑料低剂量长期暴露的研究还需加强。同时,海洋环境的研究正在起步并将逐渐深入,而针对淡水生态环境的研究尚严重缺失。暴露试验条件(酸碱、温度、有机质含量等)对微塑料形态和迁移的影响,以及进入生物体后微塑料与生物大分子的相互作用尚未明确,在未来的研究中应予以重视,这样才能更准确预估实际环境中的微塑料毒性效应,并进行全面的生态风险评价。
(3)研究微塑料的载体作用,全面评价微塑料的生态效应
关于微塑料如何改变共存污染物的富集和毒性作用的机理尚不明确,需要进一步研究和探索。微塑料对微生物的载体作用,以及微塑料被包裹在藻类团聚体和生物质颗粒中发生垂直迁移等方面的研究不足,应加快研究进程以了解微塑料对微生物的迁移和碳循环的作用。微塑料的载体作用在水生生态系统中的影响可能超过其自身的毒理学效应,是未来研究的关注重点。
(4)开展微塑料污染控制政策研究
我国沿海码头浮筒和水产养殖设施中经常使用的浮筒类材料主要由泡沫聚苯乙烯塑料构成,在使用过程中极易形成无数的微小塑料颗粒,成为局部区域微塑料污染的一个重要来源。我国近海海面和海滩中泡沫聚苯乙烯类微塑料污染现状不容乐观[11, 96]。欧美等国对微塑料的管控已经在政策层面上体现,包括欧盟海洋战略框架指令(MSFD)的2010/477/EU决议,以及美国环保局(EPA)都将微塑料列入了海洋有害威胁物质名单中[5,97]。我国也亟需加快从法律和政策角度对水环境中塑料及微塑料污染控制。
参考文献(References):
[1]Plastics Europe. Plastics, the facts 2016 [EB/OL]. (2017-01-25) [2017-02-10]. www.plasticseurope.org
[2]Thompson R C, Olsen Y, Mitchell R P, et al. Lost at sea: Where is all the plastic? [J]. Science, 2004, 304(5672): 838
[3]Klaine S J, Alvarez P J J, Batley G E, et al. Nanomaterials in the environment: Behavior, fate, bioavailability, and effects [J]. Environmental Toxicology Chemistry, 2008, 27(9): 1825-1851
[4]Koelmans A A, Besseling E, Shim W J. Nanoplastics in the Aquatic Environment. Critical Review [M]. Geneva: Springer International Publishing, 2015: 325-340
[5]European Commission (EU). Guidance on monitoring of marine litter in European seas. A guidance document within the common implementation strategy for the Marine Strategy Framework Directive [R]. Ispra: European Commission, Joint Research Centre, MSFD Technical Subgroup on Marine Litter, 2013
[6]Law K L, Thompson R C. Microplastics in the seas [J]. Science, 2014, 345(6193): 144-145
[7]Andrady A L. Microplastics in the marine environment [J]. Marine Pollution Bulletin, 2011, 62(8): 1596-1605
[8]Barnes D K, Galgani F, Thompson R C, et al. Accumulation and fragmentation of plastic debris in global environments [J]. Philosophical Transactions of the Royal Society B, 2009, 364: 1985-1998
[9]Law K L, Morét-Ferguson S, Maximenko N A, et al. Plastic accumulation in the North Atlantic subtropical gyre [J]. Science, 2010, 329(5996): 1185-1188
[10]Zbyszewski M, Corcoran P L. Distribution and degradation of fresh water plastic particles along the beaches of Lake Huron, Canada [J]. Water, Air, and Soil Pollution, 2011, 220: 365-372
[11]周倩, 章海波, 李远, 等. 海岸环境中微塑料污染及其生态效应研究进展[J]. 科学通报, 2015, 60: 3210-3220
Zhou Q, Zhang H B, Li Y, et al. Progress on microplastics pollution and its ecological effects in the coastal environment [J]. Chinese Science Bulletin, 2015, 60: 3210-3220 (in Chinese)
[12]Shah A A, Hasan F, Hameed A, et al. Biological degradation of plastics: A comprehensive review [J]. Biotechnology Advances, 2008, 26(3): 246-265
[13]Thompson R C, Moore C J, vom Saal F S, et al. Plastics, the environment and human health: Current consensus and future trends[J]. Philosophical Transactions of the Royal Society B, 2009, 364: 2153-2166
[14]Zarfl C, Matthies M. Are marine plastic particles transport vectors for organic pollutants to the Arctic? [J]. Marine Pollution Bulletin, 2010, 60(10): 1810-1814
[15]Woodall L C, Sanchez-Vidal A, Canals M, et al. The deep sea is a major sink for microplastic debris [J]. Royal Society Open Science, 2014, 1: 140317
[16]Cauwenberghe L, Vanreusel A, Mees J, et al. Microplastic pollution in deep-sea sediments [J]. Environmental Pollution, 2013, 182: 495-499
[17]Turra A, Manzano A B, Dias R J S, et al. Three-dimensional distribution of plastic pellets in sandy beaches: Shifting paradigms [J]. Scientific Reports, 2014, 4: 4435
[18]Baztan J, Carrasco A, Chouinard O, et al. Protected areas in the Atlantic facing the hazards of micro-plastic pollution: First diagnosis of three islands in the Canary Current [J]. Marine Pollution Bulletin, 2014, 80(1-2): 302-311
[19]Yu X B, Peng J P, Wang J D, et al. Occurrence of microplastics in the beach sand of the Chinese inner sea: The Bohai Sea [J]. Environmental Pollution, 2016, 214: 722-730
[20]周倩, 章海波, 周阳, 等. 滨海潮滩土壤中微塑料的分离及其表面微观特征[J]. 科学通报, 2016, 61(14): 1604-1611
Zhou Q, Zhang H B, Zhou Y, et al. Separation of microplastics from a coastal soil and their surface microscopic features [J]. Chinese Science Bulletin, 2016, 61(14): 1604-1611 (in Chinese)
[21]Duis K, Coors A. Microplastics in the aquatic and terrestrial environment: Sources (with a specific focus on personal care products), fate and effects [J]. Environmental Sciences Europe, 2016, 28(1): 2
[22]Desforges J P, Galbraith M, Dangerfield N, et al. Widespread distribution of microplastics in subsurface seawater in the NE Pacific Ocean [J]. Marine Pollution Bulletin, 2014, 79(1-2): 94-99
[23]Law K L, Morét-Ferguson S E, Goodwin D S, et al. Distribution of surface plastic debris in the eastern Pacific Ocean from an 11-year data set [J]. Environmental Science & Technology, 2014, 48(9): 4732-4738
[24]Hidalgo-Ruz V, Gutow L, Thompson R C, et al. Microplastics in the marine environment: A review of the methods used for identification and quantification [J]. Environmental Science & Technology, 2012, 46(6): 3060-3075
[25]Zhao S, Zhu L, Wang T, et al. Suspended microplastics in the surface water of the Yangtze estuary system, China: First observations on occurrence, distribution [J]. Marine Pollution Bulletin, 2014, 86(1-2): 562-568
[26]Arthur C, Baker J, Bamford H. Proceedings of the international research workshop on the occurrence, effects, and fate of microplastic marine debris [C]. USA: National Oceanic and Atmospheric Administration Technical Memorandum, 2008
[27]彭谷雨, 李道季, 江沛霖,等. 长江口沉积物中微塑料分布研究 [C]. 无锡:第三届生态毒理学学术研讨会, 2016
[28]Lechner A, Keckeis H, Lumesberger-Loisl F, et al. The Danube so colourful: A potpourri of plastic litter outnumbers fish larvae in Europe’s second largest river [J]. Environmental Pollution, 2014, 188: 177-181
[29]Faure F, Corbaz M, Baecher H, et al. Pollution due to plastics and microplastics in Lake Geneva and in the Mediterranean Sea [J]. Archives des Sciences, 2012, 65: 157-164
[30]Eriksen M, Mason S, Wilson S, et al. Microplastic pollution in the surface waters of the Laurentian Great Lakes [J]. Marine Pollution Bulletin, 2013, 77(1-2): 177-182
[31]Free C M, Jensen O P, Mason S A, et al. High-levels of microplastic pollution in a large, remote, mountain lake [J]. Marine Pollution Bulletin, 2014, 85(1): 156-163
[32]苏磊, 薛银刚, 李陵云, 等. 太湖环境介质中的微塑料污染 [C]. 无锡:第三届生态毒理学学术研讨会, 2016
[33]Klein S, Worch E, Knepper T P. Occurrence and spatial distribution of microplastics in river shore sediments of the Rhine-Main area in Germany [J]. Environmental Science & Technology, 2015, 49(10): 6070-6076
[34]Imhof H K, Ivleva N P, Schmid J, et al. Contamination of beach sediments of a subalpine lake with microplastic particles [J]. Current Biology, 2013, 23(19): R867-R868
[35]Kooi M, Reisser J, Slat B, et al. The effect of particle properties on the depth profile of buoyant plastics in the ocean [J]. Scientific Reports, 2016, 6: 33882
[36]Browne M A, Galloway T, Thompson R. Microplastic—An emerging contaminant of potential concern? [J]. Integrated Environmental Assessment and Management, 2007, 3(4): 559-561
[37]Kaposi K L, Mos B, Kelaher B P, et al. Ingestion of microplastic has limited impact on a marine larva [J]. Environmental Science and Technology, 2014, 48(3): 1638-1645
[38]Cole M, Lindeque P, Fileman E, et al. Microplastic ingestion by zooplankton [J]. Environmental Science and Technology, 2013, 47(12): 6646-6655
[39]Watts A J, Lewis C, Goodhead R M, et al. Uptake and retention of microplastics by the shore crab Carcinus maenas [J]. Environmental Science and Technology, 2014, 48(15): 8823-8830
[40]Moos N, Burkhardt-Holm P, Köhler A. Uptake and effects of microplastics on cells and tissue of the blue mussel Mytilus edulis L. after an experimental exposure [J]. Environmental Science and Technology, 2012, 46(20): 11327-11335
[41]Desforges J P, Galbraith M, Ross P S. Ingestion of microplastics by zooplankton in the Northeast Pacific Ocean [J]. Archives of Environmental Contamination and Toxicology, 2015, 69(3): 320-330
[42]Goldstein M C, Goodwin D S. Gooseneck barnacles (Lepas spp.) ingest microplastic debris in the North Pacific Subtropical Gyre [J]. PeerJ PrePrint, 2013, 1: e184
[43]Cauwenberghe L, Claessens M, Vandegehuchte M B, et al. Microplastics are taken up by mussels (Mytilus edulis) and lugworms (Arenicola marina) living in natural habitats [J]. Environmental Pollution, 2015, 199: 10-17
[44]Boerger C M, Lattin G L, Moore S L, et al. Plastic ingestion by planktivorous fishes in the North Pacific Central Gyre [J]. Marine Pollution Bulletin, 2010, 60(12): 2275-2278
[45]Cauwenberghe L, Janssen C R. Microplastics in bivalves cultured for human consumption [J]. Environmental Pollution, 2014, 193: 65-70
[46]Avio C G, Gorbi S, Regoli F. Experimental development of a new protocol for extraction and characterization of microplastics in fish tissues: First observations in commercial species from Adriatic Sea [J]. Marine Environmental Research, 2015, 111: 18-26
[47]Browne M A, Dissanayake A, Galloway T S, et al. Ingested microscopic plastic translocates to the circulatory system of the mussel, Mytilus edulis (L) [J]. Environmental Science and Technology, 2008, 42(13): 5026-5031
[48]Farrell P, Nelson K. Trophic level transfer of microplastic: Mytilus edulis (L.) to Carcinus maenas (L.) [J]. Environmental Pollution, 2013, 177: 1-3
[49]Chen Q Q, Gundlach M, Yang S Y, et al. Quantitative investigation of the mechanisms of microplastics and nanoplastics toward zebrafish larvae locomotor activity [J]. Science of the Total Environment, 2017, 584-585: 1022-1031
[50]Kashiwada S. Distribution of nanoparticles in the see-through medaka (Oryzias latipes) [J]. Environmental Health Perspectives, 2006, 114(11): 1697-1702
[51]Hutchinson T H. Small is useful in endocrine disrupter assessment—Four key recommendations for aquatic invertebrate research [J]. Ecotoxicology, 2007, 16(1): 231-238
[52]Lee K W, Shim W J, Kwon O Y, et al. Size-dependent effects of micro polystyrene particles in the marine copepod Tigriopus japonicus [J]. Environmental Science and Technology, 2013, 47(19): 11278-11283
[53]Setälä O, Fleming-Lehtinen V, Lehtiniemi M. Ingestion and transfer of microplastics in the planktonic food web [J]. Environmental Pollution, 2014, 185: 77-83
[54]Tosetto L, Williamson J E, Brown C. Trophic transfer of microplastics does not affect fish personality [J]. Animal Behaviour, 2017, 123: 159-167
[55]Gutow L, Eckerlebe A, Gimenez L, et al. Experimental evaluation of seaweeds as a vector for microplastics into marine food webs [J]. Environmental Science and Technology, 2016, 50(2): 915-923
[56]Cole M, Lindeque P, Fileman E, et al. The impact of polystyrene microplastics on feeding, function and fecundity in the marine copepod Calanus helgolandicus [J]. Environmental Science & Technology, 2015, 49(2): 1130-1137
[57]Cedervall T, Hansson L A, Lard M, et al. Food chain transport of nanoparticles affects behaviour and fat metabolism in fish [J]. PloS One, 2012, 7(2): e32254
[58]Liboiron M, Liboiron F, Wells E, et al. Low plastic ingestion rate in Atlantic cod (Gadus morhua) from Newfoundland destined for human consumption collected through citizen science methods [J]. Marine Pollution Bulletin, 2016, 113(1-2): 428-437
[59]Miranda D D, de Carvalho-Souza G F. Are we eating plastic-ingesting fish? [J]. Marine Pollution Bulletin, 2016, 103(1-2): 109-114
[60]Yang D Q, Shi H H, Li L, et al. Microplastic pollution in table salts from China [J]. Environmental Science & Technology, 2015, 49(22): 13622-13627
[61]Hämer J, Gutow L, Köhler A, et al. Fate of microplastics in the marine isopod Idotea emarginata [J]. Environmental Science and Technology, 2014, 48(22): 13451-13458
[62]Cole M, Lindeque P K, Fileman E, et al. Microplastics alter the properties and sinking rates of zooplankton faecal pellets [J]. Environmental Science and Technology, 2016, 50(6): 3239-3246
[63]Wright S L, Rowe D, Thompson R C, et al. Microplastic ingestion decreases energy reserves in marine worms [J]. Current Biology, 2013, 23(23): 1031-1033
[64]Besseling E, Wegner A, Foekema E M, et al. Effects of microplastic on fitness and PCB bioaccumulation by the lugworm Arenicola marina (L.) [J]. Environmental Science and Technology, 2013, 47(1): 593-600
[65]Browne M A, Niven S J, Galloway T S, et al. Microplastic moves pollutants and additives to worms, reducing functions linked to health and biodiversity [J]. Current Biology, 2013, 23(23): 2388-2392
[66]Besseling E, Wang B, Lurling M, et al. Nanoplastic affects growth of S. obliquus and reproduction of D. magna [J]. Environmental Science and Technology, 2014, 48(20): 12336-12343
[67]Ma Y N, Huang A, Cao S Q, et al. Effects of nanoplastics and microplastics on toxicity, bioaccumulation, and environmental fate of phenanthrene in fresh water [J]. Environmental Pollution, 2016, 219: 166-173
[68]Oliveira M, Ribeiro A, Hylland K, et al. Single and combined effects of microplastics and pyrene on juveniles (0+ group) of the common goby Pomatoschistus microps (Teleostei, Gobiidae) [J]. Ecological Indicators, 2013, 34: 641-647
[69]Rochman C M, Kurobe T, Flores I, et al. Early warning signs of endocrine disruption in adult fish from the ingestion of polyethylene with and without sorbed chemical pollutants from the marine environment [J]. Science of the Total Environment, 2014, 493: 656-661
[70]Rochman C M, Hoh E, Kurobe T, et al. Ingested plastic transfers hazardous chemicals to fish and induces hepatic stress [J]. Scientific Reports, 2013, 3: 3263
[71]Velzeboer I, Kwadijk C J, Koelmans A A. Strong sorption of PCBs to nanoplastics, microplastics, carbon nanotubes, and fullerenes [J]. Environmental Science and Technology, 2014, 48(9): 4869-4876
[72]Mato Y, Isobe T, Takada H, et al. Plastic resin pellets as a transport medium for toxic chemicals in the marine environment [J]. Environmental Science and Technology, 2001, 35(2): 318-324
[73]Koelmans A A. Modeling the Role of Microplastics in Bioaccumulation of Organic Chemicals to Marine Aquatic Organisms. A Critical Review [M]. Geneva: Springer International Publishing, 2015: 309-324
[74]Gouin T, Roche N, Lohmann R, et al. A thermodynamic approach for assessing the environmental exposure of chemicals absorbed to microplastic [J]. Environmental Science and Technology, 2011, 45(4): 1466-1472
[75]Koelmans A A, Besseling E, Wegner A, et al. Plastic as a carrier of POPs to aquatic organisms: A model analysis [J]. Environmental Science and Technology, 2013, 47(14): 7812-7820
[76]Koelmans A A, Bakir A, Burton G A, et al. Microplastic as a vector for chemicals in the aquatic environment: Critical review and model-supported reinterpretation of empirical studies [J]. Environmental Science and Technology, 2016, 50(7): 3315-3326
[77]Beckingham B, Ghosh U. Differential bioavailability of polychlorinated biphenyls associated with environmental particles: Microplastic in comparison to wood, coal and biochar [J]. Environmental Pollution, 2017, 220: 150-158
[78]Herzke D, Anker-Nilssen T, Nost T H, et al. Negligible impact of ingested microplastics on tissue concentrations of persistent organic pollutants in northern fulmars off coastal Norway [J]. Environmental Science and Technology, 2016, 50(4): 1924-1933
[79]Hirai H, Takada H, Ogata Y, et al. Organic micropollutants in marine plastics debris from the open ocean and remote and urban beaches [J]. Marine Pollution Bulletin, 2011, 62(8): 1683-1692
[80]Fries E, Dekiff J H, Willmeyer J, et al. Identification of polymer types and additives in marine microplastic particles using pyrolysis-GC/MS and scanning electron microscopy [J]. Environmental Science: Processes and Impacts, 2013, 15: 1949-1956
[81]Iguchi T, Watanabe H, Katsu Y. Application of ecotoxicogenomics for studying endocrine disruption in vertebrates and invertebrates [J]. Environmental Health Perspectives, 2006, 114: 101-105
[82]Zettler E R, Mincer T J, Amaral-Zettler L A. Life in the ‘plastisphere’: Microbial communities on plastic marine debris [J]. Enviromental Science & Technology, 2013, 47(13): 7137-7146
[83]Lobelle D, Cunliffe M. Early microbial biofilm formation on marine plastic debris [J]. Marine Pollution Bulletin, 2011, 62(1): 197-200
[84]Reisser J, Proietti M, Shaw J, et al. Ingestion of plastics at sea: Does debris size really matter? [J]. Frontiers in Marine Science, 2014, 1: 70
[85]Carson H S, Nerheim M S, Carroll K A, et al. The plastic-associated microorganisms of the North Pacific Gyre [J]. Marine Pollution Bulletin, 2013, 75(1-2): 126-132
[86]Majer A P, Vedolin M C, Turra A. Plastic pellets as oviposition site and means of dispersal for the ocean-skater insect Halobates [J]. Marine Pollution Bulletin, 2012, 64(6): 1143-1147
[87]Goldstein M C, Rosenberg M, Cheng L. Increased oceanic microplastic debris enhances oviposition in an endemic pelagic insect [J]. Biology Letters, 2012, 8(5): 817-820
[88]United States Environmental Protection Agency (US EPA). Municipal solid waste in the United States: 2005 Facts and figures [R]. Washington, D.C.: Office of Solid Waste, 2016
[89]Moriceau B, Garvey M, Ragueneau O, et al. Evidence for reduced biogenic silica dissolution rates in diatom aggregates [J]. Marine Ecology Progress Series, 2007, 333: 129-142
[90]Thornton D C O. Diatom aggregation in the sea: Mechanisms and ecological implications [J]. European Journal of Phycology, 2002, 37(2): 149-161
[91]Turner J T. Zooplankton fecal pellets, marine snow and sinking phytoplankton blooms [J]. Aquatic Microbial Ecology, 2002, 27(1): 57-102
[92]Wright S L, Thompson R C, Galloway T S. The physical impacts of microplastics on marine organisms: A review [J]. Environmental Pollution, 2013, 178: 483-492
[93]Long M, Moriceau B, Gallinari M, et al. Interactions between microplastics and phytoplankton aggregates: Impact on their respective fates [J]. Marine Chemistry, 2015, 175: 39-46
[94]Shim W J, Song Y K, Hong S H, et al. Producing fragmented micro- and nano-sized expanded polystyrene particles with an accelerated mechanical abrasion experiment [C]. Spain: SETAC Europe 24thAnnual Meeting, 2014
[95]Mattsson K, Hansson L A, Cedervall T. Nano-plastics in the aquatic environment [J]. Environmental Science: Processes and Impacts, 2015, 17(10): 1712-1721
[96]中国海洋信息网. 中国国家海洋局. 中国海洋环境质量公报[EB/OL]. (2016-01-20) [2017-01-15]. https://www.coi.gov.cn/gongbao/nrhuanjing/nr2014/201503/t20150316_32225.html
[97]United States Environmental Protection Agency (US EPA). Toxicological threats of plastic [EB/OL]. (2016-09-30) [2017-01-15]. https://www.epa.gov/trash-free-waters/toxicological-threats-plastic

