碲化镉量子点(CdTe QDs)对肝细胞的毒性效应及线粒体介导的毒性机制研究
陆杰,姚影,汪岩,臧一腾,瞿靖,何克宇,吴添舒,梁雪,魏婷婷,熊丽林,张婷,#,唐萌,*
1. 环境医学工程教育部重点实验室,东南大学公共卫生学院;苏州纳米科技协同创新中心,南京210009 2. 江苏省生物材料与器件重点实验室,东南大学,南京210009
量子点(quantum dots, QDs)是由Ⅲ~Ⅴ族或Ⅱ~Ⅵ族元素组成的一种核-壳结构的纳米材料,直径为2~10 nm,有独特的荧光特性[1-2]。QDs种类繁多,包括碲化镉量子点(CdTe QDs)、硒化镉量子点(CdSe QDs)、石墨烯量子点(graphene quantum dots, GOD)和磷化铟量子点(InP QDs)等[3-5],其中最为常见的是CdTe/Se QDs。CdTe QDs因具有激发光波段范围宽、发射光谱宽度窄、较传统有机荧光染料荧光强度大、稳定性好等优点,在荧光探针、靶向治疗、医学诊断等方面有着广泛应用[6]。CdTe QDs具备医学应用潜力的同时,其生物安全性评价也越来越受到关注。
在生产、实验及医疗过程中,QDs可能通过皮肤、消化道和静脉等多种途径进入生物体。相关研究均表明,不同暴露方式下,QDs 进入大鼠或小鼠体内后,在动物的主要器官,如心脏、肝脏、脾脏、肺脏、肾脏和脑中都可以检测到一定剂量的QDs,尤其在肝脏、肾脏和脾脏中半衰期较长,可达2年之久[7-11]。Ye等[12]以恒河猴为模型,研究了QDs在灵长类动物体内分布,实验证明QDs 主要富集在肝、脾、肾脏中(总计占到染毒剂量的99%),含量分别是染毒剂量的35%、58%和6%。体外毒性研究结果均显示:CdTe QDs可以对多种来源的细胞系造成不同程度的损伤,如造成细胞增殖率下降、氧化应激、细胞凋亡等[13]。
肝脏作为生物体最重要的代谢器官,在生物体内起着去氧化、储存肝糖、分泌性蛋白质的合成等作用,当QDs等进入生物体后在肝脏中大量蓄积,因此研究QDs对肝脏的毒性作用对全面认识和评估其毒性显得尤为重要。目前已有关于CdTe QDs肝毒性研究报道,Zhang等[11]以小鼠正常肝细胞(AML12细胞)为研究对象,染毒MPA-CdTe QDs后,具有剂量和尺寸依赖性的细胞毒性,细胞凋亡为主要毒性表现。Nguyen等[14]以HepG2细胞为研究对象,CdTe QDs染毒后,通过死亡受体途径和线粒体途径诱发细胞凋亡。Lu等[15]将CdSe/ZnS QDs作用于人正常肝细胞(L02)细胞后,除了引起细胞凋亡外,还通过激活NLRP3炎性小体,导致Caspase-1的激活和白介素1β(IL-1β)的分泌,最终引起细胞焦亡(pyroptosis)。关于CdTe QDs引起肝细胞损伤的机制研究目前仍处于探索阶段,还需要进一步研究。
本研究采用人肝癌细胞(HepG2细胞)和人正常肝细胞(L02细胞)2种不同类型的肝细胞作为体外模型评价CdTe QDs的肝毒性作用和潜在的机制,探讨CdTe QDs对不同肝细胞的毒作用和有关机制,为更全面地进行CdTe QDs的安全性评估提供一定科学依据。
1 材料与方法(Materials and methods)
1.1 实验细胞
L02细胞和HepG2细胞均购于中国科学院上海细胞所。
1.2 实验试剂和仪器
实验所用3-巯基丙酸包被的碲化镉量子点(MPA-CdTe QDs)根据詹庆玲等[16]提供的方法自行合成。合成量子点后,实验前按照CdTe QDs:丙酮为1:2(V:V)的比例混合,以15 000 r·min-1离心(离心半径为8.3 cm)20 min,离心2次后,用完全培养基配成一定浓度的储备液备用,经0.22 μm滤膜抽滤除菌,于4 ℃冰箱中存放,使用前超声分散。
磷酸盐缓冲液(武汉博士德生物工程有限公司,中国);胎牛血清(杭州四季青公司,中国);杜尔伯科改良伊格尔培养基(Dulbecco’s Modified Eagle Medium,DMEM)(Hyclone 公司,美国);质量分数为0.25% 的胰蛋白酶溶液(Biosharp 公司,中国);二甲基亚砜(中国国药集团化学试剂有限公司,中国);CCK-8试剂、乳酸脱氢酶(LDH)检测试剂盒、活性氧(ROS)检测试剂盒、ATP检测试剂盒、线粒体膜电位检测试剂盒,均购于上海碧云天生物技术有限公司;细胞凋亡试剂盒(江苏省凯基生物技术股份有限公司,中国);3-巯基丙酸(MPA,美国Sigma 公司),CdCl2·2.5H2O、氢氧化钠、高纯氮气(>99.99%)均购于国药集团化学试剂有限公司。
Series8000系列-3423 型CO2培养箱(美国Thermo Scientific 公司),CK40-F200 倒置显微镜(日本Olympus公司),MRX全自动酶标仪(美国Dynex Technologies公司),TDZ6B-WS 离心机(上海卢湘仪离心机仪器有限公司),BS210S 电子天平(北京赛多利斯天平有限公司),KQ2200E 超声清洗器(昆山市超声仪器有限公司),SW-CJ-2F 净化工作台(中国苏州安泰空气技术有限公司);流式细胞术测定仪(BD 公司,型号:FACS CantoTM);Zetasizer Nano-ZS90 型Malvern 粒度分析仪(马尔文仪器有限公司,英国)。
1.3 材料表征
利用马尔文激光粒度仪测定CdTe QDs在完全培养基中的水合粒径;利用荧光分光光度计测定CdTe QDs的最大吸收波长和最大发射波长。
1.4 细胞培养
L02细胞和HepG2细胞采用DMEM培养基(含体积分数为10%的胎牛血清,体积分数为1%的双抗)于37 ℃、5%CO2的细胞培养箱中进行培养。每日用倒置显微镜观察细胞生长状况,取对数生长期的细胞进行试验。
1.5 细胞CCK-8试验
取对数生长期的细胞种于96孔板中,每孔5×103个细胞,培养24 h后弃去培养液。根据预实验结果,加入浓度为0,25,50和100 μmol·L-1的染毒液,每个染毒组设置5个复孔。染毒24 h后,弃去染毒液,加入含体积分数10%的CCK-8完全培养基,继续培养1.5 h,在酶标仪上490 nm处测定吸光度。
1.6 细胞形态学观察
取对数生长期细胞种于6孔板中,每孔种2×105个细胞,培养24 h,弃去培养液,加入浓度为0,25,50和100 μmol·L-1的染毒液,染毒24 h。染毒结束后在生物图像导航仪上进行细胞形态学观察。
1.7 LDH释放检测
取对数生长期细胞种于96孔板中,每孔5×103个细胞,培养24 h后弃去培养基,加入浓度为0,25,50和100 μmol·L-1的染毒液,染毒24 h。染毒结束后收集染毒液,根据试剂盒上试验步骤进行LDH的释放检测。
1.8 细胞对CdTe QDs的摄入情况测定
取对数生长期细胞种于6孔板中,每孔2×105个细胞,培养24 h,弃去培养基,加入浓度为0,25,50和100 μmol·L-1的染毒液,染毒1 h、2 h、4 h、8 h和24 h。染毒结束后,胰酶消化收集细胞,并计数。将收集的细胞置于15 mL离心管中,加入1 mL浓硝酸硝化过夜,以充分裂解细胞。硝化结束后每管加入2 mL过氧化氢,并转移至烧杯中,放在电热板上进行加热赶酸,待烧杯中残留的液体刚好覆盖烧杯底部时停止加热,加入2%的稀硝酸2 mL,并将液体转移至10 mL离心管中,并用2%稀硝酸定容至5 mL,抽滤。最后在石墨炉上进行镉元素含量的测定,间接反映细胞对CdTe QDs的摄入情况。
1.9 ROS含量测定
取对数生长期细胞种于6孔板中,每孔2×105个细胞,培养24 h,弃去培养液,加入浓度为0,25,50和100 μmol·L-1的染毒液,染毒24 h。染毒结束后按照1:2 000用无血清培养液稀释DCFH-DA,使终浓度为5 μmol·L-1。去除细胞培养液,每孔加入1 mL稀释好的DCFH-DA,37 ℃细胞培养箱内孵育20 min。用无PBS洗涤细胞2次,以充分去除未进入细胞内的DCFH-DA。使用488 nm激发波长,525 nm发射波长,在流式细胞仪上检测染毒前后荧光强度的变化。
1.10 细胞凋亡测定
取对数生长期细胞种于6孔板中,每孔2×105个细胞,培养24 h,弃去培养液,加入染毒液,染毒浓度为0,25,50和100 μmol·L-1,染毒24 h。染毒结束后,弃去染毒液,用PBS洗2遍,加入无EDTA的胰酶消化细胞,收集细胞,用PBS洗涤细胞2次(2 000 r·min-1,5 min)。加入500 μL Binding Buffer,充分混匀细胞,再加入5 μL Annexin V-FITC,混匀后再加入5 μL混匀后Propidium Iodide,混匀,在流式细胞仪上检测染毒前后荧光强度的变化。
1.11 ATP含量检测
取对数生长期细胞种于6孔板中,每孔2×105个细胞,培养24 h,弃去培养液,加入浓度为0,25,50和100 μmol·L-1的染毒液,染毒24 h。设置0、0.05、0.1、0.5、1、5和10 μmol·L-1等浓度制作标准曲线。吸除染毒液,按照6孔板每孔加入200 μL裂解液的比例(即相当于细胞培养液量2 mL的1/10)加入裂解液,裂解细胞。再根据试剂盒说明书配制ATP检测工作液,加100 μL ATP检测工作液到检测孔或检测管内。室温放置3~5 min,以使本底性的ATP全部被消耗掉,从而降低本底值。在检测孔或检测管内加上20 μL样品或标准品,用化学发光检测仪进行检测,最后根据标准曲线计算得出ATP含量。
1.12 细胞线粒体膜电位检测
JC-1是一种广泛用于检测线粒体膜电位(mitochondrial membrane potential)△Ψm的理想荧光探针。可以检测细胞、组织或纯化的线粒体膜电位。取对数生长期细胞种于6孔板中,每孔2×105个细胞,培养24 h,弃去培养液,加入浓度为0,25,50和100 μmol·L-1的染毒液,染毒24 h。染毒结束后,收集细胞,用0.5 mL新鲜培养基重悬细胞,再加入0.5 mL JC-1染色工作液,充分混匀,细胞培养箱中37 ℃孵育20 min。37 ℃孵育结束后,600 g、4 ℃离心3~4 min,沉淀细胞,弃上清。用JC-1染色缓冲液(1×)洗涤2次(600 g、4 ℃离心3~4 min,沉淀细胞,弃上清。)再用适量JC-1染色缓冲液(1×)重悬后,在流式细胞仪上检测染毒前后荧光强度的变化。
1.13 统计学处理
采用SPPS 20.0软件对数据进行统计分析,计量资料以x±s表示,采用t检验,以P<0.05为统计学差异具有显著意义。
2 结果(Results)
2.1 材料表征结果
如图1所示,荧光分光光度计测得MPA-CdTe QDs的最大激发波长为300 nm,最大发射波长为555 nm。采用马尔文激光粒度仪测得CdTe QDs在DMEM完全培养基中的水合粒径和zeta电位的结果,水合粒径和zeta电位分别为(31.93±3.92) nm和-(6.62±0.49) mV。
2.2 细胞毒性试验结果
细胞毒性试验结果包括细胞活性测定、LDH释放检测和细胞形态学观察。细胞活性试验结果如图2 所示,与对照组相比,染毒组细胞的生存率随着染毒浓度的升高显著降低(P<0.05),且具有效应-剂量依赖性关系。QDs染毒24 h后,L02细胞活力低于HepG2细胞,说明CdTe QDs对L02细胞的毒性大于HepG2细胞。
CdTe QDs染毒细胞24 h后,观察2种细胞形态学的改变,如图3 (A和B)所示,对照组细胞形态正常,细胞之间紧密连接,细胞堆积生长;染毒组细胞的形态则发生明显改变,在最低浓度组(25 μmol·L-1),部分细胞开始出现皱缩,细胞变圆,细胞之间连接减少,随着染毒剂量的增大,细胞数量明显减少,细胞连接被破坏,异常形态细胞增多。
细胞膜结构的破坏会导致细胞浆内的酶释放到培养液中,其中包括酶活性较为稳定的乳酸脱氢酶(lactate dehydrogenase, LDH)。通过检测从质膜破裂的细胞中释放到培养液中的LDH活性,可以实现对细胞毒性的分析。CdTe QD染毒2种肝细胞24 h后,检测LDH的释放情况,结果表明,与对照组相比,染毒组染毒液中LDH含量显著升高(P<0.05),且具有剂量依赖性,同一染毒剂量下,L02细胞染毒液中LDH含量要高于HepG2细胞。
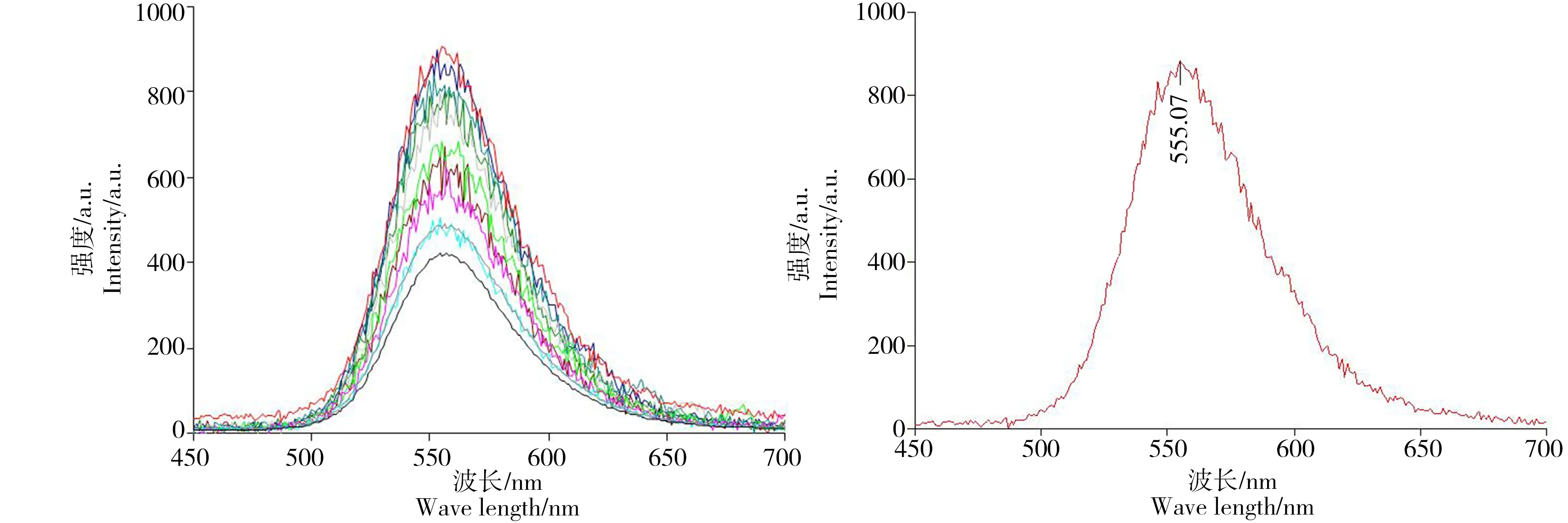
图1 碲化镉量子点的最大激发波长Fig. 1 The maximum emission wavelength of cadmium telluride quantum dots
2.3 细胞凋亡检测结果
凋亡是细胞死亡形式之一,当细胞受到有害因素作用,是在一系列基因的调控下细胞程序性死亡的过程。此过程涉及多个基因的激活、表达以及调控作用,细胞凋亡对维持机体的稳态和胚胎发育必不可少。如图5所示,CdTe QDs染毒2种细胞24 h后,凋亡细胞逐渐增多,并且具有剂量依赖性关系。
2.4 细胞对 CdTe QDs摄入情况检测
本研究利用石墨炉法检测染毒不同浓度和时间后2种细胞内镉元素的含量,间接反应2种细胞对CdTe QDs的摄入情况。结果如图6所示,随着染毒时间的延长,细胞内镉含量显著增多,这与细胞活力的结果相一致,说明QDs引起2种肝细胞活力的降低与细胞对CdTe QDs的摄取相关。同样染毒剂量和时间下,L02细胞内镉含量显著高于HepG2细胞内镉含量。
2.5 ROS含量检测结果
正常生理状态下,细胞生理代谢过程中会产生少量的ROS,适量的ROS对维持细胞正常的生理功能具有重要作用。但是当细胞受到外界刺激时,细胞内ROS会明显升高,过量的ROS会造成氧化应激,产生氧化损伤。CdTe QD染毒2种肝细胞24 h
后,细胞内ROS的检测结果如图7所示,染毒24 h后,细胞内ROS显著升高,且具有剂量依赖性关系。
2.6 线粒体功能检测
线粒体是细胞能量代谢的主要场所,对维持细胞内钙离子的稳定也具有重要作用。当线粒体受到损伤时,细胞的氧化呼吸过程被破坏,会诱发细胞凋亡的发生。如图8所示,CdTe QDs染毒细胞24 h后,2种细胞线粒体膜电位都出现不同程度的下降,并随着染毒剂量的增大,线粒体膜电位下降的细胞比率增多,2种细胞之间比较发现,CdTe QDs对L02细胞线粒体膜电位影响更明显。同时对细胞ATP含量进行检测,如图8所示,随着染毒剂量的增大,细胞ATP含量显著降低,并且L02细胞ATP含量的降低比HepG2细胞更为显著,这一结果与线粒体膜电位的结果一致。
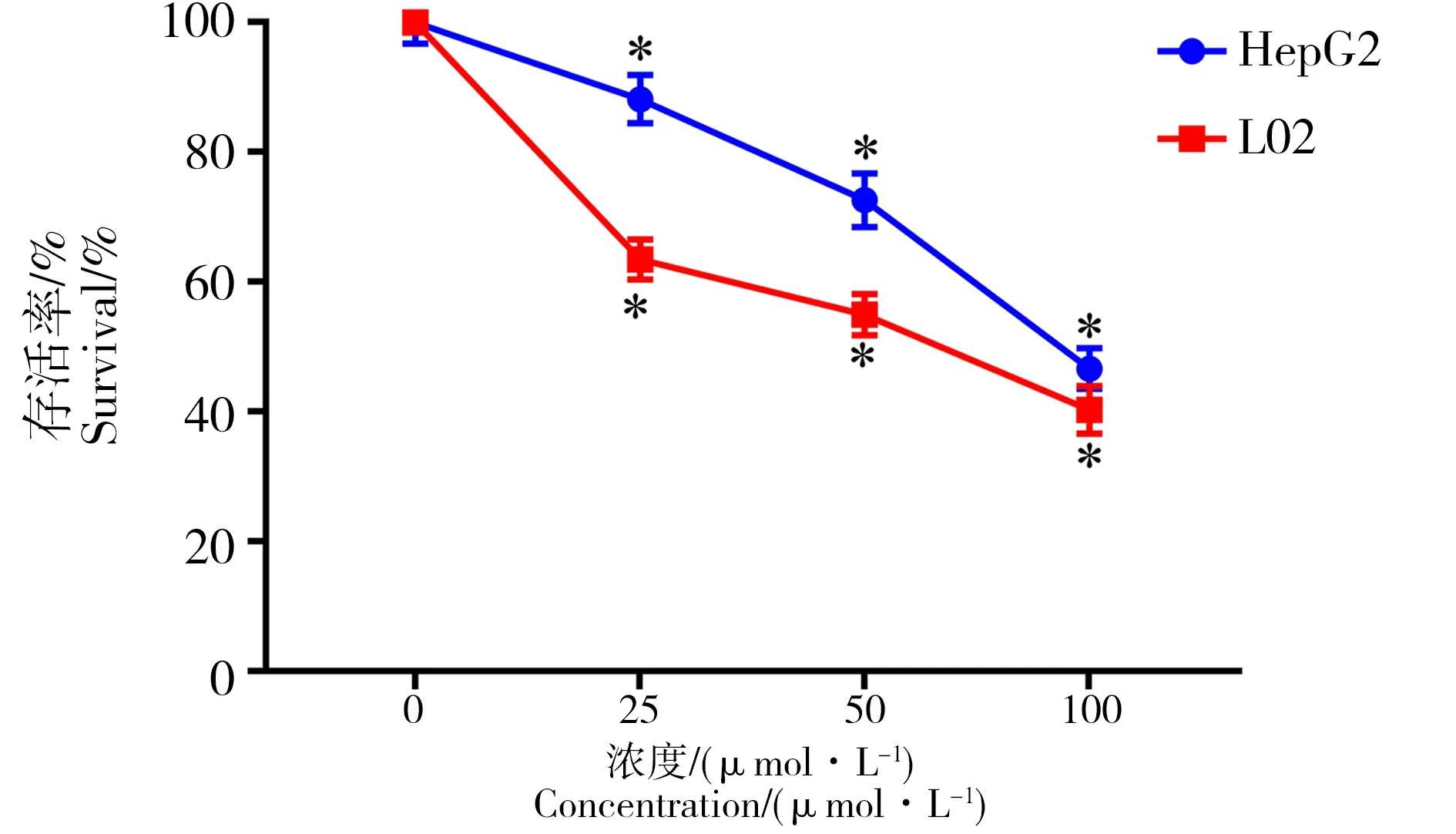
图2 CCK-8法检测CdTe QDs对HepG2和L02细胞生存率的影响注:*P<0.05表示与对照组相比差异具有统计学意义。Fig. 2 Effect of CdTe QDs on HepG2 and L02 cell survival by CCK-8Note: *P<0.05, compared with normal control group.
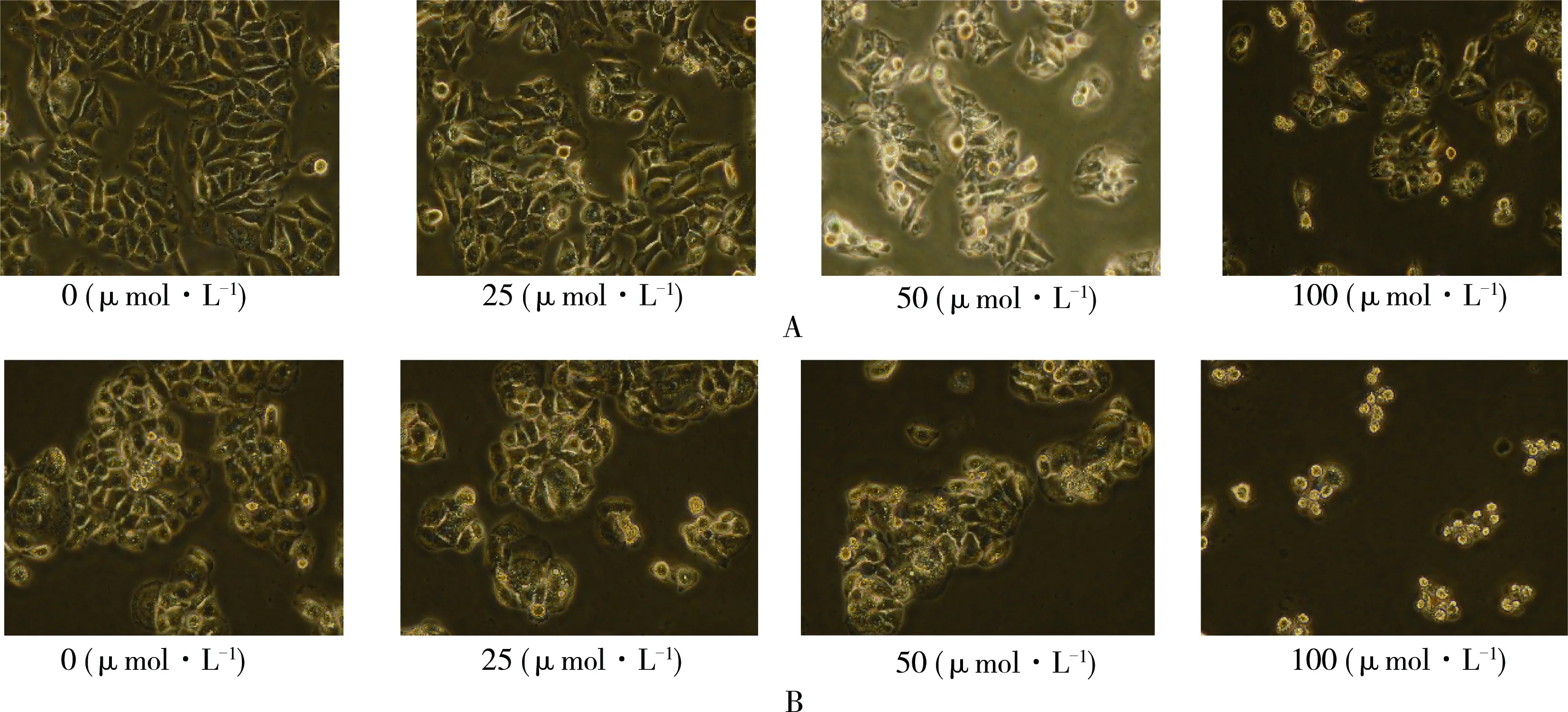
图3 CdTe QDs对HepG2(A)和L02(B)细胞的形态学影响注:*P<0.05,与对照组相比差异具有统计学意义。Fig. 3 Effect of CdTe QDs on HepG2 and L02 cell morphologyNote: A, HepG2 cell; B, L02 cell. P<0.05, compared with control group.
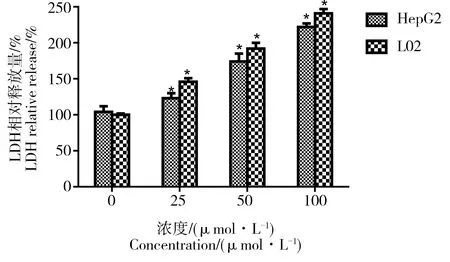
图4 CdTe QDs对HepG2和L02细胞的LDH释放检测试验注:*P<0.05,与对照组相比差异具有统计学意义。Fig. 4 Effect of CdTe QDs on HepG2 and L02 cell LDH releaseNote: *P<0.05, compared with normal control group.
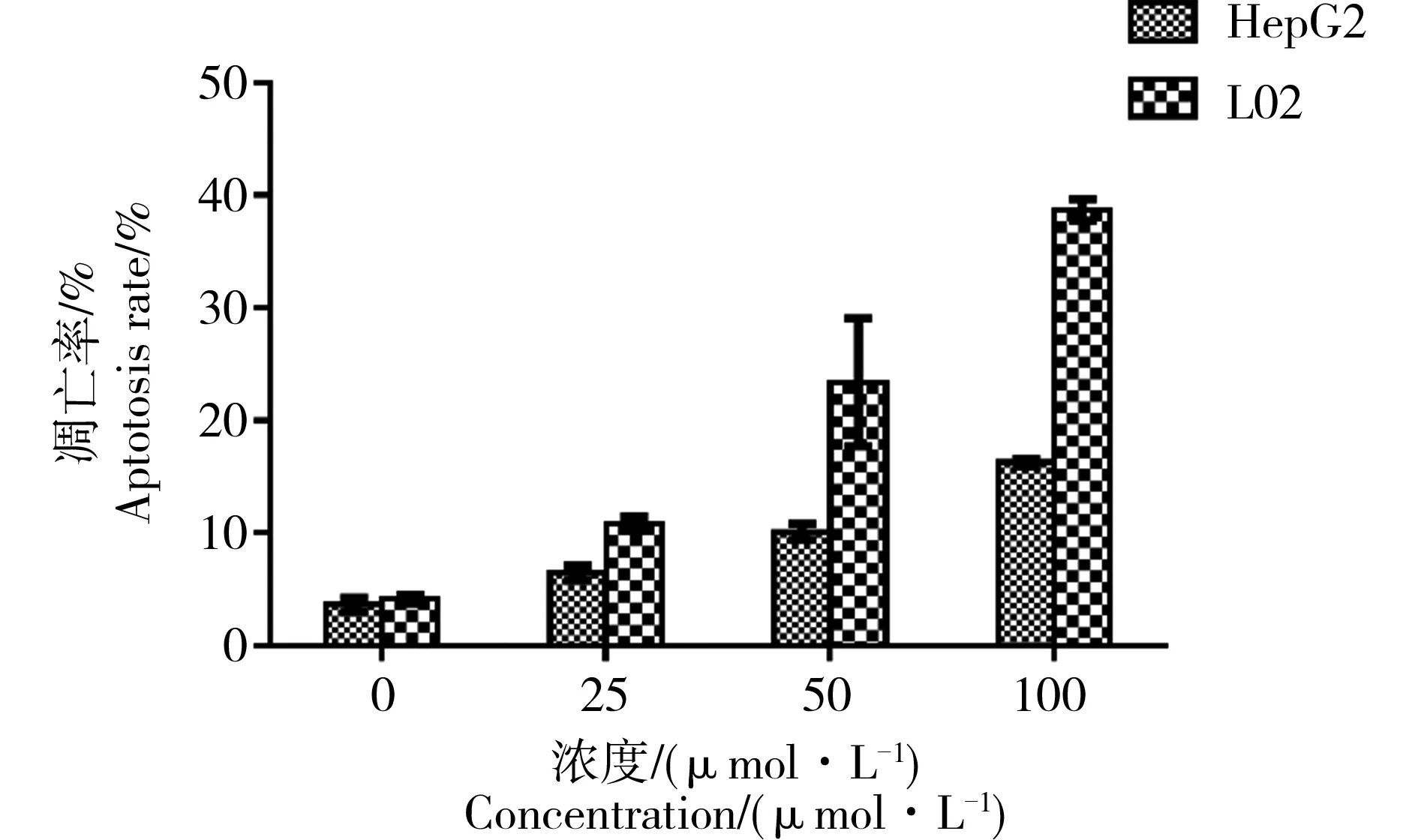
图5 FITC/PI法检测CdTe QDs对HepG2和L02细胞凋亡率的影响注:*P<0.05,与对照组相比差异具有统计学意义。Fig. 5 Effect of CdTe QDs on HepG2 and L02 cell apoptosis by FITC/PI assaysNote:*P<0.05, compared with normal control group.
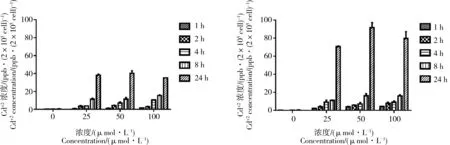
图6 2种肝细胞内镉离子浓度注: 2种肝细胞CdTe QDs染毒浓度为0~100 μmol·L-1,染毒1、2、4、8和24 h;*P<0.05, 与对照组相比差异具有统计学意义。A,HepG2 cell;B, L02 cell。Fig. 6 The concentration determination of cadmium in both liver cellsNote: Both liver cells were treated with 0-100 μmol·L-1 CdTe QDs for 1, 2, 4, 8 and 24 h. *P<0.05, compared with normal control group. A, HepG2 cell; B, L02 cell.
3 讨论(Discussion)
CdTe QDs本身具有良好的荧光特性,在生物医学领域具有巨大的应用前景,可用于疾病诊断等[17]。肝脏是机体最为重要的代谢器官,也是CdTe QDs体内蓄积的主要器官之一,但是对肝脏的毒性作用研究结果并不一致[18-20]。Lin等[18]的研究表明,CdTe/Se QDs进入生物体内会蓄积于肝脏中,虽未引起明显的组织病理学改变,但是引起肝脏中某些微量元素的改变,抗氧化酶活性的升高等。Wang等[19]研究了CdTe QDs染毒ICR小鼠后引起小鼠肝脏明显的组织学改变,金属硫蛋白表达升高,肝细胞凋亡等毒性作用。但是,Fan等[20]的研究表明CdTe /CdS QDs进入小鼠体内后只引起肝细胞自噬的发生而未引起细胞凋亡。体外肝细胞毒性研究表明,CdTe QDs能够造成HepG2细胞、AML12细胞等肝细胞生存率降低,细胞凋亡的发生等毒作用[11-14]。但是研究使用的CdTe QDs理化性质各异,研究结果也有矛盾之处,因此CdTe QDs的肝毒性机制研究仍需要进一步探讨。
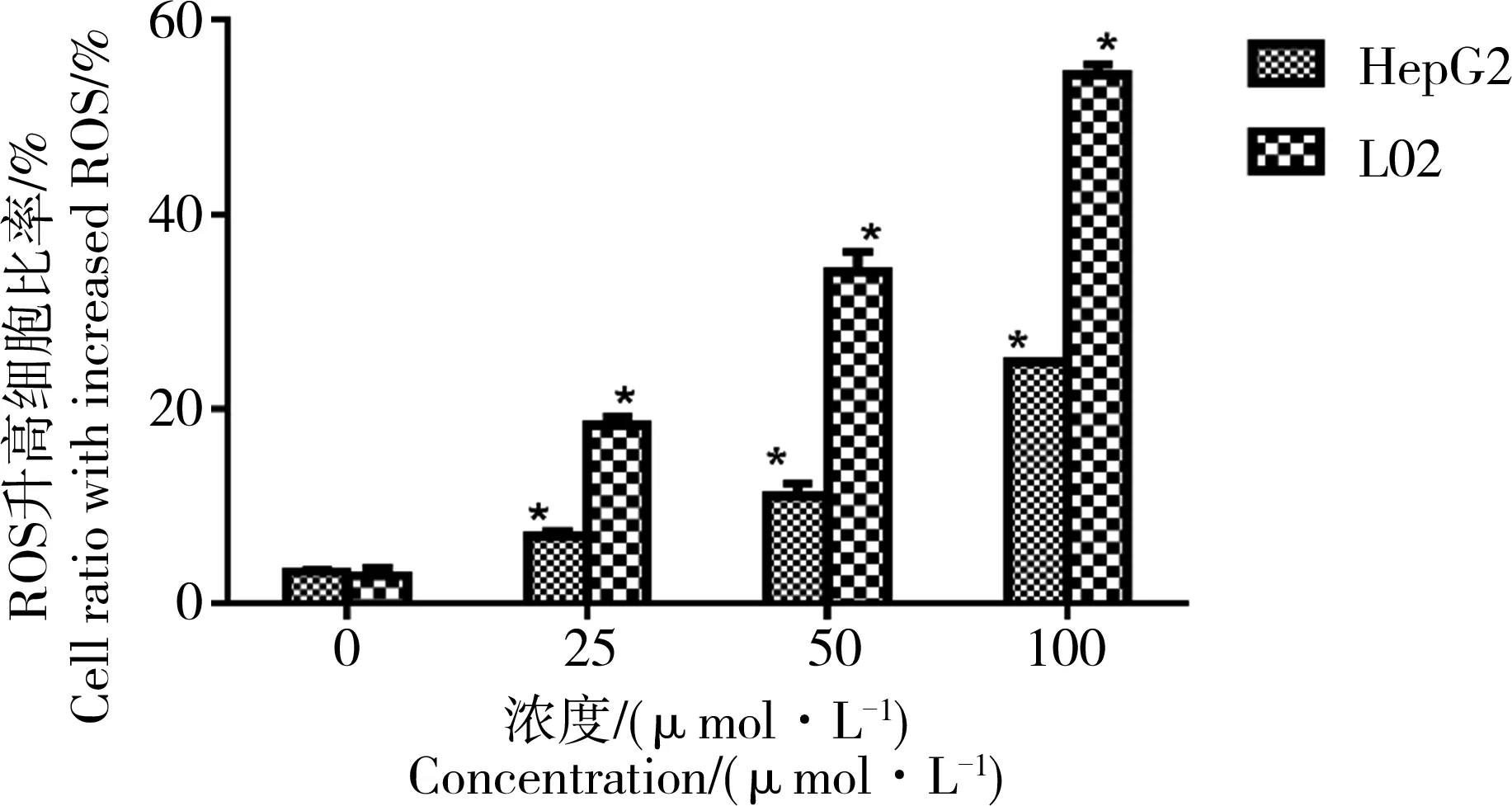
图7 CdTe QDs诱导HepG2和L02细胞内ROS的检测注:*P<0.05, 与对照组相比差异具有统计学意义。Fig. 7 CdTe QDs induced ROS in HepG2 and L02 cellNote: *P<0.05, compared with normal control group.
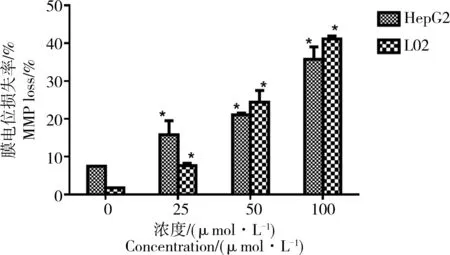
图8 JC-1法测定CdTe QDs对HepG2和L02细胞线粒体膜电位的影响注: *P<0.05,与对照组相比差异具有统计学意义。Fig. 8 Effect of CdTe QDs on HepG2 and L02 cell mitochondrial membrane potential (MMP) by JC-1 assaysNote: *P<0.05, compared with normal control group.
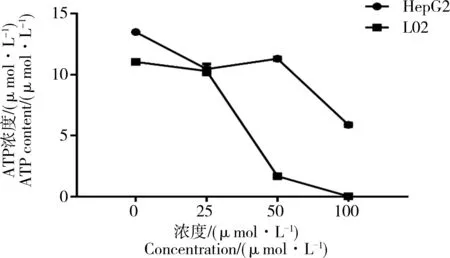
图9 2种肝细胞ATP含量检测注:*P<0.05,与对照组相比差异具有统计学意义。Fig. 9 The content determination of ATP in both liver cellsNote: *P<0.05, compared with normal control group.
本研究以HepG2和L02细胞为体外细胞模型,探讨CdTe QDs对不同类型肝细胞的毒性及其可能的毒作用机制,为CdTe QDs的安全性评价提供一定的依据。CdTe QDs染毒24 h后引起2种肝细胞生存率降低,同等剂量下,CdTe QDs对L02细胞的损伤比肝癌细胞更严重。细胞凋亡结果表明,细胞凋亡率显著升高,L02细胞的凋亡率显著高于HepG2细胞,尤其在中高剂量组,L02细胞凋亡率远高于HepG2细胞,这一结果与细胞生存率结果一致,进一步说明CdTe QDs对正常肝细胞的毒性要大于肝癌细胞,且CdTe QDs引起细胞死亡的形式以细胞凋亡为主。
已有的研究表明,CdTe QDs对细胞的毒性与CdTe QDs中镉离子的释放和其本身的尺寸效应相关[21-22]。镉离子作为重金属离子,其可对细胞直接产生毒性作用[21-23],同时被细胞摄取的CdTe QDs进入细胞内激活信号转导通路,破坏细胞正常生物学过程最终诱发细胞死亡[24]。本次研究利用石墨炉法检测细胞内镉元素含量,间接反映细胞内CdTe QDs的含量。结果显示,同等染毒时间和染毒剂量情况下,L02细胞内镉元素含量较HepG2细胞高,说明L02细胞对CdTe QDs摄取更多,这也是CdTe QDs导致L02损伤更为严重的原因之一。同时,造成2种肝细胞对CdTe QDs差异性摄入以及摄入QDs后在细胞内的分布与代谢也需要进一步研究,有助于阐明QDs的毒性机制。
除镉离子释放外,ROS的过量生成在纳米材料诱导细胞损伤中扮演重要角色,ROS与细胞内的大分子结合,如DNA、蛋白质和脂质,影响细胞生物学功能,最终引发细胞死亡。Paesano等[25]研究发现,CdS QD可造成HepG2细胞内ROS水平升高,诱导线粒体途径介导的细胞凋亡的产生。Nguyena等[14]的研究结果也表明CdTe-QDs可引起HepG2细胞内ROS水平升高,导致还原性谷胱甘肽的耗竭,还原性谷胱甘肽与氧化性谷胱甘肽比值降低,最终引发死亡受体和线粒体途径介导的HepG2细胞凋亡。李艳博等[26]研究发现,巯基乙酸(TGA)包被的CdTe QDs可导致人肝细胞(HL-7702)细胞ROS水平升高,诱发DNA损伤和细胞周期阻滞。在本研究中,CdTe QDs染毒24 h后细胞内ROS含量显著升高,诱发细胞氧化应激,且L02细胞内ROS含量比HepG2更多,这结果与细胞活性和凋亡率结果一致,结合细胞摄取的结果,提示我们被摄取进入细胞内的CdTe QDs引起细胞内氧化应激水平的明显升高,诱发细胞氧化损伤。进一步检测线粒体功能发现,CdTe QDs能够造成肝细胞线粒体膜电位的降低和ATP含量的减少,且具有剂量依赖性关系,说明CdTe QDs诱发过量的ROS生成后,CdTe QDs引发线粒体损伤,破坏线粒体正常的氧化呼吸过程,影响了细胞的生物学功能,从而诱发细胞凋亡。如Nguyen等[27]探讨了CdTe-QD对HepG2细胞线粒体损伤,发现CdTe QDs造成HepG2细胞线粒体膜电位降低,细胞内钙离子水平升高,损害了氧化呼吸过程,降低三磷酸腺苷的含量,过氧化物酶体增殖物激活受体-c共激活剂水平(peroxisome proliferator-activated receptor-γ coactivator)显著升高,表明CdTe QDs影响了线粒体的生物合成功能。
综上所述,CdTe QDs对2种不同类型的HepG2和L02细胞均可造成损伤,降低细胞生存率,诱发细胞凋亡。2种肝细胞之间的比较发现CdTe QDs对L02细胞的毒性作用大于HepG2细胞,其机制是由于L02细胞对CdTe QDs摄入水平高于HepG2细胞,引发更为严重的线粒体膜损伤,线粒体功能受损和更高的ROS水平,造成氧化应激,最终诱发细胞凋亡。但是有关2种细胞之间的毒性差异的机制仍需进一步探讨,需要进一步阐明在分子水平上的差异,为更好地评价CdTe QDs的肝毒性提供理论依据。
参考文献(References):
[1]Bruchez M J,Moronne M,Gin P,et al. Semiconductor nanocrystals as fluorescent biological labels [J]. Science, 1998, 281(5385): 2013-2016
[2]Leutwyler W K, Bürgi S L, Burgl H. Semiconductor clusters,nanocrystals,and quantum dots [J]. Science, 1996, 271(5251): 933-937
[3]Manshian B B, Soenen S J, Al-Ali A, et al. Cell type-dependent changes in CdSe/ZnS quantum dot uptake and toxic eEndpoints [J]. Toxicology Science, 2015, 144(2): 246-258
[4]Brunetti V, Chibli H, Fiammengo R, et al. InP/ZnS as a safer alternative to CdSe/ZnS core/shell quantum dots: In vitro and in vivo toxicity assessment [J]. Nanoscale, 2013, 5: 307-317
[5]Chong Y, Maa Y F, Shen H, et al. The in vitro and in vivo toxicity of graphene quantum dots [J]. Biomaterials, 2014, 35: 5041-5048
[6]Barroso M M. Quantum dots in cell biology [J]. Journal of Histochemistry and Cytochemistry, 2011, 59(3): 237-251
[7]Fitzpatrick J A J, Andreko S K, Ernst L A, et al. Long-term persistence and spectral blue shifting of quantum dots in vivo [J]. Nano Letters, 2009, 9(7): 2736-2741
[8]Hauck T S, Anderson R E, Fischer H C, et al. In vivo quantum-dot toxicity assessment [J]. Small, 2010, 6(1): 138-144
[9]Su Y, Peng F, Jiang Z, et al. In vivo distribution, pharmacokinetics, and toxicity of aqueous synthesized cadmium-containing quantum dots [J]. Biomaterials, 2011, 32(25): 5855-5862
[10]Liu W, Zhang S, Wang L, et al. CdSe quantum dot (QD)-induced morphological and functional impairments to liver in mice [J]. PLoS ONE, 2011, 6(9): e24406
[11]Zhang T, Hu Y, Tang M, et al. Liver toxicity of cadmium telluride quantum dots (CdTe QDs) due to oxidative stress in vitro and in vivo [J]. International Journal of Molecular Sciences, 2015, 16(10): 23279-23299
[12]Ye L, Yong K T, Liu L, et al. A pilot study in non-human primates shows no adverse response to intravenous injection of quantum dots [J]. Nature Nanotechnology, 2012, 7(7): 453-458
[13]陆杰, 张婷, 唐萌, 等. 碲化镉量子点细胞毒性研究进展[J]. 生态毒理学报, 2016, 11(5): 24-31
Lu J, Zhang T, Tang M, et al. Research advances in cytotoxicity of CdTe quantum dots [J]. Asian Journal of Ecotoxicology, 2016, 11(5): 24-31 (in Chinese)
[14]Nguyen K C, Willmore W G, Tayabali A F. Cadmium telluride quantum dots cause oxidative stress leading to extrinsic and intrinsic apoptosis in hepatocellular carcinoma HepG2 cells [J]. Toxicology, 2013, 306: 114-123
[15]Lu Y H, Xu S C, Chen H Y, et al. CdSe/ZnS quantum dots induce hepatocyte pyroptosis and liver inflammation via NLRP3 inflammasome activation [J]. Biomaterials, 2016, 90: 27-39
[16]Zhan Q L, Tang M, Zhang T, et al. Effects of CdTe@MPA quantum dots on RAW264.7 cells viability [J]. Journal of Environment Health, 2014, 31(2): 111-113
[17]Breunig M, Bauer S, Goepferich A, et al. Polymers and nanoparticles: Inteligent tools for intracellular targeting [J]. European Journal of Pharmaceutics and Biopharmaceutices, 2008, 68(1): 112-128
[18]Lin C H, Yang M H, Louis W, et al. Cd/Se/Te-based quantum dot 705 modulated redox homeostasis with hepatotoxicity in mice [J]. Nanotoxicology, 2011, 5(4): 650-663
[19]Wang M M, Wang J L, Sun H B, et al. Time-dependent toxicity of cadmium telluride quantum dots on liver and kidneys in mice: Histopathological changes with elevated free cadmium ions and hydroxyl radicals [J]. International Journal of Nanomedicine, 2016, 11: 2319-2328
[20]Fan J J, Sun Y, Wang S F, et al. Inhibition of autophagy overcomes the nanotoxicity elicited by cadmium-based quantum dots [J]. Biomaterials, 2016, 78: 102-114
[21]Su Y Y, Hub M, Fan C H, et al. The cytotoxicity of CdTe quantum dots and the relative contributions from released cadmium ions and nanoparticle properties [J]. Biomaterials, 2010, 31: 4829-4834
[22]Chen N, He Y, Su Y Y, et al. The cytotoxicity of cadmium-based quantum dots [J]. Biomaterials, 2012, 33: 1238-1244
[23]Lemarie A, Lagadic G D, Morzadec C, et al. Cadium induces caspase -independent apoptosis in liver Hep3B cells: Role for calcium in signaling oxidative stress-relatived impairment of mitochondria and relocation of endonuclease G and apoptosis-inducing factor [J]. Free Radical Biology Medicine, 2004, 36(12): 1517-1531
[24]Peng L, He M, Chen B B, et al. Cellular uptake, elimination and toxicity of CdSe/ZnS quantum dots in HepG2 cells [J]. Biomaterials, 2013, 34: 9545-9558
[25]Paesano L, Perotti A, Buschini A, et al. Markers for toxicity to HepG2 exposed to cadmium sulphide quantum dots; damage to mitochondria [J]. Toxicology, 2016, 374: 18-28
[26]Li Y B, Zhang H X,Guo C X, et al. Induction of thioglycolic acid-capped cadmium selenide quantum dots on hepatotoxicity and DNA damage in human hepatic cells [J]. Journal of Jilin University: Medicine Edition, 2012, 38(3): 495-500
[27]Nguyen K C, Rippstein P, Azam F, et al. Mitochondrial toxicity of cadmium telluride quantum dot nanoparticles in mammalian hepatocytes [J]. Toxicology Science, 2015, 146(1): 31-42

