不同干燥工艺对冬瓜皮中生物活性成分含量的影响
李杨,刘明杰,肖洪,2,3,李斌,刘士健*
(1.西南大学 食品科学学院,食品科学与工程国家级实验教学示范中心,重庆 400715;2.北京正博和源科技有限公司重庆分公司,重庆 400716;3.北京正博和源科技有限公司,北京 102400)
冬瓜皮是冬瓜的干燥外层果皮,为不规则的碎片,常向内卷曲或筒状,大小不一。外表面灰绿色,或有白霜,内表面较粗糙,可见筋脉状维管束。体轻而脆,易折断,味淡[1]。冬瓜最早起源于中国与东印度,广泛分布于亚洲温带、亚热带以及热带地区,产量高,在中国的主要产地位于广东、安徽、四川、河北等省,种植面积在20万公顷,是夏秋两季常见蔬菜[2]。多数地区的冬瓜依然以鲜销为主。植物多糖在降血压、降血脂、调节免疫功能、抗衰老、治疗糖尿病等方面表现出非常优秀的作用[3-5]。黄酮能有效预防骨质疏松症,治疗糖尿病,尤其在抗肿瘤方面有着重要的作用,能有效抑制肿瘤细胞的增长[6,7]。多酚类化合物在食品加工中占有重要地位,是一种重要的食品添加剂,它具有抗氧化作用,能清除食品中少量的氧和自由基,能阻断氧化反应的进一步进行。它同时具有一定的保健功能,它在抗癌、抑菌等方面作用显著[8,9]。叶绿素主要包含了叶绿素a和叶绿素b,而有部分低等植物中还含有叶绿素c和叶绿素d等。叶绿素有造血、提供维生素、解毒、抗病等多种用途[10]。冬瓜是一种物美价廉、药食兼用的佳品,受到消费者的青睐,目前国内外对冬瓜的研究与开发局限在冬瓜肉和冬瓜汁上,对冬瓜皮的研究很少,因我国国民食物烹制加工习惯,冬瓜皮在烹饪前都会被去掉,最终会被以餐厨垃圾的形式抛弃,这不仅会造成污染和浪费,还会大大降低冬瓜的综合利用价值。本文研究了常温干燥、烘箱干燥、微波干燥三种干燥工艺对冬瓜皮活性`成分总叶绿素、叶绿素a、叶绿素b、多糖、黄酮、多酚含量的影响,为冬瓜皮的开发利用提供一定的理论基础。
1 材料与方法
1.1 材料与仪器
材料:普通青冬瓜(Benincasahispida(Thunb.) Cogn.):永辉超市售。
试剂:芦丁(rutin)标准品、没食子酸(gallic acid)标准品北京盛世康普化工技术研究所;葡萄糖(一水)(分析纯)、水乙醇(分析纯)、无水碳酸钠(分析纯)成都市科龙化工试剂厂;苯酚(分析纯)、浓硫酸(优级纯)、氢氧化钠(分析纯)、硝酸铝(九水)(分析纯)重庆川东化工(集团)有限公司;丙酮(分析纯)重庆科试化学有限公司;亚硝酸钠(分析纯)广东省化学试剂工程技术研究开发中心;福林酚上海如吉生物科技发展有限公司。
FW80型高速万能粉碎机天津市泰斯特仪器有限公司;DGX-9143 B-1型烘箱上海福玛实验设备有限公司;WD7009(MG-5355M)型LG微波炉乐金电子(天津)电器有限公司;722型可见光分光光度计上海菁华科技仪器有限公司;AP-01P型真空泵天津奥特塞恩斯仪器有限公司;HH-8型数显恒温水浴锅常州澳华仪器有限公司;1580型多功能离心机基因有限公司;MP002型电子天平上海恒平科学仪器有限公司;FA004A型电子天平上海精天电子仪器有限公司。
1.2 实验方法
1.2.1前处理
将买来的冬瓜表面洗净擦干,切下冬瓜皮,尽量使大小薄厚均匀,称重,分别进行常温干燥、烘箱60,75,90,105 ℃干燥以及微波功率P-60(420 W),P-80(560 W)干燥处理。待干燥完成后,称重,计算失水率。用粉碎机粉碎,放入样品袋中,于4 ℃冰箱中保存备用。
1.2.2多糖检测[11,12]
1.2.2.1多糖标准曲线的制作
取0.1000 g已烘干至恒重的葡萄糖于100 mL烧杯中,加少量纯水溶解,定容至100 mL,得到1 mg/mL葡萄糖标准溶液。
取上述1 mg/mL葡萄糖标准溶液0,1.0,2.0,3.0,4.0,5.0 mL于50 mL容量瓶中,加纯水定容至刻度。
取上述5种稀释度的溶液1 mL于玻璃试管中,向试液中加入1 mL的5%苯酚溶液,然后快速加入5.0 mL浓硫酸(与液面垂直加入,勿接触试管壁,以利于和反应液充分混合),静置10 min,振荡使反应液充分混匀,将试管置于30 ℃水浴中反应20 min,得待测液,另精密吸取1 mL蒸馏水,同法操作,作为空白,在波长490 nm处测定吸光度,制作标准曲线,得到标准液浓度(Y)与吸光度(X)之间的回归方程。
1.2.2.2冬瓜皮多糖检测
称取0.1 g冬瓜皮粉,加入25 mL纯水,于80 ℃水浴锅中加热1 h,取上清液,再加入25 mL纯水,于80 ℃下水浴提取1 h,合并2次提取液,抽滤,定容至50 mL,得待测液,量取1 mL,按标准曲线制作方法检测多糖含量。
1.2.3黄酮检测
1.2.3.1黄酮标准曲线的制作
称取干燥至恒重的芦丁5 mg,以少量70%乙醇溶解,用70%乙醇定容至50 mL,摇匀静置,配成含芦丁0.1 mg/mL的标准溶液。
精密量取标准溶液0,1.0,2.0,3.0,4.0,5.0,6.0,7.0,8.0 mL分别置于25 mL容量瓶中,加1 mL 5%亚硝酸钠溶液,混匀,静置6 min;加入1 mL 10%硝酸铝溶液,混匀,静置6 min;加入10 mL 1 mol/L氢氧化钠溶液,用70%乙醇定容至25 mL混匀,静置15 min得待测液。在波长510 nm处测定吸光度,制作标准曲线,得到标准液浓度(Y)与吸光度(X)之间的回归方程。
1.2.3.2冬瓜皮黄酮检测[13]
称取冬瓜皮粉1 g,加入70%乙醇50 mL,在75 ℃下水浴提取2 h,移出上清液,再加入50 mL 70%乙醇水浴提取2 h,将2次提取液真空抽滤,滤液用70%乙醇定容至100 mL,制得冬瓜皮黄酮粗提液。吸取1 mL,按照黄酮标准曲线制作方法测定冬瓜皮中黄酮含量。
1.2.4多酚检测[14,15]
1.2.4.1多酚标准曲线的制作
称取5 mg没食子酸,用少量纯水溶解并定容至100 mL容量瓶中,得到0.05 mol/L没食子酸标准液。精密吸取标准液0,1.0,2.0,4.0,6.0,8.0,10.0 mL,分别置于7个25 mL容量瓶中,加入1 mL Folin-Ciocalteu试剂,4 mL 10%碳酸钠溶液,用蒸馏水定容,混匀后在室温下静置90 min,于765 nm波长处测定吸光度,绘制标准曲线,得到标准溶液(Y)与吸光度(X)之间的回归方程。
1.2.4.2冬瓜皮多酚检测
称取1 g冬瓜皮粉,加入75 mL 70%乙醇溶液,70 ℃水浴提取90 min,抽滤,滤液定容至100 mL得待测液,吸取1 mL,按照多酚标准曲线制作方法测定冬瓜皮多酚含量,若有沉淀,则用4000 r/min离心20 min。
1.2.5冬瓜皮中叶绿素检测
取冬瓜皮粉0.1 g,加入20 mL 80%丙酮溶液,于40 ℃水浴中浸提5.5 h,抽滤,定容至25 mL。取提取液分别在663,645 nm下测定吸光度,以95%乙醇为空白对照。按照下列公式,分别计算冬瓜皮粉中叶绿素a,b和总叶绿素的含量(mg/g)。
式中:V为样品提取液总体积(mL);m为样品质量(g);D为不同波长下样品吸光度。
1.3 数据分析
所用软件为SPSS Statistics 17,Excel 2010。
2 结果与分析
2.1 不同干燥方式对冬瓜皮失水率的影响
通过冬瓜皮干燥前后的质量比,算出不同干燥方式下冬瓜皮的失水率。

表1 不同干燥方式下冬瓜皮失水率Table 1 The water loss rates of waxgourd peel under different drying methods
由表1可知,常温30 ℃干燥时,冬瓜皮失水率最低;烘箱干燥时,随着烘箱温度从60 ℃升到105 ℃,冬瓜皮失水率基本不变;微波干燥P-80(560 W)相比P-60(420 W),冬瓜皮失水率明显上升;相对于常温干燥和烘箱干燥,微波干燥会将冬瓜皮干燥得更彻底。究其原因可能是冬瓜皮吸收微波后内部直接升温,形成较小的正温度梯度,有利于内部水分的扩散。
2.2 标准曲线的绘制
2.2.1葡萄糖标准曲线
葡萄糖溶液标准曲线见图1。
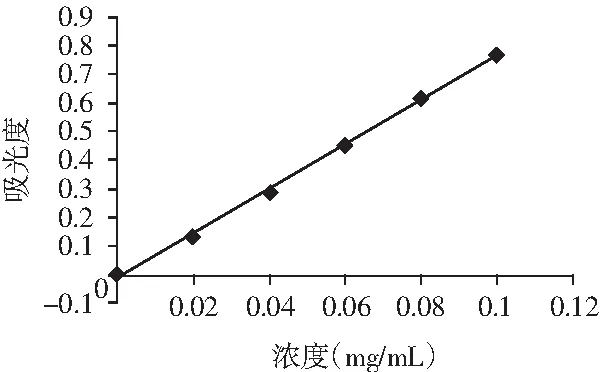
图1 葡萄糖溶液标准曲线Fig.1 Standard curve of glucose solution
根据所测试的结果计算得出葡萄糖对照品溶液的回归方程为: y=7.7529x-0.0145,相关系数r=0.9994,式中:x为葡萄糖的浓度(mg/mL),y为吸光度,表明葡萄糖溶液在线性范围内与吸光度呈良好的线性关系。
2.2.2芦丁标准曲线
芦丁标准溶液标准曲线见图2。

图2 芦丁标准溶液标准曲线Fig.2 Standard curve of rutin solution
根据所测试的结果计算得出芦丁标准溶液的回归方程为: y=12.492x-0.0045,相关系数r=0.9992,式中:x为芦丁的浓度(mg/mL),y为吸光度,表明芦丁标准溶液在线性范围内与吸光度呈良好的线性关系。
2.2.3没食子酸标准曲线
没食子酸标准溶液标准曲线见图3。

图3 没食子酸标准溶液标准曲线Fig.3 Standard curve of gallic acid standard solution
根据所测试的结果计算得出没食子酸溶液的回归方程为:y=64.768x+0.0873,相对系数r=0.9952,式中:x为没食子酸的浓度(mg/mL),y为吸光度,表明对照品溶液在线性范围内与吸光度呈良好的线性关系。
2.3 不同干燥方式对冬瓜皮中多糖含量的影响
采用常温30 ℃、烘箱60 ℃、烘箱75 ℃、烘箱90 ℃、烘箱105 ℃、微波P-60(420 W)、微波P-80(560 W)对样品进行烘干,通过分光光度计法研究不同干燥方式对冬瓜皮中多糖含量的影响。

表2 不同干燥方式下冬瓜皮中多糖的含量Table 2 The content of polysaccharides in waxgourd peel under different drying methods
注:同列中不同的上标字母代表差异显著(P<0.05)。
由表2可知,常温干燥、烘箱干燥的各个温度梯度、微波干燥两种功率间的干燥冬瓜皮多糖含量存在显著性差异。从不同干燥温度下冬瓜皮中多糖含量的变化,发现在烘箱干燥60~105 ℃范围内,干燥冬瓜皮中多糖含量随着温度的升高而降低,在60 ℃时多糖含量最高,达到2985.46 mg/100 g鲜重。
常温干燥与微波干燥下,冬瓜皮中多糖含量变化不大;烘箱干燥条件下的冬瓜皮多糖最低含量仍然比常温干燥与微波干燥下冬瓜皮多糖含量高。
由微波P-60(420 W)和P-80(560 W)下多糖含量对比得知,随着微波功率从420 W升到560 W,冬瓜皮含量降低。对比常温干燥与烘箱干燥可知,冬瓜皮中多糖含量先增加,然后随着温度的升高,多糖含量逐渐下降。这是因为多糖都是由糖苷键结合的糖链,适当地升高温度有助于多糖的提取;但是过高的温度会导致糖苷键断裂而形成多个糖单体,而糖单体没有活性。
2.4 不同干燥方式对冬瓜皮中黄酮含量的影响
采用常温30 ℃、烘箱60 ℃、烘箱75 ℃、烘箱90 ℃、烘箱105 ℃、微波P-60(420 W)、微波P-80(560 W)进行对样品进行烘干,通过分光光度计法研究不同干燥方式对冬瓜皮中黄酮含量的影响。

表3 不同干燥方式下冬瓜皮中黄酮的含量Table 3 The content of flavonoids in waxgourd peel under different drying methods
注:同列中不同的上标字母代表差异显著(P<0.05)。
由表3可知,常温30 ℃干燥时,干燥冬瓜皮中黄酮含量最高,达到62.80 mg/100 g鲜重;烘箱60 ℃和烘箱75 ℃黄酮含量差别很小,没有显著性差异;烘箱90 ℃相比烘箱75 ℃干燥条件下黄酮含量明显降低,差异显著;烘箱90 ℃和烘箱105 ℃之间黄酮含量差别较小,没有显著性差异;微波P-60功率下冬瓜皮黄酮含量略小于烘箱105 ℃条件下黄酮含量,没有显著性差异。
随着干燥温度的升高,冬瓜皮中黄酮含量呈现总体下降趋势,黄酮损失的原因可能是黄酮属于热敏性物质,随着温度的升高,黄酮类化合物受热分解所致。
相比较而言,这三种干燥方式对冬瓜皮中黄酮的保留效果优劣顺序为:常温30 ℃干燥>烘箱干燥>微波干燥。
2.5 不同干燥方式对冬瓜皮中多酚含量的影响
采用常温30 ℃、烘箱60 ℃、烘箱75 ℃、烘箱90 ℃、烘箱105 ℃、微波P-60(420 W)、微波P-80(560 W)对样品进行烘干,通过分光光度计法研究不同干燥方式对冬瓜皮中多酚含量的影响。
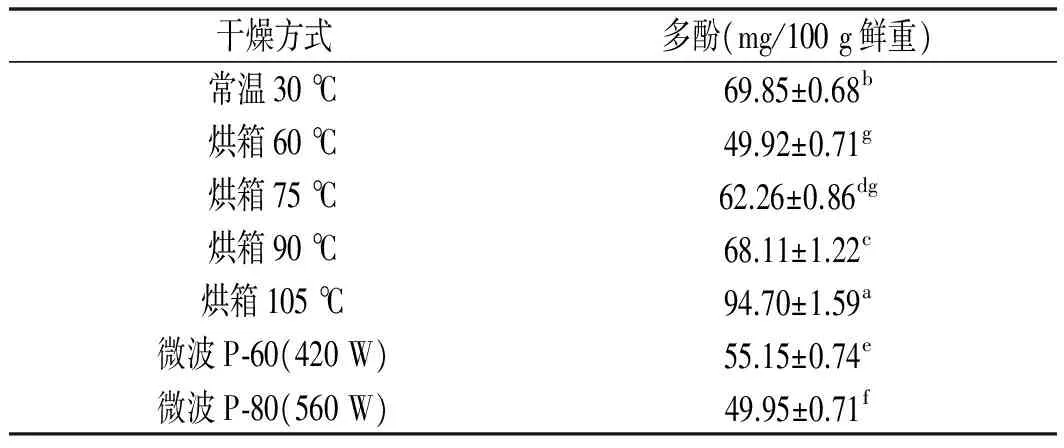
表4 不同干燥方式下冬瓜皮中多酚的含量Table 4 The content of polyphenols in waxgourd peel under different drying methods
注:同列中不同的上标字母代表差异显著(P<0.05)。
由表4可知,不同干燥条件下,冬瓜皮中多酚含量比较,随着烘箱温度从60~105 ℃增加,干燥冬瓜皮中多酚含量增加。当烘箱温度105 ℃干燥下,多酚含量达到最高,为94.70 mg/100 g鲜重。烘箱干燥温度60 ℃和75 ℃时,冬瓜皮多酚含量差异不显著;微波干燥,随着功率由420 W升到560 W,冬瓜皮多酚含量降低。常温30 ℃干燥和烘箱90 ℃干燥时冬瓜皮多酚含量相差较小,高于烘箱60 ℃和烘箱75 ℃条件下多酚含量,同时也高于微波干燥条件下的多酚含量。相比较而言,这三种干燥方式对冬瓜皮中多酚的保留效果优劣顺序为:烘箱干燥>常温30 ℃干燥>微波干燥。
2.6 不同干燥方式对冬瓜皮中叶绿素含量的影响
采用常温30 ℃、烘箱60 ℃、烘箱75 ℃、烘箱90 ℃、烘箱105 ℃、微波P-60(420 W)、微波P-80(560 W)对样品进行烘干,通过分光光度计法研究不同干燥方式对冬瓜皮中叶绿素含量的影响。

表5 不同干燥方式下冬瓜皮中叶绿素的含量Table 5 The content of chlorophyll in waxgourd peel under different drying methods
注:同列中不同的上标字母代表差异显著(P<0.05)。
由表5可知,不同干燥条件下,冬瓜皮中叶绿素含量的比较,常温30 ℃和烘箱60 ℃条件下,冬瓜皮中叶绿素a,b和总叶绿素含量均差别不大,在这个温度区间内,冬瓜皮中叶绿素含量较高。在烘箱60 ℃到烘箱105 ℃的范围内,叶绿素a,b和总叶绿素含量均呈现下降趋势。烘箱75 ℃相比烘箱60 ℃,冬瓜皮叶绿素下降明显;在烘箱干燥75~105 ℃,叶绿素含量呈现下降趋势,但下降缓慢。微波干燥条件下,随着功率的升高,冬瓜皮中叶绿素明显下降。功率越高、火力越大,对冬瓜皮叶绿素的破坏越严重。
比较相同干燥条件下,冬瓜皮中叶绿素a含量比叶绿素b含量高。
3 结论
上述试验表明:冬瓜皮中含有丰富的多糖、多酚、黄酮等活性成分;不同干燥方式对冬瓜皮中多糖、黄酮、多酚、叶绿素a、叶绿素b和总叶绿素等活性成分均有显著影响。综合考虑,这三种干燥方式中对冬瓜皮中活性成分保留效果最好的为烘箱60 ℃干燥。
参考文献:
[1]王栋梁,王娜,王丹蕾,等.冬瓜皮成分及抗氧化活性成分分析[J].江苏农业科学,2015(11):411-414.
[2]谢大森,何晓明,彭庆务.冬瓜种质资源的综合鉴评[J].中国蔬菜,2009(8):36-41.
[3]罗祖友,胡筱波,吴谋成.植物多糖的降血糖与降血脂作用[J].食品科学,2007,28(10):596-600.
[4]毛宇奇,张建鹏.植物多糖抗衰老作用的研究进展[J].生物技术通讯,2014,25(4):588-590.
[5]尚庆辉,解玉怀,张桂国,等.植物多糖的免疫调节作用及其机制研究进展[J].动物营养学报,2015,27(1):49-58.
[6]Edejman G,Verstraeten V,Frsga G,et a1.The interaction of flavonoids with membranes: potential determinant of flavonoid antioxidant effects[J].Free Radical Research,2004,38(12):1311-1320.
[7]王勇,赵海燕.植物黄酮类治疗糖尿病药理机制的研究进展[J].医学综述,2010,16(4):612-615.
[8]Aviram M,Fuhrman B.Polyphenolic flavonoides inhibit macrophage mediated oxidation of LDL and attenuate athero genesis[J] .Atherosclerosis,1998,137(1):45-50.
[9]张欣.多酚化合物抗氧化性的化学-生物学研究[D].哈尔滨:东北农业大学,2008.
[10]王平荣,张帆涛,高家旭,等.高等植物叶绿素生物合成的研究进展[J].西北植物学报,2009,29(3):629-636.
[11]Jun Ding.Extraction process of selenium polysaccharide in hedgehog fungus and determination analysis of chemical components[J].Applied Mechanics and Materials,2013,274:440-443.
[12]徐琴,徐增莱,沈振国,等.淮山药多糖的研究[J].中药材,2006(9):909-912.
[13]李光,余霜,邓银,等.金荞麦叶黄酮提取技术研究[J].江苏农业科学,2013(7):264-266.
[14]陈月华,李嘉,符锋,等.不同干燥方法对冬瓜皮活性成分的影响[J].食品与发酵工业,2017(2):129-133.
[15]李娜,李瑜,谷文荣.响应面法优化冬瓜皮多酚提取工艺[J].包装与食品机械,2015,33(1):27-32.

