急性和慢性乙型病毒性肝炎中自然杀伤细胞的功能研究
曹卫华 吴淑玲 冉崇平 齐天林 王星月 屈晓晶 张丹 张璐 路遥 郝红晓 常敏 胡蕾苹 刘如玉 吴云忠 杨民 华文浩 刘顺爱 李明慧 谢尧
100015 北京大学地坛医院教学医院肝病中心(曹卫华、谢尧);100015 北京,首都医科大学附属北京地坛医院肝病中心(吴淑玲、冉崇平、齐天林、王星月、屈晓晶、张丹、张璐、路遥、郝红晓、常敏、胡蕾苹、刘如玉、吴云忠、杨民、李明慧),检验科(华文浩),传染病研究所(刘顺爱)
HBV感染的发病机制是由宿主免疫、肝细胞和病毒之间相互作用所介导的免疫应答[1]。大约95%成人发生HBV感染后表现为急性、自限性,而约90%新生儿感染后进展为慢性[2]。NK细胞是一种来源于骨髓的淋巴细胞,属于固有免疫系统的主要效应细胞。NK细胞不仅在病毒的清除中发挥重要作用,而且参与肝脏组织损伤过程[3-4]。CD56brightNK和CD56dimNK是NK细胞的亚群,CD56brightNK细胞主要功能是分泌细胞因子,如TNF-α、IFN-γ、IL-10等,通过非细胞毒性作用发挥抗病毒作用,CD56dimNK细胞通过颗粒酶和穿孔素介导细胞毒作用杀伤病毒感染的肝细胞[5]。NKp46为NK细胞的活化性受体,急性乙型肝炎感染中,NKp46受体表达上调,NK细胞活性增强[6]; NK细胞表面还表达受体IFNAR2,IFNAR2表达上调可使得IFN-a更易激活NK细胞,发挥抗病毒作用,有利于清除病毒。该研究通过探讨急、慢性HBV感染患者外周血NK细胞及其亚群的频数,NK细胞表面功能分子IFNAR2、NKp46的表达情况,并分析它们与ALT、HBV DNA以及HBV markers相关性,从而助于进一步了解自然杀伤细胞在急、慢性HBV感染中的作用。
1 材料与方法
1.1研究对象自2014年10月至2017年7月,本研究入组126例在首都医科大学附属北京地坛医院就诊的患者,包括急性乙型病毒性肝炎和慢性乙型病毒性肝炎免疫活动期两组,这些患者均未曾接受治疗,其中有12例急性乙型病毒性肝炎患者失访。急性乙型病毒性肝炎参照诊断标准[6],慢性乙型病毒性肝炎诊断标准参照文献[7]。排除标准:除外HBV以外的其它病毒感染者;梅毒、艾滋抗体阳性者除外;除外伴脂肪肝、自身免疫性肝病、酒精性肝病、肝脏代谢性疾病、肝纤维化、肝硬化以及肝癌等其它肝脏疾病者。本研究已通过首都医科大学附属北京地坛医院伦理委员会审核,入组每位研究对象均已签署知情同意书。
1.2临床指标检测视情况而定,每隔3个月检测病毒学指标(HBeAg、HBsAg和HBV DNA)、生化指标(ALT、AST、TBIL、DBIL等)、血常规等,这些指标均由首都医科大学附属北京地坛医院检验科提供。
1.3血样采集利用EDTA 抗凝紫管采集患者血样2 ml,经处理后4 h内使用BD FACS Calibur上机收集细胞。
1.4细胞表型染色及流式细胞仪分析用Anti-Human IFNAR2-FITC,Mouse anti-Human-CD3- PerCP,Mouse anti-Human CD56-APC和anti-Human CD335(NKp46)-PE四种抗体检测NK细胞,并用FlowJo7.6分析数据。
1.5统计学方法应用SPSS 19.0软件进行统计分析,所有数据以均数±标准差(mean ± SEM)或中位数、四分位数间距[median (Q1, Q3)]或box-and-whisker plots呈现,利用GraphPad Prism 5分析。组内比较用Wilcoxon检验,多组间两两比较用Mann-Whitney U 检验。变量的相关性分析采用线性回归分析。P<0.05被认为有统计学意义。
2 结果
2.1IA和AHB两组间基线HBVDNA含量、血清HBsAg、HBeAg水平及ALT水平入组IA组94人、AHB组32人,入组患者的基本信息如表1所示。
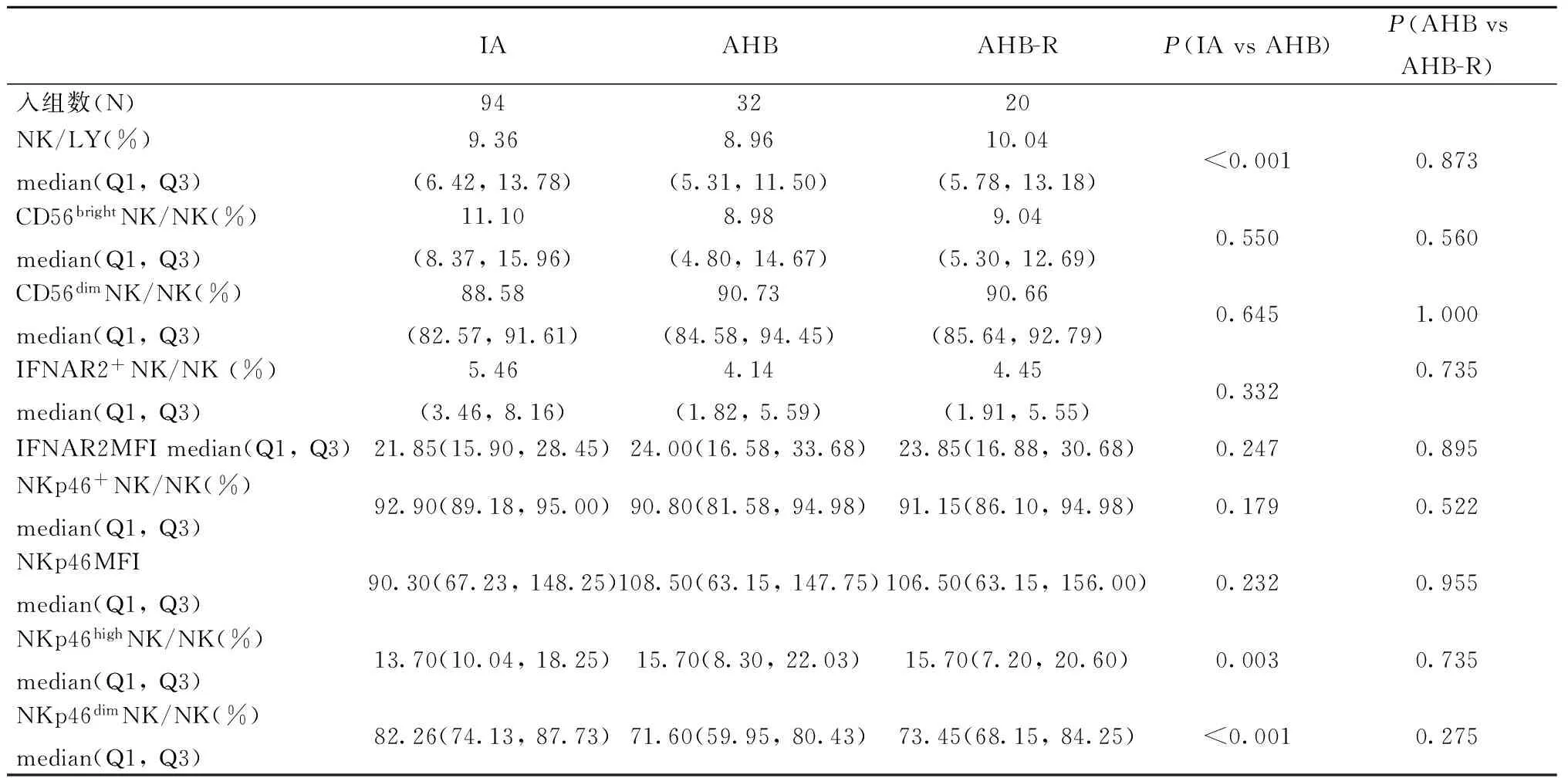
表2 IA、AHB、AHB-R组间NK细胞及其亚群细胞频数和功能分子
注:AHB,急性乙型病毒性肝炎组;IA,免疫活动期;AHB-R,急性乙型病毒性肝炎恢复期;P<0.05差异有统计学意义
Note: AHB, acute hepatitis B; IA, immune activity; AHB-R, acute hepatitis B recovery period;P<0.05 was considered statistically significant
2.2在IA和AHB组NK细胞及其亚群细胞频数和功能分子表达表2结果显示:IA组与AHB组相比,IA组NK 和NKp46dimNK细胞频数显著高于AHB组; AHB组NKp46highNK细胞频数显著高于IA组,而CD56brightNK频数、CD56dimNK频数、IFNAR2+NK、NKp46+NK细胞频数和IFNAR2MFI、NKp46MFI水平在两组间无显著的统计学差异。AHB组和AHB-R组相比,各个指标间未得出显著的统计学差异,但是AHB-R组CD56brightNK、IFNAR2+NK、NKp46+NK和NKp46dimNK细胞频数中位数值高于AHB组,AHB组IFNAR2MFI、NKp46MFI中位数值高于AHB-R组。

表1 IA和AHB入组患者基本特征
注:AHB,急性乙型病毒性肝炎组;IC,慢乙肝免疫活动期;P<0.05 差异有统计学意义
Note: AHB, acute hepatitis B; IA, immune activity;P<0.05 was considered statistically significant
2.320例急乙肝恢复患者NK细胞及其亚群细胞频数以及细胞表面功能分子表达在入组的31例急乙肝患者中20例在24周时恢复,急乙肝恢复期NK细胞和NKp46dimNK细胞频数显著高于急性炎症期NK和NKp46dimNK细胞频数,急乙肝恢复期NKp46highNK细胞频数显著低于急性炎症期(表3),而CD56brightNK、CD56dimNK、IFNAR2+NK、NKp46+NK细胞频数和IFNAR2MFI、NKp46MFI在急乙肝恢复前后无显著的统计学差异(表3),但是由图1中可以看出在急乙肝恢复前后CD56brightNK、CD56dimNK、IFNAR2+NK、NKp46+NK细胞频数和IFNAR2MFI、NKp46MFI存在变化趋势:CD56brightNK、IFNAR2MFI、NKp46MFI频数在急乙肝恢复后有下降趋势(图1),而CD56dimNK(图1)、IFNAR2+NK和NKp46+NK(图2)细胞频数则呈上升趋势。
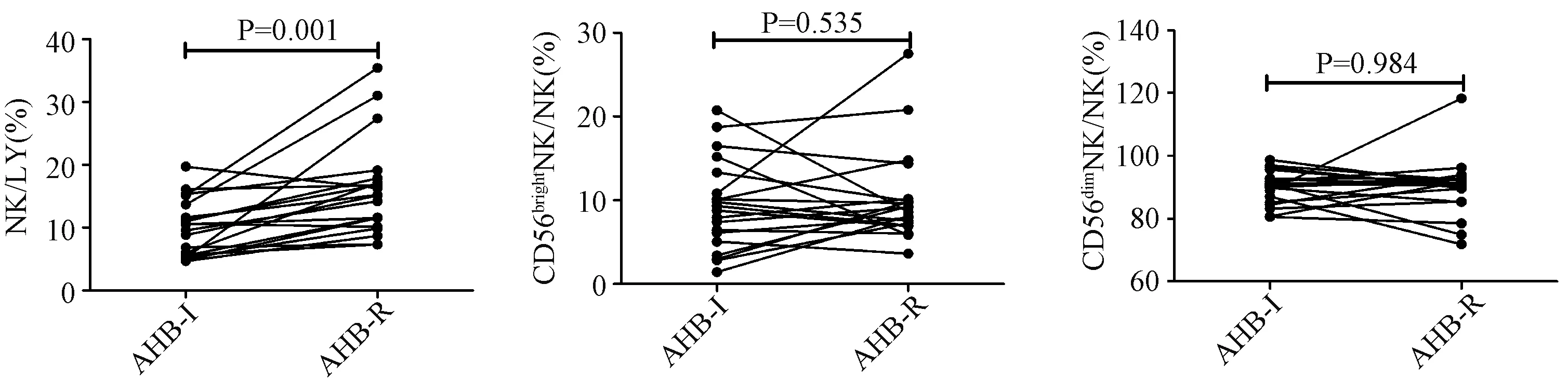
图1 20例急性乙型肝炎恢复患者外周血NK细胞、CD56brightNK和CD56dimNK细胞所占的频数的变化趋势Fig.1 The changing trend of frequency of NK cells, CD56brightNK cells and CD56dimNK cells in peripheral blood in the recovery of 20 patients with acute hepatitis B
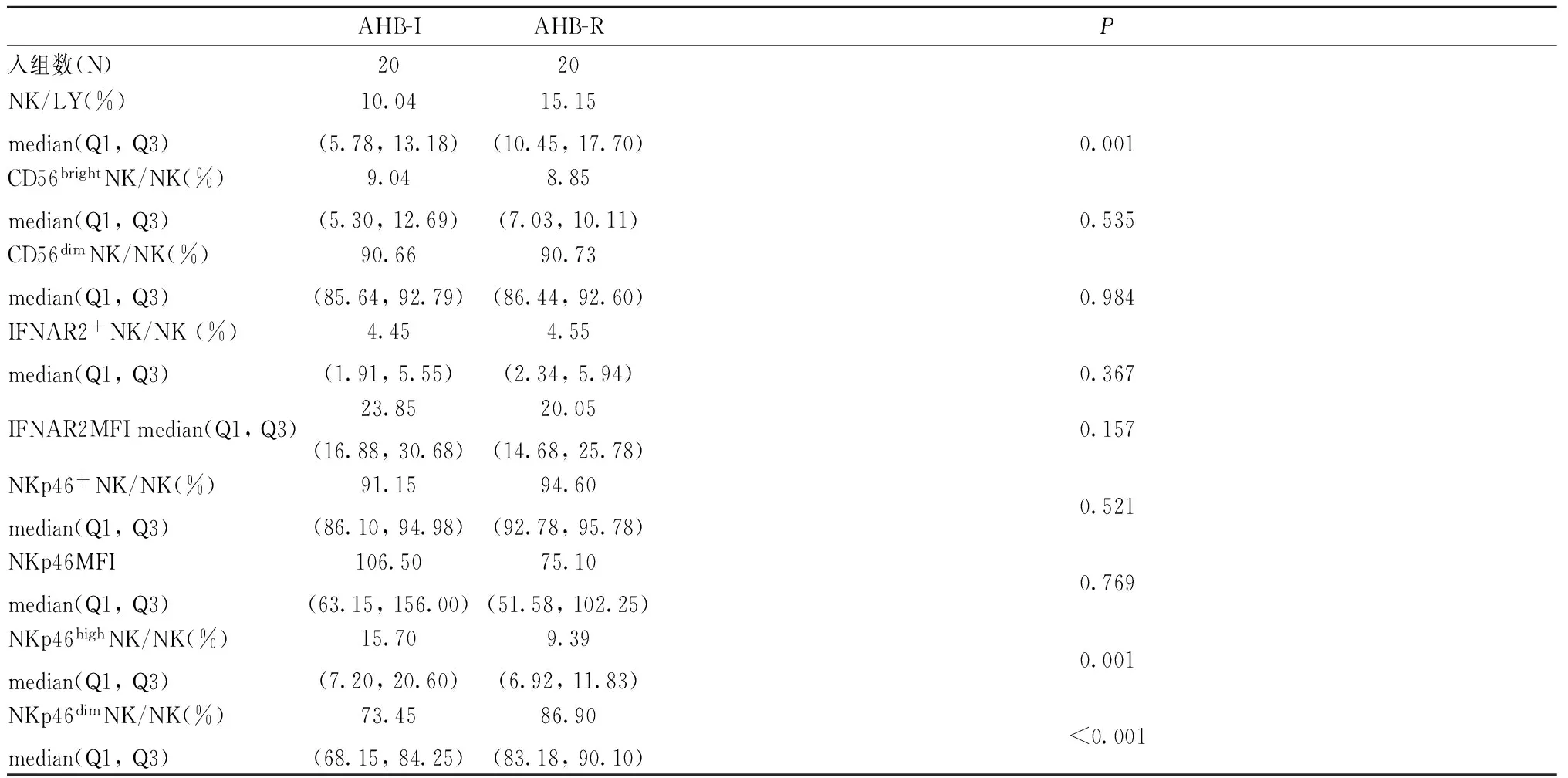
AHB-IAHB-RP入组数(N)2020NK/LY(%)median(Q1,Q3)10.04(5.78,13.18)15.15(10.45,17.70)0.001CD56brightNK/NK(%)median(Q1,Q3)9.04(5.30,12.69)8.85(7.03,10.11)0.535CD56dimNK/NK(%)median(Q1,Q3)90.66(85.64,92.79)90.73(86.44,92.60)0.984IFNAR2+NK/NK(%)median(Q1,Q3)4.45(1.91,5.55)4.55(2.34,5.94)0.367IFNAR2MFImedian(Q1,Q3)23.85(16.88,30.68)20.05(14.68,25.78)0.157NKp46+NK/NK(%)median(Q1,Q3)91.15(86.10,94.98)94.60(92.78,95.78)0.521NKp46MFImedian(Q1,Q3)106.50(63.15,156.00)75.10(51.58,102.25)0.769NKp46highNK/NK(%)median(Q1,Q3)15.70(7.20,20.60)9.39(6.92,11.83)0.001NKp46dimNK/NK(%)median(Q1,Q3)73.45(68.15,84.25)86.90(83.18,90.10)<0.001
注:AHB-I,急性乙型病毒性肝炎炎症期;AHB-R,急性乙型病毒性肝炎恢复期;P<0.05差异有统计学意义
Note: AHB-I, acute hepatitis B inflammation period; AHB-R, acute hepatitis B recovery period;P< 0.05 was considered statistically significant
2.4临床指标(ALT、HBeAg、HBsAg和HBVDNA)与NK细胞的相关性分析在AHB组HBV DNA与ALT(r=0.394,P=0.026)呈正相关,但是在IA组HBV DNA、HBsAg、HBeAg与ALT、NK细胞及其亚群细胞频数和NK细胞表面功能分子表达水平均无相关性。而通过对所有指标在急乙肝恢复前后差值的相关性分析得出:ΔHBV DNA和ΔALT呈正相关(图3 A)、与ΔNK/LY(%)呈正相关(图3B);图4所示:ΔALT与ΔNKp46highNK频数、ΔNKp46MFI、ΔIFNAR2MFI呈正相关。
3 讨论
急性乙型病毒性肝炎和慢性乙型病毒性肝炎是两种不同的HBV感染状态,其临床结局也完全不同。本研究结果显示,急乙肝炎症期NK细胞总数低于慢乙肝,可能因为NK细胞被募集到肝脏而发挥作用,使得外周血NK细胞频数下降;而急乙肝CD56dimNK、ΔNKp46highNK细胞频数高于慢乙肝,这些细胞具有细胞毒性作用,参与病毒感染的清除,同时IFNAR2表达水平在急乙肝炎症期高于慢乙肝,在感染早期时,急乙肝NK细胞更易被激活而发挥抗病毒作用,利于病毒被清除[8]。在急乙肝炎症期,HBV DNA病毒载量与ALT水平呈正相关,病毒刺激NK细胞活化,发挥抗病毒作用,既有细胞毒性作用又参与肝脏损伤过程[9],这就可以解释急性乙型肝炎时患者可以清除病毒,而慢性乙型肝炎者则不可以。
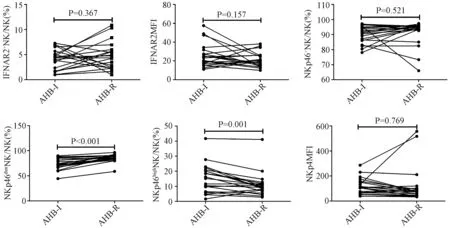
图2 20例急性乙型肝炎恢复患者外周血IFNAR2+NK、NKp46+NK、NKp46highNK、 NKp46dimNK细胞所占的频数及功能分子IFNAR2、NKp46平均荧光强度的变化趋势Fig.2 The changing trend of frequency of IFNAR2+NK cells, NKp46+NK cells, NKp46highNK cells and NKp46dimNK cells, and IFNAR2MFI, NKp46MFI in peripheral blood in the recovery of 20 patients with acute hepatitis B
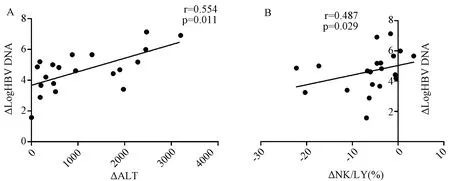
图3 HBV DNA 在急乙肝恢复前后差值的变化与ALT及NK细胞频数的相关性Fig.3 The association of ΔHBV DNA and ΔALT, ΔNK cells before and after acute hepatitis B recovery
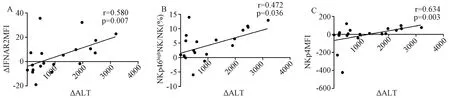
图4 ALT在急乙肝恢复前后差值与NKp46highNK细胞频数差值及IFNAR2MFI和NKp46MFI差值的相关性Fig.4 The association of ΔALT and ΔNKp46highNK, ΔIFNAR2MFI, ΔNKp46MFI before and after acute hepatitis B recovery
大多数成人发生HBV感染后通过有效的免疫应答可将病毒清除。有研究显示,急性乙型肝炎中,NK细胞在感染早期优先被激活[10],本研究结果显示,急乙肝炎症期NK细胞频数低于恢复期,可能因在炎症期,NK细胞被招募至肝脏发挥抗病毒作用,外周血NK细胞相对减少,而在恢复期,肝脏中的病毒被清除,NK细胞不再向肝脏中迁移,外周血NK细胞数反而上升。本研究还发现,急乙肝炎症期CD56brightNK细胞频数高于恢复期,NKp46highNK细胞频数及功能分子NKp46和IFNAR2表达水平在急乙肝恢复过程中呈现下降趋势,本研究还发现,在急乙肝恢复中ALT的变化与NKp46highNK细胞频数、NKp46MFI、IFNAR2MFI的变化呈现正相关,这就说明急乙肝炎症期,NK细胞活化[11-12],发挥抗病毒作用以及参与肝脏炎症损伤过程[13],NKp46和IFNAR2表达上调更有利于清除病毒[6,14]。
在HBV感染过程中,有很多因素参与其中,不仅包括免疫细胞,还有很多的细胞因子和趋化因子等等。本研究虽然证明在NK细胞在急、慢性乙型病毒性肝炎发病和转归中的作用,但是并没有研究细胞因子在其中的作用,因此,需要更进一步研究其机制。
总之,虽然NK细胞具有双重作用,在发挥抗病毒过程中也会导致肝脏组织的损伤,但是不同的感染阶段NK细胞发挥作用的机制也不同,因此,针对性地增加NK细胞分泌细胞因子作用而减弱其细胞毒性作用,从而减弱对肝脏组织的损伤作用,这对以后HBV感染的治疗提供了新思路。
利益冲突:无
[1]Kumar A. Innate immune responses in hepatitis B virus (HBV) infection[J]. Virol J, 2014, 11(1): 22. DOI: 10.1186/1743-422X-11-22.
[2]Trépo C, Chan HLY, Lok A. Hepatitis B virus infection[J]. Lancet, 2014, 384(9959): 2053-2063. DOI: 10.1016/S0140-6736(14)60220-8.
[3]屈晓晶, 李明慧, 曹卫华, 等. NK 细胞在 HBV 感染中的作用研究[J]. 中华实验和临床病毒学杂志, 2016, 30(5): 439-443. DOI:10.3760/cma.j.issn.1003-9279.2016.05.006.
[4]Rehermann B. Natural killer cells in viral hepatitis[J]. Cell Mol Gastroentrol Hepatol, 2015, 1(6): 578-588. DOI: 10.1016/j.jcmgh.2015.09. 004.
[5]Mondelli MU, Varchetta S, Oliviero B. Natural killer cells in viral hepatitis: facts and controversies[J]. Eur J Clin Invest, 2010, 40(9): 851-863. DOI:10.1111/j.1365-2362.2010.02332.x.
[6]Zhao J, Li Y, Jin L, et al. Natural killer cells are characterized by the concomitantly increased interferon-γ and cytotoxicity in acute resolved hepatitis B patients[J]. PLoS One, 2012, 7(11): e49135. DOI: 10.1371/journal.pone.0049135.
[7]European Association For The Study Of The Liver. EASL clinical practice guidelines: Management of chronic hepatitis B virus infection[J]. J Hepatol, 2012, 57(1): 167-185. DOI: 10.1016/j.jhep.2012. 02. 010.
[8]Schuch A, Hoh A, Thimme R. The role of natural killer cells and CD8+ T cells in hepatitis B virus infection[J]. Front Immunol, 2014, 5:258. DOI: 10.3389/fimmu.2014.00258.
[9]Gao B, Radaeva S. Natural killer and natural killer T cells in liver fibrosis[J]. BBA-Mol Basis Dis, 2013, 1832(7): 1061-1069. DOI: 10.1016/j.bbadis.2012.09.008.
[10]Lunemann S, Malone DFG, Hengst J, et al. Compromised function of natural killer cells in acute and chronic viral hepatitis[J]. J Infect Dis, 2013, 209(9):1362-1373. DOI: 10.1093/infdis/jit561.
[11]Wang L, Wang K, Zou ZQ. Crosstalk between innate and adaptive immunity in hepatitis B virus infection[J]. World J Hepatol, 2015, 7(30): 2980. DOI: 10.4254/wjh.v7.i30.2980.
[12]张丹, 李明慧, 屈晓晶, 等. HBV 不同感染状态患者 CD4+ T 细胞功能的差异研究[J]. 中华实验和临床病毒学杂志, 2016, 30(2): 185-188. DOI:10.3760/cma.j.issn.1003-9279.2016.02. 019.
[13]Li MH, Zhang D, Zhang L, et al. Ratios of T-helper 2 cells to T-helper 1 cells and cytokine levels in patients with hepatitis B[J]. Chin Med J, 2017, 130(15): 1810. DOI:10.4103/0366-6999.211541.
[14]Yoshioka T, Tatsumi T, Miyagi T, et al. Frequency and role of NKp46 and NKG2A in hepatitis B virus infection[J]. PLoS One, 2017, 12(3): e0174103. DOI: 10.1371/journal.pone.0174103.

